Применение комбинации вируса миксомы и рапамицина для терапевтического лечения
Иллюстрации
Показать всеНастоящее изобретение относится к терапевтическому лечению раковых заболеваний и касается применения вируса миксомы в комбинации с рапамицином. Представлены способы ингибирования раковой клетки, способы лечения рака с использованием комбинации вируса миксомы или его аналога, который не экспрессирует функциональный M135R, и рапамицина, фармацевтические композиции и наборы, содержащие комбинацию вирус миксомы или его аналог, который не экспрессирует функциональный M135R, и рапамицин. Обработка рапамицином усиливает способность вируса миксомы селективно инфицировать клетки, которые имеют недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон. Представленные изобретения возможно применять для лечения раковых заболеваний при менее токсичном воздействии на здоровые клетки. 19 н. и 57 з.п. ф-лы, 43 ил., 3 табл., 3 пр.
Реферат
Перекрестная ссылка на родственную заявку
Эта заявка претендует на положительный эффект и приоритет предварительной заявки на патент США № 60/658,816, поданной 7 марта 2005, содержание которой включено сюда в качестве ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится в целом к терапевтическому применению вируса миксомы и рапамицина.
Описание предшествующего уровня техники
Современные способы лечения, используемые для лечения различных типов рака, имеют тенденцию осуществляться отравлением или уничтожением раковых клеток. К сожалению, способы лечения, которые токсичны для раковых клеток, обычно имеют тенденцию быть токсичными также для здоровых клеток. Более того, гетерогенная природа опухолей представляет собой одну из первичных причин того, что эффективные способы лечения по поводу рака еще не найдены. Современные основные способы лечения, такие как химиотерапия и лучевая терапия, имеют тенденцию применяться в пределах узкого терапевтического диапазона токсичности. Эти виды лечения считаются «тупыми инструментами», у которых ограниченная применимость вследствие меняющихся типов опухолевых клеток и ограниченного диапазона, в котором могут проводиться эти способы лечения.
Разрабатываемые современные виды противораковой терапии пытаются селективно нацеливаться на опухолевые клетки, в то же время оказывая менее токсичное действие на здоровые клетки, в результате чего повышается вероятность избавиться от воздействия на здоровые клетки.
Онколитическая вирусная терапия представляет собой один подход, который нацелен на использование клеточных различий между опухолевыми клетками и нормальными клетками. При таком лечении в качестве противораковых средств используются подходящие для репликации, селективные к опухолям вирусные векторы. Онколитический вирус либо специфично нацелен на раковые клетки для инфекции, либо больше подходит для эффективной репликации в раковых клетках по сравнению со здоровыми клетками. Такие подходящие для репликации онколитические вирусы являются или естественно встречающимися, или полученными методами генной инженерии для того, чтобы быть высоко селективными и сильнодействующими средствами, нацеленными на гетерогенную опухолевую популяцию. Поскольку репликационно селективный онколитический вирус эффективно не реплицируется в нормальных клетках, токсичность для пациента должна быть низкой, особенно по сравнению с традиционными видами лечения, такими как лучевая терапия и химиотерапия.
В многочисленных исследованиях сообщалось об онколитической активности различных вирусных штаммов, причем самыми перспективными онколитическими вирусами являются естественно встречающийся или генетически модифицированный вариант аденовируса, вируса простого герпеса 1 ("HSV1"), реовируса, вируса коровьей оспы, вируса везикулярного стоматита ("VSV") или вируса полиомиелита. Модифицированные онколитические вирусы, исследуемые в настоящее время в качестве противораковых средств, включают HSV, аденовирус, вирус ньюкастлской болезни ("NDV"), реовирус и вирус коровьей оспы, кори, VSV и вирус полиомиелита. Различные онколитические вирусы проходят I фазу и II фазу клинических испытаний, причем некоторые из них проявляют длительную эффективность. Однако неизвестно, какие вирусы наилучшим образом будут выполнять онколитические цели длительной репликации, специфичности и высокой литической активности. Полностью эффективным кандидатом на онколитический вирусный вектор был бы тот, который имеет короткий жизненный цикл, быстро образует зрелые вирионы, эффективно распространяется от клетки к клетке и имеет большой геном, готовый для вставок. Также имеющиеся доказательства свидетельствуют о том, что ингибирование раннего природного иммунного ответа и замедление развития реакций Th1 важны для эффективности онколитической терапии. Ясно, что человеческие вирусы являются высоко иммуногенными, по данным измерения высокого уровня антитела и реакций Т клеток, которые наблюдаются в здоровой популяции по многим из вирусов, рассматриваемым для разработки онколитических вирусов.
Клиническая работа показала, что современные онколитические вирусы действительно безопасны, но недостаточно сильнодействующие в качестве видов монотерапии для того, чтобы быть полностью клинически эффективными. Поскольку обычно наблюдается недостаточная или неэффективная инфекция опухолевых клеток, современное движение направлено в сторону перспективных вирусов путем воздействия на них методами генной инженерии для экспрессии терапевтических трансгенов с целью увеличения их эффективности. Большинство из указанных выше онколитических вирусов в настоящее время испытывается в комбинации с другими обычными видами онколитической терапии.
Аденовирус можно легко подвергнуть генетическим манипуляциям, и он выполняет хорошо известную ассоциированную функцию вирусного белка. Кроме того, он связан с достаточно легким заболеванием. Человеческий аденовирус ONYX-015 (Onyx Pharmaceuticals Inc.) представляет собой один из наиболее обширно испытуемых онколитических вирусов, который был оптимизирован для клинического применения. Считают, что он реплицируется предпочтительно в р53-отрицательных опухолях и проявляет перспективность в клинических испытаниях у пациентов, страдающих раком головы и шеи. Однако сообщения показывают, что ONYX-015 вызвал объективную клиническую реакцию только у 14% получавших лечение пациентов (Nemunaitis J, Khuri F, Ganly I, Arseneau J, Posner M, Vokes E, Kuhn J, McCarty T, Landers S, Blackburn A, Romel L, Randlev B, Kaye S, Kirn D. J. Clin. Oncol. 2001 Jan 15;19(2):289-98).
В документах WO96/03997 и W097/26904 описан мутантный онколитический HSV, который ингибирует рост опухолевых клеток и специфичен к нейронным клеткам. Другие преимущества состоят в том, что HSV можно с легкостью генетически модифицировать, и существуют лекарственные препараты, для выключения любой нежелательной вирусной репликации. Однако применение такого обычного человеческого патогена ограничено, поскольку имеется вероятность того, что общая популяция контактировала с этим вирусом и приобрела иммунную реакцию на него, которая ослабила бы литический эффект вируса. HSV может также вызвать тяжелые побочные эффекты или потенциально летальное заболевание.
Реовирус III типа связан с относительно легкими заболеваниями, и его вирусная генная функция достаточно хорошо изучена и понятна. Реовирус III типа в настоящее время разрабатывается фирмой Oncolytic Biotech в качестве терапевтического противоракового средства, которое проявляет свойства усиленной репликации в клетках, экспрессирующих мутантный ras онкоген и предпочтительно растет в клетках PKR -/- (Strong J.E. and P.W. Lee, J. Virology, 1996. 70:612-616). Однако реовирусом трудно генетически манипулировать, и его вирусную репликацию нельзя с легкостью отключить.
VSV связан с относительно легкими заболеваниями и также выполняет хорошо известную вирусную генную функцию. В документе WO99/04026 раскрыто применение VSV в качестве вектора при генной терапии для экспрессии, широко используемого при лечении разнообразных расстройств. Однако VSV связан с такими же проблемами как реовирус, заключающимися в том, что им трудно генетически манипулировать, и его вирусную репликацию нельзя с легкостью отключить.
Вирус коровьей оспы и вирус полиомиелита представляют собой другие перспективные онколитические вирусы, описанные в данной области, но они были связаны с тяжелым или потенциально летальным заболеванием.
В патенте США № 4806347 раскрыто применение гамма интерферона и фрагмента IFNγ против человеческих опухолевых клеток. В документе WO99/18799 раскрыт способ лечения заболевания у млекопитающего, при котором пораженные клетки имеют дефекты опосредованной интерфероном противовирусной реакции, причем способ включает введение млекопитающему терапевтически эффективного количества чувствительного к интерферону, репликационно компетентного клонального вируса. В WO99/18799, в частности, раскрыто, что частицы VSV обладают токсической активностью против опухолевых клеток, но что облегчение цитотоксичности VSV в здоровых клетках происходит в присутствии интерферона. В документе WO99/18799 также раскрывается, что вызванная NDV чувствительность наблюдалась у опухолевых клеток, обработанных интерфероном, но что добавление интерферона к нормальным клеткам делает эти клетки устойчивыми к NDV. Этот способ нацелен на то, чтобы сделать клетки чувствительными к интерферону инфицированием их чувствительными к интерферону вирусами.
Краткое описание сущности изобретения
Настоящее изобретение основано на неожиданном обнаружении того, что вирус кроличьей миксомы, включая новый вирус миксомы, который не экспрессирует функциональный белок M135R, может селективно инфицировать клетки, включая человеческие опухолевые клетки, которые имеют недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон, и что такая инфекция усиливается обработкой таких клеток лекарственным препаратом рапамицином. Используемый в настоящем контексте термин «природный» описывает неспецифическую к антигену иммунную реакцию. Поскольку вирус миксомы эффективно не реплицируется в нормальных человеческих клетках, то его можно поэтому использовать в качестве лечебного средства при различных расстройствах и состояниях, характеризуемых клетками, которые имеют недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон, например, в качестве онколитического лечения по поводу рака. Этот вирус можно также применять для идентификации клеток, которые имеют недостаточную природную противовирусную реакцию, и для визуализации этих клеток in vivo.
В одном аспекте, настоящее изобретение предоставляет способ ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, включающий введение в клетку эффективного количества комбинации вируса миксомы и рапамицина.
В одном аспекте, настоящее изобретение предоставляет способ лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию, включающий введение нуждающемуся в нем пациенту эффективного количества комбинации вируса миксомы и рапамицина.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества комбинации вируса миксомы и рапамицина для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, и для изготовления лекарственного средства для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества комбинации вируса миксомы и рапамицина для лечения патологического состояния у пациента, причем патологическое состояние характеризуется наличием клеток, которые имеют недостаточную природную противовирусную реакцию, и для изготовления лекарственного средства для лечения такого патологического состояния у пациента.
В другом аспекте, настоящее изобретение предоставляет фармацевтическую композицию, включающую вирус миксомы и рапамицин. Фармацевтическую композицию можно применять для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию.
В другом аспекте, настоящее изобретение предоставляет набор, включающий вирус миксомы, рапамицин и инструкции для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию. Патологические состояния включают рак и хроническую вирусную инфекцию.
Настоящее изобретение, кроме того, предоставляет способ выявления клетки, которая имеет недостаточную природную противовирусную реакцию, включающий контакт популяции клеток с комбинацией вируса миксомы и рапамицина; предоставление вирусу возможности инфицировать клетку, которая имеет недостаточную природную противовирусную реакцию; и определение инфекции любых клеток популяции клеток вирусом миксомы.
Настоящее изобретение, кроме того, основано на неожиданном обнаружении того, что белок M135R вируса кроличьей миксомы участвует в вызове иммунной реакции у кроликов и что штамм вируса миксомы, который не экспрессирует функциональный M135R, может уничтожать клетки in vitro, но не вызывает миксоматозного заболевания у животных. Такой вирусный штамм можно применять для обработки клеток, имеющих недостаточную природную противовирусную реакцию, включая клетки, которые не реагируют на интерферон, и включая виды лечения, проводимые с лекарственным препаратом рапамицином, без необходимости в повышенном содержании вируса, что приводит к повышенной безопасности.
В одном аспекте, настоящее изобретение предоставляет способ ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, включающий введение в клетку эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно, в комбинации с эффективным количеством рапамицина.
В одном аспекте, изобретение предоставляет способ лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию, включающий введение пациенту, нуждающемуся в нем, эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно, в комбинации с эффективным количеством рапамицина.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно в комбинации с эффективным количеством рапамицина, для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, и при изготовлении лекарственного препарата для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию.
Настоящее изобретение, кроме того, предоставляет применение эффективного количества вируса миксомы, который не экспрессирует функциональный M135R, необязательно в комбинации с эффективным количеством рапамицина, для лечения патологического состояния у пациента, причем патологическое состояние характеризуется наличием клеток, которые имеют недостаточную природную противовирусную реакцию, и при изготовлении лекарственного препарата для лечения такого патологического состояния у пациента.
В еще одном аспекте, настоящее изобретение предоставляет вирус миксомы, который не экспрессирует функциональный M135R.
В другом аспекте, настоящее изобретение предоставляет фармацевтическую композицию, включающую вирус миксомы, который не экспрессирует функциональный M135R. Фармацевтическую композицию можно применять для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию. Фармацевтическая композиция может, кроме того, включать рапамицин.
В другом аспекте, настоящее изобретение предоставляет набор, включающий вирус миксомы, который не экспрессирует функциональный M135R, и инструкции для ингибирования клетки, которая имеет недостаточную природную противовирусную реакцию, или для лечения патологического состояния, характеризуемого наличием клеток, которые имеют недостаточную природную противовирусную реакцию. Набор может, кроме того, включать рапамицин. Патологическое состояние включает рак и хроническую вирусную инфекцию.
Настоящее изобретение, кроме того, предоставляет способ выявления клетки, которая имеет недостаточную природную противовирусную реакцию, включающий контакт популяции клеток с комбинацией вируса миксомы, который не экспрессирует функциональный M135R, необязательно в комбинации с рапамицином; предоставление вирусу возможности инфицировать клетку, которая имеет недостаточную природную противовирусную реакцию; и определение инфекции любых клеток популяции клеток вирусом миксомы.
Другие аспекты настоящего изобретения станут очевидны средним специалистам в данной области после анализа следующего описания конкретных вариантов осуществления изобретения в сочетании с сопровождающими чертежами. Однако следует понимать, что подробное описание и определенные примеры, хотя и указывающие предпочтительные варианты осуществления изобретения, приведены только в качестве иллюстрации, поскольку для специалистов в данной области на основании этого подробного описания станут очевидными изменения и модификации в пределах сущности и объема изобретения.
Краткое описание чертежей
На чертежах, которые иллюстрируют варианты осуществления настоящего изобретения, только в виде примера.
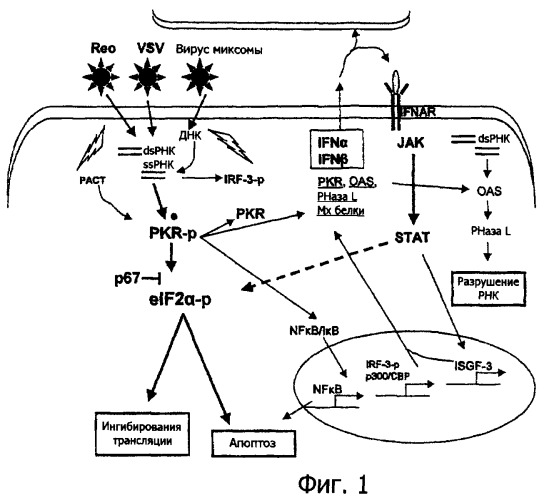
Фиг.1 представляет собой схематический график опосредованной интерфероном схемы передачи противовирусных сигналов, вызванной после вирусной инфекции клетки;
Фиг.2 представляет собой контрастную по фазе микрофотографию не пермиссивных мышиных эмбриональных фибробластов WT ("MEF") после контакта с вирусом миксомы, демонстрирующую, что MEF становятся пермиссивными после ингибирования интерферона α/β нейтрализующим антителом;
Фиг.3 представляет собой вестерн блот, показывающий состояния фосфорилирования (активации) STAT1 и STAT2 после инфекции вирусом миксомы, демонстрирующий, что не пермиссивные инфекции клеток MEF связаны с активацией STAT1 и STAT2;
Фиг.4 представляет собой вестерн блот, показывающий состояния фосфорилирования (инактивации) STAT3, STAT4, STAT5 и STAT6 после инфекции вирусом миксомы, демонстрирующий, что не пермиссивные инфекции клеток MEF не активирует ни один из этих видов;
Фиг.5 представляет собой контрастную по фазе микрофотографию IFNα/β R -/- MEF и STAT1 -/- MEF, показывающую, что инактивация передачи сигналов IFN/STAT/JAK после инфекции вирусом миксомы делает клетки пермиссивными для инфекции вирусом миксомы;
Фиг.6 представляет собой вестерн блот, показывающий состояния фосфорилирования PKR в MEF не пермиссивного дикого типа после инфекции вирусом миксомы, демонстрирующий, что PKR не активируется инфекцией вирусом миксомы;
Фиг.7 представляет собой вестерн блот, показывающий состояния фосфорилирования PKR в MEF дикого типа, или ложно инфицированные, или предварительно инфицированные вирусом миксомы, показывающий, что вирус миксомы блокирует активацию PKR в клетках MEF;
Фиг.8 представляет собой вестерн блот, показывающий состояния фосфорилирования PERK в MEF дикого типа после инфекции вирусом миксомы, показывающий, что вирус миксомы блокирует активацию PEKR в клетках MEF;
Фиг.9 представляет собой контрастную по фазе микрофотографию PKR-/-, РНазу L-/- и Mx1 -/- тройного «нокаута» после контакта с вирусом миксомы, показывающую, что противовирусное состояние у клеток MEF опосредовано определенным путем;
Фиг.10 представляет собой контрастную по фазе микрофотографию PKR-/-, РНазу L-/- и Mx1 -/- тройного «нокаута» после контакта с вирусом миксомы;
Фиг.11 представляет собой контрастную по фазе микрофотографию PKR-/-, РНазу L-/- и Mx1 -/- тройного «нокаута» после обработки нейтрализующим антителом к IFNα/β и после контакта с вирусом миксомы;
Фиг.12 представляет собой вестерн блот, показывающий уровни фосфорилирования eIF2α и PKR в не пермиссивных MEF после обработки нейтрализующим антителом к IFNα/β и после контакта с вирусом миксомы, показывающий, что фосфорилирование eIF2α в не пермиссивных клетках катализируется путем, независимым от PKR;
Фиг.13 представляет собой вестерн блот, показывающий состояния фосфорилирования STAT1 при тройном «нокауте» PKR-/-, РНазу L-/- и Mx1 -/- после инфекции вирусом миксомы, указывающий на нормальные реакции передачи сигналов, вызванные IFN;
Фиг.14 представляет собой контрастную по фазе микрофотографию, иллюстрирующую субклеточную локализацию фосфорилированного тирозином STAT1, в не пермиссивных клетках PKR-/-, РНазу L-/- и Mx1 -/- через 12 ч после инфекции, указывающую на то, что активированный STAT локализуется в ядре, как прогнозируется для нормальных реакций передачи сигналов IFN/STAT;
Фиг.15 представляет собой флюоресцентное изображение головного мозга бесшерстных мышей, имеющих внутричерепные глиомы, ложно инфицированные или инфицированные мертвым или живым вирусом миксомы, экспрессирующим GFP (гамма-фетопротеин), показывающее нацеливание вируса миксомы на клетки глиомы;
Фиг.16 представляет собой флюоресцентное изображение и фотографию тонких срезов мышиной глиомы, инфицированной вирусом миксомы, экспрессирующим GFP, показывающее, что вирус миксомы реплицировался только в опухолевых клетках;
Фиг.17 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли НТ29, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример не пермиссивной инфекции человеческих клеток;
Фиг.18 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли НОР92, окрашенных X-Gal или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример пермиссивной инфекции человеческих клеток;
Фиг.19 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли OVCAR4, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример пермиссивной инфекции человеческих клеток;
Фиг.20 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли SK-MEL3, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример пермиссивной инфекции человеческих клеток;
Фиг.21 представляет собой контрастную по фазе микрофотографию клеток человеческой опухоли SK-MEL28, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую пример полупермиссивной инфекции человеческих клеток;
Фиг.22 представляет собой контрастную по фазе микрофотографию клеток BGMK, окрашенных или X-Gal, или кристальным фиолетовым после инфекции вирусом миксомы, показывающую типичную пермиссивную контрольную инфекцию;
Фиг.23 представляет собой контрастную по фазе микрофотографию положительных контрольных клеток BGMK и линий клеток опухолей человека U87, A172 и U373, инфицированных увеличивающимися концентрациями вируса миксомы, экспрессирующего белок LacZ, окрашенных X-Gal, показывающую, что все эти клетки глиомы человека были пермиссивны в отношении репликации вируса миксомы;
Фиг.24 представляет собой графическое изображение, показывающее частоту выживания клеток BGMK, U87, A172 и U373, инфицированных вирусом миксомы, через 72 ч после инфекции, в увеличивающихся концентрациях вируса, демонстрирующее способность вируса миксомы уничтожать все эти клетки;
Фиг.25 представляет собой контрастную по фазе микрофотографию и флюоресцентную микрофотографию клеток астроцитомы SF04 1585, инфицированных MV GFP, показывающую инфекцию в клетках первичной глиомы человека;
Фиг.26 представляет собой контрастную по фазе микрофотографию клеток глиомы U373, инфицированных вирусом миксомы, экспрессирующим белок LacZ, и окрашенных X-Gal, показывающую инфекцию этих опухолевых клеток человека;
Фиг.27 представляет собой графическое изображение, показывающее частоту выживания клеток SF04 1585, инфицированных MV GFP, через 48 ч после инфекции, показывающее уничтожение этих инфицированных человеческих опухолевых клеток;
Фиг.28 представляет собой флюоресцентную микрофотографию линий клеток медуллобластомы Daoy и D384, инфицированных вирусом миксомы, экспрессирующим GFP, показывающую инфекцию этих человеческих опухолевых клеток;
Фиг.29 представляет собой графическое изображение скорости продукции вируса в различных линиях клеток при предварительной обработке рапамицином или без нее: BGMK (контрольная линия клеток приматов); RK-13 и RL5 (контрольные линии кроличьих клеток); 4T1 и B16F10 (линии мышиных раковых клеток); HOS, PC3, 786-0, HCT116, ACHN, MCF-7, M14 и COLO205 (линии человеческих раковых клеток); с использованием вируса vMyxLac дикого типа и «выключающего» М-Т5 вируса vMyxT5KO, как указано;
Фиг.30 представляет собой фотографии инфицированных вирусами линий клеток, инфицированных или vMyxLac дикого типа, или «выключающим» М-Т5 вирусом vMyxLacT5-;
Фиг.31 представляет собой графическое изображение скорости продукции вируса в различных линиях клеток (BGMK; A9; MCF-7; MDA-MB-435; M14; и COLO205) с предварительной обработкой рапамицина и без нее;
Фиг.32 представляет собой (А) схематическую выверку белка M135R вируса миксомы и белка B18R белка вируса коровьей оспы и (В) выверку аминокислотной последовательности между M135R и первыми 179 аминокислотами B18R;
Фиг.33 представляет собой (А) вестерн блот M135R, экспрессированного в клетках BGMK, инфицированных вирусом миксомы Lausanne (vMyxLau) и (В) вестерн блот M135R, экспрессированного в клетках BGMK, инфицированных вирусом vMyxLau и обработанных araC, туникамицином или моненсином;
Фиг.34 представляет собой (А) флюоресцентную микрофотографию клеток BGMK, ложно инфицированных или инфицированных вирусом миксомы и окрашенных для выявления M135R, и (В) вестерн блот против иммунопреципитаций или клеточных лизатов клеток, инфицированных вирусом миксомы дикого типа (vMyxgfp), или штаммом «выключенного» M135R (vMyx135KO) с использованием антитела против M135R;
Фиг.35 представляет собой (А) схематическую диаграмму стратегии клонирования для получения vMyx135KO, (В) - агарозный гель продукта вставки PCR (полимеразной реакции синтеза цепи) и (С) - вестерн блот клеток, инфицированных вирусом миксомы дикого типа и вирусом миксомы с «выключением» M135R;
Фиг.36 представляет собой кривую роста вирусных очагов в клетках BGMK, инфицированных vMyxgfp или vMyx135KO;
Фиг.37 представляет собой световую и флюоресцентную микрофотографии фибробластов кроличьего эмбриона, инфицированных vMyxgfp или vMyx135KO;
Фиг.38 представляет собой световую и флюоресцентную микрофотографии кроличьих фибробластов HIG82, инфицированных vMyxgfp или vMyx135KO;
Фиг.39 представляет собой световую и флюоресцентную микрофотографии первичных фибробластов человека, инфицированных vMyxgfp или vMyx135KO;
Фиг.40 представляет собой график температуры тела кроликов, инфицированных vMyxLau или vMyx135KO;
Фиг.41 представляет собой график эмиссий 125I клеток, ложно инфицированных или инфицированных vMyxgfp или vMyx135KO и обработанных кроличьим интерфероном α/β, меченным 125I;
Фиг.42 представляет собой график очагов, образованных инфицированием клеток RK13 или BGMK vMyxgfp или vMyx135KO, причем клетки были не обработаны или обработаны кроличьим интерфероном α/β за 24 ч до инфекции; и
Фиг.43 представляет собой фотографии вестерн блотов при использовании клеточных лизатов из клеток рака человека 786-0, которые были предварительно обработаны или 20 нМ рапамицина (R), или контролем носителя (D), зондированные с использованием антител, направленных против указанных белков.
Подробное описание
Ранее заявители обнаружили, что вирус миксомы дикого типа, вирус, который обычно инфицирует кроликов, может селективно инфицировать и уничтожать клетки, включая человеческие клетки, которые имеют недостаточную природную противовирусную реакцию, например клетки, которые не реагируют на интерферон, как описано в заявке PCT/CA2004/000341, которая полностью включена сюда в качестве ссылки. Вирус миксомы эффективно не реплицируется в нормальных клетках человека. Поскольку многие заболевания или состояния характеризуются наличием клеток, которые имеют недостаточную природную противовирусную реакцию, например, включая клетки, которые не реагируют на интерферон, например раковые клетки, вирус миксомы можно применять для лечения таких заболеваний и состояний, включая рак, при низкой токсичности для нормальных, здоровых клеток. Вирус миксомы можно также применять для лечения хронически инфицированных клеток, поскольку такие клетки имеют недостаточную природную противовирусную реакцию. Например, многие вирусы кодируют генные продукты, которые функционируют для ингибирования противовирусной, интерфероновой реакции клеток; вирус миксомы может селективно инфицировать такие клетки.
Вирус миксомы ("MV") представляет собой этиологический агент миксоматоза у кроликов. MV относится к роду Leporipoxvirus семейства Poxviridae, самого крупного из вирусов ДНК. MV вызывает заболевание у своего естественного хозяина, кролика Sylvilagus, в Северной и Южной Америке. Однако он представляет собой вирулентный и специфичный в отношении хозяина поксвирус, который вызывает летальное заболевание у европейских кроликов, характеризуемое поражениями, обнаруживаемыми системно, и особенно вокруг областей слизистых оболочек (Cameron C, Hota-Mitchell S, Chen L, Barrett J, Cao JX, Macaulay C, Willer D, Evans D, McFadden G. Virology 1999, 264(2): 298-318; Kerr P & McFadden G. Viral Immunology 2002, 15(2): 229-246).
MV представляет собой крупный вирус с геномом двухнитевой ДНК из 163 т.п.н., который реплицируется в цитоплазме инфицированных клеток (B. N. Fields, D. M. Knipe, P. M. Howley, Eds., Virology Lippincott Raven Press, New York, 2nd ed., 1996). Известно, что MV кодирует разнообразные клеточно-ассоциированные и секретируемые белки, которые, как считали, участвуют в подавляющей регуляции иммунных и воспалительных реакций хозяина и ингибировании апоптоза инфицированных вирусом клеток. MV может захватываться всеми соматическими клетками человека. Однако в отличие от нормальных соматических кроличьих клеток, если клетки имеют нормальную природную противовирусную реакцию, вирус не будет способен продуктивно инфицировать клетку, это означает, что вирус будет неспособен реплицироваться и вызывать гибель клетки.
Интерфероны ("IFNs") представляют собой семейство цитокинов, которые секретируются в ответ на разнообразные стимулы. Интерфероны связываются с рецепторами клеточной поверхности, активируя каскад передачи сигналов, который ведет к многочисленным клеточным реакциям, включая противовирусную реакцию и индукцию ингибирования роста и/или апоптозные сигналы. Интерфероны классифицируются или как I типа, или II типа. IFNs I типа включают IFN-α, -β, -τ и -ω, которые все являются мономерными; единственный IFN II типа представляет собой IFN-γ, димер. 12 различных подтипов IFN-α продуцируются 14 генами, но все другие IFNs являются моногенными (Arduini et al., 1999). IFNs оказывают прямое противоопухолевое действие посредством модуляции экспрессии онкогена. Избыточная экспрессия стимулирующих рост онкогенов или потеря онкогенов-опухолевых супрессоров может привести к злокачественной трансформации. Некоторые онкогены, участвующие в развитии рака, представляют собой p53, Rb, PC, NF1, WT1, DCC.
Вирус миксомы, так же как другие онколитические вирусы, такие как реовирус и VSV, должен обойти противовирусные защитные механизмы, которые существуют в нормальных, здоровых клетках, для того чтобы быть способным реплицироваться внутри клеток. MV и другие онколитические вирусы вызывают продукцию интерферона и в целом чувствительны к противовирусному эффекту пути IFN. Релевантные белки, индуцируемые противовирусной реакцией IFN и которые, главным образом, воздействуют на размножение вируса, включают PKR, OAS синтетазу и L нуклеазу РНазы. PKR активирует eIF2α, приводя к ингибированию трансляции и индукции апоптоза. Схематическое представление пути реакции IFN изображено на фиг.1. В нормальных клетках на MV непосредственно воздействует PKR и eIF2α.
Пути противовирусной реакции часто прерваны в раковых клетках. Например, сниженная или дефектная реакция на IFN представляет собой генетический дефект, который часто возникает во время процесса трансформации и опухолевого развития. Более 80% линий опухолевых клеток не реагируют на интерферон или проявляют нарушенные реакции на него (Stojdl et al., Cancer Cell (2003) 4: 263-275 и приведенные в документе ссылки; Wong et al. J Biol Chem. (1997) 272(45):28779-85; Sun et al. Blood. (1998) 91(2):570-6; Matin et al. Cancer Res. (2001) 61(5):2261-6; Balachandran et al. Cancer Cell (2004) 5(1):51-65). Как ранее описано в документе PCT/CA2004/000341, MV может инфицировать и уничтожать раковые клетки, включая человеческие опухолевые клетки, и без ограничения какой-либо конкретной теорией, считают, что MV может инфицировать эти клетки, потому что у них имеется недостаточная природная противовирусная реакция.
Имеющиеся данные свидетельствуют о том, что ингибирование ранней природной иммунной реакции и замедление развития реакций Th1 важны для эффективности онколитической терапии. Хотя вирус миксомы представляет собой вирулентный вирус, он специфичен в отношении хозяина и имеет очень узкий диапазон хозяев; он не инфицирует людей или мышей. Без ограничения какой-либо конкретной теорией, считают, что поскольку вирус миксомы представляет собой не человеческий вирус, он не должен столкнуться с ранее существовавшим иммунным распознаванием у людей. Поэтому его потенциал в качестве онколитического вируса будет меньше скомпрометирован, и вирус миксомы должен будет обеспечить более сильную инфекцию пермиссивных опухолевых клеток, чем нативные человеческие вирусы, и посредством этого может обеспечить эффективное онколитическое лечение рака.
Представляется, что ген М-Т5 диапазона хозяев вируса миксомы играет решающую роль во время инфекции вирусом миксомы многих линий клеток человеческих опухолей (Sypula et al, (2004) Gene Ther. Mol. Biol. 8:103). Ген МТ-5 кодирует белок повтора анкирина, который требуется для репликации вируса миксомы в кроличьих лимфоцитах, и вирус миксомы с делецией гена МТ-5 не может вызвать миксоматоз у восприимчивых кроликов (Mossman et al, (1996) J. Virol. 70: 4394). Имеющиеся доказательства свидетельствуют о том, что различия во внутриклеточной передаче сигналов внутри инфицированной человеческой опухолевой клетки имеют решающее значение для различения человеческих опухолевых клеток, которые пермиссивны к инфекции вирусом миксомы и продуктивной репликации (Johnston et al, (2003) J. Virol. 77: 5877).
Кроме того, вирус миксомы имеет белок, M135R, который проявляет гомологию с аминоконцевой частью рецептора интерферона α/β ("IFNα/β-R"). Предполагалось, что M135R имитирует IFNα/β-R хозяина для предотвращения запуска IFNα/β противовирусной реакции хозяина (Barrett et al., Seminars in Immunology (2001)13:73-84). Прогноз основан на гомологии последовательности с вирусным IFNα/β-R от вируса коровьей оспы, B18R, и было продемонстрировано, что вирус коровьей оспы ("VV") использует такую стратегию ухода от иммунных реакций. Однако M135R имеет только половину размера B18R VV и всех других гомологов IFNα/β-R из секвенированных поксвирусов и во всех случаях совпадает только с аминоконцевой половиной гомолога.
Заявители обнаружили, что даже хотя результаты иммунофлюоресценции свидетельствуют, что M135R локализуется на клеточной поверхности, попытки продемонстрировать способность M135R взаимодействовать с IFNα/β были отрицательными. Несмотря на эти результаты, заявители обнаружили, что делеция M135R резко ослабляет способность вируса миксомы вызвать заболевание у животных-хозяев, хотя вирус миксомы, имеющий такую делецию, одинаково эффективен в плане инфицирования и уничтожения клеток in vitro, в сравнении с MV дикого типа. Таким образом, в одном аспекте, изобретение относится к открытию, что вирус миксомы, который не экспрессирует функциональный M135R, можно использовать для обработки клеток, имеющих недостаточную природную противовирусную реакцию, включая применение для онколитических исследований, поскольку этот вирус предоставляет более безопасную альтернативу для онколитической вирусной терапии, поскольку для пациентов, подвергающихся лечению, не потребовались бы необычные стратегии сдерживания.
В другом аспекте, настоящее изобретение относится к открытию того, что противораковое средство рапамицин действует для усиления уровней инвазионной способности вируса миксомы в человеческих опухолевых клетках, которые пермиссивны в отношении инфекции вирусом миксомы, и что рапамицин обеспечивает возможность репликации определенных штаммов вируса миксомы в человеческих опухолевых клетках, которые без рапамицина рестриктивны в отношении репликации этих штаммов вируса миксомы. Клетка, которая пермиссивна в отношении инфекции вирусом миксомы, представляет собой клетку, в которую вирус может войти и в которой вирус может продуктивно в