Способ получения наноразмерных частиц сложных оксидов металлов
Иллюстрации
Показать всеИзобретение относится к способам получения наноразмерных порошков сложных оксидов металлов, которые могут быть использованы как электролиты и электродные материалы электрохимических устройств, а также в качестве компонентов каталитических систем. Сущность изобретения: способ получения наноразмерных частиц сложных оксидов металлов включает синтез оксидов, который осуществляют взаимодействием термически стойких расплавов галогенидов металлов с кислородсодержащей газовой фазой. Технический результат заключается в получении наночастиц сложных оксидных материалов с развитой удельной поверхностью, однородным гранулометрическим составом и в возможности их выделения новыми нетрадиционными методами, расширяющими спектр их практического использования. 2 з.п. ф-лы, 12 ил.
Реферат
Предлагаемое изобретение относится к способам получения наноразмерных порошков сложных оксидов металлов, которые могут быть использованы как электролиты и электродные материалы электрохимических устройств (литиевых аккумуляторов, высокотемпературных топливных элементов, электролизеров, сенсоров), а также в качестве компонентов каталитических систем.
Синтез сложных оксидных соединений различного состава и назначения в настоящее время приобрел очень широкое распространение, поскольку позволяет существенно расширить ассортимент получаемых материалов с заданными механическими, электрическими, магнитными, оптическими и другими свойствами. Хорошо известны используемые для этих целей способы твердофазного взаимодействия, золь-гель методы, метод СВС, размол с механохимической активацией и др.
В ряде публикаций для синтеза неорганических соединений, в том числе оксидов металлов, отмечена перспективность использования солевых расплавов. (Беляев И.Н, Евстифеев Е.Н. Ионные расплавы как среды для синтеза неорганических веществ - в кн.: Ионные расплавы. - Киев: Наукова думка, 1975, вып.3, с.153-166 [1]; Combes R. et al. Dissociation and solubility variation vs pO2- of some alkaline earth oxides in molten NaCl-KCl - Electrochimica Acta, 1980, v.25, No4, p.371-374 [2]; Делимарский Ю.К., Барчук Л.П. Прикладная химия ионных расплавов. - Киев: Наукова думка, 1988, 192 с.[3]; Витинг Л.М. Высокотемпературные растворы-расплавы. - М.: МГУ, 1991. - 221 с.) [4].
В большинстве случаев синтез проводили в термически неустойчивых расплавах солей щелочных и щелочноземельных элементов, разлагающихся при высоких температурах с образованием оксидов этих металлов, которые затем подвергали термическому отжигу, для того чтобы осуществить твердофазную реакцию с находящимися в реакторе оксидами переходных или редкоземельных металлов при температурах выше 1000°С. Синтез при таких температурах сопровождается агломерацией (укрупнением размера) образующихся сложных оксидов.
В ряде работ и изобретений последних лет описаны способы получения двойных (и более сложных) оксидов металлов в солевых расплавах либо за счет взаимодействия простых оксидов и (или) термически неустойчивых кислородсодержащих солей (нитратов, карбонатов и т.п.) как прекурсоров, либо проводя подобные реакции в расплавах бескислородных солей, использующихся в качестве инертных защитных сред. (Xiaohui Jiang, Junfeng Ma et al. Synthesis of ZnWO4 nano-particles by a molten salt method - Materials Letters, 2007, vol.61, p.4595-4598 [5]; Hongjun Zhou, Yuanbing Mao, and Stanislaus S.Wong. Probing Structure-Parameter Correlations in the Molten Salt Synthesis of BaZrO3 Perovskite Submicrometer-Sized Particles - Chem. Mater., 2007, vol.19, p.5238-5249 [6]; Коваленко И.В., Черненко Л.В., Хайнаков С.А., Лысин В.И., Андрийко А.А. // Укр. Хим. журн, 2008. Т.74, №3. С.52-54 [7]; Fabrication method of LiCoO2 nano powder by surface modification of precursor. United States Patent 6821679) [8].
Возможность получить такими способами продукты реакции с регулируемым и однородным гранулометрическим составом ограничена, поскольку единственным контролируемым параметром, регулирующим скорость протекания процесса и размер образующихся частиц, является температура. Поэтому традиционными, применяемыми в настоящее время способами, типичные из которых описаны в приведенных выше работах, достичь значительного прогресса в получении наночастиц оксидных материалов с развитой удельной поверхностью, однородным гранулометрическим составом, от которых зависит высокая электрохимическая и каталитическая активность и др. полезные свойства, не удается.
Исходя из вышесказанного разработка новых воспроизводимых способов получения функциональных материалов, сформированных из наноразмерных частиц, до сих пор остается актуальной задачей.
В основу предлагаемого способа положены описанные в литературе реакции замещения ионов галогена в расплавленных галогенидах металлов и их смесях ионами кислорода при контакте этих солей с газообразным кислородом, воздухом или парами воды. (Smirnov M.V., Tkacheva O.Yu. Interaction of Oxygen with Molten Alkali Chlorides - Electrochim. Acta, 1992, vol.37, p.781-788 [9]; Smirnov M.V., Korzun I.V., Oleynikova V.A. Hydrolysis of Molten Alkali Chlorides, Bromides and Iodides - Electrochim. Acta, 1988, vol.33, p.781-788 [10]; Николаева E.B., Бове А.Л., Гаврилов А.Г. Влияние рО среды на термодинамическую стабильность кислородсодержащих соединений РЗМ в различных расплавленных растворителях на основе хлоридов щелочных металлов - Расплавы, 2006, №4, с.34-44) [11].
В предлагаемом способе в качестве исходных реакционных сред использованы расплавленные смеси термически устойчивых в широких температурных интервалах галогенидов щелочных, щелочноземельных, редкоземельных и переходных металлов, играющих роль своеобразных «прекурсоров» при синтезе сложных оксидов. При взаимодействии галогенидов металлов с кислородом устанавливается динамическое равновесие между исходными и конечными продуктами реакции, например:
2MX+1/2O2↔M2O+X2;
2M'X2+3/2O2↔M'2O3+2X2,
где М - щелочной металл, М' - переходный металл, X - галоген.
Равновесия этих реакций, как правило, смещены в левую сторону (Smirnov M.V., Tkacheva O.Yu. Interaction of Oxygen with Molten Alkali Chlorides - Electrochim. Acta, 1992, vol.37, p.781-788 [9]; Anufrieva T.A., Derlyukova L.E. Reactions of Cobalt Oxide with Chlorine - Russian J. Inorg. Chemistry, 2007, vol 52, No.12, p.1840-1843 [12]). Однако выводя образовавшиеся продукты из зоны взаимодействия галогенидов с кислородом, можно постоянно поддерживать определенную концентрацию взаимодействующих между собой весьма реакционно-способных молекул оксидов металлов, которые образуют конечный продукт приведенных выше реакций - не растворимые в галогенидном расплаве сложные оксиды различных металлов, химический состав которых зависит от катионного состава исходных галогенидных расплавов:
M2O+M'2O3=2MM'O2↓.
Подбирая состав галогенидного расплава, температуру и парциальное давление кислорода (воды), можно тонко регулировать как скорость протекания реакций с образованием частиц сложного оксида, так и их размеры. Сама ионная по своей природе солевая среда препятствует агломерации образующихся наноразмерных частиц, сольватированных ионами солевого расплава. Более того, это позволяет выделить продукты реакции не традиционным (например, фильтрацией, центрифугированием), а электрохимическим методом.
В качестве примера реализации предлагаемого способа рассмотрим синтез наноразмерных частиц кобальтата лития (LiCoO2), идентификацию их химического и гранулометрического состава и выделения в виде тонких пленок на различных металлических поверхностях.
1. Реакционными средами служили расплавленные смеси хлоридов лития и кобальта разного состава, которые при температурах 620 или 720°C были обработаны кислородсодержащим газом (сухим воздухом) в течение 6-8 часов либо путем его барботирования через расплав, либо созданием потока газа над расплавом.
За это время в расплаве происходило накопление нерастворимого в нем конечного продукта, образовавшегося в результате следующих реакций:
2LiCl+1/2O2↔Li2O+Cl2;
2CoCl2+3/2O2↔Co2O3+2Cl2;
Li2O+Co2O3=2LiCoO2↓.
2. После охлаждения расплава, содержащего продукты реакции, солевой плав был растворен в дистиллированной воде. Полученную взвесь продуктов реакции в водном растворе электролита, содержащего хлориды лития и кобальта, фильтровали через два слоя плотного бумажного фильтра (синяя полоса). Однако большая часть взвешенного в растворе продукта реакции проходила через фильтр, указывая на малые размеры нерастворимых в электролитическом растворе частиц.
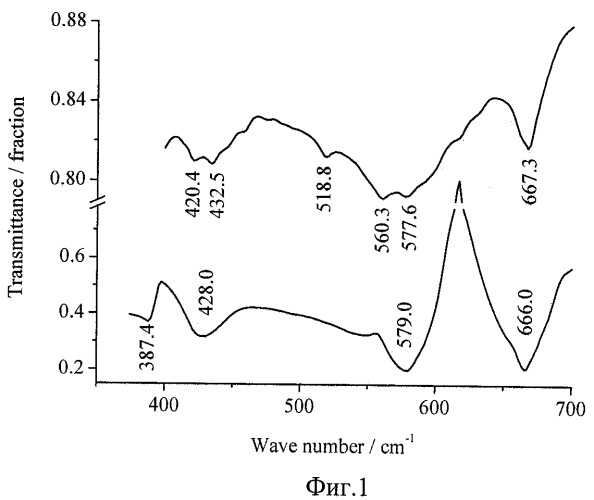
3. Для идентификации химического состава полученного продукта часть осевшего промытого порошка была проанализирована методом инфракрасной (ИК) спектроскопии. Результаты анализа, показанные на фиг.1, свидетельствовали о том, что отфильтрованный осадок представляет собой кобальтат лития с малыми примесями оксидов кобальта (Co2O3 и Co3O4).
4. Оставшийся фильтрат представлял собой ультрадисперсную систему из взвешенных в растворе электролита мельчайших частиц продуктов реакции, которые нельзя было отделить от раствора повторной фильтрацией. Поэтому для выделения частиц был использован метод электрофореза, который осуществляли в специально сконструированной электрохимической ячейке с двумя пластинчатыми металлическими (никелевыми, медными) электродами. Между ними помещали фильтрат (взвесь мелких частиц в растворе электролита). При пропускании через электролит постоянного тока наблюдали перемещение взвешенных частиц к одному из электродов и их осаждение на его поверхности. Этот процесс осуществляли 6-8 часов, после чего пластину с осадком вынимали из раствора, промывали дистиллированной водой и сушили. Затем поверхность пластины подвергали всестороннему исследованию для установления химического и гранулометрического состава покрытия, его толщины и морфологических особенностей.
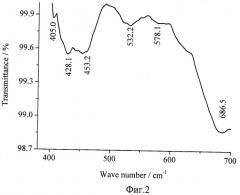
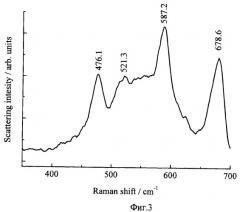
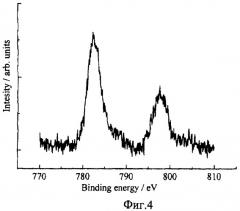
5. Исследования химического состава осажденных частиц методами ИК спектроскопии (фиг.2.), комбинационного рассеяния света (фиг.3) и рентгеновской фотоэлектронной спектроскопии (фиг.4) показали, что он, как и отфильтрованный осадок, по своему химическому составу соответствовал кобальтату лития (LiCoO2), спектры которого известны (A.W.Moses, H.G.Garcia Flores, J.-G.Kim, and M.A.Langell. Surface properties of LiCoO2, LiNiO2 and LiNi1-xCoxO2 - Applied Surface Science 253:10 (March 15, 2007), pp.4782-4791 [13]; Christopher M.Burba, K.M.Shaju, P.G.Bruce and R.Frech. Infrared and Raman spectroscopy of nanostructured LT-LiCoO2 cathodes for Li-ion rechargeable batteries - Vibrational Spectroscopy, Vol.51, Issue 2, 10 November 2009, pp.248-250 [14]; M. Jo, Y.-S.Hong, J. Choo, and J. Choa. Effect of LiCoO2 Cathode Nanoparticle Size on High Rate Performance for Li-Ion Batteries - J. Electrochem. Soc. 2009, 156, No.6, pp.A430-A434) [15].
Как показали эллипсометрические исследования, в зависимости от времени осаждения кобальтата лития указанным выше способом толщину слоя можно было менять от 100 до 250 нм.
Наконец, размеры и форма (морфология) полученных описанным выше способом частиц LiCoO2 были определены методом сканирующей электронной микроскопии. На фиг.5, 6, 7, 8, 9, 10, 11 и фиг.12 ясно видно, что полученные и осажденные на металлических поверхностях частицы имеют разную форму (веретенообразную, игольчатую, глобулярную) и достаточно однородны по своему гранулометрическому составу. В зависимости от контролируемых условий синтеза частиц в солевом расплаве (его химического состава, температуры, способа и скорости формирования содержащего кислород газового потока) размер частиц (диаметр глобул или толщина игл) менялся от 20 до 200 нм.
Предложенный способ обладает рядом положительных качеств и преимуществ, отличающих его от известных решений, связанных с синтезом наноразмерных частиц сложных оксидов. Одним из существенных преимуществ является снижение температуры процесса на сотни градусов, обеспечивающее значительное уменьшение энергозатрат. Другой положительный эффект от использования этого способа связан с простотой его реализации и возможностью тонко регулировать размер и морфологию частиц при изменении не только температуры и состава исходных веществ, но и содержания (парциального давления) кислорода в газовой фазе, скорости и способа обмена кислорода с солевым расплавом. Преимуществом предлагаемого способа является также возможность формирования тонких слоев функционального оксидного наноматериала, не проводящего электрический ток в обычных условиях, на желаемой электропроводной (например, металлической) поверхности легко осуществимым и контролируемым электрохимическим способом.
Новый технический результат, достигаемый заявляемым изобретением, заключается в получении наночастиц сложных оксидных материалов с развитой удельной поверхностью, однородным гранулометрическим составом и возможностью их выделения новыми нетрадиционными методами, расширяющими спектр их практического использования.
1. Способ получения наноразмерных частиц сложных оксидов металлов, включающий синтез оксидов, который осуществляют взаимодействием термически стойких расплавов галогенидов металлов с кислородсодержащей газовой фазой.
2. Способ по п.1, отличающийся тем, что в качестве исходных реакционных сред для синтеза оксидов используют расплавленные смеси термически устойчивых в широких температурных интервалах галогенидов щелочных, щелочноземельных, редкоземельных и переходных металлов.
3. Способ по п.1, отличающийся тем, что синтезированные наноразмерные частицы осаждают на поверхности электропроводных материалов методом электрофореза.