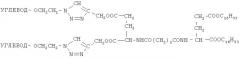
Бивалентные неогликоконъюгаты на основе диэфира l-глутаминовой кислоты и способ их получения
Иллюстрации
Показать всеИзобретение относится к области биоорганической химии, в частности к производным аминокислот и пептидов, принадлежащих к классу алифатических диэфиров, содержащих два углеводных остатка. Техническим результатом предлагаемого изобретения является повышение афинности углеводных остатков к белкам через создание новых бивалентных лигандов на основе диэфира L-глутаминовой кислоты, специфичных к соответствующим рецепторам, содержащих в своем составе остатки различных углеводов (например, лактозы, маннозы и др.), по реакции 1,3-диполярного циклоприсоединения. Использование двух углеводных остатков в структуре бивалентного неогликоконъюгата способствует увеличению в 6 раз эффективности связывания по сравнению с моновалентным производным монолактозил-L-глутамат-сукцинат-дигексадецил-L-глутаминовой кислоты, что может быть использовано для создания высокоэффективных направленных систем доставки лекарственных препаратов. 2 н.п. ф-лы, 2 пр.
Реферат
Изобретение относится к области биоорганической химии, в частности производным аминокислот и пептидов, принадлежащих к классу алифатических диэфиров, содержащих два углеводных остатка.
Применение бивалентного производного углевода в качестве лиганда асиалогликопротеиновых рецепторов, галектинов и других рецепторов в зависимости от выбранного гликозида является перспективным направлением для увеличения аффинности связывания транспортных систем с соответствующими белками.
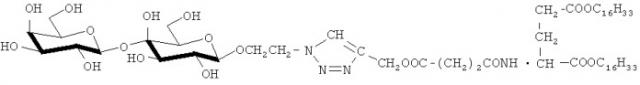
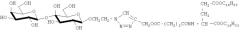
Структурообразующими компонентами бивалентных неогликоконъюгатов на основе диэфира L-глутаминовой кислоты являются углеводные остатки и фрагменты двух диэфиров L-глутаминовой кислоты.
Известно моновалентное производное лактозы, в котором спейсерная часть молекулы представлена производным диэтиленгликоля.
Наличие углеводного остатка и использование спейсера способствует связыванию конъюгата с соответствующими рецепторами. Однако недостатком указанного соединения является его достаточно высокая цитотоксичность (за счет наличия дисульфидной связи) и низкая эффективность связывания с лектином RCA.
Наиболее близким техническим решением к заявленному изобретению является монолактозил-L-глутамат-сукцинат-дигексадецил-L-глутаминовой кислоты.
В этом соединении наличие диэфира L-глутаминовой кислоты способствует фиксации производного в липидном бислое, а лактозильный остаток служит лигандом галактоспецифичных рецепторов для придания наносистемам адресной функции. Однако наличие лишь одного углеводного остатка в составе молекулы обеспечивает недостаточно высокую эффективность взаимодействия с соответствующими рецепторами или лектинами.
Техническим результатом предлагаемого изобретения является повышение аффинности углеводных остатков к белкам через создание новых бивалентных лигандов на основе диэфира L-глутаминовой кислоты, специфичных к соответствующим рецепторам, содержащих в своем составе остатки различных углеводов (например, лактозы, маннозы и других), по реакции 1,3-диполярного циклоприсоединения.
Дигексадециловый эфир L-глутаминовой кислоты является производным природной аминокислоты, поэтому соединения на его основе обладают низкой токсичностью и высокой биодеградируемостью. Применение принципа «click-chemistry», основанного на реакции 1,3-диполярного циклоприсоединения, позволяет быстро и эффективно синтезировать предлагаемый конъюгат. Наличие двух углеводных остатков повышает эффективность взаимодействия и константу связывания производного со специфичными рецепторами поверхности клетки.
Для достижения указанного технического результата разработан способ получения соединения, включающий следующие стадии: синтез дипропаргилового эфира сукцината дигексадецилового эфира L-глутаминовой кислоты, синтез азидоэтильного производного углевода и конъюгацию этих компонентов с образованием 1,3-триазольного соединительного кольца.
Реализация данного изобретения подтверждается примерами.
Пример 1. Синтез дилактозила-L-глутамат-сукцинат-дигексадецил-L-глутаминовой кислоты.
К 0,5 г дигексадецилового эфира L-глутаминовой кислоты прибавляют 0,126 г ангидрида янтарной кислоты. После перемешивания в течение 10 ч карбоксильную группу соединения активируют N-гидроксисукцинимидом в присутствии дициклогексилкарбодиимида и добавляют 0,065 г дипропаргилового эфира L-глутаминовой кислоты. Дипропаргиловый эфир сукцината дигексадецилового эфира L-глутаминовой кислоты выделяют колоночной хроматографией в системе хлороформ-метанол, 10:1. Выход 0,345 г (45%), Rf 0,73 (хлороформ-метанол, 5:1).
Масс-спектр [М]+: 901,661 (М+).
К раствору 2,003 г 1,2,3,6,2',3',4',6'-окта-O-ацетил-β-D-лактозида прибавляют 1,18 мл 2-бромэтанола в присутствии эфиратного комплекса трехфтористого бора и выдерживают 6 ч при комнатной температуре. Реакционную массу нейтрализуют 25%-ным раствором аммиака до pH 7. Раствор промывают 3×50 мл водой.
Полученный 2,3,6,2',3',4',6'-гепта-O-ацетил-1-O-(2-бромэтил)-β-D-лактозид выделяют колоночной хроматографией в системе гексан-этилацетат, 5:1. Выход 2,034 г (86%), Rf 0,43 (гексан-этилацетат, 3:1).
1Н-ЯМР-спектр (δ, м.д.): 1.96, 2.01, 2.02, 2.03, 2.05, 2.07, 2.09 (с, 24Н, COCH3), 3.25-3.42 (т, 4Н, OCH2CH2), 3.60-3.63 (м, 2Н, Н-5, Н-5'), 3.80-4.0 (м, 2Н, Н-6), 4.10-4.20 (м, 2Н, Н-6'), 4.30-4.35 (д, 1Н, Н-4), 4.50-4.55 (д, 1Н, Н-1, J1,2 7,8 Гц), 4.53-4.58 (д, 1Н, Н-1', J1,2 7,7 Гц), 4.90-5.0 (д, 1H, Н-3'), 5.20-5.34 (м, 2Н, Н-2, Н-2'), 5.18-5.26 (м, 2Н, Н-4', Н-3).
К 200 мг полученного соединения добавляют 85,8 мг азида натрия и перемешивают при температуре 65°C в течение 20 ч. Реакционную массу фильтруют, выливают в 20 мл воды и экстрагируют 3×30 мл безводного хлороформа. Органический слой отделяют, растворитель удаляют в вакууме.
Получают 2,3,6,2',3',4',6'-гепта-O-ацетил-1-O-(2-азидоэтил)-β-D-лактозид. Выход 170 мг (78%), Rf 0,54 (гексан-этилацетат, 3:1).
1Н-ЯМР-спектр (δ, м.д.): 1.96, 2.01, 2.02, 2.03, 2.05, 2.07, 2.09 (с, 24Н, COCH3), 3.25-3.42 (т, 4Н, ОСН2СН2), 3.60-3.63 (м, 2Н, Н-5, Н-5'), 3.80-4.0 (м, 2Н, Н-6), 4.10-4.20 (м, 2Н, Н-6'), 4.30-4.35 (д, 1Н, Н-4), 4.50-4.55 (д, 1H, Н-1, J1,2 7,8 Гц), 4.53-4.58 (д, 1H, Н-1', J1,2 7,7 Гц), 4.90-5.0 (д, 1H, Н-3'), 5.20-5.34 (м, 2Н, Н-2, Н-2'), 5.18-5.26 (м, 2Н, Н-4', Н-3).
К раствору 200 мг 2,3,6,2',3',4',6'-гепта-O-ацетил-1-O-(2-азидоэтил)-β-D-лактозида в сухом метаноле при перемешивании при комнатной температуре прибавляют 0,2 мл свежеприготовленного 0,1 М раствора метилата натрия до достижения pH 8. Обессоливают раствор ионообменной смолой КУ-2 (H+-форма), фильтруют и удаляют растворитель в вакууме.
Получают 1-O-(2-азидоэтил)-β-D-лактозид. Выход 0,108 г (93%), Rf 0,06 (гексан-этилацетат, 3:1).
ИК-спектр: (νmax, см-1): 3300 (O-H), 2900, 1435, 1340 (C-H), 1215 (C-O), 1140-1030 (C-O, 4 полосы, углеводный скелет).
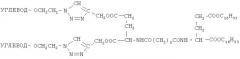
К 50 мг 1-O-(2-азидоэтил)-β-D-лактозида добавляют 35,8 мг дипропаргилового эфира сукцината дигексадецилового эфира L-глутаминовой кислоты. Реакцию ведут в ацетонитриле в присутствии каталитического количества CuI и DIPEA. Получают дилактозил-L-глутамат-сукцинат-дигексадецил-L-глутаминовой кислоты. Выход 0,048 г (57,4%), Rf 0,23 (хлороформ-метанол, 3:1).
Масс-спектр [М]+: 1723,461 (М+).
Пример 2. Синтез диманнозила-L-глутамат-сукцинат-дигексадецил-L-глутаминовой кислоты.
Дипропаргиловый эфир сукцината дигексадецилового эфира L-глутаминовой кислоты получают аналогично примеру 1.
К раствору 5,12 г 1,2,3,4,6-пента-O-ацетил-α-D-маннопиранозида прибавляют 1,14 мл 2-бромэтанола в присутствии эфиратного комплекса трехфтористого бора и выдерживают 12 часов при 20°C. Реакционную массу нейтрализуют 25%-ным раствором аммиака до pH 7. Раствор промывают 3×100 мл воды.
Полученный 2,3,4,6-тетра-O-ацетил-1-O-(2-бромэтил)-α-D-маннопиранозид выделяют колоночной хроматографией в системе гексан-этилацетат, 5:1. Выход 3,342 г (59%), Rf 0,45 (гексан-этилацетат, 3:1).
1Н-ЯМР-спектр (CDCl3, δ, м.д.): 1.99, 2.05, 2.10, 2.16 (с, 12Н, COCH3), 3.50-3.53 (т, 2Н, OCH2CH2), 3.86-4.0 (м, 2Н, OCH2CH2), 4.10-4.16 (м, 2Н, Н-6), 4.24-4.30 (дд, 1Н, Н-5), 4.88-4.87 (д, 1Н, Н-1, J12 1,78), 5.26-5.31 (м, 2Н, Н-2, Н-4), 5.34-5.37 (дд, 1Н, Н-3).
К 200 мг полученного соединения добавляют 85,8 мг азида натрия и перемешивают при температуре 65°C в течение 20 ч. Реакционную массу фильтруют, выливают в 30 мл воды и экстрагируют 3×30 мл безводного хлороформа. Органический слой отделяют, растворитель удаляют в вакууме.
Получают 2,3,4,6-тетра-О-ацетил-1-О-(2-азидоэтил)-α-D-маннопиранозид. Выход 0,170 г (78%), Rf 0,65 (гексан-этилацетат, 3:1).
1Н-ЯМР-спектр (CDCl3, δ, м.д): 1.99, 2.05, 2.10, 2.16 (с, 12Н, COCH3), 3.50-3.53 (т, 2Н, OCH2CH2), 3.86-4.0 (м, 2Н, OCH2CH2), 4.10-4.15 (м, 2Н, Н-6), 4.24-4.29 (дд, 1Н, Н-5), 4.88-4.87 (д, 1H, Н-1, J12 1,78), 5.26-5.31 (м, 2Н, Н-2, Н-4), 5.34-5.37 (дд, 1Н, Н-3).
К 200 мг 2,3,4,6-тетра-O-ацетил-1-O-(2-азидоэтил)-α-D-маннопиранозида в безводном метаноле при перемешивании при комнатной температуре прибавляют 0,1 мл свежеприготовленного 0,1 М раствора метилата натрия в метаноле до достижения pH 8. Обессоливают раствор ионообменной смолой КУ-2 (H+-форма), фильтруют и удаляют растворитель в вакууме.
Получают 1-O-(2-азидоэтил)-α-D-маннопиранозид. Выход 0,125 г (82%) Rf 0,15 (гексан-этилацетат, 3:1).
ИК-спектр: (νmax, см-1): 3300 (O-H), 2900, 1435, 1340 (C-H), 1215 (C-O), 1140-1030 (C-O, 4 полосы, углеводный скелет).
К 50 мг 1-O-(2-азидоэтил)-α-D-маннопиранозида добавляют 28,8 мг дипропаргилового эфира сукцината дигексадецилового эфира L-глутаминовой кислоты. Реакцию ведут в ацетонитриле в присутствии каталитического количества CuI и DIPEA.
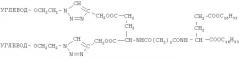
Получают диманнозил-L-глутамат-сукцинат-дигексадецил-L-глутаминовой кислоты. Выход 0,044 г (45,4%), Rf 0,19 (хлороформ-метанол, 3:1).
Масс-спектр [М]+: 1399,691 (М+).
С использованием синтезированных бивалентных неогликоконъюгатов получают смешанные липосомы и исследуют их взаимодействие с лектинами.
Синтезированные соединение встраивают в липосомы на основе дигексадецил-N-(L-орнитил)-L-глутамата в количестве 5%. Частицы имеют размер 45-61 нм, который является оптимальным для транспортных систем. Приготовленные коллоидные растворы сохраняют стабильность в течение недели при хранении при комнатной температуре.
К 2 мл дисперсий липосом, содержащих соответствующий бивалентный неогликоконъюгат (2 мг/мл), прибавляют 10 мкл 1% раствора лектина и записывают кинетику связывания, измеряя изменение оптической плотности растворов при 400 нм через определенные промежутки времени.
Использование двух углеводных остатков в структуре бивалентного неогликоконъюгата способствует увеличению в 6 раз эффективности связывания по сравнению с моновалентным производным монолактозил-L-глутамат-сукцинат-дигексадецил-L-глутаминовой кислоты, что может быть использовано для создания высокоэффективных направленных систем доставки лекарственных препаратов.
1. Бивалентные неогликоконъюгаты на основе диэфира L-глутаминовой кислоты как лиганды углеводспецифичных рецепторов.
2. Способ получения бивалентных неогликоконъюгатов на основе диэфира L-глутаминовой кислоты, включающий следующие стадии: синтез дипропаргилового эфира сукцината дигексадецилового эфира L-глутаминовой кислоты, синтез азидоэтильного производного углевода и конъюгацию этих компонентов с образованием 1,3-триазольного соединительного кольца.