Применение дрожжевых клеточных стенок для лечения и/или предупреждения гиперинсулинемии
Иллюстрации
Показать всеИзобретение относится к области фармацевтики. Применяют дрожжевые клеточные стенки в получении фармацевтической композиции для лечения и/или предупреждения гиперинсулинемии у пациента, который не является диабетиком. При этом дрожжевые клеточные стенки имеют суммарное содержание глюканов и маннанов по меньшей мере 34,0% от содержания сухого вещества по массе и содержание гликогена менее чем 10,0% от содержания сухого вещества по массе. Использование заявленного изобретения позволяет повысить эффективность применения дрожжевых клеточных стенок, а также эффективность предупреждения и лечения гиперинсулинемии, обусловленной устойчивостью к инсулину, избыточной массой, ожирением или метаболическим синдромом. 15 з.п. ф-лы, 2 пр., 3 табл., 4 ил.
Реферат
Настоящее изобретение относится к применению дрожжевых клеточных стенок для лечения и/или предупреждения гиперинсулинемии.
Инсулин представляет собой гипогликемический гормон, секретируемый β-клетками островков Лангерганса поджелудочной железы. Инсулин может снижать гликемию, в частности, посредством активации транспорта глюкозы в ткани-мишени (мышцы, печень и жировые ткани).
Диабет типа 2 характеризуется устойчивостью к инсулину, переходящей во время первой фазы в гиперинсулинизм. Некоторые виды ожирения также обусловлены гиперинсулинизмом. Для диабета с устойчивостью к инсулину могут быть предписаны лекарственные препараты, которые могут снижать избыточный сахар в крови без стимуляции секреции инсулина (например, метформин).
В документе JP-A-61-167622 предложен агент для борьбы с диабетом, содержащий клеточную фракцию пивных дрожжей, называемую в данном документе клеточной стенкой, и полученный путем гидролиза пивных дрожжей со сниженной горечью в течение по меньшей мере 2 часов при температуре от 50 до 70°С и водной экстракции водорастворимых компонентов. Указанная клеточная фракция пивных дрожжей, в частности, имеет содержание глюканов около 14,8%, содержание маннанов около 13,9%. Указанная клеточная фракция также имеет содержание гликогена около 24,9%. Гликоген представляет собой резервный полисахарид, также присутствующий в мышцах и, в частности, в печени. Этот гликоген также является резервным веществом дрожжей, используемым дрожжами в качестве источника энергии для обеспечения их выживания. Хотя он является одним из основных компонентов клеточной фракции в данной японской заявке, он не составляет часть клеточной стенки дрожжей.
В патентной заявке WO 2005/021015 описано применение дрожжевых клеточных стенок для предупреждения и лечения гипергликемии и стабилизации гликемии, где эти дрожжевые клеточные стенки имеют низкое содержание гликогена и могут быть получены с использованием простого способа ферментативного автолиза или гидролиза. Суммарное содержание глюканов и маннанов указанных дрожжевых клеточных стенок составляет по меньшей мере 34,0% масс/масс сухого вещества.
β-глюканы клеточной стенки дрожжей представляют собой по существу полимеры глюкозы, глюкозные звенья которых в основной цепи связаны β-1,3 связями, и ветви которых связаны β-1,6 связями, β-глюканы дрожжей нерастворимы и обладают низкой вязкостью.
β-глюканы, очищенные из дрожжевой клеточной стенки, обладают иммуностимулирующими свойствами. В частности, показано, что β-глюканы дрожжей способны к связыванию с макрофагами и их активации. β-глюканы дрожжей были исследованы на их применение в качестве антибактериальных, антивирусных и противоопухолевых средств (Adams D.S., Journal of Leukocyte Biology, 1997).
Сущность настоящего изобретения составляет применение дрожжевых клеточных стенок в качестве агента, регулирующего инсулин.
Одним из объектов изобретения является, в частности, применение дрожжевых клеточных стенок для лечения и/или предупреждения гиперинсулинемии.
Одним из объектов настоящего изобретения является применение дрожжевых клеточных стенок для получения фармацевтической композиции, предназначенной для лечения и/или предупреждения гиперинсулинемии, где дрожжевые клеточные стенки имеют:
- суммарное содержание глюканов и маннанов по меньшей мере 34,0% содержания сухого вещества по массе, и
- содержание гликогена менее чем 10,0% содержания сухого вещества по массе.
Термин «дрожжевые клеточные стенки» относится к нерастворимой фракции дрожжевых клеток, не обогащенной хромом, полученной после автолиза или ферментативного гидролиза, в частности, протеазами, приводящего к солюбилизации по меньшей мере 50% и предпочтительно по меньшей мере 60% масс/масс сухого вещества цельных дрожжевых клеток и сохранению структурных полисахаридов клеточной стенки, то есть β-глюканов и маннанов, где эти маннаны находятся в форме маннопротеинов.
Этот автолиз или ферментативный гидролиз проводят таким образом, чтобы солюбилизировать большую часть резервных сахаров дрожжевой клетки, то есть гликоген и трегалозу. Дрожжевые клеточные стенки получают путем отделения солюбилизированной фракции, используя автолиз или ферментативный гидролиз, предпочтительно в течение по меньшей мере 18 часов. Предпочтительные способы автолиза дрожжевой суспензии описаны на стр.370-377 в справочнике «Yeast Technology» 2nd edition, 1991, G.Reed and T.W.Nogodawithana, опубликованном Van Nostrand Reinhold, New York, ISBN 0-442-31892-8. Дрожжевые клеточные стенки, полученные таким образом, затем обычно высушивают, используя общепринятый способ высушивания, такой как распылительная сушка или сушка на нагретых вальцах.
Дрожжевые клеточные стенки по изобретению имеют суммарное содержание глюканов и маннанов в клеточной стенке (систематически выраженное в эквивалентной массе глюкозы и маннозы соответственно - см. способы измерения ниже) по меньшей мере 34,0% масс/масс сухого вещества и содержание гликогена (систематически выраженное в эквивалентной массе глюкозы - см. способы измерения ниже) менее чем 10,0% масс/масс сухого вещества.
Под «гиперинсулинемией» подразумевают как базальную гиперинсулинемию, так и постпрандиальную гиперинсулинемию. В одной предпочтительной форме осуществления дрожжевые клеточные стенки по изобретению применяют для предупреждения и/или лечения постпрандиальной гиперинсулинемии. Альтернативно дрожжевые клеточные стенки по изобретению применяют для предупреждения и/или лечения базальной гиперинсулинемии. В другой форме осуществления дрожжевые клеточные стенки по изобретению применяют для предупреждения и/или лечения как базальной гиперинсулинемии, так и постпрандиальной гиперинсулинемии.
Базальная гиперинсулинемия характеризуется высоким базальным уровнем инсулина в плазме. Базальный уровень соответствует уровням инсулина между приемами пищи, в частности при голодании человека. Физиологический базальный уровень обычно равен или ниже 10 МЕ/л у стройного здорового индивидуума. Следовательно, базальная гиперинсулинемия может быть охарактеризована базальным уровнем между приемами пищи (в частности, во время голодания) более чем 10 МЕ/л.
Постпрандиальная гиперинсулинемия соответствует избыточному ответу инсулина после приема пищи.
О постпрандиальной гиперинсулинемии может свидетельствовать оральный тест на толерантность к глюкозе (ОТТГ). Физиологический ответ на тест ОТТГ характеризуется пиком секреции инсулина обычно между 30 и 60 МЕ/л у здорового стройного индивидуума. Следовательно, постпрандиальная гиперинсулинемия может быть охарактеризована ответом на ОТТГ с пиком секреции инсулина более чем 60 МЕ/л.
Уровень инсулина в плазме пациента измеряют, используя общепринятые методики, известные специалистам в данной области техники. В частности, РИА тест (радиоиммунологический анализ) можно проводить на образце плазмы, взятом у пациента (например, РИА, Biosurce, Medgenix Diagnostics, Rungis, France).
Цель лечения гиперинсулинемии состоит в снижении базального уровня инсулина в плазме и/или в восстановлении физиологического ответа инсулина после приема пищи.
Цель предупреждения гиперинсулинемии, в частности, состоит в поддержании базального уровня инсулина в плазме при физиологических значениях и/или в поддержании физиологического ответа инсулина после приема пищи.
Сущностью изобретения, в частности, является лечение и/или предупреждение постпрандиальной гиперинсулинемии.
Объектом изобретения, в частности, является применение, как определено выше, где клеточные стенки принадлежат дрожжам рода Saccharomyces cerevisiae.
Указанные дрожжи предпочтительно представляют собой пекарские дрожжи. Пекарские дрожжи представляют собой дрожжи, принадлежащие к виду Saccharomyces cerevisiae, продуцируемые по существу путем аэробного размножения или культивирования, как указано в справочнике «Yeast Technology», цитируемом выше, и которые не применены ни для какой цели до их автолиза или ферментативного гидролиза, в противоположность, например, пивным дрожжам, которые являются побочным продуктом производства пива и, следовательно, служили для производства пива перед их сбором для ферментативного автолиза или гидролиза. Эти пивные дрожжи культивировали по существу в анаэробных условиях (поскольку производство пива является анаэробным процессом).
Объектом настоящего изобретения является применение, как определено выше, где дрожжевые клеточные стенки имеют суммарное содержание глюканов и маннанов по меньшей мере 40,0% содержания сухого вещества по массе, предпочтительно по меньшей мере 45,0% содержания сухого вещества по массе.
Полезно, чтобы дрожжевые клеточные стенки по изобретению имели содержание белка N x 6,25 от 17,0 до 35,0% содержания сухого вещества по массе, предпочтительно от 18,0 до 26,0% содержания сухого вещества по массе.
Частным случаем изобретения является применение, как определено выше, где дрожжевые клеточные стенки имеют содержание маннана менее чем 30% содержания сухого вещества по массе.
В одной предпочтительной форме осуществления изобретения содержание маннанов дрожжевых клеточных стенок находится между 20 и 26% содержания сухого вещества по массе. Данная форма осуществления соответствует дрожжевым клеточным стенкам, полученным путем ферментативного автолиза или гидролиза, отделения солюбилизированной фракции и высушивания нерастворимой фракции, такой как описано выше и в примере 1.1 (раздел под заголовком: Получение дрожжевых клеточных стенок, содержащих маннаны). Указанный продукт после орального теста на толерантность к глюкозе (ОТТГ) дает возможность получения сниженного пика инсулина по сравнению с плацебо у пациентов, страдающих диабетом типа 2 (см. пример 2).
Объектом изобретения, в частности, является применение, как определено выше, где дрожжевые клеточные стенки имеют содержание маннанов менее чем 2% содержания сухого вещества по массе, в частности менее чем 1% содержания сухого вещества по массе, в частности менее чем 0,1% содержания сухого вещества по массе.
В другой предпочтительной форме осуществления изобретения содержание маннанов дрожжевых клеточных стенок ниже, чем 0,1% содержания сухого вещества по массе.
Маннаны могут быть удалены горячей щелочной обработкой. Горячая щелочная обработка состоит в помещении в водную суспензию дрожжевых клеточных стенок по изобретению, полученных, как описано выше, и в нагревании суспензии в щелочной среде примерно при 70°С и 100°С в течение максимального времени три часа. Фракцию, солюбилизированную этой обработкой, содержащую большую часть маннопротеинов и даже все маннопротеины, удаляют путем центрифугирования и отмывки. Остаточную не солюбилизированную фракцию собирают и обычно высушивают.
Предпочтительно маннаны удаляют горячей щелочной обработкой с последующей кислотной обработкой для полного удаления маннанов.
Эти обработки подробно описаны в разделе примеров.
При получении указанных продуктов из исходных дрожжевых клеточных стенок, подвергнутых горячей щелочной обработке и, может быть, кислотной обработке, такой как описана выше (см. также пример 1.1, раздел под заголовком: Получение дрожжевых клеточных стенок, свободных от маннанов), и в которых маннаны полностью или почти полностью удалены (глюканы представляют большую часть суммарного содержания глюканов и маннанов), возможно, после теста ОТТГ, получить сниженный пик инсулина по сравнению с плацебо и даже по сравнению с дрожжевыми клеточными стенками, в которых маннаны не удалены, у пациентов, страдающих диабетом типа 2 или избыточной массой (см. пример 2).
Объектом настоящего изобретения является применение, как определено выше, где дрожжевые клеточные стенки имеют суммарное содержание глюканов и маннанов, равное или меньшее чем 90% содержания сухого вещества по массе, в частности равное или меньшее чем 80% содержания сухого вещества по массе, в частности равное или меньшее чем 70% содержания сухого вещества по массе.
Объектом настоящего изобретения более конкретно является применение, как определено выше, где дрожжевые клеточные стенки имеют суммарное содержание глюканов и маннанов от 45 до 90% содержания сухого вещества по массе, в частности от 52% до 80% содержания сухого вещества по массе, предпочтительно от 65% до 77% содержания сухого вещества по массе и более предпочтительно от 72% до 77% содержания сухого вещества по массе. Следовательно, согласно одной особенно предпочтительной форме осуществления содержание глюканов и маннанов находится между 72% и 77% содержания сухого вещества по массе.
В частности, в одной конкретной форме осуществления, объектом настоящего изобретения является применение, как определено выше, где содержание глюканов и маннанов находится между 72% и 77% содержания сухого вещества по массе, и содержание маннанов составляет менее чем 2% содержания сухого вещества по массе, в частности менее чем 1% содержания сухого вещества по массе, в частности менее чем 0,1%.
Альтернативно содержание глюканов и маннанов может быть также равным или меньшим 55% содержания сухого вещества по массе, при условии, что оно остается выше, чем 45% содержания сухого вещества по массе.
Следовательно, согласно одной предпочтительной форме осуществления содержание глюканов и маннанов находится между 52% и 57% содержания сухого вещества по массе.
В частности, в одной конкретной форме осуществления объектом настоящего изобретения является применение, как определено выше, где содержание глюканов и маннанов находится между 52% и 57% содержания сухого вещества по массе, и содержание маннанов составляет менее чем 2% содержания сухого вещества по массе, в частности менее чем 1% содержания сухого вещества по массе, в частности менее чем 0,1%.
Объектом настоящего изобретения является применение, как определено выше, где дрожжевые клеточные стенки имеют содержание гликогена менее чем 8,0% содержания сухого вещества по массе, предпочтительно менее чем 5,0% содержания сухого вещества по массе, предпочтительно менее чем 3,0% содержания сухого вещества по массе, предпочтительно менее чем 1,0% содержания сухого вещества по массе, и более предпочтительно менее чем 0,1% содержания сухого вещества по массе.
Чтобы удалить гликоген полностью или почти полностью из дрожжевых клеточных стенок, дрожжевые клеточные стенки по изобретению можно подвергать горячей щелочной обработке, такой как описано выше, и предпочтительно горячей щелочной обработке с последующей кислотной обработкой.
При указанной обработке возможно получение дрожжевых клеточных стенок согласно изобретению, имеющих суммарное содержание глюканов и маннанов от 45% до 90% содержания сухого вещества по массе, предпочтительно от 52% до 80% содержания сухого вещества по массе, предпочтительно от 65% до 77% содержания сухого вещества по массе и более предпочтительно от 72 до 77% содержания сухого вещества по массе. При указанной обработке возможно, в частности, получение дрожжевых клеточных стенок, которые также содержат менее чем 1,0% содержания сухого вещества по массе гликогена, предпочтительно менее чем 0,1% содержания сухого вещества по массе гликогена.
Фармацевтическую композицию согласно изобретению можно вводить в различных формах или презентациях.
Фармацевтическая композиция согласно изобретению содержит по меньшей мере одно активное вещество, представленное дрожжевыми клеточными стенками, и фармацевтически приемлемый носитель.
Фармацевтическая композиция по изобретению может содержать одно или более чем одно другое активное вещество, например, выбранное среди гипогликемических агентов или инсулин-сенсибилизирующих агентов, и, в частности, среди гипогликемических сульфамидов, бигуанида, метформина и производных тиазолидиндиона, ингибиторов α-глюкозидаз.
Композиция может также содержать один или более чем один витамин, в частности, выбранный среди витамина А, витамина С, витамина D, витамина Е, витамина К, витаминов В1 (тиамина), В2 (рибофлавина), В3 (ниацина), В5 (пантотеновой кислоты), В6, В8 (биотина), В9 (фолиевой кислоты), В12 (кобаламина), и/или один или более чем один пищевой минерал, в частности, выбранный среди кальция, фосфора, калия, натрия, магния и железа.
Объектом настоящего изобретения также являются фармацевтические композиции, такие как определено выше, содержащие хром.
Фармацевтическая композиция может содержать один или более фармацевтически приемлемых эксципиентов.
В одной предпочтительной форме осуществления фармацевтическая композиция согласно изобретению пригодна для введения пероральным путем.
Фармацевтическая композиция может, в частности, находиться в форме таблетки, капсулы, пилюли, порошка, гранулы или суспензии.
Фармацевтическая композиция по изобретению может, в частности, находиться в форме принимаемой дозы, соответствующей количеству сухого вещества дрожжевых клеточных стенок согласно изобретению менее чем 10 г, предпочтительно от 8 до 9 г.
В одной предпочтительной форме осуществления объектом настоящего изобретения является применение, как определено выше, где дрожжевые клеточные стенки имеют содержание сухого вещества, равное или большее чем 90%, предпочтительно равное или большее чем 94% и более предпочтительно равное или большее чем 96% масс/масс.
При содержании сухого вещества, равном или большем чем 90%, предпочтительно равном или большем чем 94%, и более предпочтительно равном более чем 96%, возможно получение лучшего сохранения дрожжевых клеточных стенок, в частности лучшей бактериологической стабильности и лучшей стабильности против вредных реакций, ферментативного или не ферментативного происхождения.
Объектом настоящего изобретения является применение дрожжевых клеточных стенок, как определено выше, для предупреждения и/или лечения гиперинсулинемии, либо базальной, либо постпрандиальной гиперинсулинемии, независимо от происхождения гиперинсулинемии.
Объектом изобретения, в частности, является применение дрожжевых клеточных стенок, как определено выше, для предупреждения и/или лечения гиперинсулинемии, обусловленной устойчивостью к инсулину, избыточной массой, ожирением или метаболическим синдромом, у любого типа пациента, страдающего гиперинсулинемией данного происхождения.
Однако, хотя изобретение подразумевают для предупреждения и лечения любого типа гиперинсулинемии, у любого типа пациента, в одной предпочтительной форме осуществления дрожжевые клеточные стенки по изобретению применяют для получения лекарственного средства, предназначенного для предупреждения и/или лечения гиперинсулинемии у пациента, не являющегося диабетиком. В данном случае объектом настоящего изобретения, в частности, является применение дрожжевых клеточных стенок, как определено выше, для предупреждения и/или лечения гиперинсулинемии, обусловленной устойчивостью к инсулину, избыточной массой, ожирением или метаболическим синдромом, у людей, не являющихся диабетиками.
Альтернативно дрожжевые клеточные стенки согласно изобретению можно также применять для получения лекарственного средства, предназначенного для предупреждения и/или лечения гиперинсулинемии у пациента с диабетом типа 2. Объектом настоящего изобретения, таким образом, является, в частности, применение дрожжевых клеточных стенок, как определено выше, для предупреждения и/или лечения гиперинсулинемии, обусловленной устойчивостью к инсулину, избыточной массой, ожирением или метаболическим синдромом, у человека с диабетом типа 2.
Под «диабетом типа 2» также подразумевают инсулиннезависимый диабет ИНЗД. Диабет типа 2 характеризуется гликемией натощак более чем 1,26 г/л.
Когда гликемия натощак составляет между 1,10 г/л и 1,26 г/л, используют термин аномалия гликемии.
В частности, объектом настоящего изобретения является применение дрожжевых клеточных стенок, как определено выше, для предупреждения и/или лечения гиперинсулинемии во время первых стадий диабета типа 2.
Под «устойчивостью к инсулину» подразумевают отсутствие ответа инсулинозависимых тканей на действие инсулина. Тогда поджелудочная железа продолжает секретировать инсулин, уровни которого в плазме становятся слишком высокими.
Под «избыточной массой» или «ожирением» подразумевают избыточную массу. У взрослых людей избыточная масса характеризуется индексом массы тела (ИМТ) между 25 и 30 кг/м2, а ожирение - индексом массы тела (ИМТ) более чем 30 кг/м2. Индекс массы тела у человека определяют приведенной ниже формулой:
Выражение «избыточная масса или ожирение у людей, не являющихся диабетиками» означает избыточную массу или ожирение, как определено выше, у людей, гликемия которых правильно регулируется.
В частности, уровень глюкозы в плазме натощак у людей, не являющихся диабетиками, составляет менее чем 1,26 г/л (7 ммоль/л), в частности менее чем 1,10 г/л (6,1 ммоль/л).
Под выражением «метаболический синдром» подразумевают группу факторов риска развития сердечно-сосудистых расстройств, инсульта и диабета типа 2.
Диагноз метаболического синдрома основан на оценке нескольких параметров, включая размер талии, уровни холестерина и триглицеридов, гликемию натощак, инсулинемию и кровяное давление.
В частности, в соответствии с NCEP-ATPIII (Национальной образовательной программой по холестерину - III Доклада группы экспертов по лечению взрослых), метаболический синдром диагностируют, если присутствуют три или более чем три из приведенных ниже факторов риска:
- размер талии более чем 88 см у женщин и более чем 102 см у мужчин,
- уровень холестерина ЛПВП менее чем 1 ммоль/л у мужчин и 1,2 ммоль/л у женщин,
- уровень триглицеридов, равный или больший чем 1,7 ммоль/л,
- гликемия натощак, равная или большая 6,1 ммоль/л,
- кровяное давление выше 130 мм Hg/85 мм Hg.
Постпрандиальная гиперинсулинемия может, в частности, играть роль в развитии метаболического синдрома.
Настоящее изобретение также относится к способу лечения и/или предупреждения гиперинсулинемии у пациента, включающему введение пациенту фармацевтической композиции согласно изобретению.
Способ лечения и/или предупреждения гиперинсулинемии может, в частности, представлять собой способ лечения и/или предупреждения гиперинсулинемии, обусловленной устойчивостью к инсулину, избыточной массой, ожирением или метаболическим синдромом. В одной предпочтительной форме осуществления пациент представляет собой пациента, не являющегося диабетиком. Альтернативно пациент может также представлять собой пациента с диабетом типа 2.
Изобретение, в частности, относится к указанному способу, при котором фармацевтическую композицию вводят пациенту посредством перорального пути.
Различные способы согласно изобретению могут, в частности, включать введение пациенту фармацевтической композиции в суточной дозе, соответствующей 1-10 г, предпочтительно 8-9 г дрожжевых клеточных стенок согласно изобретению, где указанную суточную дозу возможно вводить в однократной дозе или одновременно с приемом пищи, например с завтраком, либо в нескольких частичных дозах, то есть распределенных в течение суток.
Способы по изобретению могут также включать по меньшей мере одну стадию проверки для проверки базального уровня инсулина пациента и/или ответа инсулина, следующего за приемом пищи, либо теста ОТТГ, после однократного или продолжительного введения фармацевтической композиции.
Способы согласно изобретению могут также включать стадию измерения для измерения базального уровня инсулина пациента и/или для оценки ответа инсулина после приема пищи или теста ОТТГ перед однократным или продолжительным введением вышеописанной фармацевтической композиции.
Настоящее изобретение также относится к способу снижения или стабилизации базального уровня инсулина в плазме у пациента, страдающего базальной гиперинсулинемией, включающему введение пациенту эффективного количества фармацевтической композиции согласно изобретению.
Способ снижения или стабилизации базального уровня инсулина в плазме может, в частности, относиться к пациенту, страдающему базальной гиперинсулинемией, обусловленной устойчивостью к инсулину, избыточной массой, ожирением или метаболическим синдромом. В одной предпочтительной форме осуществления пациент представляет собой пациента, не являющегося диабетиком. Альтернативно пациент может также представлять собой пациента с диабетом типа 2.
Настоящее изобретение также относится к способу снижения пика секреции инсулина после приема пищи у пациента, страдающего постпрандиальной гиперинсулинемией, включающему введение пациенту эффективного количества фармацевтической композиции согласно изобретению.
Способ снижения пика секреции инсулина после приема пищи может, в частности, относиться к пациенту, страдающему постпрандиальной гиперинсулинемией, обусловленной устойчивостью к инсулину, избыточной массой, ожирением или метаболическим синдромом. В одной предпочтительной форме осуществления пациент представляет собой пациента, не являющегося диабетиком. Альтернативно пациент может также представлять собой пациента с диабетом типа 2.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
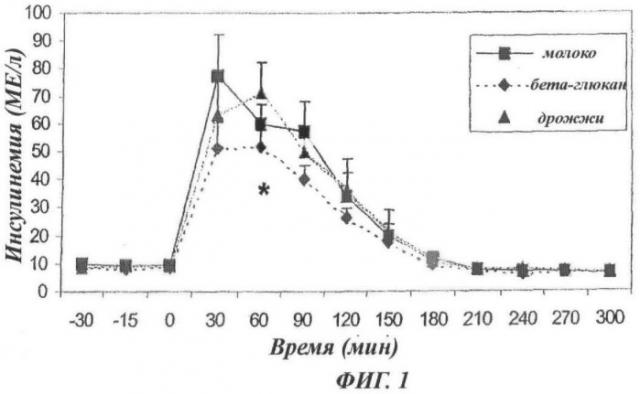
- Фиг.1: Кинетика постпрандиальной инсулинемии у пациентов с избыточной массой (n=12).
Результаты 3 суток исследования приведены в виде среднего ± СОС. Инсулинемия в контролях, которые принимали молоко, показана в виде сплошной линии с квадратами, у людей, которые принимали дрожжевые клеточные стенки без маннанов (бета-глюканы), в виде пунктирной линии с ромбиками, и у людей, которые принимали дрожжевые клеточные стенки с маннанами, в виде точечной линии с треугольниками. Уровень инсулина (в МЕ/л) приведен в виде функции времени в минутах (мин).
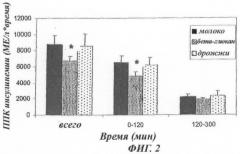
- Фиг.2. Тенденция в постпрандиальной инсулинемии, показанная в виде площади под кривой (ППК) у пациентов с избыточной массой (n=12).
Результаты 3-суточного исследования приведены в виде среднего ± СОС. Площадь под кривой, полученная у контрольных людей, которые принимали молоко, показана в виде черного столбика, у людей, которые принимали дрожжевые клеточные стенки без маннанов (бета-глюканы), в виде плотно заштрихованного столбика, и у людей, которые принимали дрожжевые клеточные стенки с маннанами, в виде неплотно заштрихованного столбика. Площадь для инсулинемии (в МЕ/л по времени) приведена за период 0-300 минут (всего), период 0-120 минут и период 120-300 минут.
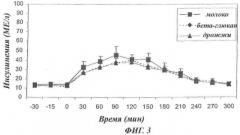
- Фиг.3: Кинетика постпрандиальной инсулинемии у людей с диабетом типа 2 (n=11).
Результаты 3-суточного исследования приведены в виде среднего ± СОС. Инсулинемия в контролях, которые принимали молоко, показана в виде сплошной линии с квадратами, у людей, которые принимали дрожжевые клеточные стенки без маннанов (бета-глюканы), в виде пунктирной линии с ромбиками, и у людей, которые принимали дрожжевые клеточные стенки с маннанами, в виде точечной линии с треугольниками. Уровень инсулина (в МЕ/л) приведен в виде функции времени в минутах (мин).
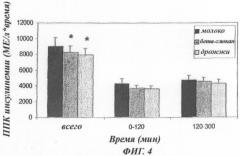
- Фиг.4: Тенденция в постпрандиальной инсулинемии, показанная в виде площади под кривой (ППК) у пациентов с диабетом типа 2 (n=11).
Результаты 3-суточного исследования приведены в виде среднего ± СОС. Площадь под кривой, полученная в контролях, которые принимали молоко, показана в виде черного столбика, у людей, которые принимали дрожжевые клеточные стенки без маннанов (бета-глюканы), в виде плотно заштрихованного столбика, и у людей, которые принимали дрожжевые клеточные стенки с маннанами, в виде неплотно заштрихованного столбика. Площадь для инсулинемии (в МЕ/л по времени) приведена за период 0-300 минут (всего), период 0-120 минут и период 120-300 минут.
ПРИМЕРЫ
Пример 1: Получение дрожжевых клеточных стенок согласно изобретению
1. Материал и методы
Получение дрожжевых клеточных стенок, содержащих маннаны
Водное дрожжевое молоко (то есть суспензию дрожжевых клеток в воде) Saccharomyces cerevisiae, имеющее содержание сухого вещества между 12 и 18% масс/масс, подвергают гидролизу, используя эндогенные ферменты дрожжевых клеток, не обязательно с добавлением протеаз, экзогенных для дрожжевых клеток, таких как, например, папаин. Гидролиз проводят при 50°С в течение 24 часов, чтобы солюбилизировать по меньшей мере 60% масс/масс сухого вещества дрожжевых клеток.
На практике и обычно автолиз и ферментативный гидролиз по изобретению проводят при температуре между 45°С и 55°С в течение 18-36 часов без использования какого-либо фермента, который может солюбилизировать глюканы или маннопротеины.
Солюбилизированную фракцию отделяют от нерастворимой фракции в нескольких последовательных стадиях путем центрифугирования и промывания водой.
Нерастворимую фракцию высушивают на нагретых вальцах до содержания сухого вещества 95% масс/масс. Образовавшиеся агломераты удаляют путем просеивания, и получают дрожжевые клеточные стенки по изобретению.
Получение дрожжевых клеточных стенок, не содержащих маннанов
Дрожжевые клеточные стенки, полученные, как описано выше, помещают в водную суспензию и обрабатывают в щелочной среде при температуре между 70°С и 100°С в течение периода не более трех часов. В частности, суспензию в щелочном водном растворе гидроксида натрия нагревают до 85°С в течение двух часов.
Фракцию, солюбилизированную этой обработкой, удаляют, и оставшуюся не солюбилизированную фракцию собирают, промывают и, как правило, высушивают. Солюбилизированную фракцию, содержащую маннопротеины, а также гликоген, удаляют путем центрифугирования и промывания.
Дрожжевые клеточные стенки, полученные после горячей щелочной обработки, предпочтительно подвергают кислотной обработке для удаления каких-либо следов маннопротеина. Нерастворимую фракцию затем подкисляют фосфорной или уксусной кислотой, затем инкубируют при 80°С в течение одного-двух часов. Солюбилизированную фракцию, содержащую остатки маннопротеинов, гликогена, а также некоторые липиды, удаляют путем центрифугирования и промывания.
Измерение содержания гликогена
К образцу 20 мг высушенных дрожжевых клеточных стенок, то есть имеющих содержание сухого вещества по меньшей мере 90% масс/масс, добавляют 0,5 мл 0,25 М Nа2CO3, и эту смесь держат при 95°С в течение 4 часов.
Затем смесь доводят до рН 5,2 добавлением 0,3 мл 1 М уксусной кислоты и 1,2 мл 0,2 М ацетата натрия и смешиванием ингредиентов. Добавляют дистиллированную воду до суммарного объема 2 мл.
0,5 мл суспензии, полученной таким образом, инкубируют в течение 15 часов в присутствии избытка амилоглюкозидазы Aspergillus niger, такой как имеется в продаже от фирмы ROCHE под № по каталогу 102857 при 55°С.
После центрифугирования высвобожденную глюкозу анализируют с помощью ферментативного анализа.
Ферментативный анализ глюкозы, в частности, описан в руководстве «Methods of Biochemical Analysis and Food Analysis - using Single reagents», опубликованном BOEHRINGER MANNHEIM GmbH Biochemica © 1989, с.50-55, и предпочтительно его проводят, используя "Test-Combination D-Glucose/-Fructose" № по каталогу 139106 от дочерней компании ROCHE: BOEHRINGER MANNHEIM GmbH/R-BIOPHARM GmbH, Дармштадт, Германия.
Количество (в мг) глюкозы, проанализированной таким образом, соответствует количеству гликогена, присутствующего в образце, выраженное в эквивалентной массе глюкозы.
Измерение суммарного содержания глюканов и маннанов
Образец 20 мг высушенных дрожжевых клеточных стенок, то есть имеющих содержание сухого вещества по меньшей мере 90% масс/масс, подвергают кислотному гидролизу путем смешивания с 20 мл 2 н. НСl, и смесь держат в закрытой пробирке с завинчивающейся крышкой в течение 4 часов при 103°С в печи при встряхивании каждые 15 мин.
Затем кислый раствор, полученный таким образом, нейтрализуют, и определяют относительное количество глюкозы и маннозы ферментативным путем в нейтрализованном растворе.
Этот ферментативный анализ глюкозы и маннозы также описан на с.50-55 цитируемого выше руководства, и предпочтительно его проводят, используя "Test-Combination" № по каталогу 139106.
Вычисляют разность между количеством глюкозы (выраженное в мг), определенным с использованием этого способа, и количеством глюкозы (также выраженном в мг), определенным для этих дрожжевых клеточных стенок с использованием вышеописанного способа измерения содержания гликогена.
Это различие (в мг) между двумя аналитически определенными количествами глюкозы соответствует суммарному количеству глюканов, присутствующих в образце, где это количество выражено в эквивалентной массе глюкозы.
Количество (в мг) аналитически определенной маннозы соответствует суммарному количеству маннанов, присутствующих в образце, где это количество выражено в эквивалентной массе маннозы.
2. Результаты
Дрожжевые клеточные стенки, полученные таким образом, имеют содержание сухого вещества 95% масс/масс.
Композиция дрожжевых клеточных стенок, содержащих маннаны, и дрожжевых клеточных стенок, свободных от маннанов (полученных горячей щелочной обработкой), приведена в таблице 1.
| Таблица 1: | ||||
| Композиция дрожжевых клеточных стенок согласно изобретению | ||||
| Дрожжевые клеточные стенки, содержащие маннаны | Дрожжевые клеточные стенки, не содержащие маннанов | |||
| Анализ в г на 100 г продукта | Поглощение энергии в ккал/г | Анализ в г на 100 г продукта | Поглощение энергии в ккал/г | |
| Углеводы: | 49,9 | 2,046 | 55,1 | 2,259 |
| Глюканы | 28,2 | 55,1 | ||
| Маннаны | 21,7 | 0 | ||
| Белки | 23,6 | 1,298 | 2,2 | 0,121 |
| Липиды | 11,8 | 1,109 | 21,6 | 2,03 |
Для обоих типов дрожжевых клеточных стенок содержание гликогена составляло менее чем 10% содержания сухого вещества по массе.
Пример 2: Влияние дрожжевых клеточных стенок по изобретению на уровень инсулина людей с избыточной массой, не являющихся диабетиками, и у людей с инсулиннезависимым диабетом
В остальной части документа дрожжевые клеточные стенки, содержащие маннаны, названы «дрожжевые клеточные стенки», и дрожжевые клеточные стенки, не содержащие маннанов, называют «бета-глюканы».
1. Материалы и методы
Субъекты, характеристики и объем выборки
В исследовании принимали участие 24 волонтера 2 типов: 12 здоровых волонтеров с избыточной массой и 12 пациентов с диабетом типа 2 (мужчины или женщины).
Для волонтеров с избыточной массой критериями включения являлись: индекс массы тела между 25 и 30 кг/м2 (включительно), возраст между 30 и 65 годами (включительно), нормальная гликемия натощак: <7 ммоль/л, HbAlc: <6%, общий холестерин: ≤7,0 ммоль/л, триглицериды: ≤4,0 ммоль/л.
Для субъектов с диабетом типа 2 критериями включения являлись: возраст между 30 и 65 годами (включительно), лечение метформином и/или гипогликемическими сульфамидами и/или глинидами и/или глитазонами в течение по меньшей мере 3 месяцев, HbAlc: <10%, общий холестерин: ≤7,0 ммоль/л, триглицериды: ≤4,0 ммоль/л.
Основными критериями исключения являлись: диабет типа 1, диабет типа 2, который лечили инсулином или акарбозой, инсулинопения, хроническая почечная или печеночная недостаточность, история болезни хронического желудочно-кишечного заболевания, эндокринная патология, лечение с возможным вмешательством в метаболизм углеводов и режим питания, непереносимость коровьего молока, клаустрофобия (калориметрические измерения в условиях Canopy®), беременные женщины, люди, потребляющие большие количества продуктов из перечня запрещенных пищевых продуктов.
Только у одного человека с диабетом оказалась инсулинопения во время первой индуцированной гипергликемии, и, следовательно, он был исключен из испытания, поскольку не соответствовал определенным критериям включения. 23 других субъекта завершили исследование.
Оральный тест на толерантность к глюкозе (ОТТГ)
Испытание проводили в течение 3 суток госпитализации, разделенных интервалом от 7 до 14 суток. Каждому субъекту давали каждый из 3 ОТТГ, которые проводили в случайном порядке.
В тестах ОТТГ использовали 8 г дрожжевых клеточных стенок и 9 г бета-глюканов. Следует отметить, что потребление дрожжевых клеточных стенок в запланированной дозе 8