Изолированное антитело или его антигенсвязывающий фрагмент, специфическое(ий) для человеческого иммуноглобулина е (варианты), кодирующая его молекула нуклеиновой кислоты, клетка-хозяин, способ получения антитела или его антигенсвязывающего фрагмента, фармацевтическая композиция, применение ее для лечения расстройств, ассоциированных с ige
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к таким связывающим элементам, специфичным для IgE, как молекулам антитела и его антигенсвязывающим, фрагментам. Антитело и его варианты, специфичные для IgE, являются полезными для лечения расстройств, опосредованных IgE, включая аллергии и астму. 8 н. и 9 з.п. ф-лы, 17 ил., 8 табл., 9 пр.
Реферат
Область изобретения
Изобретение относится к связывающим элементам, в частности к молекулам антитела, для IgE. Связывающие элементы в числе прочего являются полезными для лечения расстройств, опосредованных IgE, включая аллергии и астму.
IgE представляет собой члена семейства иммуноглобулинов и опосредует аллергические ответы, такие как астма, пищевые аллергии, гиперчувствительность типа 1 и воспаление носовых пазух.
IgE секретируется и экспрессируется на поверхности В-клеток. Вкратце, IgE прикрепляется к мембране В-клетки с помощью трансмембранного домена, который является связанным с молекулой зрелого IgE посредством короткого мембраносвязывающего участка. IgE может также быть связан с помощью своего Fc участка с В-клетками, моноцитами, эозинофилами и тромбоцитами посредством рецептора IgE с низкой аффинностью (FcεRII, который также является известным как CD23). При воздействии аллергена В-клетки, которые продуцируют специфический для аллергена IgE, клонально размножаются. Специфический для аллергена IgE потом высвобождается в системное русло крови В-клетками, где он, в свою очередь, связывается с В-клетками с помощью FcεRII, а также с тучными клетками и базофилами посредством рецептора с высокой аффинностью (FcεRI). Такие тучные клетки и базофилы, таким образом, сенсибилизируются с помощью аллергена. Последующее воздействие аллергена перекрестно связывает FcεRI на тучных клетках и базофилах, активируя таким образом высвобождение ими гистамина и других факторов, ответственных за клиническую гиперчувствительность и анафилаксию.
Связывающие элементы, которые ингибируют связывание и функциональную активность посредством FcERI с одновременным ингибированием FcERII или без его ингибирования являются полезными для ингибирования опосредованных IgE болезненных состояний, таких как аллергии и астма.
При этом является понятным, что FcεRI и FcεRII связываются с сайтом(ами) узнавания в константном (Fc) домене IgE. Были предприняты различные исследования для идентификации таких сайтов узнавания. Например, пептиды, соответствующие специфическим частям IgE молекулы, использовали либо в качестве конкурентных ингибиторов связывания IgE с рецептором (Burt и др., Eur. J. Immun, 17: 437-440 [1987]; Helm и др., Nature, 331:180-183 [1988]; Helm и др., Proc. Natl. Acad. Sci., 86: 9465-9469 [1989]; Vercelli и др., Nature, 338: 649-651 [1989]; Nio и др., Peptide Chemistry, 203-208 [1990]), либо для стимуляции выработки анти-IgE антител, которые могут блокировать взаимодействие IgE с рецептором (Burt и др., Molec. Immun. 24: 379-389 [1987]; Robertson и др., Molec. Immun., 25:103-113 [1988]; Baniyash и др., Molec. Immun. 25: 705-711 [1988]).
Недавно был получен Xolair® (Омализумаб), который продается для лечения пациентов с астмой. Xolair® представляет собой гуманизированное IgG1k моноклональное антитело, которое селективно связывается с IgE, снижая, таким образом, связывание IgE, по крайней мере, с FcεRI на поверхности тучных клеток и базофилов. Путем снижения уровня связанного с поверхностью IgE на клетках, которые несут FcεRI, Xolair® в некоторой мере снижает степень высвобождения медиаторов аллергического ответа. Xolair® является раскрытым в публикациях международных патентных заявок: WO 93/04173 и WO 97/04807.
Однако существует потребность в иных связывающих элементах для IgE, таких, которые обладают более высокой аффинностью и/или эффективностью по сравнению с Xolair®, для многообещающих терапевтических стратегий.
Изобретение
Путем использования приемлемых методик селекции и анализов мы усовершенствовали связывающие элементы, которые ингибируют связывание с и функциональную активность посредством FcERI (рецептор IgE, представленный на тучных клетках) с одновременным ингибированием FcERII или при отсутствии такого ингибирования.
Связывающий элемент в соответствии с изобретением ингибирует связывание с и функциональную активность посредством FcERI с одновременным ингибированием FcERII или при отсутствии такого ингибирования. Ингибирование связывания может представлять собой непосредственное ингибирование, например путем нейтрализации IgE. Связывающий элемент в соответствии с изобретением типично нейтрализует человеческий IgE со значением IC50, меньшим, чем приблизительно 10 нМ, как определяется с помощью, например, RBL-ER51 анализа передачи кальциевого сигнала. В некоторых воплощениях связывающий элемент в соответствии с изобретением нейтрализует человеческий IgE со , значением IC50, меньшим, чем приблизительно 1 нМ, или меньшим, чем приблизительно 0,5 нМ, или меньшим, чем приблизительно 0,2 нМ, как определяется, например, с помощью RBL-ER51 анализа передачи кальциевого сигнала.
Связывающие элементы в соответствии с изобретением могут также связываться с и нейтрализовать нечеловеческий IgE, означающий IgE ортологи, которые существуют в природе у видов, отличных от человека.
Связывающие элементы в соответствии с изобретением обычно являются специфическими для IgE по сравнению с другими иммуноглобулинами и, таким образом, связывают IgE селективно. Такая селективность может быть определена или продемонстрирована, например, в стандартном анализе конкурентного связывания.
Связывающие элементы являются полезными для лечения и/или предотвращения расстройств, которые являются опосредованными IgE, в частности различных аллергий и астмы.
Связывающие элементы являются полезными для снижения циркуляции свободного IgE у млекопитающих, а также полезными для ингибирования индуцированной аллергеном дегрануляции тучных клеток in vivo или in vitro.
Связывающие элементы также являются полезными для ингибирования биологических ответов, опосредованных связыванием IgE с FcERI с одновременньм ингибированием биологических ответов, опосредованных связыванием IgE с FcERII или при отсутствии такого ингибирования, либо in vivo, либо in vitro.
Связывающие элементы в соответствии с изобретением могут также обладать диагностической полезностью, как, например, для определения присутствия или количества IgE, или присутствия, или количества специфического для аллергена IgE в образце, который представляет интерес, таком как образец, полученный от пациента с астмой или аллергией.
Может использоваться любой приемлемый способ для определения последовательности остатков, связанных связывающим элементом. Например, может использоваться сканирование пептидного связывания, такое как иммуноферментный анализ (ELISA) на основе PEPSCAN, как описано где-либо в данной заявке. При сканировании пептидного связывания, таком как форма, которая обеспечивается PEPSCAN системами, короткие перекрывающиеся пептиды, имеющие происхождение от антигена, подвергаются системному скринингу на связывание со связывающим элементом. Пептиды могут быть ковалентно связаны с поверхностью основы с образованием набора для анализа пептидов. Пептиды могут быть линейными или иметь сжатую конформацию. Сжатая конформация может быть получена при использовании пептидов, содержащих терминальный Cys остаток на каждом конце пептидной последовательности. Cys остатки могут быть ковалентно связанными непосредственно или опосредовано с поверхностью основы так, что пептид удерживается в скрученной конформации. Таким образом, пептиды, используемые в способе, могут содержать Cys остатки, присоединенные к каждому концу пептидной последовательности, соответствующей фрагменту антигена. Также могут использоваться пептиды с двумя петлями, в которых Cys остаток дополнительно размещается при или поблизости средней части пептидной последовательности. Cys остатки могут быть ковалентно связанными непосредственно или опосредовано с поверхностью основы так, что пептиды образуют конформацию с двумя петлями, с одной петлей с каждой стороны центрального Cys остатка. Пептиды могут быть получены синтетически, и Cys остатки могут, таким образом, быть встроены в желаемых положениях, несмотря на то, что такая последовательность IgE не существует в природе. Необязательно, как линейные, так и сжатые пептиды могут подвергаться скринингу в анализе пептидного связывания. Сканирование пептидного связывания может вовлекать идентификацию (например, при использовании ELISA) множества пептидов, с которыми связывается связывающий элемент, где пептиды обладают аминокислотными последовательностями, соответствующими фрагментам IgE (например, пептиды, содержащие приблизительно 5, 10 или 15 смежных остатков IgE), и сравнение пептидов для того, чтобы определить отпечаток остатков, связанных связывающим элементом, где отпечаток включает остатки, общие для перекрывающихся пептидов.
Альтернативно или дополнительно способ пептидного сканирования может вовлекать идентификацию пептидов, с которыми связывается связывающий элемент, по крайней мере, с заданным соотношением сигнал: фоновый сигнал. Подробности приемлемого способа пептидного сканирования для определения связывания являются известными в области техники. Другие способы, являющиеся хорошо известными в области техники, и такие, которые могут использоваться для определения остатков, связанных антителом и/или для подтверждения результатов пептидного сканирования, включают сайт-направленный мутагенез, обмен водород-дейтерий, масс-спектрометрию, ЯМР и рентгеновскую кристаллографию.
Связывающий элемент в соответствии с изобретением может или не может связывать и/или нейтрализовать варианты IgE. Таким образом, связывающий элемент в соответствии с изобретением может или не может ингибировать связывание вариантов IgE с FcERIc одновременным ингибированием FcERII или при отсутствии такого ингибирования.
Последовательности линейного эпитопа IgE, например в виде изолированных пептидных фрагментов или полипептидов, которые их включают, могут использоваться для идентификации, получения, изоляции и/или анализа связывающих элементов в соответствии с настоящим изобретением.
Как описывается более подробно ниже, связывающие элементы в соответствии с изобретением были продемонстрированы как такие, которые нейтрализуют IgE с высокой эффективностью. Нейтрализация означает ингибирование биологической активности IgE. Связывающие элементы в соответствии с изобретением могут нейтрализовать одну или более биологических активностей IgE, но типично ингибируют связывание IgE с FcERI с одновременным ингибированием связывания с FcERII или при отсутствии такого ингибирования.
Нейтрализация связывания IgE с FcERI с одновременным ингибированием FcERII или при его отсутствии может необязательно измеряться как функция биологической активности рецептора, такая как индуцированная аллергеном дегрануляция тучных клеток.
Приемлемые анализы для измерения нейтрализации IgE связывающими элементами в соответствии с изобретением включают, например, биохимические анализы лиганда и рецептора и поверхностный плазменный резонанс (SPR) (например, BIACORE).
Ингибирование биологической активности может быть частичным или полным. Связывающие элементы могут ингибировать биологическую активность IgE, такую как связывание рецептора или дегрануляция тучных клеток, на 100%, или альтернативно, на: по крайней мере, 95 %, по крайней мере, 90 %, по крайней мере, 85 %, по крайней мере, 80 %, по крайней мере, 75 %, по крайней мере, 70 %, по крайней мере, 60 % или, по крайней мере, 50 % активности при отсутствии связывающего элемента.
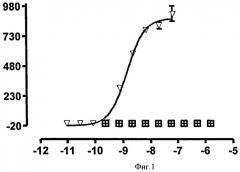
Нейтрализующая эффективность связывающего элемента обычно выражается в виде значения IC50, в нМ, если не указано другое. В функциональных анализах IC50 представляет собой концентрацию связывающего элемента, которая снижает биологический ответ на 50% от его максимума. В исследованиях связывания лиганда IC50 представляет собой концентрацию, которая снижает связывание рецептора на 50 % уровня максимального специфического связывания. Значение IC50 может быть подсчитано путем выстраивания % максимального биологического ответа как функции log концентрации связывающего элемента и при использовании программного обеспечения, такого как Prism (GraphPad) для выстраивания сигмоидальной функции в соответствии с данными для получения значений IC50. Эффективность может быть определена или измерена при использовании одного или более анализов, известных квалифицированному специалисту, и/или описанных в данной заявке, или тех, на которые содержится ссылка в данной заявке.
Нейтрализующая эффективность связывающего элемента может быть выражена в виде среднегеометрического значения. Среднегеометрическое значение (которое также является известным как среднее геометрическое значение), как используется в данной заявке, означает средние логарифмические значения набора данных, превращенные обратно к основанию 10. Это требует, по крайней мере, двух измерений, например, по крайней мере, 2, предпочтительно, по крайней мере, 5, более предпочтительно, по крайней мере, 10 повторностей. Специалист в данной области техники может понять, что чем больше количество повторностей, тем надежнее будет среднегеометрическое значение. Выбор количества повторностей может быть отнесен к компетенции специалиста, квалифицированного в данной области техники.
Нейтрализация активности IgE связывающим элементом в анализе, описанном в данной заявке, показывает, что связывающий элемент связывает и нейтрализует IgE. Другие способы, которые могут использоваться для определения связывания связывающего элемента с IgE, включают ELISA, Вестерн-блоттинг, иммунопреципитацию, аффинную хроматографию и биохимические анализы.
В другом воплощении в соответствии с изобретением обеспечивается изолированный связывающий элемент, специфический для иммуноглобулина Е, при этом связывающий элемент имеет значение IC50 для связывания указанного связывающего элемента с иммуноглобулином Е в сыворотке, по крайней мере, в 10 раз ниже, чем для Xolair™, или альтернативно, по крайней мере, в 20 раз ниже, по крайней мере, в 50 раз ниже, по крайней мере, в 75 раз ниже, по крайней мере, в 100 раз ниже, по крайней мере, в 125 раз ниже, по крайней мере, в 150 раз ниже, по крайней мере, в 200 раз ниже, по крайней мере, в 300 раз ниже, по крайней мере, в 400 раз ниже или, по крайней мере, в 500 раз ниже.
Нейтрализующая эффективность связывающего элемента, как подсчитано в анализе при использовании IgE из первых видов (например, человека), может сравниваться с нейтрализующей эффективностью связывающего элемента в подобном анализе при подобных условиях, анализе при использовании IgE из вторых видов (например, обезьяны циномолгуса) для того, чтобы оценить степень перекрестной реактивности связывающего элемента для IgE двух видов. Альтернативно, перекрестная реактивность может быть оценена в конкурентном анализе связывания, как описано более подробно где-либо в данной заявке.
Связывающий элемент в соответствии с изобретением может иметь более высокую нейтрализующую эффективность в отношении связывании человеческого IgE или в биологическом анализе, чем при использовании IgE из видов, отличных от человека. Таким образом, нейтрализующая эффективность связывающего элемента в анализе с человеческим IgE может быть большей, чем в подобном анализе с IgE из видов, отличных от человека. Эффективность в связывании человеческого IgE в биологическом анализе может, например, быть приблизительно в 5 раз большей, чем в подобном анализе, использующем IgE обезьяны циномолгуса, или в другом воплощении может быть в 15 или 20 раз больше. В частности, эффективность в анализе передачи кальциевого сигнала для человеческого RBL-ER51 может быть определена для концентрации человеческого IgE 25 нг/мл, при этом она сравнивается с эффективностью при использовании 100 нг/мл IgE циномолгуса при других подобных условиях. Примеры данных, полученных в подобных анализах передачи кальциевого сигнала RBL-ER51 при использовании человеческого IgE и IgE циномолгуса, показаны в Таблице 2b.
Связывающий элемент в соответствии с изобретением может обладать более высокой аффинностью для человеческого IgE, чем для IgE других видов. Аффинность связывающего элемента для человеческого IgE может быть, например, приблизительно в 5 или 10 раз выше, чем для IgE обезьяны циномолгуса, или, в другом воплощении, может быть приблизительно в 100 раз выше. Примеры данных, полученных для IgE, как человека, так и обезьяны циномолгуса, показаны в Таблице 2а и b.
Связывающий элемент в соответствии с изобретением может иметь нейтрализующая эффективность в отношении IgE или IC50 приблизительно 10 нМ или менее, с концентрацией человеческого IgE 25 нг/мл, например, в RBL-ER51 анализе передачи кальциевого сигнала. Альтернативно, значение IC50 является меньшим, чем приблизительно 3 нМ. В других воплощениях IC50 является меньшим, чем приблизительно 1 нМ, или меньшим, чем приблизительно 0,5 нМ, или меньшим, чем приблизительно 0,2 нМ.
В другом воплощении в соответствии с изобретением обеспечивается изолированный связывающий элемент, специфический для иммуноглобулина Е, где связывающий элемент имеет среднегеометрическое значение IC50 для ингибирования передачи сигнала кальция, индуцированного 25 нг/мл IgE в RBL-ER51 клетках менее 1 нМ, или альтернативно менее 0,6 нМ, менее 0,5 нМ, менее 0,4 нМ, менее 0,3 нМ, менее 0,2 нМ или менее 0,1 нМ.
Кинетики связывания и аффинность (выраженная как константа равновесной диссоциации KD) элементов, связывающих IgE для r человеческого IgE, может быть определена, например, при использовании поверхностного плазмонного резонанса (BIACORE). Связывающие элементы в соответствии с изобретением обычно имеют аффинность для человеческого IgE (KD) меньшую, чем приблизительно 10 нМ, и в некоторых воплощениях имеют KD меньшую, чем приблизительно 5 нМ, в других воплощениях имеют KD меньшую, чем 2 нМ. Аффинность для IgE обезьяны циномолгуса обычно составляет менее приблизительно 20 нМ, в некоторых воплощениях значение KD составляет меньше, чем приблизительно 10 нМ.
Является доступным ряд методик для измерения связывающей аффинности антитела с его антигенами, одна из таких методик представляет собой KinExA. Кинетический эксклюзионный анализ (KinExA) представляет собой иммуноаналитическую платформу для общих целей (по существу с помощью проточного спектрофлуориметра), которая является способной к измерению констант равновесной диссоциации, констант скорости ассоциации и диссоциации для взаимодействий антиген/антитело. Поскольку KinExA осуществляют после достижения равновесного состояния, методика представляет собой преимущественную для использования при измерениях KD взаимодействия мультиваленый антиген/mAb. Связывание антитела с молекулой IgE представляет собой пример связывания мультивалентного антигена. Применение KinExA является особенно приемлемым, когда мультивалентный антиген означает, что мультимеры антитела и антигена, которые образуются, включают более чем одно антитело и более чем один антиген. В таких моделях комплексного взаимодействия определение точного значения KD может быть затруднено. Методика KinExA может быть осуществлена так, как описано Drake и др. (2004) Analytical Biochemistry 328, 35-43, как измеряется с помощью KinExA методики. Антитело 11 имеет значение KD 6,3 пМ, что существенно ниже, чем для Xolair™, которое имеет значение KD 353 пМ.
В другом воплощении в соответствии с изобретением обеспечивается изолированный связывающий элемент, специфический для иммуноглобулина Е, с KD 300 пМ или ниже, как измеряется при использовании методики KinExA. Альтернативно, KD составляет 200 пМ или ниже, 100 пМ или ниже, 50 пМ или ниже, 20 пМ или ниже, или 10 пМ или ниже.
In vivo эндогенный IgE может быть гликозилированным и, таким образом, гликозилированный человеческий IgE представляет собой терапевтическую модель терапии человека. Несмотря на то, что рекомбинантный человеческий IgE, который может иметь бактериальное происхождение и не являться гликозилированным, может использоваться в анализах, описанных в данной заявке. Связывающие элементы в соответствии с изобретением могут связывать гликозилированный человеческий IgE, такой как IgE, полученный с помощью миеломной линии клеток, такой как U266.B1. Это составляет значительное преимущество связывающих элементов в соответствии с изобретением, поскольку гликозилированный человеческий IgE представляет собой целевой антиген для in vivo применений у человека.
Связывающий элемент в соответствии с изобретением может включать молекулы антитела, предпочтительно человеческие молекулы антитела или гуманизированные молекулы антитела. В одном аспекте в соответствии с изобретением молекулы антитела представляют собой моноклональное антитело.
Сайт связывания антигена обычно образуется с помощью вариабельного тяжелого (VH) и вариабельного легкого (VL) доменов иммуноглобулина, с антигенсвязывающей областью, образованной шестью поверхностными полипептидными петлями, которые называются участками, определяющими комплементарность (CDR). Существует три CDR в каждом VH (HCDR1, HCDR2, HCDR3) и в каждом VL LCDR1, LCDR2, LCDR3), вместе с участками каркасного участка (FR).
Связывающий элемент в соответствии с изобретением обычно включает домен VH и/или VL антитела. VH домен включает набор HCDR, а VL домен включает набор LCDR. Молекула антитела может включать VH домен антитела, включающий VH CDR1, CDR2, и CDR3, и каркасный участок. Она может альтернативно или дополнительно включать VL домен антитела, содержащий VL CDR1, CDR2 и CDR3, и каркасный участок. Примеры VH доменов антитела (SEQ ID NOS:2, 12, 22, 32, 42, 52, 62, 72, 82, 92, 102, 112, 122, 132, 142, 152, 162, 172, 182, 192, 202, 212, 222, 232, 242, 252, 262, 272, 282, 288, 300, и 306) и VL доменов антитела (SEQ ID NOS:318, 320, 322, 324, 326, 328, 330, 332, 334, 336, 338, 340, 342, 344, 346, 348, 350, 352, 354, 356, 358, 360, 362, 364, 366, 368, 370, 372, 374, 376, 378 и 380) и CDR (SEQ ID NOS:3-5, 8-10, 13-15, 18-20, 23-25, 28-30, 33-35, 38-40, 43-45, 48-50, 53-55, 58-60, 63-65, 68-70, 73-75, 78-80, 83-85, 88-90, 93-95, 98-100, 103-105, 108-110, 113-115, 118-120, 123-125, 128-130, 133-135, 138-140, 143-145, 148-150, 153-155, 158-160, 163-165, 168-170, 173-175, 178-180, 183-185, 188-190, 193-195, 198-200, 203-205, 208-210, 213-215, 218-220, 223-225, 228-230, 233-235, 238-240, 243-245, 248-250, 253-255, 258-260, 263-265, 268-270, 273-275, 278-280, 283-285, 296-298, 289-291, 296-298, 301-303, 307-309, и 314-316) в соответствии с настоящим изобретением приведены в прилагаемом списке последовательностей, который образует часть настоящего раскрытия (смотри также Таблицу 3а). Дополнительные CDR раскрыты ниже и в Таблице 1. Все VH и VL последовательности, CDR последовательности, наборы CDR, наборы HCDR и наборы LCDR, раскрытые в данной заявке, представляют собой аспекты и воплощения в соответствии с изобретением.
Как описывается в данной заявке, "набор CDR" включает CDR1, CDR2 и CDR3. Таким образом, набор HCDR относится к HCDR1, HCDR2 и HCDR3, а набор LCDR относится к LCDR1, LCDR2 и LCDR3. Если не указано другое, то "набор CDR" включает HCDR и LCDR.
Альтернативно, связывающий элемент в соответствии с изобретением может включать сайт связывания антигена в пределах молекулы, отличной от антитела, обычно обеспеченный одним или более CDR, например, набором CDR в белковом каркасе молекулы, отличной от антитела, как обсуждается дополнительно ниже.
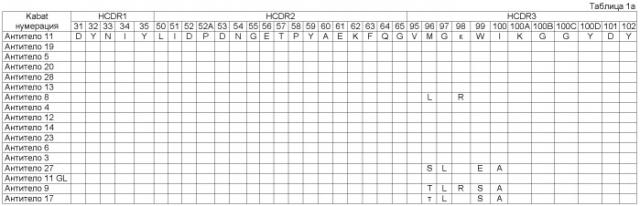
Как описывается в данной заявке, молекула исходного антитела была изолирована как такая, которая содержит набор CDR последовательностей, как показано в Таблице 1 (смотри Антитело 1), Посредством осуществления процесса оптимизации мы получили панель клонов антитела под номерами 2-28, с последовательностями CDR, которые имеют происхождение от исходных CDR последовательностей и содержат модификации в положениях, указанных в Таблице 1. Таким образом, например, из Таблицы 1 можно увидеть, что Антитело 2 имеет исходные последовательности HCDR1, HCDR2, LCDR1, LCDR2 и LCDR3, и содержит исходную HCDR3 последовательность в которой: остаток Кэбата 96 заменен на S, остаток Кэбата 97 заменен на L, остаток Кэбата 99 заменен на S, и остаток Кэбата 100 заменен на А.
Описанный в данной заявке связывающий элемент представляет собой такой включающий набор CDR, как показано в Таблице 1 (Антитело 1), где HCDR1 представляет собой SEQ ID NO:3 (остатки Кэбата 31-35), HCDR2 представляет собой SEQ ID NO:4 (остатки Кэбата 50-65), HCDR3 представляет собой SEQ ID NO:5 (остатки Кэбата 95-102), LCDR1 представляет собой SEQ ID NO:8 (остатки Кэбата 24-34), LCDR2 представляет собой SEQ ID NO:9 (остатки Кэбата 50-56) и LCDR3 представляет собой SEQ ID NO:10 (остатки Кэбата 89-97). Связывающий элемент в соответствии с изобретением может являться исходным связывающим элементом, как показано в Таблице 1, где один или более CDR содержат одно или более из аминокислотных добавлений, замен, делеций и/или инсерций. В некоторых воплощениях связывающий элемент включает набор CDR, содержащий от одного до десяти из добавлений, замен, делеций и/или инсерций по отношению к исходным последовательностям Антитела 11. В другом воплощении - от одной до десяти замен по сравнению с Антителом 11. В другом воплощении образуется от одного до одиннадцати прибавлений, замен, делеций и/или инсерций по отношению к исходным последовательностям Антитела 1. В другом воплощении - от одной до десяти замен по отношению к Антителу 1.
В некоторых воплощениях связывающий элемент в соответствии с изобретением включает HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3; где HCDR3 имеет аминокислотную последовательность SEQ ID NO:5, необязательно содержащую от 1 до 5 аминокислотных добавлений, замен, делеций и/или инсерций; а LCDR3 имеет аминокислотную последовательность SEQ ID NO:10, необязательно содержащую от 1 до 6 аминокислотных прибавлений, замен, делеций и/или инсерций. В этих воплощениях HCDR1 может содержать аминокислотную последовательность SEQ ID NO:3; HCDR2 может содержать аминокислотную последовательность SEQ ID NO:4; LCDR1 может содержать аминокислотную последовательность SEQ ID NO:8; и LCDR2 может содержать аминокислотную последовательность SEQ ID NO:9. Альтернативно, HCDR1, HCDR2, LCDR1 и LCDR2 могут также коллективно содержать одно или более аминокислотных прибавлений, замен, делеций и/или инсерций по отношению к исходным последовательностям (Антитело 1), как, например, от одной до десяти замен.
Связывающий элемент в соответствии с изобретением может включать один или комбинацию CDR, как описывается в данной заявке. Например, связывающий элемент в соответствии с изобретением может включать HCDR1, имеющий аминокислотную последовательность SEQ ID NO:3; HCDR2, имеющий аминокислотную последовательность SEQ ID NO:4; HCDR3 имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOS:5, 15, 25, 65, 75, 85, 95, 145, 155, 175 и 255; LCDR1, имеющий аминокислотную последовательность SEQ ID NO:8; LCDR2, имеющий аминокислотную последовательность SEQ ID NO:9; и LCDR3, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOS:10, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270 и 280.
В некоторых воплощениях связывающий элемент или VH домен в соответствии с изобретением включает исходный HCDR3 (SEQ ID NO:5) с одной или более из следующих замен:
остаток Кэбата 96 заменен на S, М или Т;
остаток Кэбата 97 заменен на L или G;
остаток Кэбата 98 заменен на K;
остаток Кэбата 99 заменен на S, W, А, Т или Е;
остаток Кэбата 100 заменен на А или I.
В некоторых воплощениях связывающий элемент или его VL домен может включать исходный LCDR3 (SEQ ID NO 10) с остатком Кэбата 94, замененньм на Т, R, D, Р, Е, N, H, Q или А.
В некоторых воплощениях связывающий элемент или VL домен в соответствии с изобретением включает исходный LCDR3 (SEQ ID NO 10) с одной или более из следующих замен:
остаток Кэбата 94 заменен на Т, R, D, Р, Е, N, H, Q или А;
остаток Кэбата 95 заменен на Т, K, S, I, G, H, М, F, R, N, K или Q;
остаток Кэбата 95А заменен на L, H, D, G, R, N, Q, K или Е;
остаток Кэбата 95В заменен на Т, H, S, Y, L или N;
остаток Кэбата 96 заменен на G или А;
остаток Кэбата 97 заменен на Р, S или G.
В одном воплощении изобретение представляет собой связывающий элемент, в котором HCDR1 имеет аминокислотную последовательность SEQ ID NO:103, HCDR2 имеет аминокислотную последовательность SEQ ID NO:104, HCDR3 имеет аминокислотную последовательность SEQ ID NO:105, LCDR1 имеет аминокислотную последовательность SEQ ID NO:108, LCDR2 имеет аминокислотную последовательность SEQ ID NO:109, и LCDR3 имеет аминокислотную последовательность SEQ ID NO:110. Например, смотри Антитело 11 Таблицы 1.
Другие воплощения в соответствии с изобретением представляют собой связывающие элементы, такие как молекулы антитела, способные конкурировать с антителами в соответствии с изобретением, такими как Антитело 11 Таблицы 1, за связывание с человеческим IgE, при этом связывающие элементы нейтрализуют человеческий IgE со значением IC50 меньшим, чем приблизительно 1 нМ в анализе, описанном в данной заявке, или со значением IC50 меньшим, чем приблизительно 0,5 нМ. В некоторых воплощениях IC50 является меньшим приблизительно 0,2 нМ.
Изобретение обеспечивает связывающие элементы, включающие HCDR1, и/или HCDR2, и/или HCDR3 любого из антител 1-28, и/или LCDR1, и/или LCDR2, и/или LCDR3 любого из антител 1-28, например набор CDR любого из антител 1-28, показанных в Таблице 1. Связывающий элемент может включать набор VH CDR одного из этих антител. Необязательно, он может также включать набор VL CDR одного из этих антител, и VL CDR могут быть из того же или из различных антител, что и VH CDR. VH домен, включающий набор HCDR любого из антител 1-28, и/или VL домен, включающий набор LCDR любого из антител 1-28, также обеспечиваются изобретением.
Типично, когда VH домен спаривается с VL доменом с обеспечением антигенсвязывающего сайта антитела, хотя, как обсуждается в данной заявке ниже, для связывания антигена может использоваться только VH или VL домен. VH домен Антитела 1 (смотри Таблицу 1) может спариваться с VL доменом Антитела 1, так, что образуется антигенсвязывающий сайт антитела, включающий оба VH и VL домены антитела 1. Аналогичные воплощения обеспечиваются для других VH и VL доменов, раскрытых в данной заявке. В других воплощениях VH Антитела 1 спаривается с VL доменом, отличным от VL Антитела 1. Промискуитет легких цепей является хорошо установленным в области техники. Кроме того, аналогичные воплощения обеспечиваются изобретением для других VH и VL доменов, раскрытых в данной заявке. Таким образом, VH исходного или любого из антител 2-28 может спариваться с VL исходного или любого из антител 2-28.
Связывающий элемент может включать набор Н, и/или L CDR исходного антитела, или любого из антител 2-28 с двадцатью, шестнадцатью, десятью, девятью или менее, например, одной, двумя, тремя, четырьмя или пятью аминокислотными добавлениями, заменами, делениями, и/или инсерциями в пределах раскрытого набора Н и/или L CDR. Альтернативно, связывающий элемент может включать набор Н и/или L CDR исходного антитела или любого другого из антител 2-28 с двадцатью, шестнадцатью, десятью, девятью или менее, например одной, двумя, тремя, четырьмя или пятью аминокислотными заменами в пределах раскрытого набора Н и/или L CDR. Такие модификации могут потенциально быть осуществлены при любом остатке в пределах набора CDR. Например, модификации могут быть осуществлены в положениях, модифицированных в любом другом из антител 2-28, как показано в Таблице 1. Таким образом, одна или более модификаций могут включать одну или более замен в следующих остатках: остатках Кэбата 96, 97, 98, 99 и 100 в HCDR; остатках Кэбата 94, 95, 95А, 95В, 96 и 97 в LCDR.
Связывающий элемент может включать молекулу антитела, содержащую один или более CDR, например набор CDR, в каркасном участке антитела. Например, один или более CDR или набор CDR антитела может быть пересажен в каркасный участок (например, человеческий каркасный участок) для обеспечения молекулы антитела. Каркасные участки могут представлять собой эмбрионального гены последовательности человека. Таким образом, каркасный участок может быть герминизирован, в соответствии с чем один или более остатков в каркасном участке изменяют для соответствия участкам в эквивалентном положении в наиболее подобном эмбриональном каркасном участке человека. Таким образом, связывающий элемент в соответствии с изобретением может представлять собой изолированную молекулу антитела человека, содержащую VH домен, включающий набор HCDR в человеческом эмбриональном каркасном участке, например, человеческом эмбриональном каркасном участке VH IgG. Связывающий элемент также содержит VL домен, включающий набор LCDR, например, в человеческом эмбриональном каркасном участке IgG VL.
Остатки VH и/или VL каркасного участка могут быть модифицированы, как обсуждается и представлено в примерах в данной заявке, например при использовании сайт-направленного мутагенеза. VH или VL домен в соответствии с изобретением или связывающий элемент, включающий такой VL домен, предпочтительно имеет последовательность VH и/или VL домена антитела, как представлено в Таблице 3.
Негерминизированная молекула антитела содержит те же CDR, но отличные каркасные участки, по сравнению с герминизированной молекулой антитела. Герминизированное антитело может быть получено путем герминизации каркасных участков последовательностей VH и VL доменов, указанных в данной заявке для этих антител.
Связывающий элемент в соответствии с изобретением может быть таким, который конкурирует за связывание с IgE с любым связывающим элементом, которые оба связывают IgE и включают связывающий элемент, такой, как VH и/или VL домен, CDR, например, HCDR3, и/или набор CDR, раскрытые в данной заявке. Конкуренция между связывающими элементами может быть легко проанализирована in vitro, например, при использовании ELISA и/или с помощью маркирования при использовании специфической репортерной молекулы одного связывающего элемента, который может быть определен в присутствии одного или более других немаркированных связывающих элементов, что позволяет осуществить идентификацию связывающих элементов, которые связывают один и тот же эпитоп или перекрывающиеся эпитопы. Такие способы являются хорошо известными среднему специалисту в данной области техники и описаны более подробно в данной заявке. Таким образом, дополнительный аспект в соответствии с настоящим изобретением обеспечивает связывающий элемент, включающий сайт связывания антигена человеческого антитела, которое конкурирует с молекулой антитела, например, в частности, молекулой антитела, включающей VH и/или VL домен CDR, например HCDR3 или набор CDR исходного антитела или любого другого из антител 1-28, для связывания с человеческим IgE. В одном воплощении связывающий элемент в соответствии с изобретением конкурирует с Антителом 11, как представлено в Таблице 1.
Другое воплощение в соответствии с изобретением обеспечивает связывающие элементы, которые связываются со специфическим участком IgE. Связывание может быть определено, например, с помощью определения или наблюдения специфического взаимодействия между связывающим элементом и остатками IgE, например, в структуре связывающего элемента: IgE комплекс, который может быть определен, например, при использовании рентгеновской кристаллографии. Структура Антитела 11, связанного с Cε3-Cε4 доменами человеческого IgE определяется при использовании рентгеновской кристаллографии, обеспечивающей возможность изучения двух взаимодействий Fab антитела 11 с IgE в кристалле. IgE представляет собой бивалентный антиген, поскольку существуют две легких цепи и две тяжелых цепи. Рентгеновское кристаллографическое исследование показало, что Fab связывается с эпитопом, расположенным поперек двух тяжелых цепей IgE.
Первое взаимодействие указывает на то, что сайт взаимодействия Антитела 11 включает остатки от Glu390 до Asn394 включительно и остатки сахаров GlcNAc1 и Man6 в одной тяжелой цепи IgE и Leu340, Arg342, от Ala428 до Thr434 включительно, Thr436, Ser437 и Glu472 и остатки сахара Man 5 в другой тяжелой цепи IgE.
В одном воплощении в соответствии с изобретением обеспечивается изолированный связывающий элемент, специфический для иммуноглобулина Е, где указанный связывающий элемент связывается с эпитопом в иммуноглобулине Е, который включает: остатки от Glu390 до Asn394 включительно в первой тяжелой цепи IgE и Leu340, Arg342, от Ala428 до Thr434, включительно, Thr436, Ser437 и Glu472 во второй тяжелой цепи IgE; в дополнительном воплощении указанный эпитоп дополнительно включает остатки сахаров GlcNAc1 и Man6 первой тяжелой цепи IgE и остатки сахара Man 5 во второй тяжелой цепи IgE.
Второе взаимодействие указывает на то, что сайт взаимодействия Антитела 11 включает остатки Glu390 от Gln392 до Asn394 включительно, и остатки сахаров GlcNAc1 и Man6 в первой тяжелой цепи IgE и Leu340, Arg342, от Ala428 до Thr434 включительно, Thr436, Ser437 и Glu472 во второй тяжелой цепи IgE.
В дополнительном воплощении в соответствии с изобретением обеспечивается изолированный связывающий элемент, специфический для иммуноглобулина Е, где указанный связывающий элемент связывается с эпитопом в иммуноглобулине Е, который включает:
остатки Glu390 от Gln392 до Asn394, включительно, в первой тяжелой цепи IgE и Leu340, Arg342, от Ala428 до Thr434 включительно, Thr436, Ser437 и Glu472 во второй тяжелой цепи IgE;
в дополнительном воплощении указанный эпитоп дополнительно включает остатки сахаров GlcNAc1 и Man6 первой тяжелой цепи IgE.
В дополнительно