Фармацевтическая композиция для профилактики и лечения диабета или ожирения, содержащая соединение, ингибирующее активность дипептидилпептидазы-iv, и другие противодиабетические средства или средства против ожирения в качестве активных ингредиентов
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтической композиции для профилактики и лечения диабета или ожирения, содержащей в качестве активных ингредиентов соединение, ингибирующее активность дипептидилпептидазы-IV (ДПП-IV), его фармацевтически приемлемую соль, его гидрат или его сольват, и одно или несколько других противодиабетических средств или средства против ожирения. Фармацевтическая композиция демонстрирует превосходное улучшение толерантности к глюкозе и может быть использована в профилактике и лечении диабета, ожирения и подобных заболеваний, эффективно снижая уровни глюкозы в крови и снижая жировую массу. 24 з.п. ф-лы, 8 ил., 17 табл., 32 пр.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической композиции для профилактики и лечения диабета или ожирения, содержащей в качестве активных ингредиентов соединение, ингибирующее активность дипептидилпептидазы-IV (ДПП-IV), его фармацевтически приемлемую соль, его гидрат или его сольват и одно или несколько других противодиабетических средств или средств против ожирения.
Уровень техники
Дипептидилпептидаза-IV (здесь далее называемая как ДПП-IV) представляет собой фермент, который обычно идентифицируется по классификации ферментов как EC 3.4.14.5, функционально принадлежит к серин-протеазе (Barrett A. J. et al., Arch. Biochem. Biophys., 1995, 247-250) и отщепляет N-концевой дипептид от пептидов, которые начинаются с последовательности H-Xaa-Pro-Y (или H-Xaa-Ala-Y, где Xaa представляет собой любую липофильную аминокислоту, Pro представляет собой пролин, и Ala представляет собой аланин) (Heins J., et al., Biochim. et Biophys. Acta 1988, 161), и также известен как DP-IV, DP-4 или DAP-IV. Фермент широко распространен и обнаружен в различных тканях млекопитающих, таких как почки, печень и тонкий кишечник (Hegen M. et al., J. Immunol., 1990, 2908-2914). Впервые ДПП-IV был идентифицирован как мембраносвязанный белок. Позднее была идентифицирована его растворимая форма (Duke-Cohan J. S. et al., J. Biol. Chem., 1995, 14107-14114). В соответствии с недавно опубликованными исследованиями и докладами было обнаружено, что такая растворимая форма ДПП-IV имеет такую же структуру и функцию как мембраносвязанная форма фермента и обнаружена без определенного мембраносвязанного домена в крови (Christine D. et. al., Eur. J. Biochem., 2000, 5608-5613).
Первичный интерес к ДПП-IV сосредоточился на его роли в активации T лимфоцитов. ДПП-IV, ответственный за активацию T лимфоцитов, был назван, в частности, как CD26. С учетом сообщения о том, что CD26 связывается или взаимодействует с вирусом иммунодефицита человека (ВИЧ) (Guteil W. G. et al., Proc. Natl. Acad. Sci., 1994, 6594-6598), было сделано предположение, что ДПП-IV ингибиторы могут быть использованы в лечении СПИДа (Doreen M. A. et al., Bioorg. Med. Chem. Lett., 1996, 2745-2748).
Помимо определяющей роли участия в иммунной системе, основная функция ДПП-IV, как описано выше, обусловлена ее активностью в расщеплении ферментов. Особое внимание уделено роли ДПП-IV, поскольку обнаружено, что ДПП-IV является ключевым ферментом, вовлеченным в расщепление глюкагонподобного белка-1 (именуемого в дальнейшем как "GLP-1") в тонком кишечнике (Mentlein R. et al., Eur. J. Biochem., 1993, 829-835). GLP-1 представляет собой пептидный гормон, состоящий из 30 аминокислотных остатков, который секретируется клетками кишечника в ответ на всасывание пищи тонким кишечником (Goke R. et. al., J. Biol. Chem., 1993, 19650-19655). Поскольку этот гормон, как известно, оказывает потенцирующий эффект на действие инсулина в регулировании уровня глюкозы в крови после приема пищи (Hoist J. J. et al., Diabetes Care, 1996, 580-586), было установлено, что ДПП-IV ингибиторы могут также быть использованы при лечении диабета по типу 2. Основываясь на этом предположении, при разработке ранней формы ДПП-IV ингибитора были сделаны некоторые сообщения, показывающие терапевтическую эффективность лекарственного средства в экспериментах на животных (Pauly R. P. et al., Metabolism, 1999, 385-389). Кроме того, у мышей или крыс с дефицитом ДПП-IV поддерживались GLP-1 активность и высокие уровни инсулина, что приводило к снижению уровня глюкозы в крови, и такое генетическое нарушение или мутация ДПП-IV гена не оказывало значительного эффекта на выживание отдельных животных (Marguet D. et al., Proc. Natl. Acad. Sci, 2000, 6874-6879). Вследствие этого было сделано предположение, что ДПП-IV является практически пригодным в качестве мощного терапевтического средства для лечения диабета по типу 2, что привело к ускоренному исследованию и разработке ДПП-IV ингибитора.
Связывание GLP-1 с рецептором в ряде тканей приводит к насыщению (чувству сытости), отсроченной желудочной секреции и более легкому росту панкреатических бета-клеток. Поэтому клинические исследования по лечению диабета типа 2, как описано выше, постепенно возрастают посредством внутривенного введения GLP-1 как такового (Verdich C. et al., J. Clin. Endocrinol. Metab., 2001, 4382-4389). Период полураспада GLP-1 in vivo равен всего лишь 2 минутам (Kieffer T. J., et al., Endocrinology, 1995, 3585-3596), соответственно, такой короткий период полураспада является главным препятствием для непосредственного использования GLP-1 в качестве терапевтического средства. С тех пор многочисленные исследовательские группы и институты предпринимали большое количество попыток, направленных на получение производных GLP-1, что привело к разработке и коммерциализации пептида, который способен in vivo пролонгировать непродолжительный период полураспада (Deacon C. F., Diabetes, 2004, 2181-2189). Однако такое GLP-1 производное все еще имеет основной недостаток в том смысле, что оно является инъецируемым препаратом. Кроме того, большой интерес все в большей степени сосредотачивался на получении эффективного ДПП-IV ингибитора в связи с тем, что активный GLP-1 (7-36) разлагается посредством ДПП-IV и затем преобразуется в неактивный GLP-1 (9-36) только в течение короткого периода времени, например в течение 2 минут.
Начало разработок ДПП-IV ингибиторов было аналогично началу разработок других ингибиторов. То есть большинство результатов исследований относилось к субстратным аналогам. Показательным из этих субстратных аналогов является производное дипептида, которое было получено как продукт раннего исследования, выполненного на материнском ядре, имеющем структуру, подобную структуре пролина (Pro), исходя из того факта, что ДПП-IV демонстрирует явное сродство к пептиду, содержащему определенный аминокислотный пролин (Chinnaswamy T. et al., J. Biol. Chem., 1990, 1476-1483). Типичные примеры пролинподобных структур включают пирролидид и тиазолидид, а производные, содержащие эти соединения материнского ядра, демонстрируют обратимую и конкурентную ингибиторную активность к ДПП-IV ферменту (Augustyns K J L., et al., Eur. J. Med. Chem., 1997, 301-309). В числе продуктов таких обширных исследований и разработок находятся определенные соединения, подвергаемые непрерывным исследованиям механизма их действия и эффективности, в частности Val-Pyr (валин-пирролидид), Ile-Thia (изолейцин-тиазолидид) и тому подобное. Особенно большое внимание уделялось Ile-Thia, поскольку структура Val-Pyr показала относительно слабую ингибиторную активность в отношении ДПП-IV (Hanne B. R., et al., Nat. Struct. Biol., 2003, 19-25), что само по себе способствовало проведению интенсивного исследования и изучения производных Ile-Thia соединения.
В числе не включенных в исследуемые и полученные с помощью описанных выше исследований и изучений соединений производных, обладающих наиболее выдающейся активностью, было соединение бета-аминокислотного тиазолидидного ряда, которое пыталось получить компания Merck & Co., Inc. Однако, согласно результатам фармакодинамических и фармакокинетических экспериментов, выполненных на крысах, полученное соединение показало значительно пониженную биодоступность в сочетании с очевидным ограничением в ингибировании ферментной активности (Jinyou Xu, et al., Bioorg. Med. Chem. Lett., 2004, 4759-4762). В результате чего из-за серьезных недостатков дальнейшая разработка соединений этого ряда была прекращена.
В процессе вышеуказанного исследования специалисты Merck заметили, что бета-аминокислота, в дополнение к материнскому ядру тиазолидида, является также ключевым фактором, оказывающим значительное действие на ингибиторную активность ДПП-IV. Это открытие использовали для достижения замещения материнского ядра тиазолидида на другое соединение материнского ядра (Linda L. B., et al., Bioorg. Med. Chem. Lett., 2004, 4763-4766). Вместе с проведением такого дополнительного исследования, тестирования эффективности лекарственного средства и фармакодинамических исследований, было синтезировано множество производных, имеющих замещенное материнское ядро тиазолидида на материнское ядро пиперазина. К сожалению, пиперазиновые производные, полученные компанией Merck, все еще обладают значительно низкой биодоступностью. В соответствии с задачей оптимизации соединений и устранения этого недостатка был разработан ситаглиптин, продукт MK-0431 (торговая марка: JANUVIA) путем преобразования пиперазиновой группы в триазолопиперазиновую группу. Этот продукт теперь является коммерчески доступным на основании одобрения нового лекарственного средства американским FDA в 2006 году.
Ситаглиптин
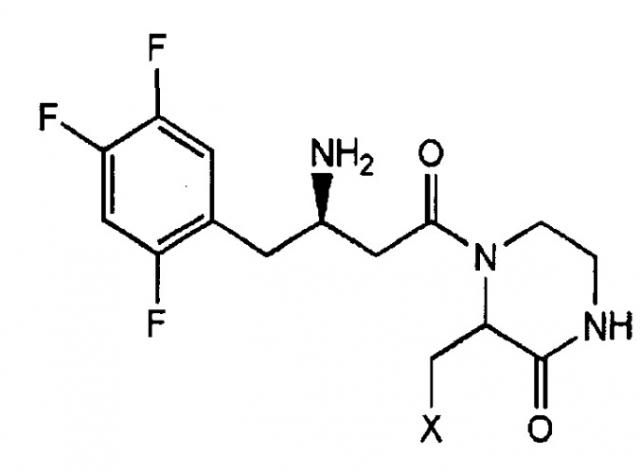
Таким образом, авторы настоящего изобретения обнаружили, что, когда замещение, включая гетероатом, осуществляют в пиперазиноновой группе, преобразованное таким образом соединение не только обладает превосходной ДПП-IV ингибиторной активностью, но также способно к достижению значительно улучшенной биодоступности по сравнению с обычными ДПП-IV ингибиторами, обеспечивая синтез нового гетероциклического соединения, содержащего бета-амино группу, и создали изобретение, касающееся соединения, представленного следующей формулой 1. На основе этого была подана заявка, зарегистрированная как корейская патентная заявка № 2007-0038462
Формула 1
(В формуле 1 X представляет собой OR1, SR1 или NR1R2, где R1 и R2 независимо представляют собой C1~C5 низший алкил, или R1 и R2 в NR1R2 могут образовывать 5-7-членное кольцо, содержащее гетероатом O.)
В дополнение к ДПП-IV ингибиторам, являющимся в настоящее время объектом активных исследований, средства для терапии диабета или ожирения, которые клинически используются или разрабатываются, включают ингибиторы α-глюкозидазы, бигуаниды, средства, усиливающие секрецию инсулина, сенсибилизаторы инсулина, антагонисты каннабиноидного рецептора 1 и тому подобное.
Ингибиторы α-глюкозидазы демонстрируют действие сдерживания абсорбции углевода из тонкого кишечника и включают акарбозу, воглибозу, эмиглитат, миглитол и тому подобное. Примеры бигуанидов включают метформин, фенформин или буформин. Стимулятор секреции инсулина может быть разделен на виды: сульфонилмочевина и несульфонилмочевина. Примеры сульфонилмочевины включают глибенкламид (глибурид), глипизид, гликлазид, глимепирид, толазамид, толбутамид, ацетогексамид, карбутамид, хлорпропамид, глиборнурид, гликуидон, глизентид, глизоламид, глизоксепид, гликлопиамид, глициламид, глипентид и тому подобное. Примеры несульфонилмочевины включают репаглинид, натеглинид и тому подобное.
Метформин, представитель группы бигуанидов, представляет собой гипогликемическое средство, снижающее высокие уровни глюкозы в крови без стимуляции секреции инсулина поджелудочной железой, и является предпочтительным в том смысле, что препарат может быть применен к тучным пациентам, страдающим диабетом, потому что метформин не связан с увеличением веса и применяется также к пациентам, которые не восприимчивы к сульфомочевиновым препаратам вследствие его другого механизма действия. Хотя механизм действия метформина полностью не известен, препарат снижает уровни глюкозы в крови только у страдающих диабетом пациентов без воздействия на уровни глюкозы в крови здоровых субъектов и не оказывает по сравнению с препаратами сульфонилмочевины какого-либо стимулирующего на β-клетки действия в поджелудочной железе для стимуляции секреции инсулина. Известно, что метформин усиливает действие инсулина в периферических клетках, таких как печень и мышцы, и снижает выработку глюкозы в печени, и в некоторых исследованиях сообщалось, что метформин оказывает воздействие на скелетные мышцы и увеличивает транспорт глюкозы через клеточную мембрану. Кроме того, препарат характеризуется восстановлением дислипидимии, понижая уровни ЛНП-холестерина и триглицеридов в крови. Клинически метформин может быть введен в относительно большой дозе, до 200 мг в день, и дважды в день, например утром и вечером. Когда метформин вводят в количестве более чем 2000 мг, его вводят вместе с едой три раза в день, а максимальная дневная доза составляет 2500 мг.
При введении метформина больным диабетом с избыточной массой тела его оценивают как превосходное средство для терапии диабета. Однако необходимо соблюдать осторожность, поскольку неблагоприятные побочные эффекты могут сопровождаться расстройствами желудочно-кишечного тракта, такими как диарея, тошнота, рвота и тому подобное, расстройствами системы крови, такими как дефицит витамина B12 и тому подобное, лактоцидозом, который представляет собой тяжелое метаболическое осложнение, возникающее редко, однако оно может привести к 50%-ной летальности при внутреннем накопление метформина, и так далее.
Сенсибилизаторы инсулина представляют собой относительно недавно разработанные лекарственные средства, имеют тазолидин-дионовую (TZD) структуру и оказывают воздействие на рецепторы, активирующие пролиферацию пероксисом (PPAR). Примеры сенсибилизаторов инсулина включают троглитазон, циглитазон, росиглитазон (AVNADIA), пиоглитазон (ACTOS), энглитазон и тому подобное. Наряду с ними в процессе реализации находятся другие различные разработки.
Антагонисты каннабиноидного рецептора-1 являются относительно недавно разработанными лекарственными мишенями, ингибируют избыточную активностью эндоканнабиноида для регулирования баланса массы тела и энергии, а также глюкозного и липидного метаболизма, и оказывают воздействие на каннабиноидный рецептор-1 (рецептор CB1), присутствующий в центральной и периферической нервных системах.
Примеры антагонистов каннабиноидного рецептора-1 включают римонабант (ACOMPLIA), отенабант, ибинабант, суринабант и тому подобное. Наряду с ними в процессе реализации находятся другие различные разработки.
Однако, поскольку диабет или ожирение являются хроническими заболеваниями и их состояния имеют осложнения, множество случаев заболеваний, при которых симптомы прогрессируют, сопровождаются различными осложнениями. Поэтому необходимо выбирать лечение, наиболее адекватное состоянию конкретного пациента. При применении только одного конкретного лекарственного средства бывают случаи заболевания, при которых достаточные эффекты могут быть получены в зависимости от симптомов этого заболевания. Кроме того, существует множество случаев заболеваний, при которых трудно в клинической практике выбрать лечение из-за различных проблем, таких как увеличение дозы или возникновение неблагоприятных побочных эффектов вследствие длительного приема лекарственного средства. Таким образом, вместо способов введения одного лекарственного препарата недавно были предложены различные способы комбинированного введения одного или нескольких препаратов с различными механизмами действия.
В частности, изучение литературы комбинированного введения ДПП-IV ингибиторов и обычных средств терапии диабета показало, что описана фармацевтическая композиция, полученная смешиванием 3~20% (вес./вес.) ситаглиптина, 25~94% (вес./вес.) метформина, 0,1~10% (вес./вес.) смазывающего вещества и 0~35% (вес./вес.) связующего вещества. В случае видаглиптина, который является коммерчески доступным соединением под торговой маркой Galvus от компании Novartis, комбинированные таблетки, содержащие вилдаглиптин и метформин в количествах 50~8%, 60~98%, 70~98% или 80~98%, описаны в International Publication Gazette WO 07/078726, а комбинированные таблетки с видаглиптином и пиоглитазоном, агонистом PPAR, полученные методом прямого прессования, описаны в International Publication Gazette WO 06/135693. Однако в этой литературе описаны фармацевтически оптимальные количества веществ в препарате, включая ДПП-IV ингибитор и метформин или агонист PPAR, а не синергетические эффекты двух лекарственных средств.
Кроме того, в JPET (2004), 310, 614-619 указано на то, что при введении животному валин-пирролидида (val-pyr) - ингибитора ДПП-IV в сочетании с метформином повышаются уровни глюкагонподобного белка, снижается потребление пищи и увеличение веса и синергетически восстанавливается толерантность к глюкозе.
В Life Science (2007), 81, 72-79 раскрыто, что после совместного введения вилдаглиптина и росиглитазона значительно нормализуется содержание глюкозы в сыворотке крови, триглицеридов и восстанавливается толерантность к глюкозе, а существующие ранее неблагоприятные побочные эффекты, такие как отек после приема росиглитазона и тому подобное, ослаблялись после комбинированного введения вилдаглиптина.
В International Publication Gazette WO 04/052362 раскрыто, что в результате проведения исследования на толерантность к глюкозе с использованием вилдаглиптина и PPAR агониста - микронизированного фенофибрата, область под кривой (AUC) после введения только вилдаглиптина была уменьшена на 18% и на 7% после введения только фенофибрата, в то время как при совместном введении этих двух препаратов AUC была уменьшена на 33%, восприимчивость к инсулину была улучшена, а увеличение веса было уменьшено.
В J. Pharmacol Sci. (2007), 104, 29-38 отмечено, что возникающие после приема пищи высокие уровни глюкозы в крови эффективно снижаются после совместного введения E3024, который является ДПП-IV ингибитором, воглибозы, которая является ингибитором α-глюкозидазы, и акарбозы, а в JPET (2007), 320 (2), 738-746 отмечено, что при совместном введении E3024 с глибенкламидом или натеглинидом, который представляет собой вид средства, усиливающего секрецию инсулина, возникающие после приема пищи высокие уровни глюкозы также эффективно снижаются.
В публикации патента Кореи № 2003-0019440 отмечено, что, когда соединение, описанное в International Publication Gazette WO 99/061431, вводится в сочетании с обычным средством для терапии диабета, активность ДПП-IV в плазме, концентрация гемоглобина (HbA1C, %) и глюкозы в плазме значительно снижаются.
В International Publication Gazette WO 07/074884 отмечено, что при введении алоглиптина в сочетании с воглибозой, пиоглитазоном и т.п. защитные эффекты поджелудочной железы усиливаются.
В International Publication Gazette WO 07/006769 отмечено, что, когда вилдаглиптин и римонабант, которые являются антагонистами каннабиноидного рецептора-1, вводятся совместно, уровни глюкозы и липида в крови и вес эффективно улучшаются, а в WO 06/119260 отмечается, что при совместном введении ситаглиптина и антагониста каннабиноидного рецептора-1 улучшаются толерантность к глюкозе и резистентность к инсулину.
Таким образом, авторы настоящего изобретения разработали соединение формулы 1, которое представляет собой новый ДПП-IV ингибитор, и обнаружили, что, когда соединение вводится совместно с противодиабетическим средством или средством против ожирения, эффективно восстанавливается толерантность к глюкозе, снижаются уровни глюкозы крови, а жировая масса уменьшается, что является осуществлением, таким образом, настоящего изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Объектом настоящего изобретения является фармацевтическая композиция для профилактики и лечения диабета или ожирения, содержащая в качестве активных ингредиентов соединение, ингибирующее активность дипептидилпептидазы-IV, и другие противодиабетические средства или средства против ожирения.
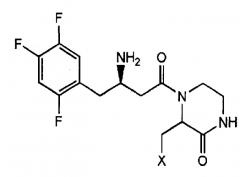
В соответствии с настоящим изобретением фармацевтическая композиция для профилактики и лечения диабета или ожирения, содержит в качестве активных ингредиентов (1) соединение, представленное следующей формулой 1, его фармацевтически приемлемую соль, его гидрат или его сольват, и (2) одно или несколько других противодиабетических средств или средств против ожирения.
Формула 1
(В формуле 1 X является таким, как определено в настоящем документе.)
ПОЛОЖИТЕЛЬНЫЙ ЭФФЕКТ
В соответствии с настоящим изобретением, фармацевтическая композиция, содержащая в качестве активных ингредиентов соединение, представляющее собой вид нового ДПП-IV ингибитора, и одно или несколько других противодиабетических средств или средств против ожирения, может быть использована при профилактике и лечении диабета, ожирения и тому подобного путем введения композиции для усиления эффектов восстановления толерантности к глюкозе, ингибирования уровней глюкозы в крови и усиления эффектов снижения жировой массы по сравнению с другими обычными противодиабетическими средствами или средствами против ожирения.
Описание фигур
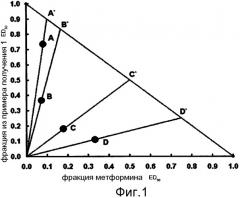
Фиг. 1 представляет собой изоболограмму, показывающую противодиабетические эффекты смешанных композиций, содержащих соединение формулы 1 и метформин;
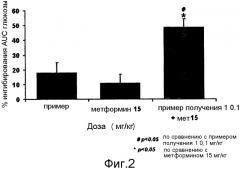
Фиг. 2 представляет собой диаграмму, показывающую процентное ингибирующее действие только отдельных компонентов и смешанной композиции соединения формулы 1 и метформина при различных дозах, вводимых животному;
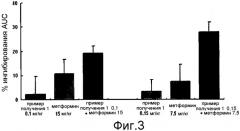
Фиг. 3 представляет собой диаграмму, показывающую процентное ингибирующее действие однократной дозы соединения 1, метформина и смешанной композиции в зависимости от улучшения толерантности к глюкозе при введении их мыши, страдающей ожирением, с различными соотношениями доз, составляющими от 1:50 до 1:150;
Фиг. 4 представляет собой диаграмму, показывающую процентное ингибирующее действие соединения 1, метформина и смешанной композиции в зависимости от уровня глюкозы в плазме крови при введении их мыши, страдающей ожирением, в течение двух недель с различными соотношениями доз, составляющими от 1:50 до 1:150;
Фиг. 5 представляет собой диаграмму, показывающую процентное ингибирующее действие соединения 1, PPARγ агониста и смешанной композиции в зависимости от уровня глюкозы в плазме крови при введении их мыши, страдающей диабетом, в течение семи дней с различными соотношениями доз от 1:0,01 до 1:0,4;
Фиг. 6 представляет собой диаграмму, показывающую процентное ингибирующее действие соединения 1, вещества ряда сульфонилмочевины, и смешанной композиции в зависимости от улучшения толерантности к глюкозе при введении с различными соотношениями доз, составляющими от 1:0,2 до 1:3,2;
Фиг. 7 представляет собой диаграмму, показывающую процентное ингибирующее действие соединения 1, ингибитора α-глюкозидазы и смешанной композиции в зависимости от улучшения толерантности к глюкозе при введении с различными соотношениями доз, составляющими от 1:0,03 до 1:0,18; и
Фиг. 8 представляет собой диаграмму, показывающую процентное ингибирующее действие соединения 1, антагониста каннабиноидного рецептора-1, смешанной композиции в зависимости от улучшения толерантности к глюкозе при введении с различными соотношениями доз, составляющими от 1:1 до 1:10.
Предпочтительный способ осуществления изобретения
Далее настоящее изобретение будет описано более подробно.
Настоящее изобретение относится к фармацевтической композиции для профилактики и лечения диабета или ожирения, содержащей в качестве активных ингредиентов (1) соединение, представленное следующей формулой 1, его фармацевтически приемлемую соль, его гидрат или его сольват, и (2) одно или несколько других противодиабетических средств или средств против ожирения.
Формула 1
В формуле 1
Х представляет собой OR1, SR1 или NR1R2,
где R1 и R2 независимо представляют собой C1~C5 низший алкил, или R1 и R2 в NR1R2 могут образовывать 5-7-членное кольцо, содержащее гетероатом O.
C1~C5 низший алкил в формуле 1 может включать C1-C5 алкил и циклоалкил.
Соединение, представленное формулой 1, может иметь два центра асимметрии и, таким образом, может иметь центр асимметрии на β-углеродном атоме и на атоме углерода в 3-положении пиперазина. Соответственно, центр может присутствовать в виде отдельного диастереомера, рацемата, рацемической смеси или диастереоизомерной смеси, каждый из которых может быть включен в соединение, представленное формулой 1 по настоящему изобретению.
Кроме того, соединение, представленное формулой 1 по настоящему изобретению, может частично присутствовать в виде таутомера, и отдельные таутомеры, а также их смеси могут быть включены в соединение по настоящему изобретению.
Стереомер по настоящему изобретению может быть получен обычным методом стереоселективного синтеза, хорошо известным в данной области, используя оптически чистое исходное вещество или известный реагент.
Предпочтительными примерами соединения, представленного формулой 1 по настоящему изобретению, являются следующие.
1) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-он;
2) (S)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутоксиметил)пиперазин-2-он;
3) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(метоксиметил)пиперазин-2-он;
4) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(изопропоксиметил)пиперазин-2-он;
5) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(циклопентилоксиметил)пиперазин-2-он;
6) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-[(диэтиламино)метил]пиперазин-2-он;
7) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-[(этилметиламино)метил]пиперазин-2-он;
8) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(морфолинометил)пиперазин-2-он;
9) (R)-4-[(R)-3-амино-4-(2,4,5-трифторфенил)бутаноил]-3-(трет-бутилтиометил)пиперазин-2-он.
Фармацевтически приемлемая соль содержащего бета-амино группу гетеросоединения формулы 1 по настоящему изобретению может быть получена любым обычно используемым способом получения солей, хорошо известным в данной области.
Используемый в настоящем документе термин "фармацевтически приемлемая соль" относится к соли, полученной из фармацевтически приемлемого нетоксичного основания или кислоты, включая неорганическое или органическое основание и неорганическую или органическую кислоту. Примеры соли, полученной из неорганического основания, включают соль алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, манганата, марганца, калия, натрия, цинка и так далее. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Твердая соль может иметь одну или несколько кристаллических структур или же может быть в форме гидрата. Примеры соли, полученной из фармацевтически приемлемого нетоксичного органического основания, включают первичный, вторичный или третичный амин, замещенный амин, такой как природный замещенный амин, циклический амин или основная ионообменная смола, такая как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовая смола, прокаин, пурин, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобное.
В случае, когда соединение по настоящему изобретению является основным, его соль может быть получена из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Примеры кислоты включают уксусную кислоту, бензолсульфоновую кислоту, бензойную кислоту, камфорсульфоновую кислоту, лимонную кислоту, этансульфоновую кислоту, фумаровую кислоту, глюконовую кислоту, глутаминовую кислоту, бромистоводородную кислоту, хлористоводородную кислоту, изэтионовую кислоту, молочную кислоту, малеиновую кислоту, яблочную кислоту, миндальную кислоту, метансульфоновую кислоту, муциновую кислоту, азотную кислоту, памовую кислоту, пантотеновую кислоту, фосфорную кислоту, янтарную кислоту, серную кислоту, винную кислоту, п-толуолсульфоновую кислоту, адипиновую кислоту и тому подобное. Предпочтительно, фармацевтически приемлемая соль может быть получена с помощью уксусной, лимонной, соляной, яблочной, фосфорной, янтарной, винной и адипиновой кислот. Более предпочтительно, фармацевтически приемлемая соль может быть получена с помощью винной кислоты.
Подразумевается, что используемое в настоящем документе соединение формулы 1 включает свою фармацевтически приемлемую соль.
Подразумевается, что гидрат соединения формулы 1 по настоящему изобретению или его фармацевтически приемлемая соль включает дополнительно стехиометрическое или нестехиометрическое количество воды, связанной с помощью нековалентных межмолекулярных сил. Гидрат может содержать 1 или более эквивалентов воды, обычно 1-5 эквивалентов воды. Гидрат может быть получен гидратацией соединения формулы 1 по настоящему изобретению или его фармацевтически приемлемой соли в воде или водосодержащем растворителе.
Подразумевается, что сольват соединения формулы 1 по настоящему изобретению или его фармацевтически приемлемая соль включает дополнительно стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными силами. Предпочтительными растворителями являются легколетучие, нетоксичные и удобные для введения человеку растворители. В качестве примера можно привести этанол, метанол, пропанол, метиленхлорид и тому подобное.
Соединение формулы 1 по настоящему изобретению может быть легко получено способом, описанным в корейской патентной заявке № 2007-0038462. В частности, (R)-(3-трет-бутоксиметил)пиперазин-2-он синтезируют из 1) (3R)-трет-бутоксикарбониламино-4-(2,4,5-трифторфенил)бутановой кислоты и сложного метилового эфира D-серина, в качестве исходных веществ, которые могут давать промежуточное соединение трет-бутил (R)-4[(R)-2-(трет-бутоксиметил)-3-оксопиперазин-1-ил]-4-оксо-1-(2,4,5-трифторфенил)-бутан-2-илкарбамат путем стандартной реакции пептидизации (стадия 1), и далее осуществляют реакцию удаления защитной группы (стадия 2) с последующей нейтрализацией с получением соединения в виде формулы 1.
Соединение формулы 1 представляет собой тип ДПП-IV ингибитора, демонстрирует превосходную ингибирующую активность в отношении ДПП-IV и биодоступность и может быть использовано при профилактике и лечении заболеваний, таких как диабет, ожирение и тому подобное, обусловленных ДПП-IV.
Противодиабетическое средство или средство против ожирения, которое смешивают с соединением, представленным формулой 1 в настоящем изобретении, для получения композиции для профилактики и лечения диабета или ожирения, может быть предпочтительно выбрано из группы, состоящей из ингибитора α-глюкозидазы, бигуанида, стимулятора секреции инсулина, сенсибилизатора инсулина и антагониста каннабиноидного рецептора-1. Однако указанное средство этими средствами не ограничивается.
Бигуанид по настоящему изобретению относится к лекарственному средству, включающему бигуанидиновую структуру и оказывающему эффекты, такие как эффекты, стимулирующие анаэробный гликолиз, эффекты, усиливающие чувствительность периферических тканей к инсулину, ослабление всасывания глюкозы из кишечника и супрессия гликонеогенеза в печени. Бигуанидин может быть выбран из группы, состоящей из, но ими не ограничиваясь, метформина, буформина и фенформина.
Сенсибилизатор инсулина по настоящему изобретению относится к лекарственному средству, которое восстанавливает нарушение действия инсулина на низкие уровни глюкозы в крови, обычно имеет тиазолидиндионовую (TZD) структуру и действует на рецепторы, активируемые активатором пероксисом (PRAR). Сенсибилизатор инсулина может быть выбран из группы, состоящей из, но ими не ограничиваясь, троглитазона, циглитазона, росиглитазона (AVNADIA), пиоглитазона (ACTOS) и энглитазона.
Стимулятор секреции инсулина по настоящему изобретению относится к лекарственному средству, способствующему секреции инсулина бета-клетками поджелудочной железы, и может быть лекарственным средством, имеющим структуру сульфонилмочевины или несульфонилмочевины. Предпочтительно, стимулятором секреции инсулина может быть лекарственное средство, имеющее структуру сульфонилмочевины, выбранное из группы, состоящей из, но ими не ограничиваясь, глибенкламида (глибурид), глипизида, гликлазида, глимепирида, толазамида, толбутамида, ацетогексамида, карбутамида, хлорпропамида, глиборнурида, гликуидона, глизентида, глизоламида, глизоксепида, гликлопиамида, глициламида и глипентида, или лекарственное средство, имеющее структуру несульфонилмочевины, такое как, но ими не ограничиваясь, репаглинид или натеглинид.
Ингибитор α-глюкозидазы по настоящему изобретению относится к лекарственному средству, избирательно ингибирующему α-глюкозидазу, которая представляет собой тип пищеварительного фермента в кишечнике, для подавления переваривания и всасывания крахмала, дисахаридов и так далее. Ингибитор α-глюкозидазы может быть выбран из группы, состоящей из, но ими не ограничиваясь, акарбозы, воглибозы, эмиглитата и миглитола.
Антагонист каннабиноидного рецептора-1 по настоящему изобретению относится к лекарственному средству, ингибирующему избыточную активность эндоканнабиноидов, для регулирования баланса массы тела и энергии, а также метаболизма глюкозы и липидов. Антагонист каннабиноидного рецептора-1 может быть выбран из группы, состоящей из, но ими не ограничиваясь, римонабанта (ACOMPLIA), отенабанта, ибинабанта и суринабанта.
Доза или дозировка фармацевтической композиции в соответствии с настоящим изобретением изменяется в зависимости от веса пациента, возраста, пола, состояния здоровья, режима питания, времени введения, способа введения, скорости выведения, тяжести заболевания и так далее. Обычная стандартная дозировка вычисляется исходя из количества активного ингредиента, которое может быть введено однократной дозой человеку весом 70 кг, оценивая получение терапевтически эффективной дозы. Однако учитывается, что точная терапевтически эффективная доза активных ингредиентов будет изменяться в зависимости от относительного количества каждого используемого активного компонента, исходя из конкретного используемого лекарственного средства и вышеуказанных синергетических соотношений.
Соединение формулы 1 может быть, предпочтительно, включено в состав фармацевтической композиции в диапазоне от около 0,1 до около 1500 мг. Однако диапазон может быть увеличен или уменьшен в зависимости от симптома заболевания.
Кроме того, рекомендуемая хорошо известная доза является подходящей в качестве ежедневной клинической дозы других противодиабетических средств или средств против ожирения, включенных в фармацевтическую композицию настоящего изобретения. Например, доза, составляющая от около 500 мг до около 2000 мг, является общеизвестной в качестве ежедневной клинической дозы метформина.
Смешиваемое соотношение соединения, представленного формулой 1, включенного в фармацевтическую композицию по настоящему изобретению, и других противодиабетических средств или средств против ожирения, в соответствии с вводимой дозой, может быть выбрано в диапазоне от 1:16,7 до 1:450. Оптимальные применяемые терапевтически эффективные дозы могут быть легко определены специалистом в данной области и будут изменяться в зависимости от количества используемых в синергетическом соотношении активных ингредиентов в соответствии с фракцией своих соответствующих ED30 значений, эффективности препарата, способа введения и улучшения подвергаемого лечению состояния или расстройства. Кроме того, факторы, относящиеся к конкретному больному, включая возраст больного, массу тела, диету и время введения лекарственного препарата, вызывают потребность скорректировать дозу до адекватного терапевтически эффективного уровня.
Фармацевтическая композиция по настоящему изобретению может быть введена с соотношением в диапазоне синергетического соотношения веществ в соответствии с фракцией своих соответствующих ED30 значений. Значение ED30 относится к дозе фармацевтической композиции, при введении которой наблюдается 30%-ное ингибирование. Процентное ингибирование может быть вычислено путем вычитания из площади под кривой экспериментальной группы, площади под кривой группы, в которой глюкоза не вводилась, в кривой изменения глюкозы в крови, сравнивая значение со значением контрольной группы, в которой вводилась глюкоза, и вычисляя коэффициент ингибирования. Обычно предполагается, что в экспериментах на мышах эффективная доза определяется как доза для уменьшения AUC на 30% или больше (WO 2006/076231 A2).
В фармацевтическую композицию по настоящему изобретению могут быть включены соединение формулы 1 и бигуанид в соотношении в диапазоне от 9:1 до 1:3, в соответствии с фракцией своих соответствующих ED30 значений, и более предпочтительно в соотношении 1:1.
В фармацевтической композиции по настоящему изобретению, в сл