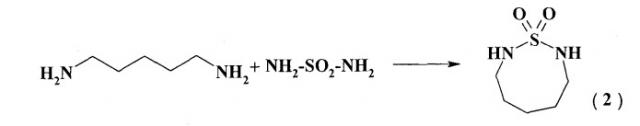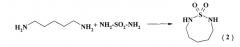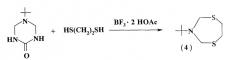Способ получения 3-арил-тетрагидро-2н,6н-1,5,3-дитиазоцинов
Иллюстрации
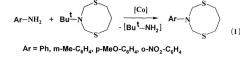
Показать всеИзобретение относится к области органической химии, в частности к способу получения 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (I):
,
где Ar=Ph, м-Ме-С6Н4, n-МеО-С6Н4, o-NO2-C6H4, который заключается в том, что 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин подвергают взаимодействию с N-ариламинами (анилин, м-метиланилин, n-метоксианилин, о-нитроанилин) в присутствии катализатора Со(асас)3 в мольном соотношении 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин:N-ариламин:Со(асас)3=10:(10-12):(0.3-0.7) в хлороформе и атмосфере аргона в течение 2.5-3.5 ч. Технический результат - разработан способ получения с высокой селективностью новых 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов, которые могут найти применение в качестве антибактериальных, антигрибковых и антивирусных агентов, в качестве комплексообразователей, селективных сорбентов и экстрагентов драгоценных металлов, специальных реагентов для подавления жизнедеятельности бактерий в различных технических средах. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к способу получения 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (I):
, где Ar=Ph, м-Ме-С6Н4, n-МеО-С6Н4, о-NO2-С6Н4
Азот и серусодержащие гетероциклы известны как антибактериальные, антигрибковые и антивирусные агенты (Stillings M.R., Welbour A.P., Walter D.J. Substituted 1,3,4-thiadiazoles with anticonvulsant activity// Med. Chem. 1986. 29. P. 2280-2284; Kidwai M., Negi N., Chaudhary S.R. Cyclothiomethylation of arge hydrazines with formaldehyde// Acta Pharma. 1995. 45. P. 511; Тюкавкина H.A., Зурабян С.Э., Белобородов В.Л. и др. Органическая химия. M.: Дрофа, 2008, с.66 - 67). Они перспективны в качестве катализаторов, биологически активных комплексообразователей, селективных сорбентов и экстрагентов драгоценных металлов [Deutsche Gold- und Silber-Scheideanstalt vormals Roessler. F.P. 1,341,792/1963 (Chem. Abs., 1964, 60, 5528d)], специальных реагентов для подавления жизнедеятельности бактерий в различных технических средах (от легкой промышленности до нефти) (Джемилев У.М., Алеев Р.С., Дальнова Ю.С., Кунакова Р.В., Хафизова С.Р., Ковтуненко С. В., Калимуллин А.А., Андрианов В.М., Исмагилов Ф.Р., Гафиатуллин P.P. Средство для подавления роста сульфатвосстанавливающих бактерий. Пат.РФ №2160233, 2000; Джемилев У.М., Алеев Р.С., Дальнова Ю.С., Кунакова Р.В., Хафизова С.Р. Средство для подавления роста сульфатвосстанавливающих бактерий. Пат.РФ №2206726, 2003).
Известен способ (M.Preiss. l,2,5-Thiadiazolidin-l,l-dioxid und Homologe. Chem.Ber, 1978, 111, p.1915-1921) получения соединений дитиазоцинового
ряда, а именно, 1,2,8-тиадиазоцин-1,1 -диоксида (2) с выходом 23% взаимодействием пентаметилендиамина с сульфамидом в этаноле при комнатной температуре и перемешивании 20 ч по схеме:
Известным способом не могут быть получены 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1).
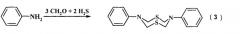
Известен способ (В.Р. Ахметова, З.Т. Ниатшина, Г.Р. Хабибуллина, И.С.Бушмаринов, А.О. Борисова, З.А. Старикова, Л.Ф. Коржова, Р.В. Кунакова. Синтез, кристаллическая структура и взаимные превращения новых "N-арил-1,3,5-дитиазинанов, 1,3,5-тиадиазинанов и 1,5-дитиа-3,7-диазациклооктанов. Изв. АН. Сер. хим., 2010, №5, 980-986) получения восьмичленных N,S-содержащих гетероциклов, а именно N,N'-дифенил-1,5-дитиа-3,7-диазациклооктанов (3) взаимодействием анилина, водного формальдегида (37%) и сероводорода при температуре 0°С по схеме:
Известным способом не могут быть получены 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1).
Известен способ (U.Wellmar. Urea as Leaving Group in the Synthesis of 3-(tert-Butyl)perhydro-l,5,3-dithiazepine. J.Heterocyclic Chem., 1998, 35, p.1531) получения 3-(трет-бутил)пергидро-1,5,3-дитиазепина (4) с выходом 45% взаимодействием 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина с 1,2-этандитиолом в присутствии ВFз·2НОАс при комнатной температуре за 2 ч по схеме:
Известным способом не могут быть получены 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1).
Таким образом, в литературе отсутствуют сведения о получении 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (1).
Предлагается новый способ получения 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (1).
Сущность способа заключается во взаимодействии 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцина с N-ариламинами общей формулы Аr-NH2, где Аr=Ph, м-Ме-С6Н4, n-МеО-С6Н4, о-NО2-С6Н4, в присутствии катализатора Со(асас)3, взятыми в мольном соотношении 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин: N-ариламин: Со(асас)3=10: (10-12):(0.3-0.7), предпочтительно 10:11:0.5, при комнатной температуре (20°С) и атмосферном давлении в хлороформе в качестве растворителя в течение 2.5-3.5 ч. Выход 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов (1) составляет 62-86%. Реакция протекает по схеме:
3-Арил-1,5,3-дитиазоцинаны общей формулы (1) образуются только лишь с участием N-ариламинов и 3-трет-бутил- тетрагидро-2Н,6Н-1,5,3-дитиазоцина под действием катализатора Со(асас)3. В присутствии других аминов (например, алкиламины) или без катализатора целевые продукты (1) не образуются.
Проведение реакции в присутствии катализатора Со(асас)3 больше 7 мол. % по отношению к 3-трет-бутил- тетрагидро-2Н,6Н-1,5,3-дитиазоцину не приводит к существенному увеличению выхода целевого продукта (1). Использование в реакции катализатора Со(асас)3 менее 3 мол. % снижает выход (1), что связано с уменьшением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре ~20°С. При более высокой температуре (например, 60°С) снижается селективность реакции и увеличиваются энергозатраты, при меньшей температуре (например, -10°С) снижается скорость реакции. Опыты проводили в хлороформе, т.к. в нем хорошо растворяются целевые продукты.
Существенные отличия предлагаемого способа:
В известном способе реакция идет с участием в качестве исходного реагента 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина в присутствии ВF3·2НОАс с образованием 3-(трет-бутил)пергидро-1,5,3-дитиазепина (4). Известный способ не позволяет получать индивидуальные 3-арил-1,5,3-дитиазоцинаны общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются 3-трет-бутил- тетрагидро-2Н,6Н-1,5,3-дитиазоцин и N-ариламины, реакция идет под действием катализатора Со(асас)3.
Предлагаемый способ обладает следующими преимуществами:
Способ позволяет получать с высокой селективностью индивидуальные 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1), синтез которых в литературе не описан.
Способ поясняется следующими примерами:
ПРИМЕР 1. В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона помещают 5 мл хлороформа, 0.5 ммолей Со(асас)3, 10 ммолей 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин и 11 ммолей анилина. Реакционную смесь перемешивают при комнатной температуре (~20°С) в течение 3 ч. Из реакционной массы выделяют 3-фенил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин с выходом 74%.
Другие примеры, подтверждающие способ, приведены в табл.1.
Таблица 1
| №п/п | Исходный N-ариламин | Соотношение 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин: N-ариламин: Со(асас)3, ммоль | Время реакции, час | Выход (1), % |
| 1 | анилин | 10:11:0.5 | 3 | 74 |
| 2 | - «- | 10:12:0.5 | 3 | 76 |
| 3 | - «- | 10:10:0.5 | 3 | 67 |
| 4 | - «- | 10:11:0.7 | 3 | 86 |
| 5 | - «- | 10:11:0.3 | 3 | 62 |
| 6 | - «- | 10:11:0.5 | 3.5 | 79 |
| 7 | - «- | 10:11:0.5 | 2.5 | 65 |
| 8 | м-метиланилин | 10:11:0.5 | 3 | 73 |
| 9 | n-метоксианилин | 10:11:0.5 | 3 | 69 |
| 10 | о-нитроанилин | 10:11:0.5 | 3 | 85 |
Все опыты проводили в хлороформе при комнатной температуре (~20°С).
Спектральные характеристики 3-фенил-тетрагидро-2Н,6Н-1,5,3 -дитиазоцина:
Спектр ЯМР 1Н (δ, м.д, СDСl3,J/Гц): 1.81 (м, 2Н, СН2 (7)); 2.74 (т, 4Н, СН2 (6,8) J=6, J=5.6); 4.93 (с, 4Н, СН2 (2,4)); 6.90-7.39 (м, 4Н, СН (10-14)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 29.00(С-6,8); 32.23(С-7); 56.64 (С-2,4);
113.44(С-14,10); 117.68(С-12); 118.92(С-11,13); 143.31(С-9).
Спектральные характеристики 3-(м-метилфенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцина:
Спектр ЯМР 1H(δ, м.д., CDCl3, J/Гц): 1.79 (м, 2Н, СН2 (7)); 2.43 (с, 3Н, СН3 (15)); 2.76 (т, 4Н, СH2, (6,8) J=6, J=5.6); 4.78 (с, 4Н, СН2, (2,4)); 6.76-7.28 (м,4Н,СН (10-14)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 22.21 (С-15); 29.05(С-7); 32.29(С-6,8);
56.70(С-2,4); 111.01(C-14); 113.25(C-12); 119.66(С-13); 129.23(С-11);
139.04(С-10); 143.47(С-9).
Спектральные характеристики 3-(n-метоксифенил)-тетрагидро-2Н, 6Н-1,5,3 -дитиазоцина:
Спектр ЯМР 1Н (δ, м.д, СDCl3, J/Гц): 1.81 (м, 2Н, СН2 (7)); 2.73 (т, 4Н, СН2 (6,8) J=6, J=5.6); 3.80 (с, 3Н, СН3 (16)); 4.76 (с, 4Н, СН2 (2,4)); 6.81-7.27(м,4Н,СН(10-14)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 29.99(С-7); 32.26(С-6,8); 55.65(С-16);
57.04(С-2,4); 114.36(С-11,13); 114.89(С-10,14); 137.34(С-9); 152.85(С-12).
Спектральные характеристики 3-(n-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцина:
Спектр ЯМР 1Н (δ, м.д., CDCl3, J/Гц): 1.84 (м, 2Н, СН2 (7)); 2.72 (т, 4Н, СН2 (6,8), J=6, J=5.6); 4.78 (с, 4Н, СН2 (2,4)); 7.93-8.22 (м, 4Н, СН (10-12,14)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 29.17(С-7); 31.77(С-6,8); 56.56(С-2,4);
112.87(С-10,14); 125.72(С-11,13); 139.63(С-12); 148.70(С-9).
Способ получения 3-арил-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (1): ,где Ar=Ph, м-Ме-С6Н4, п-МеО-С6Н4, о-NO2-С6H4, отличающийся тем, что 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин подвергают взаимодействию с N-ариламинами (анилин, м-метиланилин, п-метоксианилин, о-нитроанилин) в присутствии катализатора Со(асас)3 в мольном соотношении 3-трет-бутил-тетрагидро-2Н,6Н-1,5,3-дитиазоцин:N-ариламин:Со(асас)3=10:(10-12):(0,3-0,7) в хлороформе и атмосфере аргона в течение 2,5-3,5 ч.