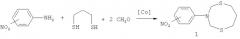Способ получения 3-(o-,м-,п-нитрофенил)-тетрагидро-2h,6h-1,5,3-дитиазоцинов
Иллюстрации
Показать всеИзобретение относится к области органической химии, в частности к способу получения 3-(о-, м-, n-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (I):
отличающийся тем, что 1,3-пропандитиол подвергают взаимодействию с водным формальдегидом и о-(или м- или п-)нитроанилином в присутствии катализатора Со(асас)3 в мольном соотношении о-(или м- или п-)нитроанилин:формальдегид:1,3-пропандитиол:Со(асас)3=10:20:10:(0.3-0.7) в атмосфере аргона в хлороформе в качестве растворителя при комнатной температуре в течение 5-7 ч. Технический результат - разработан способ получения новых 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов, которые могут найти применение в качестве антибактериальных, антигрибковых и антивирусных агентов, в качестве комплексообразователей, селективных сорбентов и экстрагентов драгоценных металлов, специальных реагентов для подавления жизнедеятельности бактерий в различных технических средах. 1 табл., 1 пр.
Реферат
Предлагаемое изобретение относится к области органической химии, в частности к способу получения 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (1):
Азот и серусодержащие гетероциклы известны как антибактериальные, антигрибковые и антивирусные агенты (Stillings M.R., Welbourn A.P., Walter D.J. Substituted 1,3,4-thiadiazoles with anticonvulsant activity. // Med. Chem. 1986. 29. P.2280-2284; Kidwai M., Negi N., Chaudhary S.R. Cyclothiomethylation of arge hydrazines with formaldehyde. // Acta Pharma. 1995. 45. P.511; Тюкавкина H.A., Зурабян С.Э., Белобородов В.Л. и др. Органическая химия. - М.: Дрофа, 2008. с.66-67). Они перспективны в качестве катализаторов, биологически активных комплексообразователей, селективных сорбентов и экстрагентов драгоценных металлов [Deutsche Gold- und Silber-Scheideanstalt vormals Roessler. F.P. 1,341,792/1963 (Chem. Abs., 1964, 60, 5528d)], специальных реагентов для подавления жизнедеятельности бактерий в различных технических средах (от легкой промышленности до нефти) (Джемилев У.М., Алеев Р.С., Дальнова Ю.С., Кунакова Р.В., Хафизова С.Р., Ковтуненко С.В., Калимуллин А.А., Андрианов В.М., Исмагилов Ф.Р., Гафиатуллин P.P. Средство для подавления роста сульфатвосстанавливающих бактерий. Пат. РФ №2160233, 2000; Джемилев У.М., Алеев Р.С., Дальнова Ю.С., Кунакова Р.В., Хафизова С.Р. Средство для подавления роста сульфатвосстанавливающих бактерий. Пат. РФ №2206726, 2003).
Известен способ (M.Preiss. 1,2,5-Thiadiazolidin-1,1-dioxid und Homologe. Chem. Ber, 1978, 111, p.1915-1921) получения соединений дитиазоцинанового ряда, а именно, 1,2,8-тиадиазоцин-1,1,-диоксид (2) с выходом 23% взаимодействием пентаметилендиамина с сульфамидом в этаноле при комнатной температуре при перемешивании 20 ч по схеме:
Известным способом не могут быть получены 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1).
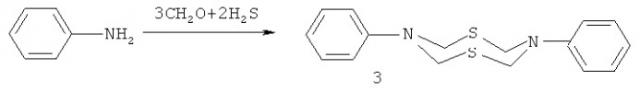
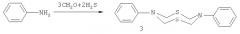
Известен способ (В.Р.Ахметова, З.Т.Ниатшина, Г.Р.Хабибуллина, И.С.Бушмаринов, А.О.Борисова, З.А.Старикова, Л.Ф.Коржова, Р.В.Кунакова. Синтез, кристаллическая структура и взаимные превращения новых N-арил-1,3,5-дитиазинанов, 1,3,5-тиадиазинанов и 1,5-дитиа-3,7-диазациклооктанов. Изв. АН. Сер. хим., 2010, №5, 980-986) получения восьмичленных N,S-содержащих гетероциклов, а именно N,N'-дифенил1,5-дитиа-3,7-диазациклооктанов (3) взаимодействием анилина водного формальдегида (37%) и сероводорода при температуре 0°C по схеме:
Известным способом не могут быть получены 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1).
Известен способ (U.Wellmar. Urea as Leaving Group in the Synthesis of 3-(tert-Butyl)perhydro-1,5,3-dithiazepine. J.Heterocyclic Chem., 1998, 35, p.1531) получения соединений 1,5,3-дитиазепинанового ряда, а именно 3-(трет-бутил)пергидро-1,5,3-дитиазепина (4) с выходом 45% взаимодействием 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина с 1,2-этандитиолом в присутствии BF3·2HOAc при комнатной температуре за 2 ч по схеме:
Известным способом не могут быть получены 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1).
Таким образом, в литературе отсутствуют сведения по получению 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (1).
Предлагается новый способ получения 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (1).
Сущность способа заключается в предварительном перемешивании формальдегида с 1,3-пропандитиолом при комнатной (~20°С) температуре в течение 30 мин с последующим добавлением о-, м-, п-нитроанилина и катализатора Co(acac)3, взятых в мольном соотношении формальдегид: 1,3-пропандитиол: о-, м-, n-нитроанилин: Co(асас)3=20:10:10:(0.3-0.7), предпочтительно 20:10:10:0.5. Реакцию проводят в атмосфере аргона при комнатной температуре (~20°C) и атмосферном давлении в хлороформе (CHCl3) в качестве растворителя. Время реакции 5-7 ч, выход целевых продуктов 60-86%. Реакция протекает по схеме:
3-(о-, м-, п-Нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1) образуются только лишь с участием формальдегида, 1,3-пропандитиола и о-, м-, п-нитроанилина, взятых в мольном соотношении 20:10:10 (стехиометрические количества). При другом соотношении исходных реагентов снижается селективность реакции. В присутствии других альдегидов (например, алкилзамещенные альдегиды), других серусодержащих соединений (например, алкил-, арилтиолы) или других замещенных анилинов (например, алкил-, ариланилины) или без катализатора целевые продукты (1) не образуются.
Проведение указанной реакции в присутствии катализатора Co(асас)3 больше 7 мол.% не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора Co(асас)3 менее 3 мол. % снижает выход (1), что связано с уменьшением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре ~20°C. При более высокой температуре (например, 60°C) снижается селективность реакции и увеличиваются энергозатраты, при меньшей температуре (например, -10°C) снижается скорость реакции. Опыты проводили в хлороформе, т.к. в нем хорошо растворяются целевые продукты.
Существенные отличия предлагаемого способа
В известном способе реакция идет с участием в качестве исходного реагента 5-(трет-бутил)-2-оксогексагидро-1,3,5-триазина в присутствии BF3·2HOAc с образованием 3-(трет-бутил)пергидро-1,5,3-дитиазепина (4). Известный способ не позволяет получать индивидуальные 3-(o-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются о-, м-, п-нитроанилины, реакция идет под действием катализатора Co(асас)3.
Предлагаемый способ обладает следующими преимуществами
Способ позволяет получать с высокой селективностью индивидуальные 3-(о-, м-, п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцины общей формулы (1), синтез которых в литературе не описан.
Способ поясняется следующими примерами:
ПРИМЕР 1. В сосуд Шленка, установленный на магнитной мешалке, в атмосфере аргона при температуре ~20°C помещают 5 мл хлороформа, 20 ммолей водного раствора (37%) формальдегида и 10 ммолей 1,3-пропандитиола, перемешивают в течение 30 мин, затем добавляют 0.5 ммолей Co(асас)3 и 10 ммолей о-нитроанилина, перемешивают при температуре ~20°C в течение 6 ч. Получают индивидуальный 3-(о-нитрофенил)-1,5,3-дитиазоцинан с выходом 69%.
Другие примеры, подтверждающие способ, приведены в таблице.
| №№ п/п | Исходный нитроанилин | Соотношение нитроанилин:формальдегид:1,2-пропандитиол:Co(асас)3, ммоль | Время реакции, час. | Выход (1),% | |
| 1 | o-нитроанилин | 10:20 | 10:0.5 | 6 | 69 |
| 2 | -«- | 10:20 | 10:0.3 | 6 | 60 |
| 3 | -«- | 10:20 | 10:0.7 | 6 | 86 |
| 4 | -«- | 10:20 | 10:0.5 | 5 | 62 |
| 5 | -«- | 10:20 | 10:0.5 | 7 | 73 |
| 6 | м-нитроанилин | 10:20 | 10:0.5 | 6 | 75 |
| 7 | n-нитроанилин | 10:20 | 10:0.5 | 6 | 81 |
Все опыты проводили в хлороформе при комнатной температуре (~20°C).
Спектральные характеристики 3-(о-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцина:
Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.57 (м, 2Н, СН2 (7)); 2.63 (м, 4Н, СН2 (6,8)); 4.52 (с, 4Н, СН2 (2,4)); 6.77-7.74 (м, 4Н, СН (10-14)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 38.67 (C-7); 29.47 (C-6,8); 55.46 (С-2,4); 114.81 (С-10,14); 116.85 (C-12); 126.92 (С-11,13); 136.02 (C-9).
Спектральные характеристики 3-(м-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцина:
Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.92 (м, 2Н, СН2 (7)); 2.28 (м, 4Н, СН2 (6,8)); 4.51 (с, 4Н, СН2 (2,4)); 7.01-8.23 (м, 4Н, СН (10-12,14)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 27.99 (C-7); 32.00 (С-6,8); 53.98 (С-2,4); 111.33 (C-14); 118.85 (C-12); 121.27 (C-10); 129.80 (C-11); 138.90 (C-9); 141.60 (C-13).
Спектральные характеристики 3-(м-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцина:
Спектр ЯМР 1H (δ, м.д., CDCl3, J/Гц): 1.84 (м, 2Н, СН2 (7)); 2.72 (т, 4Н, СН2 (6,8), J=6, J=5.6); 4.78 (с, 4Н, СН2 (2,4)); 7.93-8.22 (м, 4Н, СН (10-12,14)).
Спектр ЯМР 13С (δ, м.д., J/Гц): 29.17 (C-7); 31.77 (С-6,8); 56.56 (С-2,4); 112.87 (С-10,14); 125.72 (C-11,13); 139.63 (C-12); 148.70 (C-9).
Способ получения 3-(о-,м-,п-нитрофенил)-тетрагидро-2Н,6Н-1,5,3-дитиазоцинов общей формулы (1): отличающийся тем, что 1,3-пропандитиол подвергают взаимодействию с водным формальдегидом и о-(или м-, или п-)нитроанилином в присутствии катализатора Со(асас)3 в мольном соотношении о-(или м-, или п-)нитроанилин:формальдегид:1,3-пропандитиол:Со(асас)3=10:20:10:(0,3-0,7) в атмосфере аргона в хлороформе в качестве растворителя при комнатной температуре в течение 5-7 ч.