Лечение нейродегенеративных расстройств
Иллюстрации
Показать всеИзобретение относится к медицине и касается применения эритропоэтической молекулы для получения лекарственного средства для лечения нейродегенеративных расстройств головного и спинного мозга введением эффективного количества лекарственного средства в кровяное русло пациента, нуждающегося в таком лечении, в котором эритропоэтическая молекула включает часть молекулы эритропоэтина, имеющую по меньшей мере одну свободную аминогруппу, выбранную из группы, включающей эритропоэтин человека и его аналоги, которые имеют последовательность эритропоэтина человека, модифицированную добавлением 1-6 сайтов гликозилирования или реаранжировкой по меньшей мере одного сайта гликозилирования; указанная часть молекулы эритропоэтина ковалентно связана с «n» группами полиэтиленгликоля формулы -CO-(CH2)x-(OCH2CH2)m-OR с -СО каждой группы полиэтилена, формирующей амидную связь с одной из указанных аминогрупп. Изобретение обеспечивает проникновение эритропоэтической молекулы через барьер между кровью и мозгом, хороший период полураспада, что позволяет вводить молекулу в более низкой начальной дозе. 4 н. и 15 з.п. ф-лы, 3 пр., 3 ил., 1 табл.
Реферат
Изобретение относится к способу лечения нейродегенеративных расстройств головного и спинного мозга, используя новый агент на основе эритропоэтина (НАЭ).
Биодоступность коммерческих белковых терапевтических средств, например эритропоэтина человека (ЭПО), ограничена их коротким периодом полураспада в плазме и чувствительностью к разрушению протеазами. Эти недостатки мешают их широкому клиническому применению. Новые агенты на основе эритропоэтина были разработаны путем химической модификации ЭПО и его аналогов. Эти новые агенты обеспечивают мощное и пролонгированное эритропоэтиновое действие, способствуя оптимальному лечению анемии у пациентов с болезнью почек и СПИДом, а также у онкологических больных, проходящих курс химиотерапии.
Настоящее изобретение относится к способу лечения нейродегенеративных расстройств головного и спинного мозга путем введения пациенту, нуждающемуся в такой терапии, терапевтически эффективного количества нового агента на основе эритропоэтина (НАЭ), который является химически модифицированным эритропоэтином человека или химически модифицированным аналогом эритропоэтина человека, включающим ковалентно интегрированные группы полиэтиленгликоля определенной молекулярной массы и линкерной структуры.
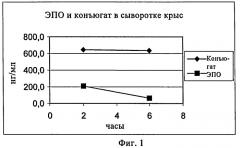
Описание фигур
Фиг.1 показывает концентрацию ЭПО и НАЭ настоящего изобретения в сыворотке крыс через 2 и 6 ч после инъекции.
Фиг.2 показывает концентрацию ЭПО и НАЭ настоящего изобретения в ликворе крыс через 2 и 6 ч после инъекции.
Фиг.3 показывает концентрацию ЭПО и НАЭ настоящего изобретения в ликворе и сыворотке крыс через 2 и 6 ч после инъекции.
Конкретно НАЭ, используемые в настоящем изобретении, являются молекулами химически модифицированного эритропоэтина, включающего предпочтительно по меньшей мере одну свободную аминную группу и включающего часть молекулы эритропоэтина, выбранного из группы, состоящей из эритропоэтина человека и его аналогов, у которых последовательность представляет последовательность эритропоэтина человека, модифицированную введением 1-6 сайтов гликозилирования или реаранжировкой по меньшей мере одного сайта гликозилирования; указанная часть эритропоэтина ковалентно связана с «n» группами полиэтиленгликоля формулы -СО-(CH2)х-(ОCH2CH2)m-OR с -СО (т.е. карбонилом) каждой группы полиэтиленгликоля, формируя амидную связь с одной из указанных аминогрупп; в которой R является низким алкилом; x обозначает 2 или 3; m обозначает число примерно от 450 до примерно 900; n обозначает число 1, 2 или 3, причем n и m выбраны таким образом, что молекулярная масса образуемого НАЭ, за вычетом молекулярной массой немодифицированной части молекулы эритропоэтина, составляет примерно от 20 кДа до примерно 100 кДа. Такие НАЭ описаны, например, в патенте US 6583272, соответствующая часть которого включена в настоящее изобретение в виде ссылки.
Новые агенты на основе эритропоэтина (НАЭ), используемые в настоящем изобретении, биохимически и функционально отличны от ЭПО. Полученные in vivo и in vitro данные свидетельствуют, что эти НАЭ проявляют существенно заниженное связывающее сродство с рецептором ЭПО и по сравнению с ЭПО диссоциируют быстрее. По сравнению с эритропоэтином человека (ЭПОч) такие НАЭ проявляют иные полезные клинические свойства, в том числе повышенный полупериод циркуляции в крови и повышенное время пребывания в плазме, пониженный клиренс и повышенное клиническое действие in vivo.
Некоторые из указанных выше наблюдений, связанных с отличительными свойствами НАЭ настоящего изобретения, возможно, могут быть объяснены новым механизмом действия. Быстрая диссоциация с рецептора эритропоэтина («ЭПО-Р») наряду с повышенным периодом полураспада в сыворотке могут привести к повышенному и устойчивому действию эритропоэтипа за счет множественных взаимодействий с рецептором. Исходя из стереохимии, такие множественные взаимодействия могут быть достаточными для индукции каскада сигналов ЭПО-Р, но они недостаточно плотные, чтобы вызвать такое прочное связывание, которое приведет к тому, что комплекс рецептор/молекула интернализируется и разрушается. Статистически только определенный процент молекул может проявлять такое прочное связывание. В итоге такой механизм действия может привести к тому, что одна молекула будет активировать более одного рецептора до своего разрушения.
Важно, что полезные свойства таких НАЭ позволяют снизить частоту введения и обеспечить более стабильный контроль над содержанием гемоглобина, позволяя оптимально лечить анемию у пациентов с болезнью почек, СПИДом или у онкологических больных во время химиотерапии. Предполагается, что такие полезные свойства приводят к лучшему исходу лечения и улучшенному качеству жизни пациентов.
Природный эритропоэтин человека (ЭПОч) вырабатывается в разных тканях организма (например, в почках, головном мозге и др.) и является гуморальным фактором плазмы, который в частности стимулирует выработку эритроцитов (Carnot P., Deflandre С., C.R. Acad. Sci. 143, 1906, с.432, Erslev A.J., Blood 8, 1953, с.349, Reissmann K.R., Blood 5, 1950, с.372, Jacobson L.O., Goldwasser E., Freid W., Pizak L.F., Nature 179, 1957, cc.6331-6334). Природный эритропоэтин стимулирует деление и дифференциацию предшественников эритроцитов в костном мозге и проявляет биологическую активность в виде связывания с рецепторами предшественников эритроцитов (Krantz B.S., Blood 77, 1991, с.419).
Ранее предполагали, что помимо применения ЭПО для лечения анемии эта молекула может применяться в связи с ее нейро- и миокардиальным защитным действием. См. обзор W. Jelkmann, K. Wagner, Ann. Hematol 83, 2004, cc.673-686.
Настоящее изобретение предусматривает применение НАЭ настоящего изобретения для лечения нейродегенеративных расстройств головного и спинного мозга путем введения НАЭ в кровяное русло. Настоящее изобретение основывается на том наблюдении, что, несмотря на относительно крупный размер, НАЭ настоящего изобретения могут преодолевать барьер между кровью и мозгом, выступая в качестве нейропротекторных агентов для нейронов головного и спинного мозга. Напротив, описанные ранее клинические свойства, которые такие НАЭ проявляют при других назначениях, также предположительно обеспечивают значительное терапевтическое преимущество при лечении нейродегенеративных расстройств по сравнению с лечением ЭПО.
Эритропоэтин получают путем биосинтеза, используя методику рекомбинантной ДНК (Egrie J.C., Strickland T.W., Lane J. и др., Immunobiol., 1986, 72, cc.213-224), и он является продуктом клонированного гена ЭПО человека, инсертированного в клетки ткани яичников китайского хомячка (клетках СНО) и экспрессирующегося в них. Первичная структура преобладающей полностью процессированной формы ЭПОч представлена последовательностью SEQ ID NO: 1. Имеется два дисульфидных мостика, расположенных между Cys7-Cys161 и Cys29-Cys33. Молекулярная масса цепи полипептида ЭПО без сахаров составляет 18236 Да. В интактной молекуле ЭПО примерно 40% молекулярной массы приходится на углеводные группы, которые гликозилируют белок по имеющимся у него сайтам гликозилирования (Sasaki Н., Bothner В., Dell A., Fukuda М., J. Biol. Chem. 262, 1987, с.12059).
Понятие «Эритропоэтин» или «ЭПО» относится к гликозилированному белку с аминокислотной последовательностью SEQ ID NO: 1, или SEQ ID NO: 2, или аминокислотной последовательностью, существенным образом гомологичной им, биологические свойства которых могут быть связаны со стимуляцией выработки эритроцитов и стимуляцией деления и дифференциации предшественников эритроцитов в костном мозге. Кроме того, понятие «эритропоэтин» относится к гликозилированному белку, проявляющему по меньшей мере одно из биологических свойств или связывающее сродство, известные в данной области техники. Таким образом, молекулы проявляют только ингибирующие нейрозащитные эффекты. В контексте настоящего изобретения к таким понятиям относятся белки, которые модифицированы целенаправленно, например, сайт-направленным мутагенезом или в результате случайных мутаций. К этим понятиям также относятся аналоги, имеющие 1-6 дополнительных сайтов для гликозилирования, аналоги, имеющие по меньшей мере одну дополнительную аминокислоту с С-конца гликопротеина, причем дополнительная аминокислота включает по меньшей мере один сайт гликозилирования, и аналоги с аминокислотной последовательностью, включающей перегруппировку по меньшей мере одного сайта для гликозилирования. К этим понятиям относятся и природный, и рекомбинантный эритропоэтин человека.
ЭПО связывается со специфическими трансмембранными рецепторами (ЭПО-Р). Функциональный ЭПО-Р человека является представителем надсемейства рецептора цитокина класса I и присутствует в виде гомодимера двух идентичных цепей гликопротеина из 484 аминокислот. Каждая цепь включает внеклеточный домен, гидрофобную трансмембранную последовательность и цитоплазматический домен, к которому присоединяется протеинтирозинкиназа JAK2. Немодифицированный ЭПО связывается с субъединицами рецептора, в соответствии с чем константы диссоциации двух сайтов связывания существенно отличаются. Связывание ЭПО с рецептором приводит к конформационному изменению и тесному соединению двух субъединиц ЭПО-Р, которое приводит к аутофосфорилированию двух молекул JAK и затем к комплексному сигнальному каскаду. Установлено, что ЭПО-индуцированный сигнальный метаболический путь возвращается примерно к исходным уровням через 30-60 мин после стимулирования. Действие ЭПО прекращается действием гемопоэтической клеточной фосфатазой (ГКФ), вызывающей интернализацию и разрушение комплекса ЭПО/ЭПО-Р.
Ранее было установлено, что ЭПО является в большей степени выраженным плейотропным фактором выживания, чем предполагалось ранее. Вероятно, ЭПО проявляет нейротрофическую и нейропротекторную (Cerami А. и др., Nephrol. Dial. Transplant. 17, 2002, cc.8-12, Chong Z.Z. и др. Curr. Drug Targets Cardiovasc. Haematol. Disord. 3, 2003, cc.141-154, Jumbe N.L. Oncology 16, 2002, cc.91-107, Marti H.H. и др. News Physiol. Sci. 15, 2000, cc.225-229), сосудистую (Masuda S. и др. Int. J. Hematol. 70, 1999, cc.1-6, Smith K.J. и др. Cardiovasc. Res. 59, 2003, cc.538-548) и кардиопротекторную функции (Smith K.J. и др. Cardiovasc. Res. 59, 2003, cc.538-548, Parsa C.J. и др. J. Clin. Invest. 112, 2003, cc.999-1007). Установлено, что ЭПО-Р находятся в разных областях мозга грызунов и других млекопитающих (Digicaylioglu М. и др. Proc. Natl. Acad. Sci. USA 92, 1995, cc.3717-3720, Li Y. и др. Pediatr. Res. 40, 1996, cc.376-380, Marti H.H. и др. Eur. J. Neurosci. 8, 1996, cc.666-676). Сайты связывания ЭПО преимущественно локализованы в гиппокампе, capsula interna, коре и среднем мозге мышей (Digicaylioglu М. и др. Proc. Natl. Acad. Sci. USA 92, 1995, cc.3717-3720). Кроме того, установлено, что ЭПО стимулирует пролиферацию и дифференциацию нейронного ствола и клеток-предшественниц (Shingo Т. и др. J. Neurosci. 21, 2001, cc.9733-9743, Studer L. и др. J. Neurosci. 20, 2000, cc.7377-7383).
Нейрозащитное действие ЭПО может быть прослежено по метаболическому пути первоочередного значения PI-3K/Akt нейропротекторного действия ЭПО за счет поддержания мембранного потенциала митохондрий в бескислородных культурах первичных нейрональных клеток гиппокампа (Chong Z.Z. и др. Circulation 106, 2003, cc.2973-2979). Дестабилизация потенциала мембраны митохондрий приводит к высвобождению цитохрома С, который активирует каспазы 8, 1 и 3, индуцирующие фрагментацию ДНК.
Нейропротекторное действие ЭПО в мозге впервые было установлено in vivo группой Sasaki в 1998 году (Sadamoto Y. и др., Biochem. Biophys. Res. Commun. 253, 1998, cc.26-32, Sakanak М. и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc.4635-4640) на монгольских песчанках. Установлено, что инфузия ЭПО в боковые желудочки предупреждает индуцируемое ишемией нарушение обучения и спасает нейроны СА1 гиппокампа от гибели. Сходные эксперименты на крысах показали индуцированное ишемией снижение способности к ориентации на месте, инфаркт коры и дегенерацию таламуса (Sadamoto Y. и др. Biochem. Biophys. Res. Commun. 253, 1998, cc.26-32). Кроме того, известный защитный эффект гипоксической предобработки существенно снижен у мышей, если передача сигнала ЭПО локально блокируется инфузией растворимого ЭПО-Р в желудочек мозга (Prass K. и др. Stroke 34, 2003, cc.1981-1986).
Ранее предполагалось, что вводимый системно ЭПО не может проникнуть в головной мозг из-за гематоэнцефалического барьера (Junk. А.K. и др., Proc. Natl. Acad. Sci USA 99, 2002, cc.10659-10664, Juul S.E. и др., Pediatr. Res., 46, 1999, cc.543-547). Гематоэнцефалический барьер (ГЭБ) отделяет мозг и спинномозговую жидкость (СМЖ, ликвор) от крови и регулирует обмен веществ между кровью и мозгом. В контексте настоящего изобретения понятие «ГЭБ» включает и барьер между мозгом и кровью, и барьер между кровью и СМЖ. В основном это относится к капиллярам мозга, кубическому эпителию сосудистого сплетения и оболочке головного мозга. Все участки ГЭБ характеризуются наличием плотного контакта между соседними клетками, отсутствием эндотелиальных пор и малочисленностью пинноцитозных пузырьков. Кроме того, капилляры мозга содержат в несколько раз большее количество эндотелиальных митохондрий по сравнению с капиллярами других частей тела. Клетки, обусловливающие эффективное функционирование ГЭБ, представляют непрерывный слой клеток, допускающих обмен растворенными соединениями только за счет межклеточного пути. Например, жирорастворимые растворы легко преодолевают ГЭБ, хотя электролиты, нерастворимые в жирах неэлектролиты и белки проникают в мозг из крови медленнее, чем они входят в ткани, отличные от нервной ткани. Эта барьерная функция способствует защите мозга от вредных веществ.
Существует четыре основных механизма, с помощью которых растворимые молекулы движутся сквозь мембраны. (1) Простая диффузия, (2) облегченная диффузия, (3) простая диффузия через водный канал и (4) активный транспорт посредством белкового носителя. Трансклеточная диффузия отсутствует в какой-либо значительной степени в ГЭБ из-за тесного контакта. В случае трансклеточной диффузии основной принцип заключается в том, что чем выше липофильность вещества, тем существеннее диффузия в мозг. Глюкоза, спирт и другие низкомолекулярные вещества непосредственно поступают в мозг за счет диффузии. Для большинства белков обычно требуется активный транспорт.
Гематоэнцефалический барьер может быть «открыт» определенными растворами, например, внутриартериальной инъекцией гипертонического раствора маннита. Предполагают, что маннит открывает гематоэнцефалический барьер за счет осмоса в результате сжатия эндотелиальных клеток.
СМЖ находится в желудочках головного мозга, спинномозговом канале и подпаутинном пространстве. СМЖ в основном образуется в сосудистых сплетениях боковых, третьего и четвертого желудочков головного мозга, и ее объем варьирует в пределах 10-20% от массы мозга. Объем СМЖ у людей составляет 140-150 мл и обновляется за 5 ч (у крыс за 1 ч). СМЖ движется в желудочках мозга и подпаутинном пространстве под давлением гидростатического давления, индуцируемого при выработке СМЖ. СМЖ создает внутреннюю опору для мозга, регулирует внеклеточную жидкость в мозге, осуществляет распределение нейроактивных веществ и является сливом, в котором собираются продукты обмена, вырабатываемые мозгом.
В работе Jumbe (Jumbe N.L., Oncology 16, 2002, cc.91-107) установлено, что соотношение концентраций в СМЖ и в сыворотке у крыс, которым ввели внутривенно рекомбинантный ЭПО человека (500 Ед./кг), составляет примерно 1×10-3. Близкие результаты получены при введении дарбепоэтина в количестве 25 мкг/кг. Рассчитанная средняя величина области под кривой зависимости концентрации от времени (AUC0-8) анализом без разделения составила 340 мЕд. ч/мл для рекомбинантного ЭПО человека (рЭПОч) и 3,6 нг ч/мл для дарбепоэтина альфа в спинномозговой жидкости против 370000 мЕд. ч/мл и 4500 нг ч/мл в сыворотке, соответственно.
В экспериментах с инфарктом установлено, что системное введение высоких доз рЭПОч подопытным животным снизило область инфаркта через 24 ч после закупорки мозговой артерии (Siren A.L. и др., Proc. Natl. Acad. Sci USA 98, 2001, cc.4044-4049), понизило смертность (Buemi М. и др., Eur. J. Pharmacol. 392, 2001, cc.31-34), предупредило нейрональное разрушение (Alafaci С. и др., Eur. J. Pharmacol. 406, 2000, cc.219-225), усилило мозговое кровообращение (Grasso G., J. Neurosurg. Sci. 45, 2001, cc.7-14) и понизило нейрологический дефицит (Grasso G. и др., J. Neurosurg. 96, 2002, cc.565-570). ЭПО также предупреждает апоптоз двигательных нейронов и нейрологическую беспомощность (Cerami А. и др., Nephrol. Dial. Transplant 17, 2002, cc.8-12), улучшает восстановление двигательной функции (Gorio А. и др., Proc. Natl. Acad. Sci. USA 99, 2002, cc.9450-9455) и снижает воспалительную реакцию при гипоксии мозга (Villa Р. и др., J. Exp. Med. 198, 2003, cc.971-975).
Кроме того, в настоящее время рассматривается применение эритропоэтина при множественном склерозе (МС). МС является воспалительным заболеванием центральной нервной системы (ЦНС), которая состоит из головного и спинного мозга. У пациентов с рассеянным склерозом очаги разрушений, называемые бляшками или поражениями, по-видимому, появляются в случайных местах в белом веществе ЦНС. В области повреждения материал, изолирующий нерв (миелин), исчезает, предположительно во время аутоиммунного воспаления. Миелиновая оболочка сходит с аксонов в ходе процесса демиелинизации. Миелиновая оболочка формируется в ЦНС в определенных участках олигодендроцитов. До сих пор неизвестна причина возникновения рассеянного склероза (PC). Выдвигались различные теории, например аутоиммунная, связанная с патогенами, с генетическими компонентами, собственными биохимическими изменениями, разрушением гематоэнцефалического барьера, диетой или недостаточностью витаминов, аллергической реакцией и др. Кроме того, обсуждается, что воспаление также вредоносно для мембран аксонов. В связи с этим до сих пор не существует радикального лечения PC. Однако может быть использован ряд лекарственных средств для симптоматического лечения заболевания. Например, могут вводиться кортикостероиды, ряд иммунносупрессантов и интерферон бета.
Diem и др., Brain, 128, 2005, cc.375-85, описали комбинированное лечение стероидами с применением ЭПО для локального воспаления, а также для лечения нейродегенеративных расстройств. Например, метилпреднизолон и эритропоэтин успешно применяют в виде комбинированной терапии на модели PC.
Выполненные Ehrenreich и др. эксперименты на людях (Ehrenreich H. и др., Mol. Med. 8, 2002, cc.495-505) с диагнозом удар показали, что имеется жесткая тенденция к снижению размера инфаркта у пациентов, которых лечили рЭПОч, связанная с выраженным неврологическим восстановлением и клиническим исходом через 1 месяц после удара. Пациенты получали внутривенно рЭПОч (3,3×104 Ед.) один раз в сутки в первые дни после удара. Средняя концентрация ЭПО в спинномозговой жидкости пациентов повышается до 17 Ед./л (в норме величина примерно составляет 1 Ед./л). Уровни в сыворотке пациентов приближаются к 5000 Ед./л через 3 ч после инфузии (нормальный уровень в сыворотке примерно составляет 15 Ед./л). Кроме того, ЭПО может успешно применяться для снижения реперфузионных повреждений в области, охватывающей место острого удара.
Известно, что ЭПО и ЭПО-Р, экспрессируемые в ткани мозга людей и грызунов (Siren A.L. и др., Acta Neuropathologica 101, 2001, cc.271-276), индуцируются гипоксией (Jelkmann W., din. Investig. 72, 1994, cc.3-10) и проявляют выраженный нейропротекторный потенциал (Bernaudin M. и др., J. Cereb. Blood Flow Metab. 19, 1999, cc.643-651, Gene S. и др., Neurosci. Lett. 298, 2001, cc.139-141). Сообщалось, что в мозге взрослых людей имеется только слабая экспрессия ЭПО и его рецептора в нейронах и астроцитах (Siren A.L. и др., Acta Neuropathologica 101, 2001, cc.271-276). В любом случае, в головном мозге людей после ишемии или гипоксии установлено, что ЭПО содержится в ткани сосудов и в воспаленных клетках, ЭПО-Р - в кровеносных сосудах, и нейрональные и астроцитные процессы - в зоне инфаркта или около зоны инфаркта. При ишемическом инфаркте ЭПО и ЭПО-Р преобладают в реактивной нейроглие. Общий эффект стимуляции ЭПО-Р в клетке-мишени сводится к пролиферации, подавлению апоптоза и, в случае эритробластов, к дифференциации.
Предполагалось, что ГЭБ эффективно сдерживает крупные гликозилированные молекулы, например ЭПО. Хотя согласно классической точке зрения ГЭБ непроницаем для крупных молекул, в исследованиях установлено, что некоторые крупные молекулы могут специфически транспортироваться в мозг через капиллярный эндотелий и влиять на функцию мозга. Это происходит через связывание с рецепторами, присутствующими на поверхностях эндотелиальных клеток в просвете сосудов. В результате инициируется эндоцитоз с последующей транслокацией через ГЭБ. Поскольку ЭПО-Р экспрессируется на капиллярах мозга, предполагалось, что транспорт ЭПО через ГЭБ действует через рецепторы.
Примечательно, что концентрации ЭПО в сыворотке, необходимые для защиты ткани, выше концентраций, требуемых для эритропоэза. Одной из причин этого является то, что рецептор для защиты ткани проявляет пониженное сродство (примерно в 1000 раз) по сравнению с предшественниками эритроцитов (Masuda S. и др., J. Biol. Chem. 268, 1993, cc.11208-11216). Другой причиной может быть ГЭБ. Предклинические данные свидетельствуют, что минимальный терапевтический уровень ЭПО, необходимый для защиты от разрушения ткани, находится в диапазоне 300-500 мл Ед./кг массы тела. Единицы ЭПО выражают количество ЭПО, вызывающее такую же эритропоэтическую реакцию у крыс, что и 15 мкмолей CoCl2 (кобальта хлорида). Вкратце, таким образом, установлено, что ЭПО обладает нейропротекторным действием на нейроны головного и спинного мозга. Однако предполагаемое использование ЭПО для такого лечения ограничено потребностью в весьма высоких терапевтических уровнях, которые требуются для достижения такого эффекта. Новый эритропоэз-стимулирующий фактор (ЭСФ), обладающий улучшенным периодом полураспада и преодолевающий ГЭБ, может быть предпочтительным, особенно если такой ЭСФ может быть введен в относительно низкой начальной концентрации в кровяное русло для того, чтобы избежать нежелательных побочных эффектов.
Проблемы в данной области решаются применением НАЭ настоящего изобретения, включающего ковалентно интегрированные группы полиэтиленгликоля, обладающего определенной молекулярной массой и линкерной структурой, которые указаны в прилагаемой формуле изобретения. В частности, НАЭ используют для выработки лекарственного средства для лечения нейродегенеративных расстройств головного и спинного мозга путем введения лекарственного средства в кровяное русло. В предпочтительном варианте осуществления настоящего изобретения указанный НАЭ является химически модифицированной эритропоэтической молекулой, содержащей по меньшей мере одну свободную аминогруппу и включающей часть эритропоэтина, выбранную из группы, состоящей из эритропоэтина человека и его аналогов, которые имеют последовательность эритропоэтина человека, модифицированную добавлением 1-6 сайтов гликозилирования или реаранжировкой по меньшей мере одного сайта гликозилирования; указанная часть молекулы эритропоэтина ковалентно связана с «n» группами полиэтиленгликоля формулы -СО-(CH2)х-(ОCH2CH2)m-OR с -СО (т.е. карбонилом) каждой группы полиэтиленгликоля, формируя амидную связь с одной из указанных аминогрупп; в которой R обозначает низший алкил, x обозначает число 2 или 3, m обозначает число примерно от 450 до примерно 900, n обозначает число от 1 до 3, а n и m выбраны таким образом, что молекулярная масса образуемого НАЭ, за вычетом молекулярной массой гликопротеина немодифицированного эритропоэтина, составляет примерно от 20 кДа до примерно 100 кДа.
Предпочтительно НАЭ имеет формулу:
в которой х, m, n и R описаны в п.1, а Р является остатком части молекулы эритропоэтина без n аминогруппы (аминогрупп), который формирует амидную связь (связи) с группой (группами) полиэтиленгликоля. В представленной выше формуле R наиболее предпочтительно является метилом, m обозначает число примерно от 650 до примерно 750, а n обозначает 1.
Наиболее предпочтительно НАЭ, используемый в способе настоящего изобретения, имеет формулу
[CH3O(CH2CH2O)mCH2CH2CH2CO-NH]n-P
в которой m обозначает число от 650 до 750, n обозначает 1 и Р обозначает остаток эритропоэтиновой части.
Предпочтительно часть молекулы эритропоэтина является гликопротеином эритропоэтина человека, который может экспрессироваться за счет активирования эндогенного гена и имеет аминокислотную последовательность SEQ ID NO: 1.
В другом варианте осуществления настоящего изобретения часть молекулы эритропоэтина имеет последовательность эритропоэтина человека, модифицированную внесением от 1 до 6 сайтов гликозилирования.
В другом предпочтительном варианте осуществления настоящего изобретения нейродегенеративные расстройства головного и спинного мозга, поддающиеся лечению согласно способу настоящего изобретения, связаны с острым случаем, выбранным из удара, травмы головного или спинного мозга. Кроме того, нейродегенеративные расстройства головного и спинного мозга могут быть связаны с хроническим лечением удара, шизофрении, болезни Альцгеймера, болезни Гентингтона, слабоумия, синдрома временного X-ассоциированного тремора/атаксии, болезни Паркинсона, губчатой энцефалопатии, множественного склероза и нейродегенерации, связанной с бактериальными или вирусными инфекциями.
В способе настоящего изобретения НАЭ вводят в количестве, достаточном для лечения или облегчения нейродегенеративных расстройств («в терапевтически эффективном количестве»). НАЭ может быть введен пациентам традиционными методами, применимыми для терапии с применением ЭПО. Точное количество НАЭ зависит от типа заболевания, подвергаемого лечению, состояния пациента, подвергаемого лечению, а также от других составляющих в композиции. Количество, выраженное в мкг, относится только к соответствующей части молекулы эритропоэтина (которая является белком). Предпочтительно пациенту вводят примерно от 0,1 до примерно 100 мкг/кг массы тела ЭСФ настоящего изобретения, предпочтительно примерно от 1 до примерно 10 мкг/кг массы тела один раз в неделю.
При необходимости НАЭ может вводиться чаще. Однако НАЭ, используемый в настоящем изобретении, также может быть введен раз в две недели, раз в три недели, или раз в месяц, или даже с более длительными интервалами, зависящими от подвергаемого лечению заболевания и способа введения. Фармацевтические композиции, содержащие конъюгат, могут быть переработаны в высокоэффективные для введения разными способами пациенту с нейродегенеративным расстройством, которому свойственна гибель нейронов. Средние терапевтически эффективные количества конъюгата могут варьировать, в частности могут основываться на рекомендациях и предписаниях опытных врачей.
Специфическая активность НАЭ в соответствии с настоящим изобретением может быть определена разными методами, известными в данной области. Биологическое действие очищенных НАЭ настоящего изобретения таково, что введение НАЭ пациентам, например инъекцией, приводит к защите нейронов головного и спинного мозга.
Фармацевтические препараты настоящего изобретения включают фармацевтические композиции, пригодные для инъекции, которые перерабатывают с фармацевтически приемлемым носителем или наполнителем. Приготовление таких фармацевтических композиций известно в данной области техники. См., например, заявку US 2002/0037841 А1 (соответствует WO 01/87329), включенную в настоящее изобретение в виде ссылки. К фармацевтически приемлемым носителям для переработки продуктов настоящего изобретения относятся сывороточный альбумин человека, белки плазмы человека и др.
Кроме того, применение высушенных разбрызгиванием препаратов настоящей композиции может быть желательно с/без добавления каких-либо стабилизаторов или наполнителей.
Эритропоэз-стимулирующие факторы (ЭСФ), используемые в настоящем изобретении, могут быть переработаны в 10 мМ буфере натрия/калия фосфата рН 7, содержащем тонический агент, например 132 мМ хлорид натрия. Необязательно фармацевтическая композиция может содержать консервант. Фармацевтическая композиция может содержать разные количества белка эритропоэтина, например 10-1000 мкг/мл, предпочтительно 50 мкг или 400 мкг.
НАЭ предпочтительно может быть введен в кровяное русло инъекцией, кожным пластырем, подкожным депо или ингаляцией.
Предпочтительно НАЭ может быть введен индивидууму в дозе примерно от 25 мкг до примерно 500 мкг/сутки на протяжении двух недель в острых случаях нейродегенерации или в дозе примерно от 25 мкг до примерно 1000 мкг/неделю при хроническом лечении нейродегенеративных заболеваний. В последнем случае введение также может быть осуществлено до одного раза в месяц или даже реже, в зависимости от типа применения и типа заболевания. В предпочтительном варианте осуществления настоящего изобретения НАЭ может быть применен в дозе примерно 165 мкг/сутки на протяжении до одной недели в острых случаях или примерно 200 мкг/неделю в хронических случаях.
Кроме того, настоящее изобретение относится к набору, включающему НАЭ, применимый согласно описанным выше применениям, а веществом, улучшающим проницаемость гематоэнцефалического барьера, является маннит.
Эритропоэтин человека и его белки-аналоги, описанные выше, могут экспрессироваться в результате активирования эндогенных генов. Предпочтительными гликопротеинами эритропоэтина человека являются гликопротеины последовательностей SEQ ID NO:1 и SEQ ID NO:2, наиболее предпочтительно последовательности SEQ ID NO:1.
Кроме того, Р может быть выбран из группы, состоящей из остатков эритропоэтина человека и его аналогов, содержащих 1-6 дополнительных сайтов гликозилирования. Приготовление и очистка ЭПО хорошо известны в данной области и подробно описаны в настоящем изобретении ниже. Понятие «ЭПО» означает природный или рекомбинантный белок, предпочтительно белок человека, полученный из какого-либо традиционного источника, например выделенный из тканей, полученный в результате синтеза белка, из культуры природных или рекомбинантных клеток. Это понятие также относится к какому-либо белку, проявляющему активность ЭПО, например мутеинам или иным образом модифицированным белкам. Понятие «какая-либо активность» также относится к связывающей специфичности с рецептором ЭПО, присутствующим только на нейрональных клетках. Таким образом, производные НАЭ согласно настоящему изобретению, которые не проявляют эритропоэтической активности, также относятся к ним. Рекомбинантный ЭПО может быть получен экспрессией в клеточных линиях СНО-, BHK- или HeLa, методом рекомбинантной ДНК или активацией эндогенных генов. Экспрессия белков, в том числе ЭПО, путем активирования эндогенных генов хорошо известна в данной области и описана, например, в патентах US 5733761, 5641670 и 5733746, а также в международных патентных заявках WO 93/09222, WO 94/12650, WO 95/31560, WO 90/11354, WO 91/06667 и WO 91/09955, содержание которых включено в настоящее изобретение в виде ссылок. Предпочтительными продуктами ЭПО для приготовления продуктов на основе гликопротеина эритропоэтина являются продукты на основе ЭПО человека. Более предпочтительными являются продукты ЭПО человека с аминокислотной последовательностью SEQ ID NO: 1 или SEQ ID NO: 2, более предпочтительно с аминокислотной последовательностью SEQ ID NO: 1.
Кроме того, Р может быть остатком аналога гликопротеина с 1-6 дополнительными сайтами гликозилирования. Гликозилирование белка одной или несколькими группами олигосахаридов происходит по определенным местам в каркасе молекулы полипептида и существенно влияет на физические свойства белка, например стабильность, секрецию, субклеточную локализацию и биологическую активность. Гликозилирование обычно бывает двух типов. O-связанные олигосахариды присоединяются к остаткам серина или треонина, a N-связанные олигосахариды присоединяются к остаткам аспарагина. Одним из типов олигосахаридов, обнаруженных и в N-связанных, и в O-связанных олигосахаридах, является N-ацетилнейраминовая кислота (сиаловая кислота), которая относится к семейству аминосахаров, содержащих 9 или более атомов углерода. Сиаловая кислота обычно является концевым остатком и на N-связанных, и на O-связанных олигосахаридах, и поскольку она несет отрицательный заряд, придает кислотные свойства гликопротеину. Эритропоэтин человека, имеющий 165 аминокислот, содержит три N-связанные и одну O-связанную цепи олигосахарида, которые составляют примерно 40% общей молекулярной массы гликопротеина. N-связанное гликозилирование происходит по остаткам аспарагина, расположенным в положениях 24, 38 и 83, а O-связанное гликозилирование происходит по остатку серина в положении 126. Цепочки олигосахарида модифицированы концевыми остатками сиаловой кислоты. Ферментативное удаление всех остатков сиаловой кислоты из гликозилированного эритропоэтина приводит к утрате активности in vivo, но не активности in vitro, поскольку сиалирование эритропоэтина предупреждает его связывание связывающим белком печени с последующим клиренсом.
К гликопротеинам, используемым в химическом синтезе НАЭ настоящего изобретения, относятся аналоги эритропоэтина человека с одним или несколькими изменениями аминокислотной последовательности эритропоэтина человека, что приводит к повышению числа сайтов присоединения сиаловой кислоты. Эти гликопротеиновые аналоги, которые могут быть получены сайт-направленным мутагенезом, имеют дополнения, делеции или замещения аминокислотных остатков, которые усиливают или изменяют сайты, доступные для гликозилирования. Аналоги гликопротеина, у которых уровни содержания сиаловой кислоты выше уровней в эритропоэтине человека, получают добавлением сайтов гликозилирования, которые не нарушают вторичную или третичную конформацию, необходимую для проявления биологической активности. Гликопротеины, используемые в химическом синтезе НАЭ согласно настоящему изобретению, также включают аналоги с повышенными уровнями содержания присоединенных углеводов по сайту гликозилирования, который обычно включает замещение одной или нескольких аминокислот непосредственно около N-связанного или O-связанного сайта. К гликопротеинам, используемым в химическом синтезе НАЭ настоящего изобретения, также относятся аналоги с одной или несколькими аминокислотами, протяженными от С-конца эритропоэтина, содержащие по меньшей мере один дополнительный сайт присоединения углеводов. К гликопротеинам, используемым в химическом синтезе НАЭ настоящего изобретения, также относятся аналоги с аминокислотной последовательностью, включающей реаранжировку по меньшей мере одного сайта для гликозилирования. Такая реаранжировка сайта гликозилирования включает делецию одного или нескольких сайтов гликозилирования в эритропоэтине человека и добавление одного или нескольких искусственных сайтов гликозилирования. Аналоги эритропоэтина с дополнительными сайтами гликозилирования описаны более подробно в заявке на получение европейского патента 640619.
Кроме того, гликопротеины, используемые для химического синтеза НАЭ настоящего изобретения, содержат аминокислотную последовательность, включающую по меньшей мере один дополнительный сайт гликозилирования, например эритропоэтины (которыми перечень не ограничивается), включающие последовательность эритропоэтина человека, модифицированные следующим образом:
Asn30Thr32,
Asn51Thr53,
Asn57Thr59,
Asn69,
Asn69Thr71,
Ser68Asn69Thr71,
Val87Asn88Thr90,
Ser87Asn88Thr90,
Ser87Asn88Gly89Thr90,
Ser87Asn88Thr90Thr92,
Ser87Asn88Thr90Ala162,
Asn69Thr71Ser87Asn88Thr90,
Asn30Thr32Val87Asn88Thr90,
Asn89Ile90Thr91,
Ser89Asn89Ile90Thr91,
Asn136Thr138,
Asn138Thr140,
Thr125 и
Pro124Thr125.
Обозначение, применяемое в настоящем изобретении для модификации аминокислотной последовательности, означает, что положение (положения) соответствующего немодифицированного белка (например, ЭПОч последовательности SEQ ID NO:1 или SEQ ID NO:2), показанное надстрочным индексом (индексами), изменено по аминокислоте (аминокислотам), которые непосредственно предшествуют соответствующему приведенному вверху номеру (номерам).
Гликопротеин также может быть аналогом, содержащим по меньшей мере одну дополнительную аминокислоту с С-конца гликопротеина, в котором дополнительная аминокислота включает по меньшей мере один сайт гликозилирования, т.е. конъюгат, описанный выше, также о