Сероводородные производные нестероидных противовоспалительных лекарственных средств
Иллюстрации
Показать всеИзобретение относится к производным нестероидных противовоспалительных лекарственных препаратов (NSAID) общей формулы:
где А представляет собой NSAID радикал, выбранный из группы, состоящей из ацетилсалициловой кислоты (ASA), диклофенака, напроксена, индометацина, флурбипрофена, ибупрофена, кетопрофена и люмиракоксиба, Y представляет собой -С(O)O-, и Х выбирают из группы, состоящей из:
,и
имеющих улучшенные противовоспалительные свойства, пригодные для лечения воспаления, боли и лихорадочного состояния. Получены NSAID производные с фрагментом, высвобождающим сероводород (Н2S), для получения новых противовоспалительных соединений, обладающих ослабленными побочными действиями. 9 н. и 14 з.п. ф-лы, 16 ил., 24 пр.
Реферат
Настоящая заявка подана в качестве частично продолженной заявки PCT/CA2006/000484, поданной 31 марта 2006, которая испрашивает приоритет заявки PCT/CA2005/000819, поданной 27 мая 2005. Настоящая заявка дополнительно испрашивает приоритет предварительных заявок на патент США №№ 60/807639, поданной 18 июля 2006, и 60/887188, поданной 30 января 2007.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к производным нестероидных противовоспалительных лекарственных средств (NSAID), имеющих улучшенные противовоспалительные свойства, полезные при лечении воспаления, боли и лихорадочного состояния. Более конкретно, NSAID представляют собой производные с сероводородом (H2S), высвобождающие остаток с получением новых противовоспалительных соединений, имеющих сниженные побочные эффекты.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Нестероидные противовоспалительные лекарственные средства (NSAID) широко используют для лечения различных состояний, связанных с болью, лихорадкой и воспалением, включая остеоартрит, ревматоидный артрит, подагру и анкилозирующий спондилит. Их также широко используют для лечения острой боли, связанной с травмами и хирургическими процедурами (включая зубные процедуры), и головной боли. В основном считается, что благоприятное действие NSAID может быть обусловлено их способностью подавлять синтез простагландинов за счет ингибирования циклооксигеназы-1 (СОХ-1) и циклооксигеназы-2 (СОХ-2).
Однако длительное применение NSAID в значительной степени ограничивается их способностью вызывать клинически значимые повреждения в желудочно-кишечном тракте (Wallace, J. L. Nonsteroidal anti-inflammatory drugs and gastroenteropathy: the second hundred years. Gastroenterology. 1997; 112:1000-1016). Селективные ингибиторы СОХ-2 рассматривались в качестве улучшения по сравнению с традиционными NSAID, поскольку, как оказалось, они в меньшей степени вызывают повреждение желудочно-кишечного тракта. Однако возникло беспокойство в отношении сердечно-сосудистой токсичности указанных препаратов и, возможно, также традиционных NSAID (Grosser et al., Biological basis for the cardiovascular consequences of COX-2 inhibition: therapeutic challenges and opportunities. J Clin Invest. 2006; 116: 4-15).
Хорошо известно, что NSAID стимулируют адгезию лейкоцитов и уменьшение кровотока в слизистой желудка, и указанные действия представляют собой важный вклад в патогенез вызванного NSAID повреждения желудочно-кишечного тракта (Wallace, 1997). Индукция адгезии лейкоцитов за счет неселективных и СОХ-2-селективных NSAID может также давать вклад в сердечно-сосудистые осложнения указанных лекарственных средств.
Недавно заметили, что сероводород (H2S) проявляет противовоспалительные и анальгезирующие активности. H2S представляет собой эндогенное вещество, продуцируемое во многих тканях и оказывающее действие на многие функции (Wang, Two's company, three's a crowd: can H2S be the third endogenous gaseous transmitter? FASEB J 2002; 16: 1792-1798). Также было показано, что он является сосудорасширяющим средством и может подавлять адгезию лейкоцитов к эндотелию сосудов (Wang, 2002; Fiorucci et al., Inhibition of hydrogen sulfide generation contributes to gastric injury caused by anti-inflammatory nonsteroidal drugs. Gastroenterology. 2005; 129: 1210-1224). Дополнительно, Fiorucci et al. (2005) показали, что предварительная обработка донором H2S может уменьшать тяжесть индуцированного NSAID повреждения желудочно-кишечного тракта крысы.
Неожиданно, авторы данного изобретения показали в настоящей заявке, что противовоспалительная активность различных NSAID в значительной степени улучшается или при ковалентном связывании, или при образовании солей NSAID с высвобождающимся фрагментом H2S. Дополнительно, было показано, что указанные производные NSAID обладают пониженным побочным действием. В частности, авторы показали, что NSAID производные настоящего изобретения имеют одну или несколько из следующих дополнительных характеристик: (1) приводят к меньшему повреждению желудочно-кишечного тракта по сравнению с традиционными NSAID; (2) ускоряют лечение уже существовавших язв желудка и (3) в значительно меньшей степени вызывают повышение системного кровяного давления по сравнению с традиционными NSAID. Более того, производные NSAID настоящего изобретения понижают адгезию лейкоцитов к эндотелию сосудов, что может давать вклад в снижение побочного действия как на желудочно-кишечный тракт, так и на сердечно-сосудистую систему.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения обеспечивают производные NSAID, причем указанные производные включают H2S-высвобождающий фрагмент, который или ковалентно связан с NSAID, или образует соль с NSAID. Неожиданно, соединения настоящего изобретения демонстрируют улучшенную противовоспалительную активность в модели индуцированного каррагинаном отека лапы крысы по сравнению с одним NSAID, одним H2S-высвобождающим фрагментом и комбинацией NSAID и H2S-высвобождающего фрагмента, вводимых раздельно, но одновременно. Более того, производные NSAID настоящего изобретения приводят к умеренному кратковременному увеличению концентраций H2S в плазме. Без связи с определенной теорией, кратковременное увеличение концентраций H2S в плазме, которое все еще остается в физиологическом диапазоне, может давать вклад в их улучшенную противовоспалительную активность.
Неожиданно, соединения настоящего изобретения могут также демонстрировать улучшенную способность по подавлению активности циклооксигеназы-2 (COX-2) и/или активности циклооксигеназы-1 (COX-1) по сравнению с их соответствующими немодифицированными NSAID аналогами. Такая улучшенная способность по подавлению активности COX-2 и/или COX-1 может также давать вклад в улучшенную противовоспалительную активность. Более того, соединения настоящего изобретения, обладающие улучшенной способностью по подавлению активности COX-1, демонстрируют значительное подавление выработки тромбоксана В2 в тромбоцитах, что может давать вклад в пониженную сердечно-сосудистую токсичность.
Дополнительно, соединения настоящего изобретения в меньшей степени демонстрируют побочные действия по сравнению с их соответствующими немодифицированными NSAID аналогами. Например, некоторые соединения неожиданно вызывают в значительной степени меньше повреждений желудка, чем сами NSAID, несмотря на то что соединения заметно подавляют синтез желудочного простагландина. Притом что сохранность желудка наблюдается при указанных H2S-высвобождающих производных NSAID, указанный результат не достигается, если NSAID и H2S-высвобождающий фрагмент вводят крысам раздельно, но одновременно. Без связи с определенной теорией, было показано, что соединения настоящего изобретения уменьшают адгезию лейкоцитов к эндотелию сосудов, что может давать вклад в их безопасность для желудка. Дополнительно, пониженная адгезия лейкоцитов к эндотелию сосудов может снижать побочное действие на сердечно-сосудистую систему, которое часто наблюдается при продолжительном применении NSAID.
Дополнительно, соединения настоящего изобретения неожиданно вызывают меньшее увеличение систолического кровяного давления при введении крысам, страдающим гипертензией, по сравнению с наблюдаемым при введении обычных NSAID. Пониженная склонность к повышению кровяного давления может снижать побочные действия на сердечно-сосудистую систему, которые часто наблюдаются при продолжительном применении NSAID.
В соответствии с настоящим изобретением обеспечивают соединения общей формулы:
A-Y-X, (Формула I)
где А представляет собой NSAID радикал, Y выбирают из группы, состоящей из -C(O)O-, -C(O)NH-, -C(O)OC(O)-, -C(O)NHCH2C(O)- или нуля, и Х представляет собой фрагмент, способный высвобождать сероводород или сам по себе, или при связывании с NSAID (здесь далее обозначаемый как H2S-высвобождающий фрагмент), или его фармацевтически приемлемую соль, таким образом, что если Y представляет собой нуль, производное NSAID может представлять собой соль А и Х.
В предпочтительном варианте осуществления изобретения Х в формуле I выбирают из группы, состоящей из:
Однако предполагается, что в настоящем изобретении может быть использован любой нетоксичный эффективный фрагмент, способный к высвобождению H2S или сам по себе, или при связывании с NSAID.
В одном из вариантов осуществления соединения по изобретению имеют следующую общую формулу:
В-C(O)O-X, (Формула II)
где В-C(O)O- представляет собой производное NSAID, имеющего свободную карбоксильную группу, или карбокси-замещенного NSAID и X представляет собой H2S-высвобождающий фрагмент или его фармацевтически приемлемую соль.
В одном из вариантов осуществления В-C(O)O- в формуле II выбирают из группы, состоящей из:
и Х представляет собой сероводород (H2S) высвобождающий фрагмент.
В одном из вариантов осуществления Х в формуле II выбирают из группы, состоящей из
Однако предполагается, что в настоящем изобретении может быть использован любой нетоксичный эффективный фрагмент, способный к высвобождению H2S или сам по себе, или при связывании с NSAID.
NSAID, рассматриваемые для включения в соединения настоящего изобретения, включают ацетилсалициловую кислоту (ASA), диклофенак, напроксен, индометацин, флурбипрофен, сулиндак, ибупрофен, ацеклофенак, ацеметацин, беноксапрофен, бензофенак, бромфенак, буклоксовую кислоту, бутибуфен, карпрофен, целекоксиб, циклопрофен, цинметацин, клиденак, клопирак, дифлузинал, этодолак, эторикоксиб, фенбуфен, фенклофенак, фенклорак, фенопрофен, фентиазак, флуноксапрофен, фурапрофен, фуробуфен, фурафенак, ибуфенак, индопрофен, изоксепак, кетопрофен, кеторолак, локсопрофен, лоназолак, люмиракоксиб, метиазиник, мефенамовую кислоту, меклофенамовую кислоту, мелоксикам, набуметон, пиромидовую кислоту, салсалат, миропрофен, оксапрозин, оксепинак, паракоксиб, фенилбутазон, пирпрофен, пироксикам, пирозолак, протизиновую кислоту, рофекоксиб, салицилат натрия, супрофен, тиапрофеновую кислоту, толметин, вальдекоксиб, зомепирак и т.п.
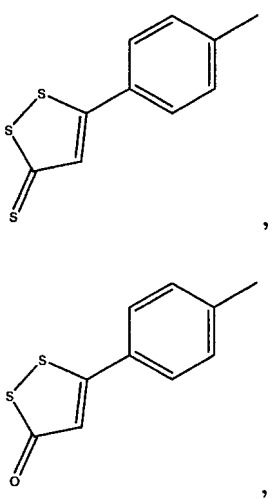
Предпочтительные соединения представляют собой соединения следующей формулы:
4-(5-тиоксо-5Н-1,2-дитиол-3-ил)фенил 2-ацетоксибензоат (I),
4-(5-тиоксо-5Н-1,2-дитиол-3-ил)фенил 2-(2-(2,6-дихлорфениламино)фенил)ацетат (II),
4-(5-тиоксо-5Н-1,2-дитиол-3-ил)фенил 2-(2-(2-хлор-6-фторфениламино)-5-метилфенил)ацетат (III),
4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир [1-(4-хлорбензоил)-5-метокси-2-метил-1Н-индол-3-ил]уксусной кислоты (IV),
4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир 2-(6-метоксинафталин-2-ил)пропионовой кислоты (V),
4-(5-оксо-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир 2-ацетоксибензойной кислоты (VI),
4-(5-оксо-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (VII),
4-(5-оксо-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир [2-(2-хлор-6-фторфениламино)-5-метилфенил]уксусной кислоты (VIII),
4-(5-оксо-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир [1-(4-хлорбензоил)-5-метокси-2-метил-1Н-индол-3-ил]уксусной кислоты (IX),
4-(5-оксо-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир 2-(6-метоксинафталин-2-ил)пропионовой кислоты (Х),
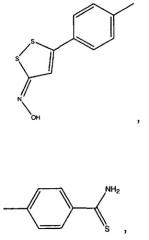
4-(5-гидроксиимино-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир 2-ацетоксибензойной кислоты (XI),
4-(5-гидроксиимино-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (XII),
4-(5-гидроксиимино-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир [2-(2-хлор-6-фторфениламино)-5-метилфенил]уксусной кислоты (XIII),
4-(5-гидроксиимино-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир [1-(4-хлорбензоил)-5-метокси-2-метил-1Н-индол-3-ил]уксусной кислоты (XIV),
4-(5-гидроксиимино-5Н-[1,2]дитиол-3-ил)фениловый сложный эфир 2-(6-метоксинафталин-2-ил)пропионовой кислоты (XV),
4-тиокарбамоилфениловый сложный эфир 2-ацетоксибензойной кислоты (XVI),
4-тиокарбамоилфениловый сложный эфир [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (XVII),
4-тиокарбамоилфениловый сложный эфир [2-(2-хлор-6-фторфениламино)-5-метилфенил]уксусной кислоты (XVIII),
4-тиокарбамоилфениловый сложный эфир [1-(4-хлорбензоил)-5-метокси-2-метил-1Н-индол-3-ил]уксусной кислоты (XIX),
4-тиокарбамоилфениловый сложный эфир 2-(6-метоксинафталин-2-ил)пропионовой кислоты (XX),
4-изотиоцианатофенил 2-ацетоксибензоат (XXI),
4-изотиоцианатофенил 2-(2-(2,6-дихлорфениламино)фенил)ацетат (XXII),
4-изотиоцианатофенил 2-(2-(2-хлор-6-фторфениламино)-5-метилфенил)ацетат (XXIII),
4-(изотиоциано)фенил 2-[1-(4-хлорбензоил)-5-метокси-2-метилиндол-3-ил]ацетат (XXXIV),
4-изотиоцианатофенил 2-(2-метоксинафталин-6-ил)пропионат (XXV),
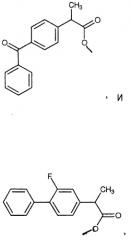
4-(5-тиоксо-5Н-1,2-дитиол-3-ил)фенил 2-(4-изобутилфенил)пропионат (XXVI),
4-(5-тиоксо-5Н-1,2-дитиол-3-ил)фенил 2-(3-бензоилфенил)пропионат (XXVII),
4-(5-тиоксо-5Н-1,2-дитиол-3-ил)фенил 2-(2-фтор-4-бифенилил)пропионат (XXVIII),
4-тиокарбамоилфенил 2-(4-изобутилфенил)пропионат (XXIX),
4-тиокарбамоилфенил 2-(4-оксофенил)фенилпропионат (XXX),
4-тиокарбамоилфенил 2-(2-фтор-4-бифенилил)пропионат (XXXI),
4-изотиоцианатофенил 2-(4-изобутилфенил)пропионат (XXXII),
4-(изотиоциано)фенил 2-(4-оксофенил)-фенилпропионат (XXXIII) и
4-(изотиоциано)фенил 2-(2-фтор-4-бифенилил)пропионат (XXXIV).
Упомянутый выше предшественник NSAID (А) получают согласно способам, известным в предшествующем уровне техники. См., например, The Merck Index, 13th Edition (2001), Merck & Co., Whitehouse Station, N.J., включенный здесь в качестве ссылки. Если доступны, могут быть использованы соответствующие изомеры, включая оптические изомеры.
Фармацевтически приемлемые соли соединений настоящего изобретения, такие как, например, соли щелочных металлов и щелочно-земельных металлов, нетоксичных аминов и аминокислот, также представляют собой часть настоящего изобретения. Предпочтительные соли соединений настоящего изобретения представляют собой соли аргинина и агматина. Также включены фармацевтически приемлемые соли присоединения кислоты.
В предпочтительном варианте осуществления изобретения NSAID настоящего изобретения представляют собой модифицированный H2S-высвобождающим фрагментом 4-гидрокситиобензамид (обозначаемый здесь как TBZ). TBZ производные равным образом демонстрируют лучшую общую противовоспалительную активность и сниженные побочные действия по сравнению с производными 5-п-гидроксифенил-1,2-дитиол-3-тиона (ADT-OH). Неожиданно, TBZ производные генерируют в значительной степени больше H2S по сравнению с ADT-OH производными, что может давать вклад как в увеличение противовоспалительной активности, так и в уменьшение побочного действия.
Дополнительно, TBZ производные сохраняют способность более стабильно ингибировать СОХ-1/СОХ-2 по сравнению с ADT-OH производными. Фактически, многие TBZ производные действительно демонстрируют усиление ингибирования СОХ-1, или ингибирования СОХ-2, или обоих. Более того, соединение ХХ (TBZ производное напроксена) показывало в значительной степени лучшие результаты в ингибировании синтеза тромбоксана В2 по сравнению с эквивалентным производным ADT-OH, соединением V (напроксен-ADT-OH), и соединение XIX (TBZ производное индометацина) показывало в значительной степени лучшие результаты в ингибировании синтеза тромбоксана В2 по сравнению с эквивалентным производным ADT-OH, соединением IV (ADT-OH производное индометацина). Улучшенное ингибирование тромбоксана В2 может давать вклад в безопасность настоящих производных в отношении сердечно-сосудистой системы.
Соединения настоящего изобретения могут быть получены, как показано на двух следующих схемах.
Схема 1
Схема 1 ниже представлена при использовании в качестве примера синтеза 4-(5-тиоксо-5Н-1,2,-дитиол-3-ил)фенил 2-(2-(2,6-дихлорфениламин)фенил)ацетата (соединение II)
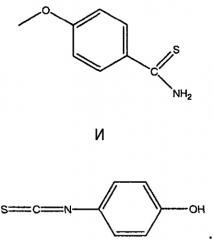
NSAID, имеющее свободную карбоксильную группу (или карбоксизамещенное NSAID), например диклофенак (1), сначала растворяли в диметилформамиде и добавляли гидроксибензотриазол (HOBt) и 1,3-дициклогексилкарбодиимид (DCC). К указанной смеси добавляли фрагмент, высвобождающий сероводород, такой как 5-п-гидроксифенил-1,2-дитиол-3-тион (ADT-OH) (2), при условиях, пригодных для получения соединений настоящего изобретения, таких как 4-(5-тиоксо-5H-1,2-дитиол-3-ил)фенил 2-(2-(2,6-дихлорфениламино)фенил)ацетат (3). Очевидно, что в настоящей схеме можно использовать другие фрагменты, высвобождающие сероводород, такие как 4-гидроксифенилизотиоцианат (здесь обозначаемый как HPI).
Схема 2
Схема 2 ниже представлена при использовании в качестве примера синтеза 4-тиокарбамоилфенилового сложного эфира [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (XVII). На указанной схеме используют реагент Лавессона для присоединения серосодержащей группы к фрагменту, высвобождающему сероводород, после его ковалентного связывания с NSAID.
NSAID, имеющее свободную карбоксильную группу (или карбоксизамещенное NSAID), например диклофенак (1), сначала растворяли в диметилформамиде и добавляли гидроксибензотриазол (HOBt) и 1,3-дициклогексилкарбодиимид (DCC). К указанной смеси добавляли предшественник, высвобождающий сероводород, такой как 4-гидроксибензамид, при условиях, пригодных для образования предшественника (например, 4-карбамоилфенил 2-(2-(2,6-дихлорфениламино)фенил)ацетата (2)) соединения настоящего изобретения, причем указанный предшественник не содержит серы. Добавляют подходящее соединение, которое может добавить серосодержащую группу, такое как реагент Лавессона, для получения соединения настоящего изобретения (например, 4-тиокарбамоилфенилового сложного эфира [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (3)).
В дополнительном аспекте настоящее изобретение обеспечивает фармацевтическую композицию соединения настоящего изобретения и фармацевтически приемлемого эксципиента или носителя, в особенности фармацевтическую композицию для применения при лечении воспалительного состояния желудочно-кишечного (GI) тракта.
Соединения настоящего изобретения пригодны для применения для, не ограничиваясь перечисленным, лечения воспаления у пациента и для лечения других заболеваний, связанных с воспалением, например в качестве анальгетика при лечении боли и головной боли или в качестве жаропонижающего средства для лечения лихорадочного состояния. Например, соединения настоящего изобретения полезны для лечения артрита, включая, но не ограничиваясь перечисленным, ревматоидный артрит, спондилоартропатии, подагрический артрит, остеоартрит, системную красную волчанку и ювенильный артрит. Такие соединения по изобретению пригодны при лечении астмы, бронхита, спазмов при менструациях, тендинита, бурсита, кожных болезней, таких как псориаз, экзема, ожоги и дерматит, и послеоперационных воспалений, включая глазную хирургию, такую как операции по удалению катаракты и рефракционную хирургию. Соединения по изобретению также полезны для лечения желудочно-кишечных заболеваний, таких как воспалительное заболевание кишечника, болезнь Крона, гастрит, синдром раздраженного кишечника и язвенный колит, а также для предотвращения или лечения рака, такого как колоректальный рак. Соединения по изобретению пригодны при лечении воспалений при таких заболеваниях, как сосудистые заболевания, мигрени, узелковый периартерит, тиреоидит, апластическая анемия, болезнь Ходжкина, склеродома, ревматическая атака, диабет I типа, заболевания нервно-мышечных соединений, включая злокачественную миастению, заболевания белого вещества, включая множественный склероз, саркоидоз, нефротический синдром, синдром Бехчета, полимиозит, гингивит, нефрит, гиперчувствительность, послетравматическая опухоль, ишемия миокарда и т.п. Соединения также полезны для лечения глазных заболеваний, таких как ретинит, ретинопатия, увеит, глазная светобоязнь и острая травма тканей глаза. Соединения также пригодны для лечения легочных воспалений, таких как связанные с вирусными инфекциями, и кистозного фиброза. Соединения также полезны для лечения определенных нарушений центральной нервной системы, таких как кортикальное слабоумие, включая болезнь Альцгеймера. Соединения по изобретению пригодны в качестве противовоспалительных средств, таких как для лечения артрита, с дополнительным преимуществом, состоящим в значительно меньшем вредном побочном действии. Указанные соединения также полезны для лечения аллергического ринита, синдрома затрудненного дыхания, синдрома эндотоксического шока, атеросклероза и повреждения центральной нервной системы в результате удара, ишемии и травмы. Соединения также полезны при лечении боли, такой как, но не ограничиваясь перечисленным, послеоперационная боль, зубная боль, мышечная боль и боль в результате ракового заболевания. Помимо полезности для лечения человека, указанные соединения также пригодны для лечения млекопитающих, включая лошадей, собак, кошек, крыс, мышей, овец, свиней и т.д.
В зависимости от конкретного состояния или заболевания, подвергаемого лечению, пациенту могут быть введены соединения настоящего изобретения в любой пригодной терапевтически эффективной и безопасной дозе, как может быть легко определено специалистом в данной области. Указанные соединения наиболее желательно вводить в дозах в диапазоне от примерно 1 до примерно 2000 мг в день, в виде одной дозы или разделенных доз, хотя неизбежно будут наблюдаться вариации в зависимости от массы и состояния пациента, подвергаемого лечению, и конкретного выбранного пути введения. Понятно, что дозы будут зависеть от конкретного NSAID, используемого для получения соединений настоящего изобретения. Однако наиболее желательна дозировка, лежащая в диапазоне от примерно 0,1 до примерно 100 мг/кг, предпочтительно в диапазоне примерно от 5 до 90 мг/кг и более предпочтительно в диапазоне примерно от 5 до 50 мг. Тем не менее могут наблюдаться вариации в зависимости от массы и состояния пациентов, подвергаемых лечению, и их индивидуальной реакции на указанное лекарственное средство, а также от типа выбранного фармацевтического препарата и периода времени и интервала, в ходе которого проводят такое введение. В некоторых случаях дозы ниже предела указанного диапазона могут оказаться более чем адекватными, тогда как в других случаях могут применяться еще большие дозы, не вызывая никакого вредного побочного действия, при условии, что такие большие дозы сначала подразделяют на несколько небольших доз для введения в течение дня.
Соединения настоящего изобретения можно вводить в форме любого фармацевтического препарата, природа которого будет зависеть от пути введения. Фармацевтические композиции могут быть получены обычными способами, при использовании совместимых фармацевтически приемлемых эксципиентов или носителей. Примеры таких композиций включают капсулы, таблетки, чрескожные пластыри, леденцы, пастилки, спреи, сиропы, порошки, гранулы, гели, эликсиры, суппозитории и т.п., препараты растворов для немедленного приема, препараты для инъекций, ректальные, назальные, глазные, вагинальные препараты и т.д. Предпочтительный путь введения представляет собой пероральный и ректальный путь введения.
Для перорального введения могут применяться таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальцийфосфат и глицин, совместно с различными дезинтегрантами, такими как крахмал (предпочтительно кукурузный, картофельный или крахмал тапиоки), альгиновая кислота и определенные сложные силикаты, вместе со связующими для гранулирования, такими как поливинилпирролидон, сахароза, желатин и гуммиарабик. Дополнительно, в целях таблетирования, могут быть использованы лубриканты, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции сходного типа можно также применять в качестве наполнителей в желатиновых капсулах; предпочтительные материалы, связанные с указанным применением, также включают лактозу или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой. Если для перорального введения желательна водная суспензия и/или эликсир, активные ингредиенты можно комбинировать вместе с подслащивающими или вкусовыми агентами, красящим веществом и, при желании, эмульгирующими и/или суспендирующими агентами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различные комбинации.
Дозированная форма может быть предназначена для немедленного высвобождения, контролируемого высвобождения, длительного высвобождения, отсроченного высвобождения или целевого отсроченного высвобождения. Определения указанных терминов известны специалистам в данной области. Кроме того, на профиль высвобождения дозированной формы может влиять состав полимерной смеси, состав матрикса с покрытием, состав из множества частиц, состав из множества частиц с покрытием, состав на основе ионообменной смолы, осмотический состав или состав биоразрушаемых полимеров. Вне связи с какой-либо теорией, считается, что на высвобождение может быть оказано влияние за счет благоприятной диффузии, растворения, эрозии, ионного обмена, осмоса или их комбинации.
В случае парентерального введения можно использовать раствор активного соединения или в кунжутном, или в арахисовом масле, или в водном растворе пропиленгликоля. Водный раствор должен быть подходящим образом забуферен (предпочтительно рН более 8), и, при необходимости, жидкий разбавитель сначала приводят в изотоническое состояние. Водные растворы пригодны для внутривенного введения. Получение всех таких растворов при стерильных условиях легко осуществлять обычными фармацевтическими технологическими способами, хорошо известными специалистам в данной области.
Следующие примеры далее описывают и позволяют обычному специалисту в данной области применять и использовать изобретение. Однако следует понимать, что данные варианты осуществления представлены в целях иллюстрации изобретения и не должны рассматриваться как ограничивающие объем притязаний изобретения, который определен формулой изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показана оценка повреждения желудка, измеренная у крыс, подвергаемых лечению носителем, диклофенаком и двумя производными диклофенака настоящего изобретения, соединением II и соединением XVII.
На фигуре 2 показано количество желудочного простагландина Е2 (PGE2), продуцированное у крыс, подвергаемых лечению носителем, диклофенаком, соединением II и соединением XVII.
На фигуре 3 показана оценка повреждения желудка, измеренная у крыс, подвергаемых лечению носителем, напроксеном и двумя производными напроксена по настоящему изобретению, соединением V и соединением XX.
На фигуре 4 показано количество тромбоксана В2, синтезируемое в крови крыс, упоминаемых на фигуре 3.
На фигуре 5 показана общая длина язв тонкого кишечника у крыс, подвергаемых лечению носителем, диклофенаком и соединением II.
На фигуре 6 показан процент гематокрита у крыс до и после лечения носителем, диклофенаком и соединением II.
На фигуре 7 показано количество экссудативного PGE2, продуцированного в подкожном кармане крыс, при использовании анализа воздушного кармана у крыс, подвергаемых лечению носителем, диклофенаком, соединением II и соединением XVII.
На фигуре 8 показано количество тромбоксана B2 (TXB2) цельной крови у крыс, представленных на фигуре 7.
На фигуре 9 показано ингибирование увеличения объема лапы у крыс, подвергаемых лечению носителем, диклофенаком и соединением II.
На фигуре 10 показано ингибирование увеличения объема лапы у крыс, подвергаемых лечению носителем, диклофенаком и соединением XVII.
На фигуре 11 показано количество экссудативного PGE2, продуцированного в подкожном кармане крыс, при использовании анализа воздушного кармана у крыс, подвергаемых лечению носителем, напроксеном, соединением V и соединением XX.
На фигуре 12 показан синтез тромбоксана (нг/мл) в крови человека (in vitro) как функция от концентрации индометацина, соединения IV и соединения XIX.
На фигуре 13 показана площадь поверхности в мм2 язв желудка у крыс на следующий день после лечения в течение одной недели носителем, диклофенаком, соединением XVII и соединением XX.
На фигуре 14 показано повышение систолического кровяного давления (мм ртутного столба) у крыс, подвергаемых лечению носителем, диклофенаком, соединением II, напроксеном и соединением XX.
На фигуре 15 показана концентрация сероводорода в плазме при пероральном лечении крыс 50 мкмоль/кг соединением II.
На фигуре 16 показано количество сероводорода, получаемого из соединения II и соединения XVII при инкубации в буфере и гомогенате печени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Получение соединений
Проводили тонкослойную хроматографию на пластинках Macherey-Nagel силикагеля 50 c флуоресцентным индикатором, и пластинки проявляли УФ-светом (254 нм). Для колоночной хроматографии использовали Kieselgel 60. Все реагенты для синтеза приобретали от Aldrich-Sigma Chemical Company и использовали без очистки. Растворители были аналитической степени чистоты или выше и были использованы в том виде, как приобретались. Роторный испаритель Buchi R-114 использовали для удаления растворителей в вакууме. Структуры соединений подтверждали спектроскопически протонным 1Н-ЯМР и 13С-ЯМР. Спектры регистрировали при использовании прибора Varian Mercury Plus 400. Химические сдвиги соотносили с Me4Si в качестве внутреннего стандарта. Масс-спектры синтезированных продуктов получали на масс-спектрометре Applied Biosystem API 2000. Точку плавления измеряли на аппарате Buchi B-540. Чистоту конечного соединения определяли при использовании обращенно-фазовой ВЭЖХ. Колонку подсоединяли к инжектору Rheodyne model 7725, ВЭЖХ системе Waters 600, настраиваемому детектору абсорбции Waters 486, установленному на 215 или 235 нм, и самописцу Waters 746. Синтезированные соединения показали удовлетворительные результаты элементного анализа; если анализы представлены исключительно символами элементов, то результаты лежат в диапазоне ±0,4% от теоретических величин.
ПРИМЕР 1
Синтез 4-(5-тиоксо-5Н-[1,2]-дитиол-3-ил)фенилового сложного эфира [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (Соединение II)
Схема 1
Синтез 5-п-гидроксифенил-1,2-дитиол-3-тиона (2; ADT-OH)
Анезол (31 г, 0,21 моль) и серу (44,8 г, 1,40 моль) нагревали в N,N-диметилформамиде (250 мл) в течение 8 часов; после удаления растворителя остаток практически полностью был растворим в толуоле. Попытка экстрагировать раствор в толуоле 2 н. водным гидроксидом натрия привела к оранжевому твердому осадку (8,5 г, т. пл. выше 300°С). Указанный продукт растворяли в кипящей воде и, после добавления соляной кислоты, получали 2 в виде оранжевого осадка (6,2 г, выход 13%) т.пл. 188-189°С.
1Н-ЯМР (ДМСО-d6) δ: 6,86 (д, 2H), 7,68 (с, 1H), 7,75 (д, 2H), 10,51 (с, -ОН); MS (ESI), m/z 225(M-).
Синтез 4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фенилового сложного эфира [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (3)
К раствору 1 (диклофенак, 890 мг, 3,0 ммоль) в 50 мл N,N-диметилформамида добавляли при перемешивании при 0°С в течение 1 ч гидроксибензотриазол (445 мг, 3,3 ммоль) и DCC (дициклогексилкарбодиимид) (680 мг, 3,3 ммоль). К реакционной смеси добавляли 5-п-гидроксифенил-1,2-дитиол-3-тион (2; 678 г, 3 ммоль) и перемешивали в течение 1 ч при 0°С и 3 ч при комнатной температуре. После фильтрования фильтрат выпаривали при пониженном давлении и полученный таким образом маслянистый остаток растворяли в этилацетате; органический слой промывали рассолом, сушили над безводным MgSO4, фильтровали и выпаривали растворитель. Неочищенный продукт 3 загружали на открытую колонку с силикагелем и элюировали CH2Cl2/MeOH (9/1), с получением 4-(5-тиоксо-5Н-[1,2]дитиол-3-ил)фенилового сложного эфира [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (1,1 г, 74% выход).
1Н-ЯМР (ДМСО-d6): δ 4,12 (с, 2H), 6,21 (д, 1H), 6,87 (т, 1H), 7,14 (т, 1H), 7,19 (д, 1H), 7,22 (т, 1H), 7,34 (д, 2H), 7,54 (д, 2H), 7,80 (с, 1H), 7,97 (д, 2H);
13С-ЯМР (ДМСО-d6): δ 37,4, 116,1, 121,0, 122,3, 123,5, 123,7, 127,0, 128,7, 129,3, 129,8, 132,0, 132,2, 136,4, 137,7, 143,8, 154,2, 170,3, 173,3, 213,2.
MS (EI), м/e 504 (М+).
Т.пл.: 83-86°C.
ПРИМЕР 2
Синтез 4-тиокарбамоилфенилового сложного эфира [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (Соединение XVII)
Схема 2
Синтез 4-карбамоилфенил 2-[2-(2,6-дихлорфениламино)фенил]ацетата (5)
К раствору 1 (диклофенак, 890 мг, 3,0 ммоль) в 50 мл N,N-диметилформамида добавляли при перемешивании при 0°С в течение 1 ч гидроксибензотриазол (445 мг, 3,3 ммоль) и DCC (680 мг, 3,3 ммоль). К реакционной смеси добавляли 4-гидроксибензамид (4, 616, мг, 4,5 ммоль) и перемешивали в течение 1 ч при 0°С и 3 ч при комнатной температуре. После фильтрования фильтрат выпаривали при пониженном давлении и полученный таким образом маслянистый остаток растворяли в хлороформе; органический слой промывали рассолом, сушили над безводным MgSO4, фильтровали и выпаривали растворитель. Неочищенный продукт 5 загружали на открытую колонку с силикагелем и элюировали CH2Cl2/MeOH (9/1) с получением 4-карбамоилфенил [2-(2,6-дихлорфениламино)фенил]ацетата (5) (212 мг, 17% выход).
Синтез 4-тиокарбамоилфенилового сложного эфира [2-(2,6-дихлорфениламино)фенил]уксусной кислоты (6)
4-карбамоилфенил 2-(2-(2,6-дихлорфениламино)фенил)ацетат (5, 480 мг, 1,14 ммоль) и реагент Лавессона (460 мг, 1,14 ммоль) растворяли в 20 мл безводного бензола. Реакционную смесь нагревали до 50°С и перемешивали в течение 6 ч. Растворитель удаляли при пониженном давлении; неочищенный остаток очищали на колонке с силикагелем (дихлорметан/метиловый спирт 9,5/0,5) с получением чистого соединения 6 (446 мг, 91% выход).
1Н-ЯМР (CDCl3): δ 4,07 (с, 2Н), 6,59 (д, 1H), 6,67 (с, 1H), 6,98 (т, 1H), 7,14 (т, 1Н), 7,19 (д, 1H), 7,28 (т, 1H), 7,33 (д, 2Н), 7,63 (с, 1H), 7,97 (д, 2H)