Антитела, модифицирующие раковые заболевания
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Предложено выделенное моноклональное антитело, индуцирующее цитотоксичность в отношении раковых клеток, продуцируемое гибридомой, депонированной в коллекции IDAC под номером 051206-01, или его антигенсвязывающий фрагмент. Описаны: химерный и гуманизированный варианты, получаемые из указанного антитела. Раскрыта гибридома, продуцирующая моноклональное антитело и депонированная в коллекции IDAC под номером 051206-01, а также композиция на основе указанного антитела для лечения раковой опухоли человека. Использование изобретения обеспечивает варианты моноклональных антител, способных индуцировать цитотоксичность in vitro в отсутствии эффекторных клеток в отношении клеток аденокарциномы легкого, что может найти применение в терапии опухолей. 5 н.п. ф-лы, 5 ил., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к выделению и выработке антител, модифицирующих раковые заболевания (АМРЗ), а также к применению указанных АМРЗ отдельно или в комбинации с одним или несколькими химиотерапевтическими агентами в способах лечения или диагностики. Настоящее изобретение также относится к исследованиям связывания, в которых используют АМРЗ по настоящему изобретению.
Предпосылки создания изобретения
Моноклональные антитела в качестве противораковых средств. Каждый человек с раковым заболеванием уникален, причем его рак отличается от рака других людей, подобно отличию самих больных. Несмотря на это современная терапия лечит всех пациентов с одинаковым типом рака, находящихся на одной и той же стадии заболевания, одним и тем же способом. На первой линии терапии результат лечения по меньшей мере 30% таких пациентов оказывается неудачным, поэтому проводят дополнительные циклы лечения и повышают вероятность неудачи лечения, метастазов и неизбежно смерти. Лучшим подходом к лечению может быть подбор терапии для конкретного индивидуума. Единственной современной терапией, которая учитывает индивидуальность пациента, является хирургия. Химиотерапия и радиотерапия не могут быть подобраны для конкретного пациента, а хирургия в большинстве случаев не соответствует выбранному курсу лечения.
После начала применения моноклональных антител вероятность разработки способов индивидуальной терапии становится более реалистичной, поскольку каждое антитело может быть направлено на единственный эпитоп. Кроме того, можно выработать сочетание антител, направленных на комбинацию эпитопов, которые уникальным образом распознают опухоль индивидуума.
Установив, что отличие раковых клеток от здоровых заключается в том, что раковые клетки содержат антигены, специфичные для трансформированных клеток, в научном сообществе сформировалось устойчивое представление о том, что моноклональные антитела можно специфически нацеливать на трансформированные клетки благодаря их специфическому связыванию с таким раковым антигеном, и что моноклональные антитела могут выступать в качестве «магической пули» для уничтожения раковых клеток. Однако в настоящее время общеизвестно, что нет единого моноклонального антитела, которое может применяться во всех случаях заболевания раком, и что моноклональные антитела могут быть использованы в качестве представителей класса антител для целевой противораковой терапии. Установлено, что моноклональные антитела, выделенные по настоящему изобретению, модифицируют процесс ракового заболевания полезным для пациента образом, например, уменьшая опухолевую нагрузку, и могут по-разному упоминаться в настоящем изобретении, или в качестве антител, модифицирующих раковые заболевания (АМРЗ), или в качестве «противораковых антител».
В настоящее время пациент, больной раком, обычно располагает несколькими вариантами лечения. Преобладающий подход к противораковой терапии приводит к улучшению общей выживаемости и показателя смертности. Однако для конкретного индивидуума такая улучшенная статистика необязательно совпадает с улучшением конкретно его состояния.
Таким образом, если бы была предложена методология, позволяющая специалисту лечить каждое опухолевое заболевание конкретного пациента независимо от других способа лечения других пациентов в той же группе, появился бы уникальный подход направленной терапии применительно к одному конкретному человеку. Такой курс терапии в идеале мог бы повысить показатель выживания и привести к лучшим результатам, тем самым удовлетворяя существующую потребность.
Ранее эффективность применения поликлональных антител для лечения раковых заболеваний человека была малоэффективна. Формы лимфомы и лейкоза лечили плазмой человека, но была всего лишь умеренная пролонгированная ремиссия или ответ. Кроме того, отсутствовала воспроизводимость, и лечебный эффект не превышал такового от применения химиотерапии. Плотные опухоли, например рак груди, меланома и почечно-клеточный рак, также лечили кровью людей, сывороткой шимпанзе, плазмой человека и сывороткой лошади с соответствующими непредсказуемыми и неэффективными результатами.
Было много клинических исследований по применению моноклональных антител для лечения плотных опухолей. В 1980-х годах было по меньшей мере четыре клинических исследования рака груди человека, в которых из 47 пациентов, которых лечили антителами против специфических антигенов или основанными на тканевой избирательности, был только один респондер. Успешные результаты были получены только в 1998 году, когда были проведены успешные клинические исследования с применением гуманизированного анти-Her2/neu антитела (продукта Herceptin®) в комбинации с цисплатином. В этом исследовании оценивали ответ 37 пациентов, из которых примерно четверть показала частичный ответ и еще одна четверть обладала незначительным или стабильным прогрессированием заболевания. Среднее время до начала прогрессирования среди респондеров составляло 8,4 месяца при средней длительности ответа 5,3 месяца.
Продукт Herceptin® одобрен в 1998 году для первой линии применения в комбинации с продуктом Taxol®. Результаты клинического исследования показали повышение среднего времени до начала прогрессирования заболевания для тех, кто получил лечение антителом плюс продуктом Taxol® (6,9 месяцев), по сравнению с группой, которая получала только продукт Taxol® (3,0 месяца). Также было небольшое увеличение средней выживаемости: 22 против 18 месяцев для лечения продуктом Herceptin® плюс продуктом Taxol® против лечения только продуктом Taxol®. Кроме того, было увеличение числа и полных (8% против 2%), и частичных респондеров (34% против 15%) в группе лечения комбинацией антитела плюс продукт Taxol® по сравнению с лечением только продуктом Taxol®. Однако лечение продуктом Herceptin® и продуктом Taxol® приводило к повышенной частоте кардиотоксичности по сравнению с лечением только продуктом Taxol® (13% против 1% соответственно). Кроме того, лечение продуктом Herceptin® было эффективно только для пациентов с избыточной экспрессией (по данным иммуногистохимического анализа (ИГХ)) рецептора эпидермального фактора роста человека 2 (human epidermal growth factor receptor 2-Her2/neu), рецептора, для которого в настоящее время не установлена функция или биологически значимый лиганд; примерно 25% пациентов имели метастатический рак груди. Таким образом, для пациентов с раком груди все еще существует насущная потребность в разработке эффективного способа лечения. Даже те пациенты, на которых продукт Herceptin® может оказать целебное воздействие, все же нуждаются в химиотерапии и, следовательно, у них возможны по меньшей мере в некоторой степени побочные эффекты от терапии такого рода.
В клинических исследованиях колоректального рака применялись антитела против и гликопротеиновых, и гликолипидных мишеней. Антитело, например, 17-1А, которое имеет некоторую специфичность в отношении аденокарциномы, прошло II фазу клинических исследований с участием более 60 пациентов, среди которых только один пациент показал частичный ответ. В других исследованиях среди 52 пациентов в протоколах с дополнительным применением циклофосфамида, применение 17-1А привело только к 1 полному ответу и 2 минорным ответам. К настоящему времени III фаза клинических исследований не показала повышенной эффективности 17-1А в качестве адьювантной терапии для III стадии рака ободочной кишки. Применение гуманизированного мышиного моноклонального антитела, первоначально одобренного для визуализации, также не приводило регрессии опухоли.
Только недавно получены некоторые положительные результаты применения моноклональных антител в клинических исследованиях колоректального рака. В 2004 году продукт ERBITUX® одобрен для второй линии лечения пациентов с EGFR-экспрессирующим метастатическим колоректальным раком, которые не поддаются химиотерапии на основе иринотекана. Результаты и II фазы клинического исследования с участием двух групп пациентов, и исследования с участием одной группы пациентов, показали, что при использовании продукта ERBITUX® в комбинации с иринотеканом степень ответа составляла 23 и 15 процентов соответственно, при среднем времени до прогрессирования заболевания 4,1 и 6,5 месяцев соответственно. Результаты той же II фазы клинического исследования с участием двух групп пациентов и другого исследования с участием одной группы пациентов показали, что лечение с применением только одного продукта ERBITUX® приводило к степени ответа 11 и 9 процентов, соответственно, при среднем времени до прогрессирования заболевания 1,5 и 4,2 месяцев соответственно.
В результате, в Швейцарии и в Соединенных Штатах лечение с применением продукта ERBITUX® в комбинации с иринотеканом, и в Соединенных Штатах лечение с применением одного продукта ERBITUX®, одобрено в качестве второй линии лечения пациентов с колоректальным раком, у которых первая линия терапии иринотеканом оказалась неудачной. Поэтому, подобно продукту Herceptin®, в Швейцарии одобрено только лечение с применением комбинации моноклонального антитела и химиотерапии. Кроме того, лечение и в Швейцарии, и в США одобрено только для пациентов в качестве второй линии терапии. К тому же в 2004 году продукт AVASTIN® одобрен для использования в комбинации с химиотерапией с применением внутривенного введения 5-фторурацила в качестве первой линии лечения метастатического колоректального рака. Результаты III фазы клинических исследований показали повышение средней выживаемости у пациентов, получавших лечение продуктом AVASTIN® в сочетании с 5-фторурацилом, по сравнению с пациентами, получавшими лечение только одним 5-фторурацилом (20 месяцев против 16 месяцев соответственно). Однако, подобно продуктам Herceptin® и ERBITUX®, лечение одобрено только в качестве комбинации моноклонального антитела и химиотерапии.
Остаются также неудовлетворительными результаты лечения рака легких, мозга, яичников, поджелудочной железы, простаты и желудка. Наиболее обещающие результаты недавно получены для немелкоклеточного рака легкого во II фазе клинического исследования, в котором в лечение было вовлечено моноклональное антитело (SGN-15, dox-BR96, анти-Sialyl-LeX), конъюгированное с лекарственным средством, убивающим клетки, доксорубицином, в комбинации с химиотерапевтическим агентом продуктом TAXOTERE®. Продукт TAXOTERE® является единственным, одобренным FDA (Food and Drug Administration - Управление по контролю за продуктами и лекарствами США) химиотерапевтическим средством второй линии лечения рака легкого. Начальные данные показывают повышенную общую выживаемость по сравнению с применением только одного продукта TAXOTERE®. Из 62 пациентов, которые участвовали в исследовании, две трети получали SGN-15 в комбинации с продуктом TAXOTERE®, а оставшаяся одна треть получала только продукт TAXOTERE®. Для пациентов, получавших SGN-15 в комбинации с продуктом TAXOTERE®, средняя общая выживаемость составляла 7,3 месяцев по сравнению с 5,9 месяцами для пациентов, получавших только продукт TAXOTERE®. Общая выживаемость до 1 года и 18 месяцев составляла 29 и 18 процентов, соответственно, для пациентов, получавших SNG-15 плюс продукт TAXOTERE®, по сравнению с 24 и 8 процентами, соответственно, для пациентов, получавших только TAXOTERE®. Планируется проведение дальнейших клинических исследований.
На предклинической стадии некоторый успех достигнут при использовании моноклональных антител в отношении меланомы. До клинических исследований дошло очень незначительное количество таких антител, и на сегодняшний день ни одно из них не одобрено и не показало благоприятных результатов в III фазе клинических исследований.
Открытие новых лекарственных средств тормозится отсутствием идентификации релевантных мишеней среди продуктов 30000 известных генов, которые могут способствовать патогенезу заболевания. В онкологическом исследовании потенциальные мишени для лекарств часто выбираются просто на основании их сверхэкспрессии в опухолевых клетках. Идентифицируемые таким образом мишени затем используются в скрининге по взаимодействию с множеством соединений. При потенциальной терапии антителами соединения-кандидаты обычно получают посредством традиционных методов выработки моноклональных антител в соответствии с фундаментальными принципами, заложенными Kohler и Milstein (Nature, 256, 1975, сс.495-497). Клетки селезенки берут от мышей, иммунизированных антигеном (например, целыми клетками, клеточными фракциями, очищенным антигеном), и сливают их с бессмертными гибридомными партнерами. Получающиеся гибридомы подвергают скринингу и отбору по секреции антител, которые наиболее активно связываются с мишенью. Многие терапевтические и диагностические антитела, направленные против раковых клеток, включая продукт Herceptin® и ритуксимаб, получены с использованием этих методов и отобраны на основе их аффинитета. Недостатки этой стратегии двояки. Во-первых, выбор подходящих мишеней для связывания терапевтических или диагностических антител ограничивается недостатком знаний о специфических канцерогенных процессах в окружающих тканях и в результате упрощенческими подходами, например, селекцией на основе сверхэкспрессиии, посредством которых эти мишени идентифицируют.Во-вторых, допущение, что молекула лекарственного средства, которая связывается с рецептором с наибольшим сродством, обычно обладает наибольшим шансом инициирования или ингибирования сигнала, не всегда оказывается верным.
Несмотря на некоторый прогресс в лечении рака молочной железы и рака ободочной кишки идентификация и разработка эффективных способов лечения на основе антител либо в качестве единственных агентов, либо для сочетанного лечения были недостаточно эффективны для всех типов рака.
Предшествующие патенты
Патент US 5750102 описывает способ, в котором клетки опухоли пациента трансфецируют генами главного комплекса гистосовместимости (ГКГ), которые могут быть клонированы из клеток или тканей пациента. Такие трансфецированные клетки затем применяют для вакцинации пациента.
Патент US 4861581 описывает способ, включающий стадии получения моноклональных антител, специфичных к внутреннему клеточному компоненту неопластических или нормальных клеток млекопитающего, но не к внешним компонентам, нанесения метки на моноклональное антитело, контакта меченого антитела с тканью млекопитающего, которого лечили, чтобы убить неопластические клетки, и определения эффективности терапии путем измерения связывания меченого антитела с внутренним клеточным компонентом перерождающихся неопластических клеток. При приготовлении антител, направленных на внутриклеточные антигены человека, в указанном патенте было установлено, что злокачественные клетки представляют соответствующий источник таких антигенов.
Патент US 5171665 описывает новое антитело и способ его получения. В частности, патент описывает получение моноклонального антитела, которое обладает способностью к сильному связыванию с белковым антигеном, связанным с опухолями человека, например, толстой кишки или легкого, связываясь при этом с нормальными клетками в гораздо меньшей степени.
Патент US 5484596 описывает способ терапии рака, включающий хирургическое удаление опухолевой ткани у человека, больного раком, обработку опухолевой ткани с целью получения опухолевых клеток, облучение опухолевых клеток, сохраняющее их жизнеспособность, но ликвидирующее опухолеродность, и использование этих клеток для приготовления вакцины для пациента, которая способна к ингибированию рецидива первичной опухоли наряду с одновременным ингибированием метастазов. Патент описывает создание моноклональных антител, которые реагируют с поверхностными антигенами опухолевых клеток. В колонке 4, строке 45 и последующих показано, что в патенте используют автохтонные раковые клетки для разработки активной специфической иммунотерапии при неоплазии человека на основе моноклональных антител.
Патент US 5693763 описывает гликопротеиновый антиген, характерный для карциномы человека, вне зависимости от происхождения эпителиальной ткани.
Патент US 5783186 посвящен анти-Her2 антителам, которые индуцируют апоптоз в экспрессирующих Her2 клетках, гибридомным клеточным линиям, вырабатывающим антитела, способам лечения рака с применением антител и фармацевтическим композициям, включающим указанные антитела.
Патент US 5849876 описывает новые линии гибридомных клеток для выработки моноклональных антител к муциновым антигенам, выделенным и очищенным из опухолевой и неопухолевой ткани.
Патент US 5869268 раскрывает способ образования лимфоцитов человека, продуцирующих антитела, специфичные к искомому антигену, способ получения моноклональных антител, а также моноклональные антитела, получаемые этим способом. В частности, патент раскрывает выработку анти-HD моноклональных антител человека, пригодных для диагностики и лечения раковых заболеваний.
Патент US 5869045 относится к антителам, фрагментам антител, конъюгатам антител и одноцепочечным иммунотоксинам, реагирующим с клетками карциномы человека. Механизм, с помощью которого эти антитела функционируют, является двояким, поскольку, во-первых, молекулы реагируют с мембранными антигенами, присутствующими на поверхности карциномы человека, и, во-вторых, после связывания антитела могут проникать внутрь клеток карциномы, что делает их особенно полезными для образования конъюгатов антитело-лекарство и антитело-токсин. В своей немодифицированной форме антитела при определенных концентрациях также проявляют цитотоксические свойства.
Патент US 5780033 раскрывает применение аутоантител для терапии и профилактики опухолевых заболеваний. Однако эти антитела являются антинуклеарными аутоантителами от старого млекопитающего. В этом случае аутоантитела согласно описанию являются одним типом природных антител, обнаруживаемых в иммунной системе. Поскольку антитела происходят от «старого млекопитающего», не требуется, чтобы аутоантитела обязательно происходили от пациента, получавшего лечение. Кроме того, патент описывает природные и моноклональные антинуклеарные антитела от старого млекопитающего и гибридомную клеточную линию, вырабатывающую моноклональные антинуклеарные антитела.
Краткое описание изобретения
Эта заявка использует методологию получения специфических для пациента противораковых антител, показанную в патенте US 6180357 для выделения клеточных линий гибридом, которые кодируют моноклональные антитела, модифицирующие раковые заболевания. Эти антитела можно получить конкретно для одной опухоли, что дает возможность проведения индивидуальной терапии рака. В контексте настоящей заявки противораковые антитела, обладающие либо приводящими к гибели клетки (цитотоксическими), либо подавляющими рост клеток (цитостатическими) свойствами, в дальнейшем будут рассматриваться в качестве цитотоксических. Эти антитела можно применять при определении стадии и диагностики рака, а также для лечения метастазов опухоли. Эти антитела можно применять для предупреждения рака путем профилактического лечения. В отличие от антител, получаемых в соответствии с традиционными принципами поиска лекарственных средств, антитела, получаемые этим способом, можно нацеливать на молекулы и пути, участие которых в росте и/или выживании злокачественной ткани ранее не было обнаружено. Кроме того, связывающее сродство этих антител соответствует условиям инициации цитотоксических событий, которые могут не поддаваться более сильным аффинным взаимодействиям. Также в рамках настоящего изобретения предусматривается соединение стандартных химиотерапевтических средств, например радионуклеотидов, с АМРЗ по настоящему изобретению, тем самым фокусируя применение химиотерапевтических средств. АМРЗ также можно соединять с токсинами, цитотоксическими компонентами или гематогенными клетками, получая, таким образом, конъюгаты антител. АМРЗ можно применять отдельно или в комбинации АМРЗ с одним или несколькими химиотерапевтическими агентами.
Возможность применения индивидуального лечения рака может привнести изменение в результате лечения человека. Вероятный клинический сценарий заключается в том, что во время описания заболевания получают образец опухоли и закладывают его в банк. На основании этого образца опухоль можно типировать по панели имеющихся антител, модифицирующих раковые заболевания. У пациента может быть условно определена стадия, но можно использовать имеющиеся в наличии антитела для последующего определения стадии заболевания. Пациента можно непосредственно лечить имеющимися в наличии антителами, а также можно получить панель специфических к опухоли антител либо с помощью способов, приведенных в настоящем описании, либо посредством использования библиотек фагового дисплея в сочетании со способами скрининга, описанными в настоящем изобретении. Все произведенные антитела могут быть добавлены к библиотеке противораковых антител, поскольку существует вероятность того, что другие опухоли могут нести некоторые из тех же эпитопов, которые характерны для опухоли, подвергающейся лечению. Произведенные в соответствие с этим способом антитела могут быть применимы для лечения раковых заболеваний у какого-либо числа пациентов, которые имеют раковые опухоли, которые связываются с указанными антителами.
Кроме противораковых антител в качестве части многомодального режима лечения пациент может получать рекомендованное в настоящее время лечение. Поскольку антитела, получаемые с помощью настоящей методологии, относительно нетоксичны для нераковых клеток, возможно применение высоких доз антител при их использовании либо отдельно, либо в сочетании с традиционной терапией. Высокий терапевтический индекс также позволяет проведение повторного лечения по краткосрочной шкале, которая уменьшает вероятность появления устойчивых к лечению клеток.
Если пациент не поддается первоначальному курсу терапии, или развиваются метастазы, процесс выработки антител, специфических к опухоли, можно повторить в качестве повторного лечения. Кроме того, противораковые антитела можно соединять с красными кровяными тельцами, получаемыми от пациента, и снова вводить их инфузией для лечения метастазов. Лечение метастазирующего рака обычно малоэффективно, и появление метастазов обычно свидетельствует о плохом прогнозе, приводящем к смерти. Однако метастатические раковые опухоли обычно хорошо васкуляризованы и доставка противораковых антител красными кровяными тельцами может привести к концентрированию антител в месте опухоли. Даже до развития метастазов выживаемость большинства раковых клеток зависит от кровоснабжения хозяина, и противораковые антитела, соединенные с красными кровяными тельцами, могут также оказаться эффективными против самих опухолей. В другом варианте антитела можно соединять с другими гематогенными клетками, например лимфоцитами, макрофагами, моноцитами, естественными клетками-киллерами и т.д. Существует пять классов антител, и каждый класс связан с функцией, которая определяется их тяжелой цепью. Обычно считают, что уничтожение раковых клеток голыми антителами опосредовано либо через антителозависимую клеточную цитотоксичность, либо через комплементзависимую цитотоксичность. Например, мышиные антитела IgM и IgG2a могут активировать человеческий комплемент путем связывания компонента С-1 системы комплемента, то есть классическим путем активации комплемента, которая может привести к лизису опухоли. Что касается антител человека, наиболее эффективными комплемент-активирующими антителами обычно являются IgM и IgG1. Мышиные антитела изотипа IgG2a и IgG3 эффективны в рекрутинге цитотоксических клеток, имеющих рецептор Fc, который приводит к лизису клеток моноцитами, макрофагами, гранулоцитами и определенными лимфоцитами. Антитела человека изотипов IgG1 и IgG3 опосредуют антителозависимую клеточную цитотоксичность (АЗКЦ).
Цитотоксичность, опосредуемая через Fc-область, требует присутствия клеток-эффекторов и их соответствующих рецепторов, или белков, например NK-клеток, комплемента и Т-клеток, соответственно. При отсутствии этих эффекторных механизмов Fc-область антитела инертна. Fc-область антитела может определять свойства, которые воздействуют на фармакокинентику антитела in vivo, но в условиях in vitro Fc-область неэффективна.
В анализах цитотоксичности по настоящему изобретению, в которых исследуют антитела, нет никаких эффекторных механизмов, и они выполняются in vitro. В этих анализах не используются клетки-эффекторы (NK, макрофаги или Т-клетки) или комплемент. Поскольку эти анализы полностью зависят от добавляемых компонентов, каждый компонент может быть описан. Анализы, применяемые в настоящем изобретении, включают только клетки-мишени, среды и сыворотки. Клетки-мишени не обладают функциональными свойствами эффекторов, поскольку они являются раковыми клетками или фибробластами. Без экзогенных клеток, которые имеют функциональные свойства эффекторов, нет клеточных элементов с такой функцией. Среда не содержит ни комплемента, ни каких-либо клеток. Согласно описанию фирм-поставщиков сыворотка, используемая для поддержки роста клеток-мишеней, не обладает активностью комплемента. Кроме того, отсутствие комплементарной активности в используемых сыворотках подтверждено в лабораториях авторов настоящего патента. Таким образом, согласно настоящему изобретению установлено, что действия антител полностью определяются связыванием антигена, которое опосредуется через Fab. Действительно, клетки-мишени очевидны и взаимодействуют только с Fab, поскольку они не имеют рецепторов для Fc. Хотя гибридома секретирует целый иммуноглобулин, который исследовался с клетками-мишенями, только части иммуноглобулина, взаимодействующие с клетками, представляют Fab, которые действуют в качестве антигенсвязывающих фрагментов.
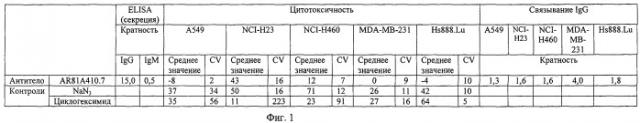
Что касается описанных в настоящем изобретении антител и антигенсвязывающих фрагментов, в поданной заявке показана их клеточная цитотоксичность, подтвержденная данными, представленными в таблице (фиг.1). Как подчеркивалось выше, и согласно объективному доказательству, представленному в настоящем описании, этот эффект полностью определяется связыванием Fab с опухолевыми клетками.
Существует важное доказательство антитело-опосредованной цитотоксичности, которая определяется прямым связыванием антитела с антигеном-мишенью и не зависит от эффекторных механизмов, связанных с Fc. Лучшим доказательством этого являются эксперименты in vitro, в которых не используют дополнительные клетки или комплемент (чтобы официально исключить эти механизмы). Эти типы экспериментов проводят с целым иммуноглобулином или с антигенсвязывающими фрагментами, например, F(ab)'2-фрагментами. В экспериментах таких типов используют антитела или антигенсвязывающие фрагменты, которые могут прямо индуцировать апоптоз клеток-мишеней, например, анти-Неr2 и анти-EGFR антитела, которые оба одобрены FDA США для маркетинга в терапии рака.
Другие возможные механизмы уничтожения раковых клеток, опосредованные антителами, могут осуществляться через использование так называемых каталитических антител, которые функционально катализируют гидролиз различных химических соединений в клеточной мембране и мембранно-связанных гликопротеинах и гликолипидах.
Существует еще три дополнительных механизма уничтожения раковых клеток, опосредованных антителами. Первый заключается в применении антител в качестве вакцины, чтобы побудить организм к иммунному ответу против предполагаемого антигена, который находится на раковой клетке. Второй заключается в применении антител к ростовым рецепторам-мишеням и нарушении их функционирования или в снижении регулирования этих рецепторов так, чтобы их функция существенно утрачивалась. Третий заключается в непосредственном эффекте таких антител на лигирование частей клеточной поверхности, которое может привести к прямой гибели клетки, например лигирование рецепторов смерти, например TRAIL R1 или TRAIL R2, или молекул интегрина, например альфа V бета 3 и других.
Клиническая ценность противоракового лекарственного препарата определяется целебным эффектом лекарства при допустимом профиле риска для пациента. В терапии рака выживаемость обычно является главной установкой после целебного эффекта, однако существует большое количество других хорошо известных целебных эффектов дополнительно к пролонгированию жизни. К таким другим целебным эффектам, когда лечение не наносит ущерб выживаемости, относят временное облегчение симптомов, защиту от побочных эффектов и удлинение времени до начала прогрессирования заболевания. Эти критерии обычно являются общепринятыми, и регулирующие органы, например, Управление по пищевым продуктам и лекарствам США (FDA), утверждают лекарственные средства на основе указанных лечебных эффектов (Hirschfeld и др., Critical Reviews in Oncology/Hematolgy, 42, 2002, сс. 137-143). Хорошо известно, что дополнительно к этим критериям существуют другие конечные точки, которые могут предсказывать эти типы лечебных эффектов. В частности, в ускоренной процедуре одобрения, предоставляемой FDA США, используются заменители, которые дают возможность прогнозировать лечебный для пациента эффект. Так к концу 2003 года по этой процедуре было одобрено шестнадцать лекарственных средств, и из них четыре дошли до полного одобрения, т.е. доведенные до конца исследования показали их непосредственный лечебный эффект для пациента, который прогнозировался на основе суррогатных конечных точек. Одной важной конечной точкой для определения эффектов лекарственного препарата на плотные опухоли является определение опухолевой нагрузки при оценке ответа на лечение (Therasse и др., Journal of the National Cancer Institute, 92(3), 2000, сс.205-216). Клинические критерии (критерии RECIST) для такой оценки опубликованы рабочей группой по критериям оценки ответа плотных опухолей (Response Evaluation Criteria in Solid Tumors Working Group), группой международных экспертов в области рака. Лекарства с достоверным эффектом на опухолевую нагрузку, показанным на основе объективных ответов в соответствии с критериями RECIST, по сравнению с соответствующей контрольной группой, в конечном счете, оказывают непосредственный лечебный эффект на пациента. В предклинических исследованиях опухолевая нагрузка обычно наиболее часто оценивается и документируется. Когда по результатам доклинических исследований предсказывается клиническая картина, лекарственные препараты, которые вызывают длительную выживаемость в предклинических моделях, имеют самую большую прогнозируемую клиническую ценность. Аналогично положительным ответам на клиническое лечение, лекарственные препараты, которые уменьшают опухолевую нагрузку в предклиническом исследовании, могут также иметь значительное непосредственное воздействие на заболевание. Хотя удлинение выживаемости представляет наибольшую клиническую выгоду от лекарственного лечения рака, существуют другие полезные для клиники целебные эффекты, и очевидно, что уменьшение опухолевой нагрузки, которая может коррелировать с задержкой прогрессирования заболевания, удлинением выживаемости или обоими указанными результатами, может также приводить к прямому общему полезному результату и иметь клиническое значение (Eckhardt и др.. Developmental Therapeutics: Successes and Failures of Clinical Trial Designs of Targeted Compounds, ASCO Educational Book, 39-oe ежегодное собрание, 2003, сс.209-219).
Настоящее изобретение описывает разработку и применение продукта AR81A410.7, идентифицированного по его действию в цитотоксических анализах и в экспериментальной модели на животной модели рака человека. Это изобретение описывает реагенты, которые специфически связываются с эпитопом или эпитопами, присутствующими на молекуле-мишени, а также обладают in vitro цитотоксическими свойствами, подобно голому антителу, против злокачественных опухолевых клеток, но не обладают таковыми против нормальных клеток, и которые также непосредственно опосредуют, подобно голому антителу, ингибирование опухолевого роста. Дополнительное усовершенствование заключается в применении противораковых антител, например, для нацеливания на опухоли, экспрессирующие близкие антигенные маркеры, для подавления опухолевого роста и достижения других положительных конечных точек лечения рака.
В целом, настоящее изобретение предусматривает применение антигена AR81A410.7 в качестве мишени для терапевтического агента, который при введении может понизить опухолевую нагрузку раковой опухоли, экспрессирующей этот антиген у млекопитающего. Настоящее изобретение также предусматривает применение АМРЗ (AR81A410.7), его производных, антигенсвязывающих фрагментов, а также лигандов, индуцирующих цитотоксичность, для нацеливания антигена с тем, чтобы понизить нагрузку раковой опухоли, экспрессирующей этот антиген, у млекопитающего. Кроме того, настоящее изобретение предусматривает использование обнаружения антигена AR81A410.7 в раковых клетках, которое может быть пригодно для диагностики, прогнозирования терапии и прогнозирования млекопитающих, несущих опухоли, которые экспрессируют этот антиген.
Таким образом, цель настоящего изобретения заключается в использовании способа для получения антител, модифицирующих раковое заболевание (АМРЗ), формирующихся против раковых клеток, полученных от конкретного пациента, или одной или нескольких раковых клеточных линий, причем АМРЗ цитотоксичны в отношении раковых клеток и при этом относительно нетоксичны в отношении нераковых клеток, чтобы выделить гибридомные клеточные линии и кодируемые ими соответствующие выделенные моноклональные антитела и их антигенсвязывающие фрагменты.
В другом объекте настоящего изобретения предусматриваются антитела, модифицирующие раковое заболевание, их лиганды и антигенсвязывающие фрагменты.
В другом объекте настоящего изобретения предусматривается получение антител, модифицирующих раковое заболевание, цитотоксичность которых опосредуется через антителозависимую клеточную токсичность.
Еще один дополнительный объект настоящего изобретения заключается в получении антител, модифицирующих раковое заболевание, цитотоксичность которых опосредуется через комплемент-зависимую клеточную токсичность.
Кроме того, объектом настоящего изобретения является получение антител, модифицирующих раковое заболевание, цитотоксичность которых является результатом их способности катализировать гидролиз клеточных химических связей.
Еще одним объектом настоящего изобретения является получение антител, модифицирующих раковое заболевание, которые можно использовать в анализах связывания для диагностики, прогнозирования и мониторинга ракового заболевания.
Другие цели и преимущества настоящего изобретения будут видны из последующего описания, в котором изложены, в виде иллюстраций и примеров, определенные варианты осуществления настоящего изобретения.
Краткое описание фигур
Фиг.1 сравнивает в процентах цитотоксичность и уровни связывания гибридомных супернатантов против клеточных линий А549, NCI-H23, NCI-Н460, MDA-MB-231 и Hs888.Lu.
Фиг.2 представляет связывание AR81A410.7 с раковыми и нормальными клеточными линиями. Данные представлены в виде таблицы, чтобы показать среднюю интенсивность флуоресценции, как кратное увеличение над изотипным контролем.
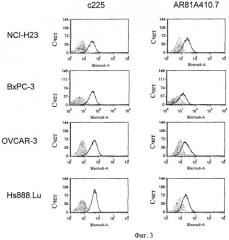
Фиг.3 включает характерные FACS гистограммы AR81A410.7 и анти-EGFR антител, направленных в отношении некоторых раковых и нераковых клеточных линий.
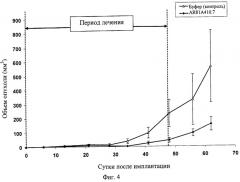
Фиг.4 демонстрирует воздействие AR81A410.7 на опухолевый рост в профилактической модели рака поджелудочной железы ВхРС-3. Вертикальные пунктирные линии показывают период, в течение которого вводится антитело. Информационные точки представляют среднее значение +/- СО (стандартная ошибка среднего значения).
Фиг.5 демонстрирует воздействие AR81A410.7 на массу тела в профилактической модели рака поджелудочной железы ВхРС-3. Информационные