3-(2-бромфенил) и 3-бензил-4,5,6,7-тетрагидроиндазола гидрохлориды, противомикробное средство на их основе
Иллюстрации
Показать всеНастоящее изобретение относится к области органической химии, а именно к новым биологически активным соединениям класса индазола: 3-(2-бромфенил)-4,5,6,7-тетрагидроиндазола гидрохлориду (Ia) и 3-бензил-4,5,6,7-тетрагидроиндазола гидрохлориду (Iб) общей формулы:
(R=C6H4Br-2 (а), CH2C6H5 (б)). Также изобретение относится к противомикробному средству на основе соединения формулы (Ia) или (Iб). Технический результат: получены новые производные индазола, обладающие противомикробной активностью. 2 н.п. ф-лы, 1 табл., 3 пр.
Реферат
Изобретение относится к области органической химии, а именно к новым биологически активным соединениям класса индазола: 3-(2-бромфенил)-4,5,6,7-тетрагидроиндазола гидрохлориду (Ia) и 3-бензил-4,5,6,7-тетрагидроиндазола гидрохлориду (Iб) общей формулы:
где R=2-BrC6H4 (а), CH2C6H5 (б), проявляющим антимикробную активность, что позволяет предложить их к применению в медицине в качестве противомикробных средств.
В практической медицине известен препарат фенилсалицилат, аналогичный по фармакологическому (противомикробному) действию предлагаемым соединениям (см. Машковский М.Д. Лекарственные средства. - Харьков: Торгсин, 1998, т.2, с.418).
Близкими по структуре к предлагаемым соединениям являются 1,3-диарилциклоалканопиразолы (индазолы), представляющие собой ингибиторы циклооксигеназы и противовоспалительные агенты (см. Ferro M., Sui Z., Wachter M. Preparation of 1,3 and 2,3-diarylcycloalkano and cycloalkeno pyrazoles as selective inhibitors of cyclooxygenase-2 and antiflammatory agents, Pat. US 6083969; Chem. Abstracts, 2000, Vol.133, №7, 89521f). Ближайший среди них аналог имеет следующую структуру:
Сведения о противомикробной активности аналогов отсутствуют.
Более близкими структурными аналогами к заявляемым соединениям, взятыми за прототип, являются основания общей формулы:
где R=4-CH3, 4-NO2 (см. Михайловский А.Г., Алиев З.Г., Базина Н.Г., Пантюхин А.А., Вахрин М.И. 2-Ароилциклогексаноны в синтезе азолов, ХГС, 2010, №6, с.905-911). Их основное отличие по структуре от заявляемых соединений в том, что они содержат другие радикалы и являются основаниями, а не гидрохлоридами. Данных о противомикробной активности этих соединений в литературе не имеется.
Задачей создания изобретения является выявление соединений указанного класса потенциальных лекарственных средств противомикробного действия для практической медицины.
Техническая задача решается посредством настоящего изобретения и состоит в синтезе гидрохлоридов 3-R-4,5,6,7-тетрагидроиндазола формулы:
где R=C6H4Br-2 (Ia), CH2C6H5 (Iб),
проявляющих противомикробную активность в отношении бактерий Staphylococcus aureus и грибка Candida albicans.
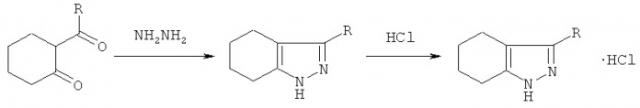
Соединения Ia, б получают взаимодействием 2-ацилциклогексанонов (R=C6H4Br-2 (а), CH2C6H5 (б)) с гидразингидратом в среде изопропанола при кипячении в течение 30 минут с последующим выделением целевых продуктов известными приемами. Реакция идет по схеме, приведенной ниже.
R=C6H4Br-2 (Ia), CH2C6H5 (Iб)
Методика получения исходных дикетонов (2-ацилциклогексанонов) изложена нами ранее (см. Михайловский А.Г., Алиев З.Г., Базина Н.Г., Пантюхин А.А., Вахрин М.И. 2-Ароилциклогексаноны в синтезе азолов, ХГС, 2010, №6, с.905-911).
Поставленная задача решается противомикробным средством, содержащим в качестве действующего начала 3-(2-бромфенил)-4,5,6,7-тетрагидроиндазола (Ia) или 3-бензил-4,5,6,7-тетрагидроиндазола (Iб) гидрохлориды общей формулы:
где R=2-BrC6H4 (а), CH2C6H5 (б).
Технический результат, получаемый при реализации изобретения, состоит в получении малотоксичных соединений с высокими выходами и высокой противомикробной активностью. Методика синтеза проста, исходные соединения легкодоступны.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 3-(2-бромфенил)-4,5,6,7-тетрагидроиндазола гидрохлорида (Ia).
К раствору 2,81 г (0,01 моль) 2-(2-бромбензоил)-циклогексанона в 10,0 мл кипящего 2-пропанола прибавляли 0,7 мл (15,0 ммоль) кипящего (0,015 моль) 70% раствора гидразингидрата. Смесь кипятили 30 минут, охлаждали до 20°С, разбавляли 100 мл ледяной воды, выпавший осадок растворяли в 150 мл этилацетата и пропусканием сухого газообразного HCl получали гидрохлорид соединения Ia, который отфильтровывали, сушили и перекристаллизовывали из 2-пропанола. Выход 77%. Тпл. 199-201°С. Соединение Ia C13H13BrN2·HCl.
Найдено, %: С 49.73; Н 4.42; N 8.93.
Вычислено, %: С 49.79; Н 4.50; N 9.0.
Пример 2. Синтез 3-Бензил-4,5,6,7-тетрагидроиндазола гидрохлорида (Iб).
Синтезирован аналогично (см. пример 1). Выход 72%. Тпл. 178-180°С. Соединение Ia C14H16N2·HCl.
Найдено, %: С 67.43; Н 6.78; N 11.43; Cl 14.18.
Вычислено, %: С 67.60; Н 6.89; N 11.26; Cl 14.25.
Соединения Ia, б представляют собой бесцветные кристаллические вещества, легко растворимые в ДМСО и ДМФА, трудно растворимые в воде, спирте, хлороформе. Устойчивы при хранении в обычных условиях.
В ИК-спектрах оснований соединений Ia, б, снятых в пасте в вазелиновом масле, присутствуют полосы валентных колебаний групп NH индазольного цикла (3250 см-1). Получение основания вещества Ia, б: водную суспензию обрабатывают избытком водного раствора аммиака, полученное основание отфильтровывают, тщательно промывая водой, и сушат.
Спектры ПМР гидрохлоридов Ia, б сняты в ДМСО-D6 (300 МГц), внутренний эталон - ГМДС. Спектр соединения Ia (δ, м.д.): 1.73-1.87 мультиплет, 4Н, 5,6-(CH2)2; 2.43-2.80 мультиплет, 4H, 4-CH2 и 7-CH2; 7.48-7.84, мультиплет (4H, Ar); 12.50 синглет (NH+). Спектр соединения Iб: 1.66-1.68 мультиплет, 4Н, 5,6-(СН2)2; 2.31-2.65 мультиплет, 4Н, 4-СН2 и 7-СН2; 4.06 синглет (CH2-Ar); 7.23-7.33, мультиплет (4Н, Ar); 12.15 синглет (NH+).
Пример 3. Противомикробная активность и токсичность.
Исследование биологической активности (токсичности и специфического действия) заявляемых соединений проводили на белых беспородных мышах массой 18-20 г и микроорганизмах Esherichia coli (1257) и Staphylococcus aureus (6538Р, 906). Противогрибковое действие изучено на музейном штамме дрожжеподобного грибка Candida albicans, 264/624.
Определение средней летальной дозы (ЛД50) проводили по методу Г.Н.Першина путем однократного орального введения и наблюдения за поведением и гибелью животных в течение 7 суток. Противомикробное действие выявляли методом двукратных серийных разведений в соответствии с методикой изучения противомикробного действия препаратов (Першин Г.Н. Методы экспериментальной химиотерапии. - М.: Медицина, 1971, с.109). Для культивирования бактерий использовали рыбно-пептонный агар и бульон (рН 7,2-7,4); для культивирования дрожжеподобных грибков - бульон и агар Сабуро. Готовили исходные разведения микробных тел по оптическому стандарту мутности из суточной агаровой культуры. Для определения противомикробного (бактериостатического, бактерицидного и фунгицидного) действия микробную взвесь (микробная нагрузка равна 2,5×105 микробных тел в 1 мл питательной среды) вносили в приготовленные разведения препарата в питательной среде. Результаты опытов учитывали после 20-часового (ингибирующее) и 7-суточного (бактерицидное действие) термостатирования при 37°С для бактерий, через 48 часов и 7 суток для Candida albicans.
Противомикробную (фунгицидную) активность оценивали по минимально действующей концентрации. Максимально испытанная концентрация соединения составила 1000 мкг/мл. Эталоном сравнения служил известный в медицинской практике фенилсалицилат.
Проведенные исследования показали (см. таблицу), что соединения Ia, б проявляют выраженное ингибирующее действие относительно штаммов золотистого стафилококка и тормозят их рост в концентрациях соответственно 15,6 и 31,2 мкг/мл, что активнее эталона (фенилсалицилата) соответственно в 48 и 24 раза.
Концентрации 15,6 и 62,5 мкг/мл предлагаемых соединений вызывают гибель испытанных штаммов золотистого стафилококка, т.е. они проявляют бактерицидный эффект. В сравнении с бактерицидным действием эталона - фенилсалицилата заявляемые соединения более активны соответственно в 128 раз (Ia) и в 32 раза (Iб).
Кроме того, заявляемые соединения тормозят рост грибка Candida albicans в концентрациях 62,5 (Ia) и 125 (Iб) мкг/мл и вызывают гибель этого штамма в концентрациях соответственно 250 и 500 мкг/мл. Препарат сравнения антигрибкового действия в отношении Candida albicans не проявляет.
Оба вещества не оказывают действия в отношении кишечной палочки (см. таблицу), что можно рассматривать как благоприятный фактор, способствующий сохранению микрофлоры кишечника.
| Таблица | ||||||
| Соединение | Противомикробная активность, мкг/мл | |||||
| Escherichia coli | Staphylococcus aureus | Candida albicans | ||||
| МИК* | МБК** | МИК* | МБК** | МИК* | МБК** | |
| Ia | - | - | 15,6 | 15,6 | 62,5 | 250,0 |
| Iб | - | - | 31,2 | 62,5 | 125,0 | 500,0 |
| фенилсалицилат | - | - | 750,0 | 2 000,0 | - | - |
| контроль: ДМСО | рост | рост | рост | |||
| Примечание: все препараты растворяли в диметилсульфоксиде (ДМСО);«-» - означает отсутствие противомикробного действия в испытанных концентрациях;*МИК - минимальная ингибирующая концентрация;**МБК - минимальная бактерицидная концентрация. |
Острая токсичность определена перорально. Оба заявляемых соединения являются малотоксичными. При пероральном введении величина ЛД50 для обоих веществ составила более 1000 мг/кг.
В связи с тем, что 3-(2-бромфенил) и 3-бензил-4,5,6,7-тетрагидроиндазола гидрохлориды обладают выраженным противомикробным действием в отношении бактерий Staphylococccus aureus и дрожжеподобного грибка Candida albicans, они могут найти применение в практической медицине.
1. 3-(2-Бромфенил)-4,5,6,7-тетрагидроиндазола (Ia) и 3-бензил-4,5,6,7-тетрагидроиндазола (Iб) гидрохлориды общей формулы где R - 2-BrC6H4 (а), CH2C6H5 (б).
2. Противомикробное средство, представляющее собой 3-(2-бромфенил)-4,5,6,7-тетрагидроиндазола (Ia) или 3-бензил-4,5,6,7-тетрагидроиндазола (Iб) гидрохлориды общей формулы где R - 2-BrC6H4 (а), СН2С6Н5 (б)