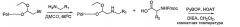Новые соединения, представляющие собой миметики обратного поворота, и их применение (3)
Иллюстрации
Показать всеОписываются новые производные гексагидро пиразино[2,1-с][1,2,4] триазина общей формулы
(значения радикалов приведены в формуле изобретения), их фармацевтически приемлемые соли и применение данных соединений для получения лекарственного средства для лечения и профилактики острого миелоидного лейкоза. 2 н. и 1 з.п.ф-лы, 4 ил., 3 прим., 3 табл.
Реферат
Область техники
Изобретение относится в целом к новым соединениям, являющимся миметиками обратного поворота, и к их применению в лечении медицинских состояний, например, раковых заболеваний, и к фармацевтическим композициям, включающим эти миметики.
Уровень техники
Случайный скрининг молекул на возможную активность в качестве терапевтических средств проводился в течение многих лет и приводил ко множеству важных открытий в области лекарственных средств. Несмотря на то, что развитие молекулярной биологии и вычислительной химии приводили к увеличенному интересу в том, что назвали "рациональным проектом лекарственного средства", такие методики не оказались настолько быстрыми или надежными, как первоначально предполагалось. Таким образом, в последние годы вновь возник интерес и случился возврат к случайному скринингу лекарственных средств. В этом плане особые успехи были сделаны в области новых технологий, основанных на развитии библиотек комбинаторной химии, и скрининга таких библиотек в поисках биологически активных членов.
Первоначально, библиотеки комбинаторной химии обычно ограничивались членами пептидного или нуклеотидного происхождения.
Хотя комбинаторные библиотеки, содержащие члены пептидного и нуклеотидного происхождения, имеют большое значение, сохраняется потребность в библиотеках, содержащих члены другого происхождения. Например, традиционные пептидные библиотеки в значительной степени просто варьируют аминокислотной последовательностью для генерации членов библиотеки. Несмотря на то, что хорошо известно, что вторичные структуры пептидов являются важными для биологической активности, такие пептидные библиотеки не передают вынужденную вторичную структуру членам библиотеки.
В этом отношении, некоторые исследователи циклизовали пептиды с дисульфидными связями в попытке обеспечить более вынужденную вторичную структуру (Tumelty et al., J. Chem. Soc. 1067-68, 1994; Eichler et al., Peptide Res. 7:300-306, 1994). Однако такие циклизованные пептиды обычно остаются весьма гибкими и отличаются низкой биодоступностью, и таким образом имеют только ограниченный успех.
Совсем недавно были разработаны непептидные соединения, которые являются более близкими миметиками вторичной структуры обратных поворотов, найденных в биологически активных белках или пептидах. Например, в патенте США 5440013 на имя Kahn и в опубликованных заявках РСТ WO94/03494, WO01/00210A1 и WO01/16135A2 на имя Kahn раскрыты конформационно затрудненные непептидные соединения, которые являются миметиками пространственной структуры обратных поворотов. Кроме того, в патенте США 5929237 и его частичном продолжении в патенте США 6013458, оба на имя Kahn, раскрыты конформационно затрудненные соединения, которые являются миметиками вторичной структуры областей обратного поворота биологически активных пептидов и белков. Синтез и идентификация конформационно затрудненных миметиков обратного поворота и их применение в отношении заболеваний были рассмотрены Obrecht (Advances in Med. Chem., 4, 1-68, 1999).
Несмотря на то, что были сделаны значительные успехи в синтезе и идентификации конформационно затрудненных миметиков обратного поворота, сохраняется потребность в малых молекулах, которые являлись бы миметиками вторичной структуры пептидов. Существует также потребность в библиотеках, содержащих такие члены, а также в методиках синтеза и скрининга членов этих библиотек против представляющих интерес мишеней, особенно биологических мишеней, для идентификации биоактивных членов библиотеки.
Между тем, протоонкоген представляет собой нормальный ген, который может стать онкогеном вследствие мутации или увеличенной экспрессии. c-Myc (MYC) известен как один из протоонкогенов, и дисрегуляцию c-Myc считают одним из ряда онкогенных событий, необходимых для онкогенеза у млекопитающих (Pelengaris S, Khan M. The many faces of c-MYC. Arch Biochem Biophys. 2003; 416:129-136). Было также обнаружено, что дисрегуляция MYC, через различные механизмы, связана с миелоидными лейкозами (Hoffman B, Amanullah A, Shafarenko M, Liebermann DA. The proto-oncogene c-myc in hematopoietic development and leukemogenesis. Oncogene. 2002; 21: 3414-3421). Кроме того, было обнаружено, что c-Myc быстро вызывает острый миелоидный лейкоз (Hui Luo et al. "c-Myc rapidly induces acute myeloid leukemia in mice without evidence of lymphoma-associated antiapoptotic mutations," Blood, 1 October 2005, volume 106, Number 7, pp 2452-2461).
Поскольку c-Myc может повышающе регулироваться в остром миелоидном лейкозе, была изучена онкогенная функция c-Myc, и была изучена ее точная роль в миелоидном лейкемогенезе. Недавно некоторые ученые обнаружили, что Myc избирательно стимулировал рост миелоидных клеток-предшественников в метилцеллюлозе и показали, что Myc является критическим даунстрим-эффектором миелоидного лейкемогенеза (там же).
Открытие того, что c-Myc играет критическую роль в миелоидном лейкемогенезе, показывает, что острый миелоидный лейкоз может быть вылечен или предотвращен путем ингибирования активации c-Myc белка.
С другой стороны, суперсемейство ферментов цитохрома P450 (CYP) является главными детерминантами периода полураспада и выполняют фармакологические эффекты многих терапевтических средств. Подсемейство человеческого цитохрома P450 (CYP) 3A включает CYP3A4, который больше всего изобилует в печени человека (~40%) и метаболизирует более 50% клинически используемых лекарственных средств (Shimada et al 1994; Rendic and Di Carlo 1997).
Вследствие ключевой роли CYP3A4 в метаболизме лекарственных средств, значительная инактивация этого фермента могла бы привести к выраженному фармакокинетическому взаимодействию лекарственных средств между собой. Ингибирование CYP3A4 может вызывать тяжелую токсичность лекарственного средства за счет увеличенного экспонирования к вводимым совместно лекарственным средствам (Dresser et al 2000). Например, когда необратимые ингибиторы CYP3A4, такие как эритромицин или кларитромицин, вводят совместно с терфенадином, астемизолом или пимозидом, пациенты могут испытать Torsades de pointes (опасную для жизни желудочковую аритмию, связанную с удлинением QT) (Spinler et al 1995; Dresser et al 2000). Пациенты, больные раком, время от времени переносят режимы множественного лечения, что увеличивает риск взаимодействия лекарственных средств, сопровождаемого неблагоприятными лекарственными реакциями.
Поэтому в разработке терапевтических средств, особенно когда они должны вводиться в комбинации с другими лекарственными средствами, существует потребность в получении соединений, имеющих меньшую CYP3A4-ингибирующую активность.
Раскрытие изобретения
Техническая задача
Цель настоящего изобретения состоит в получении новых соединений, которые являются миметиками вторичной структуры областей обратного поворота биологически активных пептидов и белков и имеют биологическую активность, такую как противораковый эффект.
Другая цель настоящего изобретения состоит в получении новых соединений, которые ингибируют передачу сигналов Wnt.
Еще одна цель настоящего изобретения состоит в получении новых соединений, которые могут использоваться в качестве фармацевтических средств, в частности, имеющих меньшую CYP3A4-ингибирующую активность (более высокую IC50).
Еще одна цель настоящего изобретения состоит в получении новых соединений для лечения или профилактики острого миелоидного лейкоза.
Техническое решение
Настоящее изобретение относится к новому типу конформационно затрудненных соединений и производных, включая их пролекарства, которые являются миметиками вторичной структуры областей обратного поворота биологически активных пептидов и белков. Это изобретение также раскрывает библиотеки, содержащие такие соединения, а также их синтез и скрининг.
Соединения согласно настоящему изобретению имеют следующую общую формулу (I):
(I)
в которой E обозначает -ZR3- или -(C=O)-, причем Z обозначает CH или N; W обозначает -(C=O)-, -(C=O)NH-, -(C=O)O-, -(C=O)S-, -S(O)2- или связь; и каждый из R1, R2, R3, R4 и R5 являются одинаковыми или разными и независимо обозначают группу боковой цепи аминокислоты или производное боковой цепи аминокислоты. Соединение, являющееся миметиком обратного поворота, может присутствовать как изолированный стереоизомер или смесь стереоизомеров или как фармацевтически приемлемая соль.
В некоторых вариантах осуществления R1 соединений формулы (I) обозначает фенил, замещенный фенил, пиридинил, замещенный пиридинил, пиримидинил, замещенный пиримидинил, индолил, замещенный индолил, бензотиазолил, замещенный бензотиазолил, бензимидазолил, замещенный бензимидазолил, бензотиофенил, замещенный бензотиофенил, бензодиоксолил, замещенный бензодиоксолил, бензоксазолил, замещенный бензоксазолил, бензизоксазолил, замещенный бензизоксазолил, хромонил, замещенный хромонил, тетрагидрокарбазолил, замещенный тетрагидрокарбазолил, бензил или замещенный бензил, аминокарбонилC1-6алкил, C1-3алкилтиазолиламинокарбонилC1-6алкил, дибензофуранил, ацетиленил или стиролил.
Частные примеры R1, R2, R3, R4 и R5 приведены в следующем подробном описании.
В варианте осуществления, в котором E обозначает CHR3, соединения по изобретению имеют следующую формулу (II):
(II)
в которой W имеет значения, определенные выше, и R1, R2, R3, R4 и R5 имеют значения, определенные в следующем подробном описании.
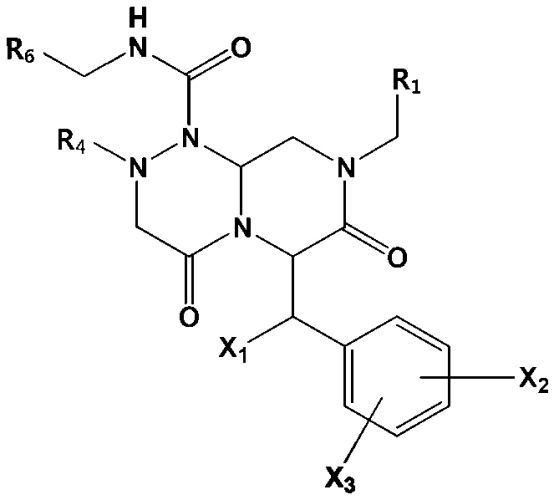
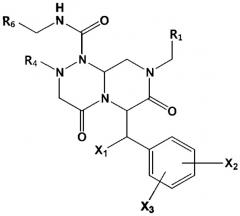
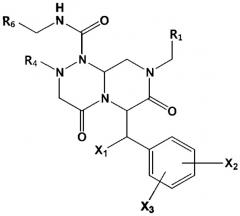
В некоторых вариантах осуществления соединения по изобретению имеют следующую общую формулу (III):
(III)
в которой R1, R4, R6, X1, X2 и X3 определены в следующем подробном описании.
Настоящее изобретение также относится к пролекарствам с использованием библиотек, содержащих одно или более соединений формулы (I). Пролекарство обычно разрабатывают таким образом, чтобы оно высвобождало активное лекарственное средство в организме в ходе или после абсорбции ферментативным и/или химическим гидролизом. Подход пролекарства является эффективным средством улучшения пероральной биодоступности или внутривенного введения лекарственных средств с низкой водорастворимостью за счет химической дериватизации с получением более водорастворимых соединений. Обычно используемый подход пролекарства для увеличения водорастворимости лекарственных средств, содержащих гидроксильную группу, заключается в получении сложных эфиров, содержащих ионогенную группу; например, фосфатную группу, карбоксилатную группу, алкиламиногруппу (Fleisher et al., Advanced Drug Delivery Reviews, 115-130, 1996; Davis et al., Cancer Res., 7247-7253, 2002, Golik et al., Bioorg. Med. Chem. Lett., 1837-1842, 1996).
Примеры функциональной группы, которая может высвобождаться в организме, могут включать фосфат, , и , но могут использоваться любые другие функциональные группы, которые обычно используются в качестве ионогенных групп в пролекарстве.
В некоторых вариантах осуществления пролекарства согласно настоящему изобретению имеют следующую общую формулу (IV):
(III)-R7 (IV)
в которой (III) является формулой (III), как описано выше; один из R1, R4, R6, X1, X2 и X3 связан с R7 через Y; Y обозначает кислород, серу или азот в R1, R4 или R6, или кислород в X1, X2 или X3; и R7 обозначает гидроксиалкил, гликозил, фосфорилоксиметилоксикарбонил, замещенный или незамещенный пиперидинкарбонилокси, или его соль; или Y-R7 обозначает аминокислотный остаток, комбинацию аминокислотных остатков, фосфат, гемималат, гемисукцинат, диметиламиноалкилкарбамат, диметиламиноацетат, или их соли; и, если они не связаны с R7: R1, R4, R6, X1, X2 и X3 имеют значения, определенные в следующем подробном описании.
В некоторых вариантах осуществления пролекарства согласно настоящему изобретению могут служить в качестве субстрата для фосфатазы, карбоксилазы или других ферментов, и таким образом, могут превращаться в соединения, имеющие общую формулу (III). Настоящее изобретение также направлено к библиотекам, содержащим одно или более соединений формулы (I), определенных выше, а также к способам синтеза таких библиотек и способам их скрининга для идентификации биологически активных соединений.
В родственном аспекте настоящее изобретение далее относится к новым соединениям, которые имеют меньшую CYP3A4-ингибирующую активность. Настоящее изобретение также относится к новым соединениям, которые имеют ингибирующую активность в отношении передачи сигналов Wnt. Настоящее изобретение также относится к новым соединениям, которые могут использоваться для получения лекарственного средства для лечения или профилактики острого миелоидного лейкоза.
Предпочтительные эффекты
Настоящее изобретение относится к новым соединениям-миметикам обратного поворота. Соединения согласно настоящему изобретению показывают меньшую CYP3A4-ингибирующую активность (более высокую IC50), что позволяет использовать эти соединения как потенциальные фармацевтические средства, особенно когда они должны вводиться в комбинации с другими лекарственными средствами. Соединения согласно настоящему изобретению показали высокую ингибирующую активность в отношении передачи сигналов Wnt. Соединения ингибировали рост раковых клеток AML, и они могут использоваться в лечении или профилактике острого миелоидного лейкоза.
Краткое описание чертежей
Далее будет сделана ссылка на предпочтительный вариант осуществления настоящего изобретения, примеры которого проиллюстрированы на приложенных чертежах. Варианты осуществления описаны ниже для того, чтобы объяснить настоящее изобретение со ссылкой на фигуры.
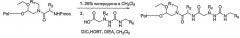
Фиг.1 представляет собой общую схему синтеза для получения миметиков обратного поворота согласно настоящему изобретению.
Фиг.2A-2E показывают эффект тестируемых соединений (соединения А-E) на активность CYP3A4. График основан на измерении IC50 для соединений А-E согласно настоящему изобретению в тесте ингибирования CYP3A4, в котором ингибирование активности CYP3A4 было измерено при различных концентрациях соединения с получением значения IC50. Подробные процедуры раскрыты в примере 1.
Фиг.3 показывает результаты измерения IC50 соединения F для клеток SW480 на TopFlash Reporter Gene Bioassay.
Фиг.4 показывает ингибирование роста раковых клеток AML тестируемым соединением в зависимости от концентрации тестируемого соединения (соединение B).
Лучший способ осуществления изобретения
В рамках описания и приложенной формулы изобретения, если не указано иное, следующие термины имеют указанное значение:
"Амино" относится к радикалу -NH2.
"Амидино" относится к радикалу -C(=NH)-NH2. Один или оба атома водорода аминогруппы амидино могут быть заменены одной или двумя алкильными группами, как определено здесь. Алкил-дериватизованные амидино-радикалы также упоминаются как "алкиламидино" и "диалкиламидино", соответственно.
"Циано" относится к радикалу -CN.
"Карбокси" относится к радикалу -COOR, в котором R обозначает водород или алкил, как определено здесь.
"Ацил" относится к радикалу -COR, в котором R обозначает алкил, арил, циклоалкил, гетероциклил, как определено здесь. Например, R может обозначать метил, бутенил, циклопропил и т.п. Алкил или арил может быть замещен заместителями, как описано для алкильной или арильной групп, соответственно. Примеры ацильных групп включают, без ограничения, фенилацил, бензилацил, C1-6ацил (например, ацетил) и т.п.
"Алкилсульфонат" относится к радикалу -S(O)2-OR, в котором R обозначает алкил, как определено здесь.
"Амидосульфонат" относится к радикалу -OS(O)2-NR2, каждый R независимо обозначает водород или алкил. Примеры амидосульфонатов включают -OS(O)2NH2, -OS(O)2NHMe.
"Аминокарбонил" относится к радикалу -C(O)NR2, каждый R независимо обозначает водород, алкил, амино, циклоалкилалкил, гетероциклил, алкоксиалкил, гидроксиалкил, гидроксил, алкокси, арилалкил, гетероциклилалкил, или два R вместе с атомом азота, к которому они присоединены, образуют гетероциклил, как определено здесь. Когда один из R обозначает водород, другой R обозначает C1-4алкил, аминокарбонил может быть представлен "C1-4алкилформамидилом".
"N-формамидил" относится к радикалу -NHC(O)Н.
"Фенилсульфонил" относится к радикалу -S(O)2-R, в котором R обозначает фенил, фенил может быть дополнительно замещен алкилом или хлором.
"Фенилсульфонат" относится к радикалу -O-S(O)2-R, в котором R обозначает фенил, фенил может быть дополнительно замещен алкилом или хлором.
"Алкилсульфонил" относится к радикалу -S(O)2-R, в котором R обозначает алкил, как определено здесь. Примеры алкилсульфонильных радикалов включают метилсульфонил.
"Алкилтио" относится к радикалу -SR, в котором R обозначает алкил, как определено здесь.
"Арилтио" относится к радикалу -SR, в котором R обозначает арил, как определено здесь. Арильная группа арилтио может быть дополнительно замещена алкилом или хлором.
"Арилокси" относится к радикалу -OR, в котором R обозначает арил, как определено здесь. Арильная группа может быть дополнительно замещена алкилом, алкокси и т.п.
"Ацилоксиалкил" относится к радикалу -R'-OC(O)-R, в котором R обозначает алкил, арил, циклоалкил, гетероциклил, как определено здесь; и R' обозначает алкил.
"Гуанидино" относится к радикалу -NH-C(=NH)-NH2. Один или оба атома водорода аминогруппы гуанидино могут быть заменены одной или двумя алкильными группами, как определено здесь. Алкил-дериватизованные радикалы гуанидина также упоминаются как "алкилгуанидино" и "диалкилгуанидино", соответственно.
"Нитро" относится к радикалу -NO2.
"Алкил" относится к радикалу с прямой или разветвленной углеводородной цепью, состоящему исключительно из атомов углерода и водорода. Алкил может быть насыщенным (содержащим атомы углерода, соединенные только простыми связями) или ненасыщенным (содержащим атомы углерода, соединенные по меньшей мере одной двойной связью или тройной связью.) Алкил, имеющий от одного до двенадцати атомов углерода, также упоминается как "низшие алкильные группы" и может быть обозначен как "C1-12алкил". В других вариантах осуществления алкил может включать от одного до четырех атомов углерода и быть обозначен как "C1-4алкил". В других вариантах осуществления алкил может включать от двух до пяти атомов углерода и быть обозначен как "C2-5алкил". Алкил присоединен к остальной части молекулы простой связью. Примеры насыщенных алкилов включают, без ограничения, метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил, 1,1-диметилэтил (трет-бутил), 3-метилгексил, 2-метилгексил и т.п. Примеры ненасыщенных алкилов включают, без ограничения, этенил (то есть винил), проп-1-енил (то есть аллил), бут-1-енил, пент-1-енил, пента-1,4-диенил, этинил (то есть ацитиленил), проп-1-инил и т.п.
Алкил может также представлять собой моноциклический или бициклический кольцевой углеводородный радикал, который может включать конденсированные или соединенные мостиковой связью кольцевые системы. Циклический алкил также упоминается как "циклоалкил". В некоторых вариантах осуществления циклоалкил может включать от трех до шести атомов углерода и может быть обозначен как "C3-6циклоалкил". Примеры моноциклических циклоалкильных радикалов включают, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Ненасыщенный циклоалкил содержит двойную эндосвязь (то есть двойную связь в кольце). Примеры ненасыщенного циклоалкила включают циклогексенил. Примеры бициклических циклоалкильных радикалов включают, например, норборнил (то есть бицикло[2.2.1]гептил), 7,7-диметил-бицикло[2.2.1]гептил и т.п.
Если в описании особо не указано иное, термин "алкил" включает как алкил, так и "замещенный алкил", который относится к алкильному радикалу, в котором один или более атомов водорода заменены одним или более заместителями, независимо выбранными из: ацила, амидино, алкиламидино, диалкиламидино, алкокси, арила, циано, циклоалкила, гуанидино, алкилгуанидино, диалкилгуанидино, галогена, гетероциклила, гидразинила, гидроксила, нитро, -OC(O)-R11, -N(R11)2, -C(O)OR11, -C(O)N(R11)2, -N(R11)C(O)OR11, -N(R11)C(O)R11, -N(R11)S(O)tR11 (где t=1 или 2), -S(O)tOR11 (где t=1 или 2), -S(O)pR11 (где p=0, 1 или 2) и -S(O)tN(R11)2 (где t=1 или 2), где каждый R11 независимо обозначает водород, алкил, арил, арилалкил, гетероциклил или гетероциклилалкил, как определено здесь.
"Алкокси" относится к радикалу, представленному формулой алкил-О-, в которой алкил имеет определенные здесь значения. Алкильная часть может быть дополнительно замещена одним или более галогенами. Алкокси может также быть обозначен числом атомов углерода в алкильной группе, например, C1-6алкокси или C1-3алкокси.
"Арил" относится к радикалу, полученному из ароматической моноциклической или бициклической кольцевой системы путем удаления атома водорода от кольцевого атома углерода. Ароматическая моноциклическая или бициклическая кольцевая углеводородная система включает от шести до двенадцати атомов углерода (то есть C6-12арил), причем по меньшей мере одно из колец в кольцевой системе полностью ненасыщено, то есть оно содержит циклическую делокализованную (4n+2) π-электронную систему в соответствии с теорией Hückel. В случае необходимости, один или два кольцевых атома арила могут быть гетероатомами, выбранными из азота, кислорода или серы. Примеры арильных радикалов включают, но не ограничены ими, фенил и нафтил. Если в описании особо не указано иное, термин "арил" включает как арил, так и "замещенный арил", который относится к арильному радикалу, в котором один или более атомов водорода заменены одним или более заместителями, независимо выбранными из: алкила, ацила, амидино, амидосульфоната, алкокси, арилокси, циано, гуанидино, алкилгуанидино, диалкилгуанидино, галогена, гидразинила, гидроксила, нитро, гетероциклила, -OC(O)-R11, -N(R11)2, -C(O)OR11, -C(O)N(R11)2, -N(R11)C(O)OR11, -N(R11)C(O)R11, -N(R11)S(O)tR11 (где t=1 или 2), -S(O)tOR11 (где t=1 или 2), -S(O)pR11 (где p=0, 1 или 2) и -S(O)tN(R11)2 (где t=1 или 2), где каждый R11 независимо обозначает водород, алкил, арил, арилалкил, гетероциклил или гетероциклилалкил.
"Арилалкил" относится к алкильному радикалу, в котором одни или более атомов водорода алкила заменены одной или более арильными группами, как определено здесь. В различных вариантах осуществления арилалкилы включают от 7 до 15 атомов углерода и могут быть обозначены как C7-15арилалкил. В некоторых вариантах осуществления арилалкил представляет собой арилC1-4алкил, причем, C1-4алкил замещен одним арилом или двумя арилами, последний также называют "диарилалкил" или "бисарилалкил". Примеры арилC1-4алкила включают, но не ограничены ими, арилметил, арилэтил, арилпропил, арилбутил, бисарилметил, бисарилэтил, бисарилпропил, бисарилбутил. Примеры арилалкильных радикалов включают, без ограничения, бензил, нафтилметил, дифенилметил, 3,3-бисфенилпропил и т.п. Если в описании особо не указано иное, термин "арилалкил" включает как арилалкил, так и "замещенный арилалкил", в котором алкильная часть и/или арильная часть арилалкильного радикала могут быть замещены, как описано здесь для алкильного радикала и арильного радикала, соответственно.
"Циклоалкилалкил" относится к алкильному радикалу, в котором один или более атомов водорода алкила заменены одной или более группами, как определено здесь. В некоторых вариантах осуществления циклоалкилалкил представляет собой циклоалкилC1-2алкил, такой как циклоалкилметил, циклоалкилэтил и т.п. Примеры циклоалкилалкильных радикалов включают, без ограничения, циклогексилалкил (например, циклогексилметил и циклогексилэтил) и циклопентилалкил (например, циклопентилметил и циклопентилэтил) и т.п. Если в описании особо не указано иное, термин "циклоалкилалкил" включает как циклоалкилалкил, так и "замещенный циклоалкилалкил", в котором алкильная часть и/или циклоалкильная часть циклоалкилалкильного радикала могут быть замещены, как описано здесь для алкильного радикала и циклоалкильного радикала, соответственно.
"Гликозил" относится к радикалу, полученному удалением гидроксильной группы полуацеталя из циклической формы моносахарида (например, глюкозы), дисахарида, олигосахарида (включающего от трех до десяти моносахаридов) или полисахарида (включающего более десяти моносахаридов).
"Галоген" относится к радикалам фтора, хлора, брома или йода.
"Галогеналкил" относится к алкильному радикалу, как определено здесь, который замещен одним или более радикалами галогена, как определено здесь. Примеры галогеналкилов включают, без ограничения: трифторметил, дифторметил, трихлорметил, 2,2,2-трифторэтил, 1-фторметил-2-фторэтил, 3-бром-2-фторпропил, 1-бромметил-2-бромэтил и т.п. Алкил, замещенный одним или более атомами фтора, также упоминается как "перфторалкил", например, "перфторC1-4алкил". Алкильная часть галогеналкильного радикала может быть замещена, как определено здесь для алкильной группы.
"Гетероциклил" относится к стабильному гетероциклическому кольцевому радикалу, который включает от двух до одиннадцати атомов углерода и от одного до трех гетероатомов, выбранных из азота, кислорода и серы. В некоторых вариантах осуществления гетероциклил содержит один или два гетероатома. Если в описании особо не указано иное, гетероциклильный радикал может быть моноциклической или бициклической кольцевой системой, которая может включать конденсированные или соединенные мостиковой связью кольцевые системы. В некоторых вариантах осуществления гетероциклил может быть 5-, 6- или 7-членным моноциклическим кольцом. В других вариантах осуществления гетероциклил может быть 8-, 9-, 10-, 11- или 12-членным конденсированным бициклическим кольцом. Гетероатомы в гетероциклильном радикале могут быть окислены. Один или более атомов азота, если они присутствуют, могут быть кватернизованы. Гетероциклильный радикал может быть неароматическим или ароматическим (то есть по меньшей мере одно кольцо в гетероциклильном радикале имеет делокализованную (4n+2) π-электронную систему в соответствии с теорией Hückel.) Гетероциклил может быть присоединен к остальной части молекулы через любой атом кольца. Примеры неароматических гетероциклильных радикалов включают, но не ограничены ими, диоксоланил, декагидроизохинолил, имидазолинил, имидазолидинил, изотиазолидинил, изоксазолидинил, морфолинил, октагидроиндолил, октагидроизоиндолил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, оксазолидинил, пиперидинил (также называемый "пиперидилом"), пиперазинил, 4-пиперидонил, 3-пирролинил, пирролидинил, пиразолидинил, хинуклидинил, тиазолидинил, тетрагидрофурил, тритианил, тетрагидропиранил, тиоморфолинил и тиаморфолинил. Примеры ароматических гетероциклильных радикалов включают, но не ограничены ими, азепинил, акридинил, бензимидазолил, бензиндолил, 1,3-бензодиоксолил, бензофуранил, бензооксазолил, бензоизоксазолил, бензо[d]тиазолил, бензотиадиазолил, бензо[b][1,4]диоксепинил, бензо[b][1,4]оксазинил, 1,4-бензодиоксанил, бензоксазолил, бензодиоксолил, бензодиоксинил, бензопиранил, бензопиразолил, бензофуранил, бензофуранонил, бензотиенил (бензотиофенил), бензотиено[3,2-d]пиримидинил, бензотриазолил, карбазолил, хромон, циннолинил, циклопента[d]пиримидинил, дибензофуранил, дибензотиофенил, фуранил, фуранонил, фуро[3,2-c]пиридинил, изотиазолил, имидазолил, индазолил, индолил, индазолил, изоиндолил, индолинил, изоиндолинил, изохинолил, индолизинил, изоксазолил, 5,8-метано-5,6,7,8-тетрагидрохиназолинил, нафтиридинил, 1,6-нафтиридинонил, оксадиазолил, 2-оксоазепинил, оксазолил, оксиранил, 5,6,6a,7,8,9,10,10a-октагидробензо[h]хиназолинил, феназинил, фенотиазинил, феноксазинил, фталазинил, птеридинил, пуринил, пирролил, пиразолил, пиразоло[3,4-d]пиримидинил, пиридинил (также называемый пиридилом), пиридо[3,2-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиразинил, пиримидинил, пиридазинил, пирролил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетрагидрохинолинил, 1,2,3,4-тетрагидрокарбазолил, 5,6,7,8-тетрагидрохиназолинил, тиазолил, тиадиазолил, триазолил, тетразолил, триазин-2-ил, тиено[2,3-d]пиримидинил, тиено[3,2-d]пиримидинил, тиено[2,3-c]пиридинил и тиофенил (то есть тиенил). Если в описании особо не указано иное, термин "гетероциклил" включает как гетероциклил, так и "замещенный гетероциклил", который относится к гетероциклильному радикалу, замещенному одним или более заместителями, выбранными из алкила, ацила, оксо (например, пиридинонил, пирролидонил), арила, арилалкила, ацилоксиалкила, амидино, алкокси, циано, гуанидино, алкилгуанидино, диалкилгуанидино, галогена, гидразинила, гидроксила, нитро, -OC(O)-R11, -N(R11)2, -C(O)OR11, -C(O)N(R11)2, -N(R11)C(O)OR11, -N(R11)C(O)R11, -N(R11)S(O)tR11 (где t=1 или 2), -S(O)tOR11 (где t=1 или 2), -S(O)pR11 (где p=0, 1 или 2) и -S(O)tN(R11)2 (где t=1 или 2), где каждый R11 независимо обозначает водород, алкил, арил, арилалкил, гетероциклил или гетероциклилалкил.
"Гетероциклилалкил" относится к алкильному радикалу, в котором один или более атомов водорода алкила заменены одной или более гетероциклильными группами, как определено здесь. Если гетероциклил является азотсодержащим гетероциклилом, гетероциклил может быть присоединен к алкильному радикалу по атому азота. В некоторых вариантах осуществления алкильная часть гетероциклилалкила содержит 1-4 атома углерода и может быть представлена как гетероциклилC1-4алкил. Примеры гетероциклилалкильных радикалов включают, без ограничения, морфолинилалкил, такой как морфолинилметил, пиперидилалкил, такой как пиперидилметил, имидазолидинилалкил, такой как имидазолидинилметил, и т.п. Дополнительные примеры гетероциклилалкильных радикалов, в которых гетероциклильные части являются ароматическими, включают, но не ограничены ими: пиридилметил, пиридилэтил, пиридилпропил, пиридилбутил, хинолинилметил, хинолинилэтил, хинолинилпропил, хинолинилбутил, индазолилметил, индазолилэтил, индазолилпропил, индазолилбутил, бензпиразолилметил, бензпиразолилэтил, бензпиразолилпропил, бензпиразолилбутил, изохинолинилметил, изохинолинилэтил, изохинолинилпропил, изохинолинилбутил, бензотриазолилметил, бензотриазолилэтил, бензотриазолилпропил, бензотриазолилбутил и т.п. Если в описании особо не указано иное, термин "гетероциклилалкил" включает как гетероциклилалкил, так и "замещенный гетероциклилалкил", в котором алкильная часть и/или гетероциклильная часть гетероциклилалкильного радикала могут быть замещены, как описано здесь для алкильного радикала и гетероциклильного радикала, соответственно.
Соединения или их фармацевтически приемлемые соли могут содержать один или более центров асимметрии и могут, таким образом, давать начало энантиомерам, диастереомерам и другим стереоизомерным формам, которые могут быть определены, в терминах абсолютной стереохимии, как (R)- или (S)-, или как (D)- или (L)- для аминокислот. Когда соединения, описанные здесь, содержат олефиновые двойные связи или другие центры геометрической асимметрии, и если не указано иное, соединения включают геометрические изомеры как E, так и Z (например, цис или транс). Аналогично, все возможные изомеры, а также их рацемические и оптически чистые формы, и все таутомерные формы также входят в рамки изобретения.
В рамках изобретения "аминокислота" включает встречающиеся в природе α-аминокислоты и/или не встречающиеся в природе аминокислоты, такие как β-аминокислоты и гомоаминокислоты. Примеры аминокислот включают, но не ограничены ими: аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин, валин, фосфосерин, фосфотреонин, фосфотирозин, 4-гидроксипролин, гидроксилизин, демозин, изодемозин, гамма-карбоксиглутамат, гиппуровую кислоту, октагидроиндол-2-карбоновую кислоту, статин, 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту, пеницилламин, орнитин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминобутиловая кислота, цитруллин, гомоцистеин, гомосерин, метилаланин, п-бензоилфенилаланин, фенилглицин, пропаргилглицин, саркозин, метионин сульфон, трет-бутилглицин, 3,5-дибромтирозин и 3,5-дийодтирозин.
"Аминокислотный остаток" или "группа боковой цепи аминокислоты" относится к части аминокислоты, которая остается после потери молекулы воды (или спирта), когда аминокислота конденсируется с молекулой. Как правило, аминокислота конденсируется с молекулой, включая соединение любой из формул (I)-(IV), образуя пептидную связь. В некоторых вариантах осуществления функциональная аминогруппа аминокислоты может конденсироваться с группой карбоновой кислоты или ее реакционно-способным эквивалентом (например, ангидридом карбоновой кислоты) молекулы. В других вариантах осуществления функциональная группа карбоновой кислоты аминокислоты может конденсироваться с аминогруппой молекулы. Как правило, молекула воды утрачивается в ходе образования пептидной связи. Примеры "аминокислотных остатков" или "групп боковой цепи аминокислоты" включают, но не ограничены ими, остатки аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина, валина, фосфосерина, фосфотреонина, фосфотирозина, 4-гидроксипролина, гидроксилизина, демозина, изодемозина, гамма-карбоксиглутамата, гиппуровой кислоты, октагидроиндол-2-карбоновой кислоты, статина, 1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты, пеницилламина, орнитина, 3-метилгистидина, норвалина, бета-аланина, гамма-аминобутиловой кислоты, цитруллина, гомоцистеина, гомосерина, метилаланина, п-бензоилфенилаланина, фенилглицина, пропаргилглицина, саркозина, метионин сульфона, трет-бутилглицина, 3,5-дибромтирозина, 3,5-дийодтирозина, гликозилированного треонина, гликозилированного серина и гликозилированного аспарагина.
"Производное боковой цепи аминокислоты" относится к производному любой группы боковой цепи аминокислоты, как описано в таблице 1. В некоторых вариантах осуществления производным боковой цепи аминокислоты является алкил, ацил, алкокси, арил, арилалкил, гетероциклил или гетероциклилалкил, как определено здесь.
| ТАБЛИЦА 1 | |
| Группа боковой цепи аминокислоты | Аминокислота |
| -H | Глицин |
| -CH3 | Аланин |
| -CH(CH3)2 | Валин |
| -CH2CH(CH3)2 | Лейцин |
| -CH(CH3)CH2CH3 | Изолейцин |
| -(CH2)4NH3 + | Лизин |
| -(CH2)3NHC(NH2)NH2 + | Аргинин |
| Гистидин | |
| -CH2COO- | Аспарагиновая кислота |
| -CH2CH2COO- | Глутаминовая кислота |
| -CH2CONH2 | Аспарагин |
| -CH2CH2CONH2 | Глутамин |
| Фенилаланин | |
| Тирозин | |
| Триптофан | |
| -CH2SH | Цистеин |
| -CH2CH2SCH3 | Метионин |
| -CH2OH | Серин |
| -CH(OH)CH3 | Треонин |
| Пролин | |
| Гидроксипролин |
"Стереоизомер" относится к соединению, состоящему из тех же самых атомов, соединенных теми же самыми связями, но имеющему другие прос