Тиксотропные фармацевтические композиции
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к тиксотропной пероральной фармацевтической композиции для доставки лекарственного средства. Тиксотропная фармацевтическая композиция включает фармакологически активную субстанцию, жидкий субстрат, биосовместимый загуститель, имеющий заранее заданные тиксотропные свойства и выбранный из агара, карагенина и геллановой камеди. Композиция обеспечивает точное введение количеств лекарственных средств пациенту, высокую степень восприятия пациентом дозировки лекарственных препаратов. 8 з.п. ф-лы, 3 ил., 10 табл.
Реферат
Настоящее изобретение относится к тиксотропной фармацевтической композиции, в которой вязкость изменяется в соответствии с внешней механической нагрузкой так, что может происходить изотермический и непрерывный переход «гель/золь/гель». Более конкретно, настоящее изобретение относится к тиксотропной фармацевтической композиции, которая включает фармакологически активную субстанцию, биосовместимый загуститель, имеющий заранее заданные тиксотропные характеристики, и необязательно, гидрофильный загуститель. Вязкость композиции относительно быстро изменяется в пределах заданного диапазона. Согласно этому можно легко дозировать количество вводимых лекарственных средств, можно вводить пациенту точное количество лекарственных веществ, высока степень восприятия пациентом дозировки лекарственных средств, и можно легко готовить композицию.
Уровень техники
Примеры фармацевтических композиций для перорального введения, которые применяются для системной терапии, включают твердые средства, включающие таблетки и капсулы, и жидкие средства, включающие сиропы, эликсиры, коллоидные суспензии и тому подобные. В случае твердых средств, их трудно вводить детям, престарелым индивидам и лицам, которые имеют проблемы с глотанием. Для этого, чтобы решить эту проблему, были разработаны пероральные жидкие лекарственные средства для повышения уровня восприятия пациентом дозировки лекарственных веществ и скорости всасывания лекарственных веществ в организме.
Однако пероральные жидкие средства создают следующие фармацевтические и фармакологические проблемы. То есть, в случае коллоидных суспензий, во время хранения могут возникать такие проблемы, как расслоение (комкование и седиментация), имеющие отношение к стабильности состава. В случае сиропов, вследствие низкой вязкости и механической нагрузки, которая прилагается к дозировочному приспособлению (ложке или тому подобному), существует опасность того, что лекарственное средство может падать с дозировочного приспособления во время отмеривания и перорального введения. Например, в случае нарушения моторики у пациента (дрожание рук, обусловленное эссенциальным тремором, тремор рук и дефицит моторного контроля тонких движений) или педиатрического пациента, испытывающего страх перед приемом медикаментов, очень трудно дозировать или вводить лекарственные средства в точном количестве с помощью дозировочного приспособления.
Чтобы решить вышеуказанные проблемы, были проведены многочисленные исследования для получения составов полутвердого типа, имеющих высокую вязкость при использовании геля. Например, Патент США №5,300,302 представляет состав гелевого типа с использованием ксантановой камеди, производного целлюлозы и тому подобного в качестве загустителя для повышения вязкости композиции, и дозировочный контейнер, с помощью которого можно выполнить накачивание с точным дозированием. Патенты США №№5,881,926, 6,071,523, 6,355,258, 6,399,079 и 6,656,482 раскрывают устойчивые к проливанию составы (торговое наименование: ElixSure™, изготовленные фирмой Taro, Inc.). Однако препараты имеют высокую вязкость, и тем самым возникает нежелательная необходимость тратить много энергии для однородного диспергирования основных лекарственных веществ в субстрате во время процесса приготовления. Более того, вследствие ограниченного вязкостного диапазона пригодности к переходу возникают проблемы того, что во время извлечения лекарственной формы из контейнера путем сдавливания контейнера требуются высокая внешняя механическая нагрузка или специальный контейнер, пригодный для отмеривания точного количества.
В дополнение, Европейский Патент ЕР №0379147 представляет гель, который пригоден для извлечения из контейнера, снабженного дозировочным насосным блоком. Однако существует проблема того, что гель может быть извлечен для однодневной дозы только накачиванием содержимого от 12 до 60 раз и повторением этой процедуры 3 или 4 раза. Проблемы нельзя избежать простым повышением концентрации фармакологически активной субстанции. Это обусловлено тем, что при увеличении количества активной субстанции растет вязкость состава; соответственно этому становится затруднительным формировать гель и равномерно диспергировать активную субстанцию в субстрате.
Более того, композиция согласно вышеупомянутой известной технологии проблематична в том отношении, что вследствие высоких вязкостных характеристик усложняется процесс производства и требуются большие энергозатраты.
Между тем, в Патентах США №№4,427,681 и 88/00825 в качестве суспензионного средства употребляется тиксотропная субстанция во избежание изменения структурных характеристик препарата циметидинового ряда, то есть, нестабильности полиморфной модификации типа В.
Описание изобретения
Техническая проблема
Настоящее изобретение было выполнено для преодоления проблем, возникающих вследствие высоких вязкостных характеристик состава полутвердого типа известного из прототипа, и цель настоящего изобретения состоит в представлении тиксотропной фармацевтической композиции, которая проста в получении, дозировании и введении.
Еще одна цель настоящего изобретения заключается в представлении пероральной фармацевтической композиции, которая имеет однородно распределенные фармакологически активные вещества.
Далее сущность и выполнение настоящего изобретения будут описаны подробно.
Техническое решение
Чтобы достигнуть вышеназванных целей, один аспект настоящего изобретения состоит в представлении тиксотропной фармацевтической композиции, которая включает по меньшей мере одну фармакологически активную субстанцию; жидкий субстрат; и по меньшей мере один биосовместимый загуститель, имеющий тиксотропные свойства, и отличается тем, что изотермическое и непрерывное превращение «гель/золь/гель» происходит, когда к композиции прилагается внешняя механическая нагрузка.
Краткое описание чертежей
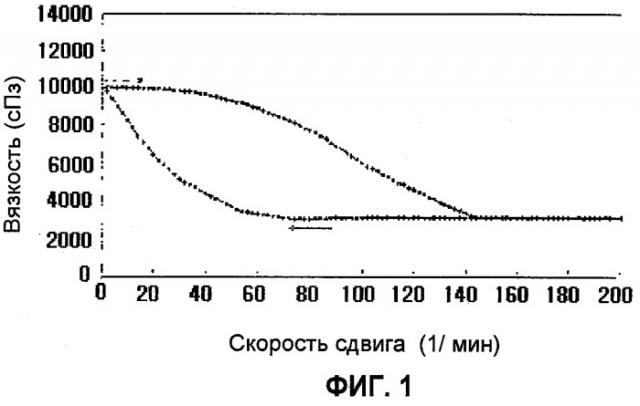
Фиг.1 представляет график, который иллюстрирует результаты измерения гистерезиса тиксотропной фармацевтической композиции, которая получена в Примере 1;
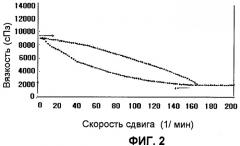
Фиг.2 представляет график, который иллюстрирует результаты измерения гистерезиса тиксотропной фармацевтической композиции, которая получена в Примере 3; и
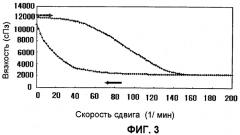
Фиг.3 представляет график, который иллюстрирует результаты измерения гистерезиса тиксотропной фармацевтической композиции, которая получена в Примере 4.
Наилучший вариант исполнения изобретения
Начальная вязкость, согласно настоящему изобретению, означает вязкость, при которой механическая нагрузка не приложена к композиции, а равновесная вязкость, согласно настоящему изобретению, означает вязкость, при которой механическая нагрузка приложена к композиции, имеющей начальную вязкость.
Предпочтительно, чтобы фармацевтическая композиция согласно настоящему изобретению имела равновесную вязкость 4000 сПз (сантипуаз) или менее, когда прилагается механическая нагрузка в такой степени, чтобы встряхивать контейнер. Когда равновесная вязкость составляет 4000 сПз или менее, как описано выше, нетрудно переносить фармацевтическую композицию из контейнера для хранения в дозировочное приспособление, и нетрудно производить перемешивание, фильтрование или упаковку в процессе приготовления, благодаря чему может быть повышена производительность.
Более предпочтительно, чтобы композиция имела начальную вязкость 5000 сПз или более в статическом состоянии и равновесную вязкость 3500 сПз или менее, когда к ней прилагается механическая нагрузка. Еще более предпочтительно, чтобы начальная вязкость варьировала в диапазоне от 7500 до 50000 сПз, и равновесная вязкость варьировала в диапазоне от 300 до 3500 сПз.
Наиболее предпочтительно, чтобы разность между начальной вязкостью и равновесной вязкостью композиции составляла по меньшей мере 3000 сПз или более. Более конкретно, разность может варьировать в диапазоне от 3000 до 30000 сПз.
В связи с этим начальная вязкость и равновесная вязкость могут быть измерены с использованием реометра Rheometer RS100, производимого фирмой Haake, Co., Ltd., при температуре 25°С и скорости сдвига 30 об/мин согласно методу РР35 в геометрии «плита/плита».
Время, затрачиваемое на переход от равновесной вязкости к начальной вязкости, варьирует в диапазоне от 10 до 60 сек, и предпочтительно от 10 до 30 сек.
В дополнение, когда композиция согласно настоящему изобретению подвергается испытанию с переворачиванием ложки, композиция не выпадает в течение 30 сек или более, предпочтительно в течение от 60 до 120 сек.
Композиция согласно настоящему изобретению может быть дозирована и введена в точном количестве без проливания, поскольку имеет место явление непрерывное превращение «гель/золь/гель». То есть, композиция находится в состоянии геля, имеющего высокую и постоянную вязкость перед дозированием (во время хранения), и если композицию в контейнере встряхивают для выполнения дозирования, гелеобразное состояние быстро переходит в состояние золя, имеющего низкую вязкость, поэтому неудобство дозирования, связанное с высокой вязкостью, может быть устранено. После дозирования состояние золя обратимо переходит в состояние геля, имеющего превосходную внутреннюю когезионную способность, намазываемость и высокую вязкость в дозирующем приспособлении, для снижения опасности утечки лекарственного средства из дозировочного устройства, так что может быть введено точное количество лекарственного вещества. После перорального введения можно легко обеспечить проглатывание благодаря снижению вязкости, обусловленному температурой тела и слюной.
В дополнение, композиции согласно настоящему изобретению имеет высокую начальную вязкость, но низкую равновесную вязкость благодаря приложению внешней механической нагрузке во время изготовления. Таким образом, нетрудно производить, хранить и упаковывать композицию, и не требуется расходовать много энергии. Далее, сниженная равновесная вязкость быстро возрастает опять до начальной вязкости, поэтому легко дозировать точное количество композиции, и нет риска утечки лекарственного средства во время введения.
В композиции согласно настоящему изобретению биосовместимый загуститель может содержаться в количестве, варьирующем от 0,01 до 12% (отношение веса к объему), и предпочтительно от 0,01 до 5% (отношение веса к объему), в расчете на общий вес композиции.
Когда биосовместимый загуститель содержится в вышеупомянутом количестве, композиция согласно настоящему изобретению имеет надлежащий диапазон вязкости, так что можно предотвратить утечку лекарственного средства из дозировочного устройства, и в результате легко выполнить приготовление, дозирование и введение.
Примеры биосовместимого загустителя могут включать любой биосовместимый загуститель в такой мере, насколько загуститель имеет тиксотропные характеристики, является биосовместимым и может быть использован в качестве загустителя. Предпочтительно может быть употреблен таковой, выбранный из агара, каррагенина, карбоксиметилцеллюлозы, смеси микрокристаллической целлюлозы и карбоксиметилцеллюлозы, коллоидного диоксида кремния, ксантановой камеди, геллановой камеди и смеси таковых.
В дополнение, композиция согласно настоящему изобретению может дополнительно включать в качестве загустителя один или более гидрофильных загустителей, не обладающих тиксотропными свойствами. Гидрофильный загуститель обеспечивает вязкость, которая достаточна для компенсации низкой вязкости биосовместимого загустителя, имеющего тиксотропные свойства, чтобы повысить вязкость и тиксотропные характеристики композиции согласно настоящему изобретению. Таким образом, вязкость, тиксотропные характеристики и подобные свойства фармацевтической композиции согласно настоящему изобретению могут быть оптимизированы до надлежащего уровня для выполнения введения и дозирования.
Гидрофильный загуститель может содержаться в количестве, варьирующем от 0,01 до 7% (отношение веса к объему), предпочтительно от 0,01 до 3% (отношение веса к объему), и более предпочтительно от 0,2 до 1% (отношение веса к объему), в расчете на общий вес композиции.
В качестве гидрофильного загустителя может быть применен любой загуститель в такой мере, насколько загуститель имеет гидрофильные свойства. Предпочтительные примеры загустителя могут быть выбраны из целлюлозы, гидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозы, метилцеллюлозы, этилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, этилгидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, карбоксиметилгидроксиэтилцеллюлозы, гомополимеров алкиленоксидов, включая полиэтиленоксид и полипропиленоксид, полиэтиленгликоля, альгинатов, поливинилового спирта, повидона, полисахаридов, винилпирролидоновых полимеров, карбоксивинильных полимеров, карбоксиполиметилена и смесей таковых.
Более предпочтительные примеры гидрофильного загустителя могут быть выбраны из целлюлозы, карбоксиметилцеллюлозы, альгината, полиэтиленгликоля, полиэтиленоксида, поливинилового спирта, винилпирролидоновых полимеров, карбоксивинильных полимеров, карбоксиполиметилена, повидона и смесей таковых.
В композиции согласно настоящему изобретению тип фармакологически активной субстанции не ограничен в такой мере, насколько фармакологически активная субстанция может быть введена перорально для лечения заболеваний, и одна или более фармакологически активных субстанций, которые известны в практике как эффективные согласно типу заболевания, могут быть надлежащим образом выбраны и определены квалифицированными специалистами в этой области технологии.
Примеры вышеназванных фармакологически активных субстанций могут включать одну или более веществ, выбранных из анальгетиков, нестероидных противовоспалительных лекарственных средств, антигистаминных препаратов, противокашлевых средств, отхаркивающих средств, бронходилататоров, противоинфекционных препаратов, активных для центральной нервной системы лекарственных препаратов, сердечно-сосудистых препаратов, антинеопластических препаратов, лекарственных средств для понижения уровня холестерина, антиэметиков, витаминов, минеральных добавок, размягчителей стула, средств контроля высокого кровяного давления, противогрибковых препаратов, противодиабетических препаратов, аминокислотных добавок и тому подобных, но не ограничиваются таковыми.
Более конкретные примеры вышеназванной фармакологически активной субстанции могут включать одно или более веществ, выбранных из ацетаминофена, ибупрофена, аспирина, дифенгидрамина, вальсартана, монтелукаста, скополамина, зальтопрофена, трамадола, диклофенака, ацеклофенака, этодолака, пироксикама, нимесулида, целекоксиба, глюкозамина, зольмитриптана, алендроновой кислоты, ризедроновой кислоты, S-карбоксиметилцистеина, декстрометорфана, гвайфенезина, псевдоэфедрина, фенилэфрина, лоратадина, эфедрина, цетиризина, мизоластина, олопатадина, эпинастина, прокатерола, ацетилцистеина, эрдостеина, теофиллина, формотерола, ципепрола, дифемерина, тизанидина, тиропрамида, диазепама, алпразолама, буспирона, этизолама, рисперидона, оланзапина, амисульпирида, кломипрамина, хлорпромазина, ривастигмина, донепезила, галантамина, энтакапона, мемантина, ропинирола, селегилина, карбидопы, леводопы, терфенадина, ранитидина, ципрофлоксацина, триазолама, тербинафина, флуконазола, итраконазола, кетоконазола, вориконазола, пропранолола, ловастатина, симвастатина, аторвастатина, питавастатина, росувастатина, правастатина, фенофибрата, эзетимиба, флуоксетина, эналаприла, ирбесартана, лозартана, Рамиприла, никорандила, доксазозина, карведилола, дилтиазема, тропизетрона, ондансетрона, меклизина, азасетрона, доласетрона, гранисетрона, метформина, глимепирида, гликлазида, митиглинида, глибенкламида, репаглинида и фармацевтически приемлемой соли или сложного эфира таковых.
Содержание фармакологически активной субстанции не ограничивается и может быть надлежащим образом определено с учетом типа заболевания, жидкого субстрата и загустителя. Является предпочтительным, что фармакологически активная субстанция содержится в количестве, варьирующем от 0,01 до 20% (отношение веса к объему), в расчете на общий вес композиции.
Принимая во внимание тип фармакологически активной субстанции и загустителя, которые должны быть использованы, в качестве жидкого субстрата может быть применен растворитель, который способен должным образом растворять или суспендировать вышеназванные субстанции. Конкретные примеры жидкого субстрата могут быть выбраны из дистиллированной воды, глицерина, спиртов, таких как этанол и тому подобные, пропиленгликоля, полиэтиленгликоля, жидких полиолов, таких как сорбит, мальтитол и тому подобные, и смеси таковых, но не ограничиваются таковыми. Жидкий субстрат может содержаться в количестве, варьирующем от 40 до 95% (отношение веса к объему), в расчете на общий вес композиции.
Между тем композиция согласно настоящему изобретению может дополнительно включать подсластитель и/или вкусо-ароматическую добавку, чтобы устранить горький вкус фармакологически активной субстанции. Если подсластитель и вкусо-ароматическую добавку, имеющую фруктовый вкус и аромат, которые нравятся детям, добавляют в заранее заданном количестве, как описано выше, горький вкус фармакологически активной субстанции может быть полностью подавлен для улучшения восприятия педиатрическим пациентом дозировки лекарственных средств. В дополнение, когда используется предварительно заданный подсластитель, композицию согласно настоящему изобретению вводят для предотвращения кариеса зубов без влияния на содержание глюкозы в крови. Соответственно этому композиция, согласно настоящему изобретению, может быть без опасений введена диабетическим пациентам.
Примеры подсластителя могут включать типичный подсластитель, который употребляется в технологии. Предпочтительные примеры подсластителя могут включать вещество, выбранное из углеводных спиртов, включая маннит, мальтитол, сорбит, ксилит и изомальт, которые не вызывают повреждения зубов, аспартамов, ацесульфамов, сахаринов, кальциевой соли сахарина, натриевой соли сахарина, сукралозы и смеси таковых.
Примеры вкусо-ароматической добавки могут включать типичную вкусо-ароматическую добавку, которая употребляется в технологии. Предпочтительные примеры вкусо-ароматической добавки могут включать одно или более веществ, выбранных из группы, включающей вкусо-ароматические добавки, которые имеют шоколадный привкус, вкус клубники, апельсиновый вкус и аромат, виноградный вкус, ванильный аромат, вишневый вкус и яблочный вкус и аромат.
Подсластитель и вкусо-ароматическая добавка могут содержаться в количестве от 0,001 до 2% (отношение веса к объему), в расчете на общий вес композиции, но количество подсластителя и вкусо-ароматической добавки не ограничивается таковыми.
Далее, в настоящем изобретении, чтобы подавить горький вкус используемого фармакологически активного вещества, для указанного фармакологически активного вещества может быть использована методика маскировки вкуса, которая обычно используется в технологии. Например, фармакологически активное вещество может быть покрыто биоразлагаемым полимером, может быть изготовлено как лекарственная форма в виде твердой дисперсии вещества или может быть капсулирована, но без ограничений. В связи с этим покрытие биоразлагаемым полимером, получение твердой дисперсии субстанции и инкапсулирование могут быть выполнены с использованием способа, который известен в технологии.
В дополнение, композиция согласно настоящему изобретению может дополнительно включать органические кислоты, чтобы улучшить восприятие пациентом дозировки лекарственных веществ. Если добавляются органические кислоты, это способствует выделению слюны у пациента после перорального введения для снижения вязкости композиции. Таким образом, может быть обеспечено удобство во время введения.
Примеры органических кислот, которые могут быть использованы в настоящем изобретении, могут включать одно или более веществ, выбранных из группы, включающей лимонную кислоту, аскорбиновую кислоту, пальмитиновую кислоту, виннокаменную кислоту и тому подобные, но не ограничиваются таковыми.
Органические кислоты могут содержаться в количестве, варьирующем от 0,001 до 5% (отношение веса к объему), в расчете на общий вес композиции.
Дополнительно, соответственно назначению и ситуации, вспомогательные добавки, такие как консервант, суспендирующее средство, солюбилизатор, буферный реагент и тому подобные могут быть выбраны квалифицированными специалистами в этой области технологии и добавлены к композиции.
Тиксотропная фармацевтическая композиция согласно настоящему изобретению может быть получена с использованием способа получения сиропа или препарата полутвердого типа, который хорошо известен в технологии. Иллюстративные, но не ограничивающие примеры такого способа будут описаны ниже. После того, как биосовместимый загуститель, имеющий тиксотропные свойства, или гидрофильный загуститель будет в достаточной степени гидратирован с использованием мешалки, фармакологически активную субстанцию растворяют отдельно или суспендируют для смешивания с биосовместимым загустителем или гидрофильным загустителем. Дополнительно к этому добавляют жидкий субстрат и вспомогательную добавку, такую как консервант, буферный реагент, подсластитель, вкусо-ароматическая добавка, краситель и тому подобные, для однородного смешивания их друг с другом, тем самым выполняя приготовление. В связи с этим при необходимости вспомогательная добавка может быть внесена в смесь, будучи растворенной отдельно.
Далее, в настоящем изобретении тиксотропная фармацевтическая композиция может храниться в контейнере для хранения, из которого композиция может быть извлечена в дозирующее приспособление, такое как ложки. В связи с этим в качестве вышеназванного контейнера может быть использован любой контейнер в такой мере, насколько контейнер может быть обычно применен для хранения или упаковки фармацевтической композиции. Примеры контейнера могут включать сдавливаемый тюбик, бутылку с насосным приспособлением, сдавливаемый тюбик с насосным приспособлением, индивидуальную упаковку в виде пакетика и тому подобные.
Способ исполнения изобретения
Настоящее изобретение будет описано более подробно с помощью нижеследующих Примеров. Однако приведенные ниже Примеры являются только иллюстративными и не ограничивают область настоящего изобретения.
ПРИМЕР 1: Получение ибупрофеновой пероральной тиксотропной фармацевтической композиции с использованием каррагенина и микрокристаллической целлюлозы Avicel CL 611 (100 мл)
45 г ксилита, 10 г раствора D-сорбита и 10 г глицерина добавили к 40 г дистиллированной воды, перемешали и смешали между собой. К смеси добавили 1,5 г каррагенина и 0,500 г целлюлозы Avicel CL 611, в то же время постоянно перемешивая полученную смесь для проведения гидратации, и добавили 0,25 г лимонной кислоты и 0,1 г бензоата натрия для проведения солюбилизации (А). После этого 0,1 г полисорбата Twin 80 отдельно добавили к 10 г дистиллированной воды для растворения такового, к раствору добавили 2 г ибупрофена и проводили перемешивание суспензии (В). После этого компонент А добавили к компоненту В, перемешали и смешали между собой, к смеси последовательно добавили 0,075 г красителя Yellow №5 и 0,1 г апельсиновой эссенции и смешали между собой, и к смеси добавили дистиллированную воду так, что общий объем полученного раствора составил 100 мл.
| Таблица 1 | ||
| Часть | Ингредиент | Количество (г) |
| А | Дистиллированная вода | 40,000 |
| Ксилит | 45,000 | |
| Раствор D-сорбита | 10,000 | |
| Глицерин | 10,000 | |
| Каррагенин | 1,500 | |
| Avicel CL 611 | 0,500 | |
| Лимонная кислота | 0,250 | |
| Бензоат натрия | 0,100 | |
| В | Дистиллированная вода | 10,000 |
| Twin 80 | 0,100 | |
| Ибупрофен | 2,000 | |
| Yellow No, 5 | 0,075 | |
| Апельсиновая эссенция | 0,100 | |
| Дистиллированная вода | Заранее заданное количество |
ПРИМЕР 2: Получение S-карбоксиметилцистеиновой пероральной тиксотропной композиции с использованием силикагеля Aerosil 200 и гидроксипропилметилцеллюлозы HPMC 2906 (100 мл)
25 г белого сахара и 10 г раствора D-сорбита добавили к 50 г дистиллированной воды, перемешали и смешали между собой. К полученному раствору добавили 1,5 г гидроксипропилметилцеллюлозы HPMC 2906 и 2 г силикагеля Aerosil 200, перемешали и гидратировали (А). После этого 0,37 г гидроксида натрия отдельно добавили к 15 г дистиллированной воды для растворения в таковой, к раствору добавили 2 г S-карбоксиметилцистеина и затем растворили в таковом (В). Компонент А добавили к компоненту В, перемешали и смешали между собой. 0,09 г метилпарабена и 0,01 г пропилпарабена отдельно добавили к 1,5 г этанола и затем растворили в таковом (С). После этого компонент С добавили к раствору смеси компонентов А и В и перемешали, к смеси добавили 0,1 г красителя Red №40 и 0,1 г эссенции, имеющей клубничный вкус, и провели смешивание до однородности, и к смеси добавили дистиллированную воду для доведения общего объема полученного раствора до 100 мл.
| Таблица 2 | ||
| Часть | Ингредиент | Количество (г) |
| A | Дистиллированная вода | 50,000 |
| Белый сахар | 25,000 | |
| Раствор D-сорбита | 10,000 | |
| Гидроксипропилметилцеллюлоза HPMC 2906 (вязкость 6000 сП) | 1,500 | |
| Aerosil 200 | 2,000 | |
| В | Дистиллированная вода | 15,000 |
| Гидроксид натрия | 0,370 | |
| S-Карбоксиметилцистеин | 2,000 | |
| С | Этанол | 1,500 |
| Метилпарабен | 0,090 | |
| Пропилпарабен | 0,010 | |
| Red No, 40 | 0,100 | |
| Эссенция, имеющая клубничный вкус | 0,100 | |
| Дистиллированная вода | Заранее заданное количество |
ПРИМЕР 3: Получение ибупрофеновой пероральной тиксотропной композиции с использованием каррагенина (100 мл)
45 г ксилита, 10 г раствора D-сорбита и 10 г глицерина добавили к 40 г дистиллированной воды, перемешали и смешали между собой. К смеси добавили 1,5 г каррагенина, в то же время постоянно перемешивая полученную смесь для проведения гидратации, и добавили 0,25 г лимонной кислоты и 0,1 г бензоата натрия для проведения солюбилизации (А). После этого 0,1 г полисорбата Twin 80 отдельно добавили к 10 г дистиллированной воды для его растворения, к раствору добавили 2 г ибупрофена и проводили перемешивание и суспендирование (В). После этого компонент А добавили к компоненту В, перемешали и смешали между собой, к смеси последовательно добавили 0,075 г красителя Yellow №5 и 0,1 г апельсиновой эссенции и смешали между собой, и к смеси добавили дистиллированную воду так, что общий объем полученного раствора составил 100 мл.
| Таблица 3 | ||
| Часть | Ингредиент | Количество (г) |
| A | Дистиллированная вода | 40,000 |
| Ксилит | 45,000 | |
| Раствор D-сорбита | 10,000 | |
| Глицерин | 10,000 | |
| Каррагенин | 1,500 | |
| Лимонная кислота | 0,250 | |
| Бензоат натрия | 0,100 | |
| В | Дистиллированная вода | 10,000 |
| Twin 80 | 0,100 | |
| Ибупрофен | 2,000 | |
| Yellow No, 5 | 0,075 | |
| Апельсиновая эссенция | 0,100 | |
| Дистиллированная вода | Заранее заданное количество |
ПРИМЕР 4: Получение ибупрофеновой пероральной тиксотропной композиции с использованием геллановой камеди и каррагенина (100 мл)
После растворения 0,08 г метилпарабена и 0,02 г бутилпарабена в 40 г горячей дистиллированной воды (при температуре около 80°С) полученный раствор охладили при комнатной температуре. К раствору добавили 15 г раствора D-сорбита и 15 г глицерина, перемешали и смешали между собой. К смеси добавили 0,26 г каррагенина и 1,0 г геллановой камеди, в то же время постоянно перемешивая полученный раствор для проведения гидратации, и добавили 0,144 г безводной лимонной кислоты и 0,137 г дигидрата цитрата натрия для проведения солюбилизации (А). После этого 0,1 г неионогенного поверхностно-активного вещества Poloxamer отдельно добавили к 10 г дистиллированной воды для растворения такового, к раствору добавили 2 г ибупрофена и проводили перемешивание и суспендирование (В). После этого компонент А добавили к компоненту В, перемешали и смешали между собой, к смеси последовательно добавили 0,14 г сукралозы, 0,01 г красителя Red №40 и 0,3 г клубничной вкусо-ароматической добавки и смешали между собой, и к смеси добавили дистиллированную воду так, что общий объем полученного раствора составил 100 мл.
| Таблица 4 | ||
| Часть | Ингредиент | Количество (г) |
| A | Дистиллированная вода | 40,000 |
| Раствор D-сорбита | 15,000 | |
| Глицерин | 15,000 | |
| Каррагенин | 0,260 | |
| Геллановая камедь | 1,000 | |
| Безводная лимонная кислота | 0,144 | |
| Дигидрат цитрата натрия | 0,137 | |
| Метилпарабен | 0,080 | |
| Бутилпарабен | 0,020 | |
| В | Дистиллированная вода | 10,000 |
| Poloxamer | 0,100 | |
| Ибупрофен | 2,000 | |
| Сукралоза | 0,140 | |
| Red No, 40 | 0,010 | |
| Клубничная вкусо-ароматическая добавка | 0,300 | |
| Дистиллированная вода | Заранее заданное количество |
ПРИМЕР 5: Получение ибупрофеновой пероральной тиксотропной композиции с использованием ксантановой камеди, геллановой камеди и каррагенина (100 мл)
После растворения 0,08 г метилпарабена и 0,02 г бутилпарабена в 40 г горячей дистиллированной воды (при температуре около 80°С) полученный раствор охладили при комнатной температуре. К раствору добавили 10 г раствора D-сорбита и 10 г глицерина, перемешали и смешали между собой. К смеси добавили 0,26 г каррагенина, 0,6 г геллановой камеди и 0,15 г ксантановой камеди, в то же время постоянно перемешивая полученный раствор для проведения гидратации, и добавили 0,144 г безводной лимонной кислоты и 0,137 г дигидрата цитрата натрия для проведения солюбилизации (А). После этого 0,1 г неионогенного поверхностно-активного вещества Poloxamer отдельно добавили к 10 г дистиллированной воды для растворения такового, к раствору добавили 2 г ибупрофена и проводили перемешивание и суспендирование (В). После этого компонент А добавили к компоненту В, перемешали и смешали между собой, к смеси последовательно добавили 0,14 г сукралозы, 0,01 г красителя Red №40 и 0,3 г клубничной вкусо-ароматической добавки и смешали между собой, и к смеси добавили дистиллированную воду так, что общий объем полученного раствора составил 100 мл.
| Таблица 5 | ||
| Часть | Ингредиент | Количество (г) |
| A | Дистиллированная вода | 40,000 |
| Раствор D-сорбита | 10,000 | |
| Глицерин | 10,000 | |
| Каррагенин | 0,260 | |
| Геллановая камедь | 0,600 | |
| Ксантановая камедь | 0,150 | |
| Безводная лимонная кислота | 0,144 | |
| Дигидрат цитрата натрия | 0,137 | |
| Метилпарабен | 0,080 | |
| Бутилпарабен | 0,020 | |
| В | Дистиллированная вода | 10,000 |
| Poloxamer | 0,100 | |
| Ибупрофен | 2,000 | |
| Сукралоза | 0,140 | |
| Red No, 40 | 0,010 | |
| Клубничная вкусо-ароматическая добавка | 0,300 | |
| Дистиллированная вода | Заранее заданное количество |
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 1: Первая оценка внешней механической нагрузки - устойчивости (оценка вибрации ложки; вибрационное испытание)
Оценивали устойчивости составов из Примеров 1-5 и препарата ElixSure™, который представлял собой коммерческую полутвердую лекарственную форму, в отношении внешней механической нагрузки. Это было выполнено с использованием встряхивателя Vortex Genie 2, изготовленного фирмой Scientific Industries, Co. 2 г каждого препарата поместили в ложку, имеющую продольный диаметр 35 мм и поперечный диаметр 25 мм с длиной лопатки 150 мм, и противоположную сторону ложки зафиксировали на вращающейся плите устройства. Ложку подвергали вращению и вибрации со слабой интенсивностью (Vortex 3) и с высокой интенсивностью (Vortex 10), и для проведения оценки измеряли время, когда состав выливался из ложки. Результаты описаны в нижеследующей Таблице 6.
| Таблица 6 | ||
| Vortex 3 (секунд) | Vortex 10 (секунд) | |
| Пример 1 | >120 | >60 |
| Пример 2 | >120 | >60 |
| Пример 3 | >100 | >50 |
| Пример 4 | >110 | >55 |
| Пример 5 | >120 | >60 |
| ElixSure | >60 | >40 |
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 2: Вторая оценка внешней механической нагрузки - устойчивости (испытание на переворачивание ложки)
Чтобы выполнить еще одну оценку устойчивостей составов из Примеров 1-5 и препарата ElixSure™, который представлял собой коммерческий препарат, в отношении внешней механической нагрузки, провели испытание на переворачивание ложки. После того, как каждый препарат был помещен в ложку, которая имела длину 90 мм, продольный диаметр 35 мм и поперечный диаметр 28 мм, и поверхность препарата стала гладкой, ложку переворачивали, и для выполнения оценки измеряли время, в течение которого препарат выпадал из ложки. Результаты описаны в нижеследующей Таблице 7.
| Таблица 7 | |
| Продолжительность переворачивания (секунд) | |
| Пример 1 | >120 |
| Пример 2 | >120 |
| Пример 3 | >110 |
| Пример 4 | >120 |
| Пример 5 | >120 |
| ElixSure | >30 |
Из Экспериментальных Примеров 1 и 2 можно видеть, что композиция согласно настоящему изобретению имела высокую начальную вязкость, и тем самым дозирование и введение выполнялись без труда.
ЭКСПЕРИМЕНТАЛЬНЫЙ ПРИМЕР 3: Первая оценка тиксотропных свойств (Измерение изменения вязкости в отношении внешней механической нагрузки)
Оценивали тиксотропные характеристики препаратов из Примеров 1-5 и средства ElixSure™, которое представляло собой коммерческий препарат. Это было выполнено с использованием реометра Rheometer RS100, изготовленного фирмой Hakke, Co., Ltd. (температура 25°С, метод РР35 в геометрии «плита/плита», и скорость сдвига 30 об/мин). Измеряли вязкость образца, который был оставлен на 1 день после приготовления (вязкость 1, начальная вязкость). Также после того, как тот же образец был помещен в градуированный цилиндр емкостью 100 мл и подвергнут 100-кратному обстукиванию с использованием виброударного устройства, измеряли вязкость образца (вязкость 2, равновесная вязкость). Результаты описаны в нижеследующей Таблице 8.
| Таблица 8 | ||
| Вязкость 1 (начальная вязкость, сПз) | Вязкость 2 (равновесная вязкость, сПз) | |
| Пример 1 | >7,000 | <4,000 |
| Пример 2 | >7,500 | <4,000 |
| Пример 3 | >7,000 | <4,000 |
| Пример 4 | >8,000 | <4,000 |
| Пример 5 | >8,500 | <4,000 |
| ElixSure | >6,000 | >5,000 |
Из Экспериментального Примера 3 можно видеть, что в случае композиции согласно настоящему изобретению разность между начальной вязкостью и равновесной вязкостью составляла 3000 сПз или более.
Экспериментальный Пример 4: Вторая оценка тиксотропных характеристик (Измерение изменения текучести в отношении внешней механической нагрузки)
Оценивали тиксотропные свойства препаратов из Примеров 1-5 и средства ElixSure™, которое представляло собой коммерческий препарат. Это было выполнено путем измерения времени, которое тре