Производные оксадиазола и их применение в качестве потенцирующих средств метаботропных глутаматных рецепторов-842
Иллюстрации
Показать всеИзобретение описывает соединение, представляющее собой 7-метил-5-(3-пиперазин-1-илметил-[1,2,4]оксадиазол-5-ил)-2-(4-трифторметоксибензил)-2,3-дигидроизоиндол-1-он, или его фармацевтически приемлемую соль, фармацевтическую композицию, обладающую потенцирующей активностью в отношении глутаматных рецепторов, содержащую описанное выше соединение, а кроме того, описывается применение соединения или фармацевтически приемлемой соли по п.1 в изготовлении лекарственного средства для терапии неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией. Технический результат: получено и описано новое соединение, которое может быть полезно в терапии неврологических и психиатрических расстройств. 3 н. и 2 з.п. ф-лы, 4 пр.
Реферат
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к новым соединениям, которые функционируют в качестве потенцирующих средств в отношении глутаматных рецепторов, способам их получения, содержащим их фармацевтическим композициям и их применению в терапии.
Метаботропные глутаматные рецепторы (mGluR) составляют семейство рецепторов, сопряженных с GTP-связывающим белком (G-белок), которые активируются глутаматом и играют важную роль в синаптической активности в центральной нервной системе, включая пластичность нервной системы, развитие нервной системы и нейродегенерацию.
Активация mGluR в интактных нейронах млекопитающих вызывает одну или более следующих реакций: активацию фосфолипазы С; увеличение гидролиза фосфоинозитидов (PI); внутриклеточное высвобождение кальция; активацию фосфолипазы D; активацию или ингибирование аденилциклазы; увеличение или уменьшение образования циклического аденозинмонофосфата (сАМР); активацию гуанилилциклазы; увеличение образования циклического гуанозинмонофосфата (cGMP); активацию фосфолипазы А2; увеличение высвобождения арахидоновой кислоты и увеличение или уменьшение активности потенциал- и лигандзависимых ионных каналов (Schoepp et аl., 1993, Trends Pharmacol. Sci., 14:13; Schoepp, 1994, Neurochem. Int., 24:439; Pin et al., 1995, Neuropharmacology 34:1; Bordi & Ugolini, 1999, Prog. Neurobiol. 59:55).
Идентифицировано восемь подтипов mGluR, которые подразделяют на три группы на основании сходства первичных последовательностей, связей при проведении сигнала и фармакологического профиля. Группа-I включает mGluR1 и mGluR5, которые активируют фосфолипазу С и генерацию внутриклеточного кальциевого сигнала. Группа-II (mGluR2 и mGluR3) и Группа-III (mGluR4, mGluR6, mGluR7 и mGluR8) mGluR опосредуют ингибирование активности аденилилциклазы и уровней циклического AMP. Обзор см. Pin et аl., 1999, Eur. J. Pharmacol., 375:277-294.
Активность семейства рецепторов mGluR вовлечена во многие нормальные процессы в ЦНС млекопитающих и является важной мишенью для соединений, используемых для лечения различных неврологических и психиатрических расстройств. Активация mGluR требуется для индукции длительной потенциации в гиппокампе и длительной депрессии в мозжечке (Bashir et al., 1993, Nature, 363:347; Bortolotto et al., 1994, Nature, 368:740; Aiba et al., 1994, Cell, 79:365; Aiba et al., 1994, Cell, 79:377). Также была продемонстрирована роль активации mGluR в ноцицепции и аналгезии (Meller et al., 1993, Neuroreport, 4: 879; Bordi & Ugolini, 1999, Brain Res., 871:223). Кроме того, предположили, что активация mGluR играет модулирующую роль во многих других нормальных процессах, включающих синаптическую передачу, развитие нейронов, апоптотическую смерть нейронов, синаптическую пластичность, пространственное обучение, обонятельную память, центральный контроль сердечной активности, бодрствование, регуляцию моторики и регуляцию вестибулоокулярного рефлекса (Nakanishi, 1994, Neuron, 13:1031; Pin et al., 1995, Neuropharmacology, supra; Knopfel et al., 1995, J. Med. Chem., 38:1417).
Недавние достижения в выяснении нейрофизиологической роли mGluR определили эти рецепторы в качестве перспективных мишеней для лекарственных средств в терапии острых и хронических неврологических и психиатрических расстройств и хронических и острых болевых расстройств. В связи с физиологическим и патофизиологическим значением mGluR существует необходимость в новых лекарственных средствах и соединениях, которые могут модулировать функцию mGluR.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения идентифицировали класс соединений, которые модулируют функцию mGluR. В одном аспекте в изобретении предложены соединения формулы I, или их фармацевтически приемлемая соль, гидрат, сольват, оптический изомер или их комбинация:
где:
R1 представляет собой галогено или C1-3галогеноалкоксил;
Q представляет собой или , и
R2 представляет собой водород или C1-3алкил, или фармацевтически приемлемая соль, гидрат, сольват, оптический изомер или их комбинация.
В изобретении также предложены способы получения соединений формулы I.
Кроме того, в изобретении предложена фармацевтическая композиция, содержащая соединение формулы I вместе с фармацевтически приемлемым носителем или эксципиентом; в другом аспекте в изобретении предложен способ лечения или предупреждения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией у животного, нуждающегося в таком лечении. Способ включает стадию введения животному терапевтически эффективного количества соединения формулы I или фармацевтической композиции, содержащей такое количество.
В изобретении также предложено применение соединения формулы I или его фармацевтически приемлемой соли или сольвата в изготовлении лекарственного средства для лечения состояний, упомянутых в данной заявке.
Кроме того, в изобретении предложено соединение формулы I или его фармацевтически приемлемая соль или сольват для применения в терапии.
Соединения, описанные в данной заявке, демонстрируют активность в качестве модуляторов метаботропных глутаматных рецепторов и, более конкретно, демонстрируют активность в качестве потенциирующих средств в отношении рецептора mGluR2. Предполагается, что соединения будут полезны в терапии в качестве лекарственных средств, в частности, для лечения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией.
Определения
Если не указано иное в описании изобретения, то номенклатура, используемая в этом описании, обычно следует примерам и правилам, принятым в Nomenclature of Organic Chemistry, Sections А, В, C, D, E, F and H, Pergamon Press, Oxford, 1979, которая включена в данную заявку посредством ссылок на названия их типичных химических структур, и правила присвоения названий химическим структурам. Возможно, название соединения может быть образовано с использованием программы присвоения названий химическим соединениям: ACD/ChemSketch, Version 5.09/September 2001, Advanced Chemistry Development, Inc., Toronto, Canada.
Термин "C1-3алкил", как использовано в данной заявке, означает неразветвленный, разветвленный или циклический углеводородный радикал, имеющий от одного до трех атомов углерода, и включает метил, этил, пропил, изопропил и циклопропил.
Термин "C1-3галогеноалкоксил", как использовано в данной заявке, означает радикал алкокси с прямой или разветвленной цепью, имеющий от одного до трех атомов углерода и по меньшей мере один галогено-заместитель, и включает фторметоксил, трифторметоксил, фторэтоксил, трифторпропилоксил, фторизопропилокси и тому подобное.
Термин "галогено", как использовано в данной заявке, означает галоген и включает фторо, хлоро, бромо, йодо, как в радиоактивной, так и нерадиоактивной формах.
Символ Δ при использовании в данной заявке означает нагревание или применение тепла.
Термин "фармацевтически приемлемая соль" означает либо соль присоединения кислоты, либо соль присоединения основания, которая совместима с введением пациентам.
"Фармацевтически приемлемая соль присоединения кислоты" представляет собой любую нетоксичную соль присоединения органической или неорганической кислоты соединения формулы I. Типичные неорганические кислоты, которые образуют подходящие соли, включают соляную, бромистоводородную, серную и фосфорную кислоты, и кислые соли металлов, такие как моногидроортофосфат натрия и гидросульфат калия. Типичные органические кислоты, которые образуют подходящие соли, включают моно-, ди- и трикарбоновые кислоты. Примером таких кислот являются, например, уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, гидроксималеиновая, бензойная, гидроксибензойная, фенилуксусная, коричная, салициловая, 2-феноксибензойная, пара-толуолсульфоновая кислота и другие сульфоновые кислоты, такие как метансульфоновая и 2-гидроксиэтансульфоновая кислота. Если возможно с химической точки зрения, то могут быть образованы моно- или двукислые соли, и такие соли могут существовать либо в гидратированной, сольватированной, либо по существу безводной форме. В целом, соли присоединения кислот этих соединений более растворимы в воде и различных гидрофильных органических растворителях и в целом демонстрируют более высокие температуры плавления по сравнению с их формами в виде свободных оснований. Другие фармацевтически неприемлемые соли, например оксалаты, могут быть использованы, например, для выделения соединений формулы I для лабораторного применения или для последующего превращения в фармацевтически приемлемые соли присоединения кислот.
"Сольват" означает соединение формулы I или фармацевтически приемлемую соль соединения формулы I, в которой молекулы подходящего растворителя включены в кристаллическую решетку. Подходящий растворитель является физиологически приемлемым в дозе, вводимой в качестве сольвата. Примерами подходящих растворителей являются этанол, вода и тому подобное. Когда вода является растворителем, тогда молекула называется гидратом.
Термин "стереоизомеры" является общим термином для всех изомеров индивидуальных молекул, которые отличаются только ориентацией их атомов в пространстве. Он включает зеркальные изомеры (энантиомеры), геометрические (цис/транс) изомеры и изомеры соединений с более чем одним хиральным центром, которые не являются зеркальными изображениями друг друга (диастереомеры).
Термин "лечить" или "лечение" означает облегчение симптомов, устранение причины симптомов на временной или постоянной основе, или предупреждение или замедление возникновения симптомов указанного расстройства или состояния.
Термин "терапевтически эффективное количество" означает количество соединения, которое является эффективным при лечении указанного расстройства или состояния.
Термин "фармацевтически приемлемый носитель" означает нетоксичный растворитель, диспергирующий агент, эксципиент, адъювант или другое вещество, которое смешивают с активным ингредиентом с целью обеспечения образования фармацевтической композиции, то есть лекарственной формы, подходящей для введения пациенту. Одним из примеров такого носителя является фармацевтически приемлемое масло, обычно используемое для парентерального введения.
Соединения
Описанные соединения в целом соответствуют формуле I:
где:
R1 представляет собой галогено или С1-3галогеноалкоксил;
Q представляет собой или , и
R2 представляет собой водород или С1-3алкил, или их фармацевтически приемлемой соли, гидрату, сольвату, оптическому изомеру или их комбинации.
В конкретном воплощении R1 представляет собой хлоро или трифторметоксил.
В другом воплощении R1 представляет собой трифторметоксил.
В еще одном воплощении Q представляет собой .
В еще одном воплощении Q представляет собой , где R2 представляет собой Н.
В еще одном воплощении R1 представляет хлоро или трифторметоксил, Q представляет собой .
В еще одном воплощении R1 представляет собой трифторметоксил, и Q представляет собой .
В еще одном воплощении R1 представляет собой хлоро или трифторметоксил, и Q представляет собой , где R2 представляет собой Н.
В еще одном воплощении R1 представляет собой хлоро или трифторметоксил, и Q представляет собой .
Считают, что фармацевтически приемлемая соль, гидрат, сольват, оптический изомер или их комбинация для каждого из упомянутых воплощений входит в объем изобретения.
Специалистам в данной области техники будет понятно, что, когда соединения по настоящему изобретению содержат один или более хиральных центров, тогда соединения по изобретению могут существовать, и могут быть выделены, в виде энантиомерных или диастереомерных форм, или в виде рацемической смеси. Настоящее изобретение включает любые возможные энантиомеры, диастереомеры, рацематы или их смеси соединения формулы I. Оптически активные формы соединения по изобретению могут быть получены, например, посредством хирального хромотографического разделения рацемата, посредством синтеза из оптически активных исходных веществ или посредством асимметрического синтеза на основе способов, описанных ниже.
Специалистам в данной области техники также будет понятно, что некоторые соединения по настоящему изобретению могут существовать в сольватированной, например гидратированной, а также несольватированной формах. Также будет понятно, что настоящее изобретение охватывает все такие сольватированные формы соединений формулы I.
В объем изобретения также входят соли соединений формулы I. Обычно фармацевтически приемлемые соли соединений по настоящему изобретению получают с использованием стандартных способов, хорошо известных в данной области техники.
В одном воплощении настоящего изобретения соединение формулы I может быть превращено в его фармацевтически приемлемую соль или сольват, в частности, в соль присоединения кислоты, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат или пара-толуолсульфонат.
Способ получения
Соединения формулы I могут быть получены различными способами синтеза, как показано в данной заявке. Поэтому выбор конкретных структурных признаков и/или заместителей может влиять на выбор одного способа относительно другого.
В рамках этих общих принципов способы, описанные в данной заявке, могут быть использованы для получения типичных подгрупп соединений по данному изобретению. Если не указано иное, то переменные в описанных схемах и способах имеют такие же определения, как и в приведенной выше формуле I.
Таким образом, среднему специалисту в данной области техники будет понятно, что изменения и дополнения, примененные к одному или более способам, раскрытым в данной заявке, позволят синтезировать и другие соединения формулы I.
Изобретение дополнительно проиллюстрировано следующими примерами, в которых описаны некоторые воплощения изобретения. Схема синтеза и процедуры синтеза, предложенные для Примеров 1, 2 и 4, приведены для иллюстрации и не должны истолковываться как ограничивающие изобретение. Специалистам в данной области техники будет понятно, что другие проиллюстрированные соединения могут быть получены способами, аналогичными описанным.
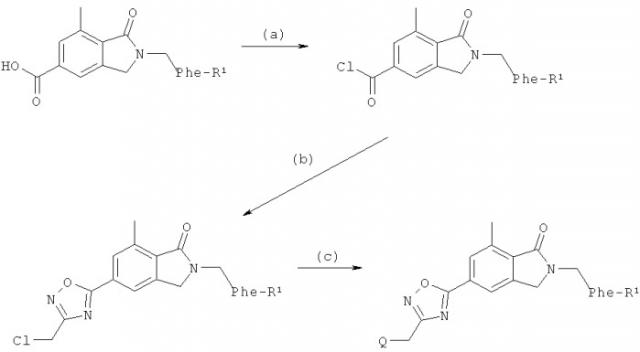
Схемы синтеза:
Реагенты и условия, используемые в типичной процедуре: (a) SOCl2, Δ; (б) 2-хлор-N-гидроксиацетамидин, К2СО3, MeCN, затем DMF, Δ; (в) QH, K2СO3, MeCN, Δ.
(а) В типичной процедуре 100 ммоль 7-метил-1-оксо-2-(замещенный-бензил)-2,3-дигидро-1Н-изоиндол-5-карбоновой кислоты растворяли в избытке тионилхлорида и нагревали при температуре флегмообразования в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и концентрировали с получением 7-метил-1-оксо-2-(замещенный-бензил)-2,3-дигидро-1Н-изоиндол-5-карбонилхлорида.
(б) К раствору 7-метил-1-оксо-2-(замещенный-бензил)-2,3-дигидро-1Н-изоиндол-5-карбонилхлорида (100 ммоль) в MeCN (50 мл) добавляли 2-хлор-N-гидроксиацетамидин (110 ммоль) и K2СО3 (200 ммоль). Смесь перемешивали в течение ночи, затем разбавляли водой и экстрагировали ЕtOАс. Органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. Остаток растворяли в DMF (50 мл) и нагревали при температуре флегмообразования в течение 3,5 ч. Охлажденный раствор разбавляли водой и экстрагировали ЕtOАс. Органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. В результате колоночной хроматографии на силикагеле (10-35% ЕtOАс/гексаны) получили 2-замещенный-бензил-5-(3-хлорметил-[1,2,4]оксадиазол-5-ил)-7-метил-2,3-изоиндол-дигидро-1-он.
(в) К раствору 2-(замещенный-бензил)-5-(3-хлорметил-[1,2,4]оксадиазол-5-ил)-7-метил-2,3-изоиндол-дигидро-1-она (100 ммоль) в MeCN добавляли K2СO3 (200-300 ммоль) и подходящий амин (QH, 150-200 ммоль). Смесь нагревали с получением желаемого изоиндола, который очищали колоночной хроматографией на силикагеле (1-5% 2 М NH3 в MeOH/CH2Cl2).
Пример 1: 7-Метил-5-(3-пиперазин-1-илметил-[1,2,4]оксадиазол-5-ил)-2-(4-трифторметоксибензил)-2,3-дигидроизоиндол-1-он
К раствору 5-(3-хлорметил-[1,2,4,]-оксадиазол-5-ил)-7-метил-2-(4-трифторметоксибензил)-2,3-дигидроизоиндол-1-она (3,25 г, 7,43 ммоль) в MeCN (50 мл) добавляли пиперазин-1-карбоновой кислоты трет-бутиловый эфир (2,77 г, 14,9 ммоль) и K2СО3 (2,57 г, 18,6 ммоль). Смесь нагревали до 40°С в течение 24 ч, затем охлаждали до комнатной температуры и разбавляли водой. Смесь экстрагировали ЕtOАс и органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. Остаток растирали с гексанами и фильтровали. В результате колоночной хроматографии на силикагеле (40-80% ЕtOАс/гексаны) с последующим растиранием с 1% MeOH//Et2O получили Вос-защищенное промежуточное соединение (4,78 г) в виде бесцветного твердого вещества.
Вос-защищенное промежуточное соединение растворяли в CH2Cl2 (15 мл) и добавляли 1:1 TFA/CH2Cl2 (40 мл). Через 45 мин реакционную смесь концентрировали и подщелачивали водной NaHCO3 до pH примерно 9-10. Продукт экстрагировали CH2Cl2. Органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. В результате колоночной хроматографии на силикагеле (1-5% 2 М NH3 в МеОН/СН2Сl2) получили 7-метил-5-(5-пиперазин-1-илметил-[1,2,4,]оксадиазол-3-ил)-2-(4-трифторметоксибензил)-2,3-дигидроизоиндол-1-он (3,79 г) в виде бесцветной пены. 1Н ЯМР (300 МГц, CDCl3) δ 8.05 (s, 1Н), 8.00 (s, 1Н), 7.36 (d, 2Н), 7.20 (d, 2Н), 4.81 (s, 2Н), 4.33 (s, 2Н), 3.77 (s, 2Н), 2.94-3.05 (m, 4Н), 2.84 (s, 3Н), 2.61 (brs, 4H).
Пример 2: 2-(4-Хлорбензил)-5-[3-(2,5-диазабицикло[2.2.1]гепт-2-илметил)-[1,2,4]оксадиазол-5-ил]-7-метил-2,3-дигидроизоиндол-1-он
К раствору 2-(4-хлорбензил)-5-(3-хлорметил-[1,2,4]оксадиазол-5-ил)-7-метил-2,3-дигидроизоиндол-1-она (40 мг, 0,103 ммоль) в MeCN (4 мл) добавляли K2СO3 (0,309 ммоль) и (1s,4s)-2,5-диазабицикло[2.2.1]гептан-2-карбоновой кислоты тpeт-бутиловый эфир (31 мг, 0,154 ммоль). Смесь нагревали при 60°С в течение ночи. Реакционную смесь охлаждали и разбавляли водой, затем экстрагировали ЕtOАс. Органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. В результате колоночной хроматографии на силикагеле (1% 2 М NH3 в MeOH/CH2Cl2) получили 2-(4-хлорбензил)-5-[3-(2,5-диазабицикло[2.2.1]гепт-2-илметил)-[1,2,4]оксадиазол-5-ил]-7-метил-2,3-дигидроизоиндол-1-он в виде коричневого твердого вещества (27 мг). 1Н ЯМР (300 МГц, CDCl3) δ 8.04 (s, 1Н), 7.99 (s, 1Н), 7.37 (d, 2Н), 7.26 (d, 2Н), 4.77 (s, 2Н), 4.30 (s, 2Н), 3.94 (dd, 2Н), 3.58 (d, 2Н), 3.26 (d, 1Н), 3.11 (d, 1Н), 2.89 (d, 1Н), 2.84 (s, 3Н), 2.63 (d, 1Н), 1.88 (d, 1Н), 1.66 (d, 1Н).
Пример 4: 2-(4-Хлорбензил)-7-метил-5-(3-пиперазин-1-илметил-[1,2,4]оксадиазол-5-ил)-2,3-дигидроизоиндол-1-он
К раствору 2-(4-хлорбензил)-5-(3-хлорметил-[1,2,4]оксадиазол-5-ил)-7-метил-2,3-дигидроизоиндол-1-она (40 мг, 0,103 ммоль) в MeCN (4 мл) добавляли К2СО3 (3,0 экв.) и пиперазин-1-карбоновой кислоты трет-бутиловый эфир (29 мг, 0,154 ммоль). Смесь инкубировали при 70°С в течение 1 недели. Реакционную смесь охлаждали и разбавляли водой, затем экстрагировали ЕtOАс. Органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. В результате колоночной хроматографии на силикагеле (10-50% ЕtOАс/гексаны) получили Вос-защищенное промежуточное соединение в виде масла. Этот остаток растворяли в 1:1 TFA/CH2Cl2 в течение 30 мин, затем реакционную смесь концентрировали и подщелачивали водным NаНСО3 до pH примерно 9-10. Продукт экстрагировали CH2Cl2. Органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали. Остаток растворяли в ЕtOАс и экстрагировали 1 М HCl. Водные фазы подщелачивали 6 М NaOH и экстрагировали CH2Cl2. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали с получением 2-(4-хлорбензил)-7-метил-5-(3-пиперазин-1-илметил-[1,2,4]оксадиазол-5-ил)-2,3-дигидроизоиндол-1-она в виде бесцветного масла (29 мг). 1Н ЯМР (300 МГц, CDCl3) δ 8.05 (s, 1Н), 7.99 (s, 1Н), 7.34 (d, 2Н), 7.26 (d, 2Н), 4.77 (s, 2Н), 4.31 (s, 2Н), 3.77 (s, 2Н), 2.97 (br s, 4Н), 2.84 (s, 3Н), 2.62 (br s, 4Н).
Соединения, представленные в следующей таблице, иллюстрируют данное изобретение:
| № пр. | Структура | Название | 1Н ЯМР |
| 1 | 7-Метил-5-(3-пиперазин-1-илметил-[1,2,4]оксадиазол-5-ил)-2-(4-трифтор-метоксибензил)-2,3-дигидроизоиндол-1-он | δ 8.05 (s, 1Н), 8.00 (s, 1Н), 7.36 (d, 2H), 7.20 (d, 2Н), 4.81 (s, 2Н), 4.33 (s, 2Н), 3.77 (s, 2H), 2.94-3.05 (m, 4H), 2.84 (s, 3Н), 2.61 (br s, 4H). | |
| 2 | 2-(4-Хлорбензил)-5-[3-(2,5-диазабицикло[2.2.1]гепт-2-илметил-[1,2,4]оксадиазол-5-ил]-7-метил-2,3-дигидроизоиндол-1-он | δ 8.04 (s, 1H), 7.99 (s, 1H), 7.26-7.35 (m, 4H), 4.83 (s, 2H), 4.00 (s, 2H), 3.94 (dd, 2H), 3.58 (d, 2H), 3.18 (d, 1H), 3.11 (dd, 1H), 2.89 (d, 1H), 2.78 (s, 3H), 2.64 (d, 1H), 1.64-1.92 (m, 6H). | |
| 3 | 2-(4-Хлорбензил)-7-метил-5-[3-(3-метилпиперазин-1-илметил-[1,2,4]оксадиазол-5-ил]-2,3-дигидроизоиндол-1-он | δ 8.04 (s, 1H), 7.99 (s, 1H), 7.25-7.35 (m, 4H), 4.77 (s, 2H), 4.30 (s, 2H), 3.72 (s, 3H), 2.84-3.01 (m, 5H), 2.84 (s, 3H), 2.25 (ddd, 1H), 1.89 (t, 1H), 1.26 (dd, 1H), 1.04 (d, 3H). | |
| 4 | 2-(4-Хлорбензил)-7-метил-5-(3-пиперазин-1-илметил-[1,2,4]оксадиазол-5-ил)-2,3-дигидро-изоиндол-1-он | δ 8.05 (s, 1H), 7.99 (s, 1H), 7.26-7.35 (m, 4H), 4.77 (s, 2H), 4.31 (s, 2H), 3.77 (s, 2H), 2.97 (br s, 4H), 2.84 (s, 3H), 2.62 (br s, 4H). | |
| 5 | 2-(4-Хлорбензил)-7-метил-5-[3-(2-метилпиперазин-1-илметил-[1,2,4]оксадиазол-5-ил]-2,3-дигидроизоиндол-1-он | δ 8.02 (s, 1Н), 7.97 (s, 1Н), 7.26-7.35 (m, 4Н), 4.81 (s, 2Н), 4.31 (s, 2Н), 3.98 (d, 2Н), 2.85-2.96 (m, 4Н), 2.85 (s, 3Н), 2.51-2.64 (m, 3Н), 1.22 (d, 3Н). | |
| 6 | 2-(4-Хлорбензил)-7-метил-5-[3-(2-метилпиперазин-1-илметил-[1,2,4]оксадиазол-5-ил]-2,3-дигидро-изоиндол-1-он | δ 8.02 (s, 1Н), 7.97 (s, 1Н), 7.26-7.35 (m, 4Н), 4.81 (s, 2Н), 4.31 (s, 2Н), 3.98 (d, 2Н), 2.85-2.96 (m, 4Н), 2.85 (s, 3Н), 2.51-2.64 (m, 3Н), 1.22 (d, 3Н). |
Фармацевтические композиции
Соединения, описанные в данной заявке, могут быть приготовлены, как правило, в виде фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль или сольват вместе с фармацевтически приемлемым носителем или эксципиентом. Фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в твердой форме включают, но не ограничиваются этим, порошки, таблетки, диспергируемые гранулы, капсулы, облатки и суппозитории.
Твердый носитель может представлять собой одно или более веществ, которые также могут действовать в качестве растворителей, ароматизаторов, солюбилизаторов, смазывающих агентов, суспендирующих агентов, связующих агентов или разрыхлителей. Твердый носитель также может представлять собой инкапсулирующий материал.
В порошках носитель представляет собой тонкодисперсное твердое вещество, которое находится в смеси с тонкодисперсным соединением активного компонента. В таблетках активный компонент смешивают с носителем, обладающим необходимыми связывающими свойствами в соответствующих пропорциях, и прессуют в желаемую форму и размер.
Для приготовления суппозиторных композиций легкоплавкий воск, такой как смесь глицеридов жирных кислот и масло какао, сначала расплавляют, и активный ингредиент распределяют в нем, например, путем перемешивания. Расплавленную однородную массу затем вливают в формы подходящего размера и оставляют охлаждаться и затвердевать.
Подходящие носители включают, но не ограничиваются этим, карбонат магния, стеарат магния, тальк, лактоза, сахар, пектин, декстрин, крахмал, трагакант, метилцеллюлозу, натрий-карбоксиметилцеллюлозу, легкоплавкий воск, масло какао и тому подобное.
Термин "композиция" также предназначен для включения препарата активного компонента с инкапсулирующим материалом в качестве носителя, образующего капсулу, в которой активный компонент (с другим носителем или без него) окружен носителем, который таким образом находится в ассоциации с ним. Аналогичным образом включены облатки.
Таблетки, порошки, облатки и капсулы могут быть изготовлены в виде твердых лекарственных форм, пригодных для перорального введения.
Композиции в жидкой форме включают растворы, суспензии и эмульсии. Например, растворы активных соединений в стерильной воде или водном пропиленгликоле могут представлять собой жидкие препараты, пригодные для парентерального введения. Жидкие композиции также могут быть приготовлены в растворе в водном растворе полиэтиленгликоля.
Водные растворы для перорального введения могут быть получены путем растворения активного компонента в воде и добавления подходящих красителей, ароматизаторов, стабилизаторов и загустителей, при желании. Водные суспензии для перорального введения могут быть изготовлены путем диспергирования тонкодисперсного активного компонента в воде вместе с вязким веществом, таким как природные синтетические камеди, смолы, метилцеллюлоза, натрий-карбоксиметилцеллюлоза и другие суспендирующие агенты, известные в области приготовления фармацевтических препаратов. Типичные композиции, предназначенные для перорального применения, могут содержать один или более красителей, подсластителей, ароматизаторов и/или консервантов.
В зависимости от способа введения, фармацевтическая композиция будет включать от примерно 0,05 мас.% (процент по массе) до примерно 99 мас.%, более конкретно от примерно 0,10 мас.% до 50 мас.% соединения по изобретению, причем все проценты по массе основаны на общей массе композиции.
Терапевтически эффективное количество для осуществления настоящего изобретения может быть определено средним специалистом в данной области техники с использованием известных критериев, включающих возраст, массу и реакцию конкретного пациента, и интерпретируется в зависимости от заболевания, которое лечат или которое предупреждают.
Медицинское применение
Соединения, описанные в данной заявке, демонстрируют активность в качестве модуляторов метаботропных глутаматных рецепторов и, более конкретно, демонстрируют активность в качестве потенциирующих средств в отношении mGluR2 рецептора. Предполагается, что соединения будут полезны в терапии в качестве лекарственных средств, в частности, для лечения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией у животного и особенно у человека.
Более конкретно, неврологические и психические расстройства включают, но не ограничиваются этим, такие расстройства, как церебральная недостаточность после операции шунтирования на сердце и трансплантации, инсульт, церебральную ишемию, травму спинного мозга, травму головы, перинатальную гипоксию, остановку сердца, гипогликемическое повреждение нейронов, деменцию (включая СПИД-индуцированную деменцию), болезнь Альцгеймера, хорею Гентингтона, боковой амиотрофический склероз, повреждение глаз, ретинопатию, когнитивные расстройства, идиопатическую и индуцированную лекарствами болезнь Паркинсона, мышечные спазмы и расстройства, ассоциированные с мышечной спастичностью, включающие треморы, эпилепсию, судороги, церебральные недостаточности, вторичные по отношению к длительному эпилептическому статусу, мигрень (включая мигренозную головную боль), недержание мочи, толерантность к веществам, синдром отмены веществ (включая такие вещества, как опиаты, никотин, табачные изделия, алкоголь, бензодиазепины, кокаин, седативные средства, снотворные средства и т.д.), психоз, шизофрению, тревогу (включая генерализованное тревожное расстройство, паническое расстройство, социофобию, обсессивно-компульсивное расстройство и посттравматическое стрессовое расстройство (PTSD)), расстройства настроения (включая депрессию, манию, биполярные расстройства), расстройства циркадного ритма (включая смену часовых поясов, сменный режим работы), тригеминальную невралгию, потерю слуха, шум в ушах, дегенерацию желтого пятна глаза, рвоту, отек головного мозга, боль (включая острые и хронические болевые состояния, сильную боль, некупируемую боль, невропатическую боль, воспалительную боль и посттравматическую боль), позднюю дискинезию, расстройства сна (включая нарколепсию), расстройство дефицита внимания/гиперактивности и расстройство поведения.
Таким образом, в изобретении предложено применение любого из соединений формулы I или его фармацевтически приемлемой соли или сольвата для изготовления лекарственного средства для лечения любого из состояний, описанных выше.
Кроме того, в изобретении предложен способ лечения субъекта, страдающего от любого из состояний, описанных выше, при котором эффективное количество соединения формулы I или его фармацевтически приемлемой соли или сольвата вводят пациенту, нуждающемуся в таком лечении. В изобретении также предложено соединение формулы I или его фармацевтически приемлемая соль или сольват, как определено в данной заявке выше, для применения в терапии.
Термин "терапия" в контексте настоящего изобретения также включает "профилактику", если не указано иное. Термин "терапевтический" и "терапевтически" следует истолковывать соответственно. Термин "терапия" в контексте настоящего изобретения дополнительно охватывает введение эффективного количества соединения по настоящему изобретению для смягчения либо уже существующего болезненного состояния, острого или хронического, либо для смягчения рецидивирующего состояния. Это определение также охватывает профилактическую терапию для предупреждения рецидивирующих состояний и длительную терапию для хронических расстройств.
В применении для терапии у теплокровного животного, такого как человек, соединения по настоящему изобретению можно вводить в форме стандартной фармацевтической композиции любым путем, включающим пероральный, внутримышечный, подкожный, местный, интраназальный, интраперитонеальный, интраторакальный, внутривенный, эпидуральный, интратекальный, интрацеребровентрикулярный путь, и посредством инъекции в суставы. В предпочтительных воплощениях изобретения путь введения является пероральным, внутривенным или внутримышечным.
Дозировка будет зависеть от способа введения, тяжести заболевания, возраста и массы пациента и других факторов, которые обычно учитываются лечащим врачом, который определяет индивидуальный режим и уровень дозировки для конкретного пациента.
Как уже упоминалось выше, соединения, описанные в данной заявке, могут быть предложены или доставлены в форме, подходящей для перорального применения, например, в таблетке, пастилке, твердой и мягкой капсуле, водном растворе, масляном растворе, эмульсии и суспензии. Альтернативно, соединения могут быть приготовлены для местного введения, например, в виде крема, мази, геля, спрея или водного раствора, масляного раствора, эмульсии или суспензии. Соединения, описанные в данной заявке, также могут быть предложены в форме, которая подходит для интраназального введения, например, в виде назального спрея, капель в нос или сухого порошка. Соединения можно вводить во влагалище или прямую кишку в форме суппозитория. Соединения, описанные в данной заявке, также можно вводить парентерально, например, посредством внутривенной, интравезикулярной, подкожной или внутримышечной инъекции или инфузии. Соединения можно вводить посредством инсуффляции (например, в виде тонкодисперсного порошка). Соединения также можно вводить трансдермально или сублингвально.
В дополнение к их применению в терапевтической медицине, соединения формулы I или их соли являются полезными в качестве фармакологических средств в разработке и стандартизации in vitro и in vivo тест-систем для оценки эффектов ингибиторов mGluR-связанной активности на лабораторных животных как части поиска новых терапевтических агентов. Такие животные включают, например, кошек, собак, кроликов, обезьян, крыс и мышей.
Общие способы
Исходные вещества имеются в продаже или ранее описаны в литературе.
1Н и 13С ЯМР спектры регистрировали либо на Bruker 300, Bruker DPX400, либо на Varian +400 спектрофотометрах, работающих при 300, 400 и 400 МГц для 1Н ЯМР, соответственно, с использованием сигнала TMS (тетраметилсилан) или остаточного растворителя в качестве эталона, в дейтерированном хлороформе в качестве растворителя, если не указано иное. Все полученные химические сдвиги приведены в млн-1 по шкале дельта и с тонким расщеплением сигналов в зарегистрированных спектрах (s: синглет, br s: широкий синглет, d: дублет, t: триплет, q: квартет, m: мультиплет).
Аналитические последовательные разделения посредством жидкостной хроматографии с последующей детекцией масс-спектров регистрировали на Waters LCMS (жидкостной хроматограф с масс-спектрометром), состоящем из Alliance 2795 (LC) и одноквадрупольного масс-спектрометра ZQ. Масс-спектрометр оснащен источником ионизации электрораспылением, работающим в режиме положительных и/или отрицательных ионов. Напряжение распыления ионов составляло ±3 кВ, и масс-спектрометр сканировали в диапазоне m/z 100-700 при времени сканирования 0,8 с. Для колонки X-Terra MS, Waters, C8, 2,1×50 мм, 3,5 мм, использовали линейный градиент от 5% до 100% ацетонитрила в 10 мМ ацетата аммония (водн.) или в 0,1% TFA (водн.).
Препаративную хроматографию с обращенной фазой осуществляли на автоматизированном препаративном высокоэффективном жидкостном хроматографе (HPLC) Gilson с детектором на диодной матрице, используя XTerra MS С8, 19×300 мм, 7 мм, в качестве колонки.
Очистку с помощью Chromatotron осуществляли на вращающихся стеклянных пластинах, покрытых силикагелем/гипсом (Merck, 60 PF-254 с сульфатом кальция), с покрывающим слоем 1, 2 или 4 мм, используя ТС Research 7924Т Chromatotron.
Очистку продуктов также осуществляли с использованием колонок для экстракции Chem Elut (Varian, кат. #1219-8002), колонок Mega BE-SI (Bond Elut Silica) SPE (Varian, кат. # 12256018; 12256026; 12256034) или флэш хроматографии в стеклянных колонках, заполненных силикагелем.
Микроволновое нагревание осуществляли в синтезаторе Smith с одномодовым СВЧ-резонатором, производящим постоянное облучение при 2450 МГц (Personal Chemistry АВ, Uppsala, Sweden).
Фармакологические свойства соединений по изобретению могут быть проанализированы с использованием стандартных анализов функциональной активности. Примеры анализов глутаматных рецепторов хорошо известны в данной области техники, как описано, например, в Aramori et аl., 1992, Neuron, 8:757; Tanabe et al., 1992, Neuron, 8:169; Miller et al., 1995, J. Neuroscience, 15:6103; Balazs, et al., 1997, J. Neurochemistry, 1997, 69:151. Методология, изложенная в этих публикациях, включена в данную заявку посредством ссылки. Обычно соединения по изобретению могут быть исследованы с помощью анализа, в котором измеряют мобилизацию внутриклеточного кальция [Ca2+]i в клетках, экспрессирующих mGluR2.
Активность hERG определяли с использованием способа, описанного в Bridgland-Taylor, М.Н., et al, J. Pharm. Tox. Methods 54 (2006) 189-199.
Растворимость определяли в фосфатном буфере с pH 7,4 после уравновешивания в течение 24 ч при 25°С, и HPLC-UV (HPLC с УФ-детектором) и LC-MSMS (жидкостной хроматограф-масс-спектрометр-масс-спектрометр) использовали для количественного определения.
Анализ связывания [35S]-GTPγS использовали для функционального анализа активации mGluR2 рецептора. Аллостерическую активаторную активность соединений в отношении человеческого mGluR2 рецептора измеряли с использованием анализа связывания [35S]-GTPγS мембранами, полученными из клеток СНО, которые стабильно экспрессируют mGluR2 человека. Анализ основан на принципе, что агонисты связывают G-белок-сопряженные рецепторы для стимуляции GDP-GTP обмена в G-белке. Поскольку [35S]-GTPγS представляет собой негидролизуемый аналог GTP, то он может быть использован в качестве показа