Лиганды для рецепторов, связанных с g-белком
Иллюстрации
Показать всеИзобретение относится к библиотеке для идентификации соединения, способного модулировать передачу сигналов через G-белок сопряженный рецептор, которая включает два или более соединения, которые соответствуют любой из формул (I), (II), (III), (IV) или фармацевтически приемлемые соли указанных соединений, причем указанные соединения имеют разнообразные замещения варьируемыми заместителями. Изобретение также относится к способу получения указанной библиотеки и способу скрининга для идентификации соединений, предназначенных для модулирования активности одного или более представителя класса G-белок сопряженных рецепторов. 16 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к созданию библиотеки соединений, содержащей обширное количество соединений, представляющих собой агонисты и антагонисты по отношению к G-белок сопряженным рецепторам.
Представители класса мембранных белков, которые представляют собой G-белок сопряженные рецепторы (G-protein coupled receptors) (также известные как рецепторы, семь раз пронизывающие мембрану, имеющие семь трансмембранных сегментов (7ТМ) или «змеевидные» рецепторы), опосредуют передачу сигналов в клетку в ответ на широкий спектр внеклеточных сигналов, включающих гормоны, нейротрансмиттеры, цитокины и даже вещества из окружающей среды, например, ответственные за запахи и вкусы. В результате взаимодействия лиганда с внеклеточной частью рецептора (обычно, это N-концевая часть рецепторного белка) рецептор временно переходит в активированное состояние (это преобразование обычно обозначают как R+L→R*L, где R - неактивный рецептор, R* - активированный рецептор и L - лиганд).
Активированный (или R*) рецептор затем способен взаимодействовать с представителями семейства G-белков. G-белки представляют собой большое семейство внутриклеточных тримерных белков, связывающих гуаниновые нуклеотиды. После взаимодействия с активированным рецептором (вероятно, по механизму, называемому «ударное сопряжение» (collisional coupling)) G-белок обменивает связанный гуанозиндифосфат (ГДФ) на гуанозинтрифосфат (ГТФ). При этом тример G-белка в ГТФ-связанной форме диссоциирует, высвобождая субъединицу Gα и димер βγ. И Gα и βγ субъединицы затем могут участвовать в дальнейших сигнальных каскадах. Например, субъединица Gα может активировать фермент аденилатциклазу (АЦ), который образует циклический аденозинмонофосфат (цАМФ) из аденозинтрифосфата. Субъединица βγ может активировать ферменты семейства PI-3-киназ. В конечном счете, эти сигналы могут привести к модулированию практически всех аспектов жизнедеятельности клетки, от сокращения до подвижности, от изменения метаболизма до дальнейшей передачи сигналов. Сигнал после активирования затем постепенно «выключается» при помощи различных механизмов. ГТФ, связанный с субъединицей Gα, гидролизуется обратно в ГДФ, что приводит к реассоциации Gα и βγ субъединиц с формированием неактивного тримерного G-белка, связанного с ГДФ. Сам G-белок сопряженный рецептор подвергается фосфорилированию по внутриклеточной C-концевой области, что предотвращает дальнейшее взаимодействие с G-белками. Наконец связанный лиганд также может диссоциировать.
Этот общий сигнальный путь является настолько основополагающим и широко распространенным в физиологии млекопитающих, что до 40% лицензированных фармацевтических препаратов имеют среди своих молекулярных мишеней G-белок сопряженный рецептор. Кроме того, бактерии эволюционировали таким образом, что воздействуют на опосредованную G-белками передачу сигналов с целью нарушения физиологии и иммунитета хозяина: Vibrio cholerae (возбудитель холеры), например, производит белок, известный как холерный токсин, который необратимо ингибирует субъединицу Gα широко распространенных G-белков, называемых Gs. Аналогично, Bordetella pertussis (возбудитель коклюша) производит белок, известный как токсин коклюша, который оказывает аналогичный эффект на другой G-белок, Gi.
Один из подходов для идентификации фармацевтических препаратов, воздействующих на передачу сигналов G-белок сопряженным рецептором, заключался в проведении скрининга библиотек большого числа произвольных соединений на способность препятствовать связыванию лиганда с мембранными препаратами, содержащими рекомбинантные или очищенные G-белок сопряженные рецепторы. Для облегчения обнаружения связывания при проведении такого рода скринингов с высокой пропускной способностью приняты различные способы. Например, при анализе с помощью проксимальной сцинтилляции (scintillation proximity assays) связывание меченного радиоактивным изотопом лиганда с рецептором приводит к сближению радионуклида с молекулой сцинтиллятора, связанной с рецептором, соответственно, при распаде радионуклида испускается излучение, которое можно детектировать и количественно измерять. Кроме того, лиганд может быть помечен флуоресцентно, и связывание выявляют при поляризации флуоресценции (зависящей от уменьшения вращательных степеней свободы флуоресцентной метки при иммоблизации лиганда при его связывании с рецептором).
Хотя применение указанных способов в некоторых случаях имело успех и были выявлены соединения, на основе которых впоследствии были разработаны фармацевтические препараты для человека (например, антагонист рецептора 5НТ3 Ondansetron, применяемый для лечения мигрени), остается множество G-белок сопряженных рецепторов, для которых не были идентифицированы практически никакие подходящие непептидные соединения-агонисты или антагонисты, несмотря на интенсивный скрининг в фармацевтической индустрии. Например, для семейства сопряженных с G-белком хемокиновых рецепторов выявлено незначительное количество специфических непептидных антагонистов и не выявлено агонистов. Поскольку хемокины играют центральную роль в иммунной регуляции, такие молекулы, как ожидают, должны представлять собой чрезвычайно ценные фармацевтические препараты, обладающие иммуномодулирующими свойствами и полезные при лечении широкого спектра заболеваний, включающих воспалительную составляющую.
Два фактора ограничивают вероятный успех программ произвольного скринига: во-первых, существует очень большое количество соединений, которые необходимо проскринировать, и даже при применении наилучшей доступной технологии с высоким выходом и наилучших подходов комбинаторной химии для создания различных библиотек, можно проанализировать лишь небольшую долю всех возможных молекулярных структур. Во-вторых, даже при успешной идентификации исходных соединений коровые фармакофоры часто не пригодны для применения in vivo: исходное соединение или его аналоги могут быть просто слишком токсичными.
Другая основная проблема такого рода подходов «негативного скрининга» (при котором выявляют способность тестируемой библиотеки блокировать связывание меченого лиганда) заключается в том, что большинство из выявленных образцов представляют собой антагонисты рецептора. Лишь немногие из образцов имеют какую-либо агонистическую активность (как предполагают, агонисты должны обладать способностью связываться с рецептором и приводить его в активированное состояние, тогда как антагонистам достаточно только способности связываться с рецептором или лигандом таким образом, предотвращая их взаимодействие), а получение аналогов исходных образцов антагонистов, которые представляли бы собой агонисты, является ненадежным подходом с очень низкой степенью успеха.
Один из способов обойти данную проблему мог бы заключаться в замене библиотеки произвольных соединений на библиотеку молекулярных структур, предварительно отобранных таким образом, чтобы обеспечить значительную долю соединений, связывающихся с G-белок сопряженным рецептором. Такая библиотека в идеальном случае должна содержать как антагонисты, так и агонисты в равном соотношении, и таким образом и те и другие можно было бы легко выявить. Также в идеале основные молекулярные структуры, применяемые в библиотеке, должны быть нетоксичными.
Могут ли быть созданы фактические библиотеки, приближенные к таким идеальным свойствам, или нет, не ясно. Если да, то это потребует существования предполагаемого «идеального» субстрата для G-белок сопряженного рецептора, который бы взаимодействовал с различными G-белок сопряженными рецепторами вне зависимости от и природных лигандных предпочтений. Варьируя заместители у идеализированного субстрата, можно было бы придавать селективность к одному рецептору, принадлежащему к указанному классу в отличие от всех других.
В данной заявке авторы настоящего изобретения описывают «идеальный» субстрат для G-белок сопряженного рецептора. На основании такого «идеального» субстрата авторы настоящего изобретения обеспечивают ряд родственных «остовов», которые могут иметь различные заместители, что приведет к получению агонистов и/или антагонистов ряда различных G-белок сопряженных рецепторов. Изобретение также обеспечивает создание библиотеки вышеуказанных замещенных соединений, а также их применение в ходе скрининга с целью получения лигандов G-белок сопряженных рецепторов с любым заданным набором специфичностей. Таким образом, можно «настраивать» лиганд G-белок сопряженного рецептора, чтобы он имел известный набор свойств (например, лиганд, который обладает агонистической активностью по отношению к рецепторам допамина D2 и в то же самое время антагонистичекой активностью по отношению к 5HT1a (рецепторам) серотонина). В противоположность этому, выявление таких смешанных лигандов из произвольных библиотек является редкой счастливой случайностью.
Необходимые условия для создания библиотек согласно настоящему изобретению включают: (i) идентификацию молекулярного мотива, необходимого для связывания с G-белок сопряженными рецепторами, (ii) остов, включающий указанный молекулярный мотив с сохранением способности связываться с G-белок сопряженным рецептором, но также с обеспечением низкой токсичности и надлежащей стабильности, фармакокинетических и/или фармакодинамических свойств, (iii) легкий способ синтеза с получением различных замещенных форм указанного остова. В основе настоящего изобретения лежит идеальный «субстрат», представленный ниже:
где X представляет собой R-CO- или R-SO2- и R представляет собой различные заместители. Пунктирная линия указывает ограничения для углов связи в пределах молекулярного мотива, например посредством циклизации.
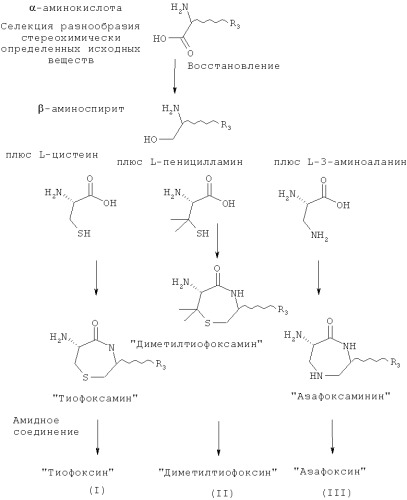
Остовы, предусмотренные данным изобретением, сконструированы с применением широкого спектра доступных α-аминокислот в качестве исходных веществ для создания разнообразных замещенных форм (см., например, Unnatural Amino Acids: Tools for Drug Discovery; Sigma-Aldrich ChemFiles Vol 4 No.6). Каждый из остовов синтезируют на основе комбинации двух α-аминокислот. Первая аминокислота может быть выбрана из цистеина, пеницилламина или 3-аминоаланина. Затем любая аминокислота может быть соединена с первой аминокислотой для создания необходимого разнообразия. Изобретение обеспечивает соединения и их соли общей формулы (I), представляющие собой продукт реакции синтеза с применением цистеина и другой аминокислоты в качестве исходных веществ:
где
X представляет собой -CO-(Y)k-(Z)n или SO2-(Y)k-(Z)n;
k представляет собой 0 или 1;
Y представляет собой циклоалкил или полициклоалкил (например, адамантил, адамантанметил, бициклооктил, циклогексил, циклопропил);
или Y представляет собой циклоалкенил или полициклоалкенил;
каждый Z независимо выбран из водорода или алкила, галоалкила, алкокси, галоалкокси, алкенила, алкинила, алкиламино, алкиламиноалкила, алкиламинодиалкила, заряженного алкиламинотриалкила или заряженного алкилкарбоксилатного радикала, содержащего от 1 до 20 атомов углерода;
или каждый Z независимо выбран из фтора, хлора, брома, йода, гидроксигруппы, оксиалкила, амино, аминоалкила, аминодиалкила, заряженного аминотриалкила, или карбоксилатного радикала; и n представляет собой любое целое от 1 до m, где m - максимальное количество замещений, допустимое в циклической группе Y.
Альтернативно, Z может быть выбран из пептидного радикала, например, содержащего от 1 до 4 пептидных звеньев, соединенных пептидными связями (например, пептидного радикала, содержащего от 1 до 4 аминокислотных остатков).
R3 и R4 представляют собой варьируемые заместители, которые наряду с Z различны у отдельных элементов библиотеки.
Этот класс соединений, 6-ациламино-[1,4]тиазепан-5-оны, описывают как «Тиофоксины». Ключевыми структурными характеристиками таких молекул являются наличие лактамамида в кольцевой системе с аминогруппой, присоединенной к атому углерода рядом с лактамкарбонильной группой (6 положение, обозначаемое как α-атом углерода), а также наличие атома серы в положении 1 и R3 и R4 (варьируемых) в положениях 3 и 2 лактамного кольца, соответственно.
Изобретение также обеспечивает соединения и их соли общей формулы (II), представляющие собой продукт реакции синтеза с применением пеницилламина и другой аминокислоты в качестве исходных веществ:
где
X представляет собой -CO-(Y)k-(Z)n или SO2-(Y)k-(Z)n;
k представляет собой 0 или 1;
Y представляет собой циклоалкил или полициклоалкил (например, адамантил, адамантанметил, бициклооктил, циклогексил, циклопропил);
или Y представляет собой циклоалкенил или полициклоалкенил;
каждый Z независимо выбирают из водорода или алкила, галоалкила, алкокси, галоалкокси, алкенила, алкинила, алкиламино, алкиламиноалкила, алкиламинодиалкила, заряженного алкиламинотриалкила или заряженного алкилкарбоксилатного радикала, содержащего от 1 до 20 атомов углерода;
или каждый Z независимо выбирают из фтора, хлора, брома, иода, гидроксигруппы, оксиалкила, амино, аминоалкила, аминодиалкила, заряженного аминотриалкила или карбоксилатного радикала; и
n представляет собой любое целое от 1 до m, где m - максимальное количество замещений, допустимое в циклической группе Y.
Альтенативно, Z может быть выбран из пептидного радикала, например, имеющего от 1 до 4 пептидных звеньев, соединенных пептидными связями (например, пептидного радикала, содержащего от 1 до 4 аминокислотных остатков).
R3 и R4 представляют собой различные заместители, которые наряду с Z различны у отдельных элементов библиотеки. R3 и R4 могут быть независимо выбраны как любые заместители, за исключением того, что R3 не может представлять собой -СООН, -COOR', -COSR' или -CONR'R'', где R' и R'' независимо представляют собой любой заместитель и любой или оба из R' и R'' могут представлять собой H. Этот класс соединений, 6-ациламино-7,7-диметил[1,4]тиазепан-5-оны, описывают как «Диметилтиофоксины». Ключевыми структурными характеристиками таких молекул являются наличие лактамамида в кольцевой системе с аминогруппой, присоединенной к атому углерода рядом с лактамкарбонильной группой (6 положение, обозначаемое α-атом углерода), а также наличие атома серы в положении 1 и R3 и R4 (варьируемых) в положениях 3 и 2 лактамного кольца, соответственно. Изобретение также обеспечивает соединения и их соли общей формулы (III), представляющие собой продукт реакции синтеза с применением 3-аминоаланина и другой аминокислоты в качестве исходных веществ:
где
X представляет собой -CO-(Y)k-(Z)n или SO2-(Y)k-(Z)n;
k представляет собой 0 или 1;
Y представляет собой циклоалкил или полициклоалкил (например, адамантил, адамантанметил, бициклооктил, циклогексил, циклопропил);
или Y представляет собой циклоалкенил или полициклоалкенил;
каждый Z независимо выбран из водорода или алкила, галоалкила, алкокси, галоалкокси, алкенила, алкинила, алкиламино, алкиламиноалкила, алкиламинодиалкила, заряженного алкиламинотриалкила или заряженного алкилкарбоксилатного радикала, содержащего от 1 до 20 атомов углерода;
или каждый Z независимо выбран из фтора, хлора, брома, йода, гидроксигруппы, оксиалкила, амино, аминоалкила, аминодиалкила, заряженного аминотриалкила или карбоксилатного радикала; и n - любое целое от 1 до m, где m - максимальное количество замещений, допустимое в циклической группе Y.
В качестве альтернативы, Z может быть выбран из пептидного радикала, например, имеющего от 1 до 4 пептидных звеньев, соединенных пептидными связями (например, пептидного радикала, содержащего от 1 до 4 аминокислотных остатков).
R2, R3 и R4 представляют собой различные заместители, которые наряду с Z различны у отдельных элементов библиотеки.
Этот класс соединений, 6-ациламино-[1,4]диазепан-5-оны, описывают как «Азафоксины». Ключевыми структурными характеристиками таких молекул являются наличие лактамамида в кольцевой системе с аминогруппой, присоединенной к атому углерода рядом с лактамкарбонильной группой (положение 6, обозначаемое как α-атом углерода), а также наличие азота в 1 положении и R3 и R4 (варьируемых) в 3 и 2 положениях лактамного кольца, соответственно. Дополнительное разнообразие может быть создано при помощи заместителя R2 (варьируемого) в положении N1.
Изобретение также обеспечивает соединения и их соли общей формулы (IV), представляющие собой альтернативный продукт реакции синтеза с применением 3-аминоаланина и другой аминокислоты в качестве исходных веществ:
где
X представляет собой -CO-(Y)k-(Z)n или SO2-(Y)k-(Z)n;
k представляет собой 0 или 1;
Y представляет собой циклоалкил или полициклоалкил (например, адамантил, адамантанметил, бициклооктил, циклогексил, циклопропил);
или Y представляет собой циклоалкенил или полициклоалкенил;
каждый Z независимо выбран из водорода или алкила, галоалкила, алкокси, галоалкокси, алкенила, алкинила, алкиламино, алкиламиноалкила, алкиламинодиалкила, заряженного алкиламинотриалкила или заряженного алкилкарбоксилатного радикала, содержащего от 1 до 20 атомов углерода;
или каждый Z независимо выбран из фтора, хлора, брома, иода, гидроксигруппы, оксиалкила, амино, аминоалкила, аминодиалкила, заряженного аминотриалкила или карбоксилатного радикала; и n - любое целое от 1 до m, где m - максимальное количество замещений, допустимое в циклической группе Y.
Альтернативно, Z может быть выбран из пептидного радикала, например, имеющего от 1 до 4 пептидных звеньев, соединенных пептидными связями (например, пептидного радикала, содержащего от 1 до 4 аминокислотных остатков).
R2 и R3 представляют собой различные заместители, которые наряду с Z различны для отдельных элементов библиотеки.
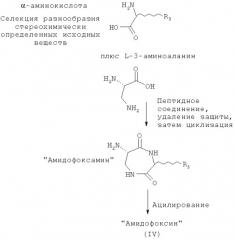
Этот класс соединений, 6-ациламино-[1,4]диазепан-2,5-дионы, описывают как «Амидофоксины». Ключевыми структурными характеристиками молекул являются наличие лактамамида в кольцевой системе с аминогруппой, присоединенной к атому углерода рядом с лактамкарбонильной группой (6 положение, обозначаемое как α-атом углерода), а также наличие азота в положении 1 и карбонильной группы в положении 2 с R3 (варьируемого) в положении 3 лактамного кольца. Дополнительное разнообразие может быть создано при помощи заместителя R2 (варьируемого) в положении N1.
α-атом углерода указанных тиофоксинов, диметилтиофоксинов, азафоксинов и амидофоксинов является асимметричным и, следовательно, соединения согласно настоящему изобретению имеют две возможные энантиомерные формы, то есть R и S конфигурации. Настоящее изобретение охватывает две энантиомерные формы и все комбинации этих форм, в том числе RS рацемические смеси. Для простоты, если в структурных формулах не указана конкретная конфигурация, то следует понимать, что представлены две энантиомерные формы и их смеси.
Все соединения общих формул (I), (II), (III) и (IV) содержат N-заместители в экзоциклической аминогруппе. N-заместитель представляет собой либо карбонамид, либо сульфонамид. Геометрия атома углерода рядом с карбонилом карбонамида или сульфонильной группой сульфонамида («ключевого» углерода) может быть важна для биологической активности молекулы. Природа N-заместителя может быть такова, что кольцо или кольца Y ограничивают углы связи при «ключевом» углероде, делая их по существу тетраэдрическими (т.е. sp3 гибридные связи). Любой заместитель Z может представлять собой заместитель в любом допустимом положении кольца или колец циклической группы Y. В частности, следует отметить, что изобретение охватывает соединения, у которых «ключевой углерод» является и частью циклической группы и сам является замещенным. Определение (Z)n охватывает соединения данного изобретения, не содержащие заместителей (т.е. Z = водород), соединения данного изобретения с одним заместителем (т.е. Z не является водородом и n=1), и также с множественными заместителями (т.е., по меньшей мере, две группы Z не являются водородом и n=2 или более).
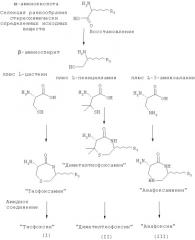
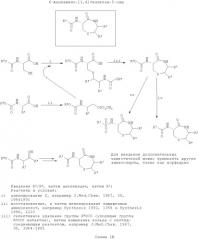
Одно из основных преимуществ соединений согласно настоящему изобретению состоит в том, что различные элементы библиотеки могут быть легко синтезированы с применением широкодоступных исходных веществ. Тиофоксины, диметилтиофоксины, азафоксины и амидофоксины представляют собой различные классы соединений (с разнообразными Z, R2 (при наличии), R3 и (при наличии) R4), которые могут быть легко синтезированы из двух различных α-аминокислот. α-аминокислоты представляют собой идеальные исходные вещества для синтеза с целью получения репертуара разнообразных соединений, поскольку известен широкий спектр α-аминокислот (отличающихся только природой заместителя R3), и они коммерчески доступны. Для синтеза тиофоксинов, диметилтиофоксинов и азафоксинов α-аминокислоты можно легко восстановить с получением β-аминоспиртов (с применением защитных групп для сохранения структуры группы R3 при необходимости). Затем различные β-аминоспирты соединяют с цистеином с получением «тиофоксаминов», с пеницилламином с получением «диметилтиофоксаминов» или с 3-аминоаланином с получением «азафоксаминов». Указанные α-аминолактамы можно затем соединить с соответствующим ацилом в качестве боковой цепи при помощи стандартных реакций амидного присоединения (также с применением защитных групп для заместителя R3 при необходимости) с получением тиофоксинов, диметилтиофоксинов или азафоксинов, соответственно.
В отличие от этого, амидофоксины получают при реакции α-аминокислоты (без предварительного ее восстановления до β-аминоспирта) с 3-аминоаланином. Следует отметить, что амидофоксины представляют собой 7-членные кольцевые аналоги хорошо известных дикетопиперазинов, синтезируемых из димеров α-аминокислот, но синтезированные на основе димера β-аминокислоты (3-аминоаланина) и α-аминокислоты.
Образующиеся тиофоксины, диметилтиофоксины, азафоксины и амидофоксины имеют тот же ряд заместителей R3, что и исходная совокупность доступных α-аминокислот. Кроме того, в данной области хорошо известны общие пути синтеза α-аминокислот (например, см. R.M.Williams, Synthesis of Optically Active α-Amino Acids (Pergamon, New York) 1989), делающие возможным создание еще большего разнообразия при необходимости.
В качестве альтернативы или дополнительно, применение непосредственно доступных β-аминоспиртов, таких как эфедрин, с различными заместителями в положении 2 обеспечивает дополнительное разнообразие за счет варьируемой группы R4 в положении 2 кольца тиофоксина, диметилтиофоксина и азафоксина.
В качестве альтернативы или дополнительно, предшествующее восстановительное алкилирование 3-аминоаланина позволяет получение разнообразия по N1 положению азафоксина или амидофоксина (варьирующая R2 группа).
Особенностью настоящего изобретения является легкость стереоконтроля синтеза. В приведенных в качестве примеров путях синтеза применяют дешевые и легко доступные L-цистеин, L-пеницилламин и L-3-аминоаланин для соединения с разнообразными β-аминоспиртами (или непосредственно с α-аминокислотами в случае амидофоксинов). В результате этого получают ряд различных α-аминолактамов, имеющих (S)-конфигурацию. Кроме того, D-цистеин, D-пеницилламин и D-3-аминоаланин также являются легкодоступными и могут быть соединены с таким же рядом β-аминоспиртов (или α-аминокислот) с получением α-аминолактамов (R)-конфигурации. Аналогично, при выборе в качестве исходного вещества соответствующей энантиомерно чистой α-аминокислоты и затем с применением пути синтеза с сохранением стереохимии (например, путей синтеза, приведенных ниже) можно легко синтезировать тиофоксамины, диметилтиофоксамины, азафоксамины и/или амидофоксамины и, следовательно, тиофоксины, диметилтиофоксины, азафоксины и/или амидофоксины с соответствующей конфигурацией атома углерода, несущего R3-заместитель. Например, при синтезе тиофоксина с применением L-аланина и L-цистеин получают (6R)-амино-(3S)-метил-[1,4]тиазапан-5-он. В противоположность этому, при синтезе с применением D-аланина и L-цистеина получают (R,R)-6-амино-3-метил-[1,4]тиазапан-5-он, с применением L-аланина и D-цистеина получают (S,S)-6-амино-3-метил-[1,4]тиазапан-5-он, а с применением D-аланина и D-цистеина получают (6S)-амино-(3R)-метил-[1,4]тиазапан-5-он. В качестве альтернативы, можно выбрать рацемические смеси одного или обоих исходных веществ с получением в качестве продуктов смеси стереоизомеров тиофоксаминов, диметилтиофоксаминов, азафоксаминов и/или амидофоксаминов и, следовательно, производных тиофоксинов, диметилтиофоксинов, азафоксинов и/или амидофоксинов.
Важным является то, что при необходимости возможно осуществление стадий реакций синтеза в различном порядке. При создании библиотеки различных соединений путем комбинаторного синтеза важно получить в конце синтеза как можно большее разнообразие. В идеале последняя стадия синтеза вносит наибольшее разнообразие в библиотеку. Поскольку разнообразие может быть получено на различных стадиях синтеза соединений согласно настоящему изобретению (с варьируемыми Z, R2 (для азафоксинов и амидофоксинов), R3 и R4 (для тиофоксинов, диметилтиофоксинов и азафоксинов)), можно вводить разнообразие в равной степени на каждой стадии (например, создавать библиотеку амидофоксинов с 8 различными группами Z, группами R2 и группами R3, таким образом, получая 512 соединений) или вводить большее разнообразие на одной из стадии синтеза (например, создавать библиотеки с 2 различными группами Z и R2, но с 128 различными группами R3 в библиотеке амидофоксинов, таким образом, получая 512 соединений). В случаях, когда разнообразие вводят по большей части на одной определенной стадии, предпочтительно осуществление данной стадии по возможности в конце пути синтеза. Одно из преимуществ настоящего изобретения, предусмотренное в данной заявке, состоит в том, что можно изменить порядок стадий реакции синтеза. Специфические примеры путей синтеза с получением тиофоксинов, диметилтиофоксинов, азафоксинов и амидофоксинов приведены в примерах ниже. Для каждого класса представлены примеры, в которых стадии реакции выполняют в различном порядке. Однако следует отметить, что существуют другие пути синтеза, которые можно применять в качестве альтернативы, и они входят в область настоящего изобретения.
Предполагается, что синтез компонентов библиотеки можно осуществлять с применением аналогичных способов синтеза, хорошо известных в данной области. Например, синтез можно осуществлять с применением смол или других твердофазных носителей для упрощения введения разнообразия и для облегчения очистки или частичной очистки образующихся компонентов библиотеки. Применение такого рода твердофазного или другого аналогичного способа синтеза, неавтоматизированного, полуавтоматизированного или автоматизированного, для создания библиотеки тиофоксинов, диметилтиофоксинов, азафоксинов или амидофоксины входит в область настоящего изобретения.
Изобретение также обеспечивает фармацевтические композиции, которые в качестве активного компонента содержат соединение общей формулы (I), (II), (III) или (IV), или его фармацевтически приемлемую соль и, по меньшей мере, один фармацевтически приемлемый наполнитель и/или носитель.
Под фармацевтически приемлемой солью понимают, в частности, аддитивные соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, бифосфат и нитрат или соли органических кислот, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, р-толуолсульфонат, пальмоат и стереат. Также в область настоящего изобретения, в случаях, когда их можно применять, входят соли, образованные из оснований, например, гидроокиси натрия или калия. Другие примеры фармацевтически приемлемых солей см. в работе "Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217.
Фармацевтическая композиция может быть в твердой форме, например в виде порошков, гранул, таблеток, желатиновых капсул, липосом или суппозиториев. Подходящей твердой основой может служить, например, фосфат кальция, стереат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза натрия, поливинилпирролидин и парафин. Другие подходящие фармацевтически приемлемые наполнители и/или носители известны специалистам в данной области.
Фармацевтические композиции согласно настоящему изобретению также могут быть представлены в жидкой форме, например, в виде растворов, эмульсий, суспензий или сиропов. Подходящей жидкой основой может быть, например, вода, органические растворители, такие как глицерол или гликоли, а также их водные смеси в различных пропорциях.
Настоящее изобретение может также обеспечивать применение соединения общей формулы (I), (II), (III) и/или (IV), или его фармацевтически приемлемой соли для получения лекарственного препарата, предназначенного для модулирования активности одного или более членов класса G-белок сопряженных рецепторов.
Настоящее изобретение обеспечивает соединения, композиции и применение соединений общей формулы (I), (II), (III) и (IV) или их фармацевтически приемлемые солей, в которых радикал R1 содержит «ключевой» углерод, двузамещенный одинаковыми или различными группами, выбранными из: алкила, галоалкила, алкокси, галоалкокси, алкенила, алкинила и алкиламино радикала.
Настоящее изобретение предусматривает соединения, композиции и применение, где «ключевой» углерод является хиральным.
Настоящее изобретение предусматривает соединения, композиции и применение, где «ключевой» углерод образует sp3 гибридные связи.
Настоящее изобретение предусматривает соединения, композиции и применение, где «ключевой» углерод образует по существу тетраэдрические углы связи.
Соединения общей формулы (I), (II), (III) или (IV), применяемые согласно настоящему изобретению, или их соли, могут быть такими, что кольцо или кольца Y ограничивают углы связи при «ключевом» углероде, делая их по существу тетраэдрическими (т.е. sp3 гибридные связи).
Настоящее изобретение также обеспечивает сульфаниламидные аналоги приведенных в качестве примеров соединений: сульфонил-α-аминолактамные эквиваленты тиофоксинов, диметилтиофоксинов, азафоксинов или амидофоксинов формулы (I), (II), (III) и (IV), соответственно.
Настоящее изобретение охватывает соединения, композиции и их применение, как определено в данной заявке, когда указанные соединения находятся в гидратированной или сольватированной форме.
Амидные и сульфонамидные производные тиофоксинов, диметилтиофоксинов, азафоксиноа и амидофоксинов, описанных в данной заявке, возможно, представляют собой функциональные агонисты и антагонисты G-белок сопряженных рецепторов. Центральная часть, «кор», состоящая из «ключевого» углерода, карбонильной или сульфонильной группы, α-аминогруппы и кольца тиофоксина, диметилтиофоксина, азафоксина или амидофоксина, представляет собой пример лиганда G-белок сопряженного рецептора. Варьируя заместители данного кора, в особенности в положении, содержащем R3 заместитель, можно получить агонисты и антагонисты G-белок сопряженных рецепторов с широким спектром желаемых свойств намного более легким способом, чем при скрининге библиотек произвольных соединений.
В результате, изобретение также обеспечивает библиотеку, которая содержит два или более представителя класса соединений, определяемых общей формулой (I), (II), (III) и/или (IV), такую библиотеку, которую можно скринировать для идентификации молекулы с конкретным требуемым набором свойств в отношении модулирования передачи сигнала от одного (или более) G-белок сопряженного рецептора. Затем можно проводить скрининг вышеупомянутой библиотеки на антагонистическую или агонистическую активность по отношению к вышеупомянутому G-белок сопряженному рецептору (рецепторам) с применением способов, хорошо известных в данной области. Например, можно проводить скрининг указанной библиотеки в отношении способности ее отдельных элементов блокировать связывание меченного радиоактивным изотопом лиганда G-белок сопряженного рецептора с препаратами мембраны, содержащими рекомбинантный или очищенный G-белок сопряженный рецептор. Кроме того, можно проводить скрининг библиотеки на способность отдельных ее элементов стимулировать образование цАМФ в клетках, экспрессирующих рекомбинантный G-белок сопряженный рецептор.
Любое соединение тиофоксина, диметилтиофоксина, азафоксина или амидофоксина согласно настоящему изобретению, обладающее требуемым набором свойств, можно применять в качестве «шаблона» для синтеза аналогичного «карбофоксина» (имеющего углеродную группу, вместо серы, в положении 1 тиофоксина или диметилтиофоксина или азота в положении 1 азафоксина или амидофоксина), например, с применением путей синтеза при помощи реакции обмена с замыканием кольца, которые хорошо известны в данной области (например, Truka, Т.М.; Grubbs, R.Н. Acc. Chem. Res. 2001, 34, 18). Соответствующие пути синтеза с применением реакции обмена с замыканием кольца также охарактеризованы, их можно применять для синтеза «карбофоксиновых» аналогов азафоксинов или амидофоксинов, в которых N в положении 1 является замещенным (т.е., R2≠Н), например, способ Del Valle R.R. & Goodman M.J. Org. Chem. 2004, 69.8946. Предполагается, что такие «карбофоксиновые» соединения являются эффективными агонистами или антагонистами G-белок сопряженных рецепторов.
Изобретение также предусматривает способы лечения, облегчения или профилактики симптомов заболевания или патологического состояния, выбранного из группы, включающей гипертонию, атеросклероз, астму, ожирение, нейродегенеративные заболевания, аутоиммунные заболевания или психопатические заболевания, путем введения пациенту эффективного количества соединения, композиции или лекарственного препарата согласно настоящему изобретению, предназначенного для модулирования активности G-белок сопряженного рецептора.
ОПРЕДЕЛЕНИЯ
Термин «около/примерно» относится к интервалу вокруг рассматриваемого значения. При использовании в данной заявке на патент «около/примерно X» означает интервал от Х минус 10% от Х до Х плюс 10% от X, и предпочтительно интервал от Х минус 5% от Х до Х плюс 5% от X.
Использование числового диапазона в данном описании предназначено для того, чтобы однозначно включить в область изобретения каждое конкретное целое значение данного диапазона и все комбинации значений верхнего и нижнего предела расширенной области данного диапазона. Таким образом, например, диапазон от 1 до 20 атомов углерода, указанный (в числе прочего) в отношении формулы I, охватывает все целые от 1 до 20 и все подобласти каждой комбинации верхних и нижних значений, приведены ли в качестве примеров в явной форме или нет.
При использовании в данном описании термин «включающий» следует понимать и как «включающий/содежащий» и как «состоящий из». Следовательно, если указано, что изобретение относится к «фармацевтической композиции, включающей в качестве активного компонента» соединение, то данные термины относятся и к композициям, в которых могут быть представлены другие активные компоненты, и к композициям, состоящим только из одного определенного активного компонента.
Термин «пептидные звенья», используемый в данной заявке, обозначает следующие 20 природных аминокислотных остатков:
| ОБОЗНАЧЕНИЕ: | ЗНАЧЕНИЕ: |
| Ala | Аланин |
| Cys | Цистеин |
| Asp | Аспарагиновая кислота |
| Glu | Глутаминовая кислота |
| Phe | Фенилаланин |
| Gly | Глицин |
| His | Гистидин |
| Ile | Изолейцин |
| Lys | Лизин |