Ингибирование ангиогенеза
Иллюстрации
Показать всеНастоящая группа изобретений относится к медицине, а именно онкологии. Изобретения могут быть использованы для способа лечения опухоли, устойчивой к лечению антагонистом VEGF, а также для способа идентификации субъекта-человека, несущего опухоль для лечения антагонистом Bv8. Для этого вводят эффективное количество антагониста Bv8. Опухоль при этом предварительно лечат антагонистом фактора роста эндотелия сосудов (VEGF), а антагонист Bv8 представляет собой антитело против Bv8 или его фрагмент, а также проводят определение того, что субъект рефрактерен к лечению антагонистом VEGF. Изобретения обеспечивают эффективное лечение пациентов с опухолями, устойчивыми к антагонистам VEGF. 2 н. и 19 з.п. ф-лы, 105 ил., 3 табл.
Реферат
Область изобретения
Изобретение в основном относится к ингибированию воспалительного клеточно-опосредованного ангиогенеза. В частности, изобретение относится к предупреждению или лечению опухолевого ангиогенеза и ингибированию развития опухоли, с использованием антагонистов Bv8, таких как антитела против Bv8.
Предпосылки изобретения
Точно установлено, что ангиогенез играет важную роль в развитии опухоли и метастазах, и меры против ангиогенеза представляют собой клинически подтвержденную противораковую стратегию (Folkman, J., Nat Med 1, 27-31 (1995); Ferrara, N. and Kerbel, R.S., Nature 438, 967-974 (2005); Carmeliet, P. Nat Med 9, 653-660 (2003)). Ангиогенез также играет роль ключевого патогенетического фактора во многих других заболеваниях, включая возрастную дегенерацию желтого пятна (AMD). Сообщалось, что хороидальная неоваскуляризация зависит по меньшей мере частично от инфильтрации нейтрофилами (Zhou et al., Mol. Vis 11; 414-424 (2005)). Традиционно считается, что опухолевые клетки являются основным источником медиаторов ангиогенеза (Folkman, J., N Engl J Med 385, 1182-1186 (1971)). Действительно, многие исследования показали, что злокачественные клетки могут продуцировать многие ангиогенные факторы, включая фактор роста эндотелия сосудов A (VEGF-A), ангиопоэтины, фактор роста гепатоцитов (HGF) и основной фактор роста фибробластов (bFGF), и различные мутации онкогенов или генов супрессоров опухолей могут привести к увеличенному образованию по меньшей мере некоторых из этих факторов (Rak, J., et al., Cancer Res 55, 4575-4580 (1995); Wizigmann, et al., Cancer Res 55, 1358-1364 (1995)). Однако теперь неопровержимые доказательства поддерживают представление о том, что строма, состоящая из фибробластов, перицитов, мезенхимальных стволовых клеток и воспалительных иммунных клеток, а также эндотелиальные предшественники также вносят вклад в рост опухоли не только посредством секреции ангиогенных факторов, но также посредством модуляции иммунной системы (Hanahan, D. and Weinberg, R. A., Cell 100, 57-70 (2000); Coussens, L.M. and Werb, Z., Nature 420, 860-867 (2002); Blankenstein T., Curr Opin. Immunol. 17:180-186 (2005); Karnoub et al., Nature 449:557-563 (2005); Orimo et al., Cell Cycle 5:1497-1601 (2006); and Rafii, S. et al., Nat Rev Cancer 2, 826-835 (2002)). Теоретически, некоторые из этих клеток могут подавлять рост опухоли с помощью механизмов иммунологического надзора, но множество доказательств указывает на то, что заметная инфильтрация лейкоцитами и другими воспалительными клетками в опухолях несет неблагоприятный прогноз (Coussens. et al., выше).
Последние исследования напрямую вовлекают различные популяции миелоидных клеток в регулирование опухолевого ангиогенеза (Da Palma, M., et al., Nat. Med. 9, 789-795 (2003); Yang, L. et al., Cancer Cell 6, 409-421 (2004); De Palma M., et al., Cancer Cell 8, 211-226 (2005)) и VEGF-индуцированной неоваскуляризации у взрослых (Grunewald, M. et al., Cell 124, 175-189 (2006)). В самых последних исследованиях предоставлено доказательство роли миелоидных клеток CD11b+Gr1+ в опосредовании рефрактерности к терапии против VEGF в некоторых моделях опухолей (Shojaei, F. et al., Cell 124, 175-189 (2006)). Описывалась роль нейтрофилов в инициации включения ангиогенеза в трансгенных моделях многостадийного канцерогенеза (Nozawa, H. et al., Proc. Natl. Acad. Sci USA 103, 12493-12498 (2006)). Миелоидные клетки могут локально секретировать ангиогенные факторы или продуцировать протеазы, такие как матриксная металлопротеиназа-9 (Yang, L., et al., выше; Nozawa et al., выше; van Kempen, L. C. et al., Eur J Cancer 42, 728-734 (2006)), которые в свою очередь могут способствовать ангиогенезу посредством увеличения биодоступности и активности VEGF-A в микроокружении опухоли (Bergers G., et al., Nat Cell. Biol 2, 737-744 (2000)). Тем не менее, наше понимание механизмов, с помощью которых миелоидные клетки мобилизуются из КM и способствуют опухолеобразованию, остается неполным.
Bv8 и EG-VEGF представляют собой близко связанные секретируемые белки, также обозначаемые как прокинетицин-1 и -2, которые структурно принадлежат к более крупному классу пептидов, определяемому по мотиву пяти дисульфидных мостиков, который называют колипазным фолдом (DeCouter, J. et al., Nature 420, 860-867 (2002); LeCouter. J. et al., Proc. Natl. Acad. Sci USA 100, 2685-2690 (2003); Li, M. et al., Mol. Pharmacol. 59, 692-698 (2001)). Изначально Bv8 идентифицировали как секретируемый белок из кожи лягушки Bombina variegate (Mollay, C. et al., Eur J Pharmacol. 374, 189-196 (1999)). Клонирование и экспрессия Bv8 описаны в WO 03/020892, который опубликован 13 марта 2003 года. Bv8 и EG-VEGF связываются с двумя близко связанными сопряженными с G-белком рецепторами (GPCR), EG-VEGF/PKR-1 (R1) и EG-VEGF/PKR-2 (R2) (Masuda, Y et al., Biochem Biophys Res Commun 293, 496-402 (2002); Lin, D.C. et al., J Biol. Chem. 277, 19276-19280 (2002)). EG-VEGF и Bv8 охарактеризованы как митогены, селективные к особым типам эндотелиальных клеток (LeCouter, J. et al., (2001) и (2003), выше). Для этого семейства описаны другие активности, включая ноцицепцию (Mollay, C. et al., выше), двигательную активность желудочно-кишечного тракта (Li, M. et al., выше), регулирование суточного локомоторного ритма (Cheng, M. Y., et al., Nature 417, 405-410 (2002)) и нейрогенез обонятельной луковицы (Matsumoto, S., et al., Proc. Natl. Acad. Sci USA 103, 4140-4145 (2006)). Кроме того, Bv8 или EG-VEGF стимулировали образование гранулоцитарных или моноцитарных колоний in vitro (LeCouter, J. et al., (2003), выше; Dorsch, M. et al., J Leukoc Biol. 78(2), 426-34 (2005)). Bv8 охарактеризован как хемоаттрактант для макрофагов (LeCouter et al., Proc. Natl. Acad. Sci USA 101, 16813-16919 (2004)).
Признание фактора роста эндотелия сосудов (VEGF) в качестве основного регулятора ангиогенеза в патологических состояниях приводило ко многим попыткам блокировать активности VEGF. VEGF представляет собой один из наиболее охарактеризованных и самых мощных положительных регуляторов ангиогенеза. См., например, Ferrara, N. & Kerbel, R.S. Angiogenesis as a therapeutic target. Nature 438:967-74 (2005). В дополнение к тому, что он является ангиогенным фактором в ангиогенезе и васкулогенезе, VEGF, в качестве плеотропного фактора роста, проявляет многие биологические эффекты в различных физиологических процессах, таких как выживаемость эндотелиальных клеток, проницаемость сосудов и вазодилятация, хемотаксис моноцитов и поступление кальция. Ferrara and Davis-Smyth (1997) Endocrine Rev. 18:4-25. Кроме того, сообщалось об исследованиях митогенных эффектов VEGF на некоторые неэндотелиальные типы клеток, такие как пигментные клетки эпителия сетчатки, клетки протока поджелудочной железы и Шванновские клетки. См., например, Guerrin et al. J. Cell Physiol. 164:385-394 (1995); Oberg-Welsh et al. Mol. Cell. Endocrinol. 126:125-132 (1997); и Sondell et al. J. Neurosci. 19:5731-5740 (1999).
Признание фактора роста эндотелия сосудов (VEGF) в качестве основного регулятора ангиогенеза в патологических состояниях привело ко многим попыткам блокировать активности VEGF. Ингибиторные антитела против рецептора VEGF, растворимые рецепторные конструкции, антисмысловые стратегии, аптамеры РНК против VEGF и низкомолекулярные ингибиторы VEGF рецептора тирозинкиназы (RFK), все были предложены для использования для того, чтобы препятствовать передаче сигналов посредством VEGF. См., например, Siemeister et al. Cancer Metastasis Rev. 17:241-248 (1998). Было показано, что нейтрализующие антитела против VEGF подавляют рост многих линий опухолевых клеток человека у голых мышей (Kim et al. Nature 362:841-844 (1993); Warren et al. J. Clin. Invest. 95:1789-1797 (1995); Borgstrom et al. Cancer Res. 56:4032-4039 (1996); and Melnyk et al. Cancer Res. 56:921-924 (1996)), а также подавляют внутриглазной ангиогенез в моделях ишемических расстройств сетчатки (Adamis et al. Arch. Ophthalmol. 114:66-71 (1996)). Действительно, гуманизированное антитело против VEGF, бевацизумаб (АВАСТИН®, Genentech, South San Francisco, CA), было одобрено Управлением по продовольствию и лекарствам США в сочетании с внутривенной химиотерапией на основе 5-фторурацила (5-FU) для терапии первого или второго ряда пациентов с метастатической карциномой толстой или прямой кишки и в сочетании с карбоплатином и паклитакселом для терапии первой линии пациентов с нерезектабельным, локально запущенным, рецидивирующим или метастазирующим несквамозным немелкоклеточным раком легких (НМКРЛ). См., например, Ferrara et al., Nature Reviews Drug Discovery, 3:391-400 (2004).
Однако способность терапевтических соединений длительно препятствовать росту опухоли часто ограничивается развитием устойчивости к лекарственному средству. Некоторые механизмы устойчивости к различным цитотоксическим соединениям были установлены и функционально описаны, в основном на одноклеточных моделях опухолей. См., например, Longley, D.B. & Johnston, P. G. Molecular mechanisms of drug resistance. J Pathol. 205:275-92 (2005). Кроме того, взаимодействия стромы хозяйского организма и опухолевых клеток могут участвовать в фенотипах с устойчивостью к лекарственным средствам. Стромальные клетки секретируют множество проангиогенных факторов и не склонны к такой генетической нестабильности и увеличению уровня мутаций, как у опухолевых клеток (Kerbel, R. S. Inhibition of tumor angiogenesis as a strategy to circumvent acquired resistance to anti-cancer therapeutic agents. Bioessays 13:31-6 (1991)). Рассмотрено в Ferrara & Kerbel и Hazlehurst et al., в Ferrara, N. & Kerbel, R. S. Angiogenesis as a therapeutic target. Nature 438:967-74 (2005); и Hazlehurst, L.A., Landowski, T.H. & Dalton, W.S. Role of the tumor microenviroment in mediating de novo resistance to drugs and physiological mediators of cell death. Oncogene 22:7396-402 (2003).
В доклинических моделях блокада передачи сигналов посредством передачи сигналов VEGF с помощью гуманизированного моноклонального антитела бевацизумаб (АВАСТИН, Genentech, South San Francisco, CA) или мышиного предшественника бевацизумаба (A4.6.1 (гибридомная клеточная линия, продуцирующая A4.6.1, депонированная 3/29/91, ATCC HB-10709)) значительно ингибировала рост опухоли и снижала опухолевый ангиогенез в большинстве протестированных ксенотрансплантатных моделей (рассмотрено в Gerber & Ferrara in Gerber, H. P. & Ferrara, N. Pharmacology and pharmacodynamics of bevacizumab as monotherapy or in combination with cytotoxic therapy in preclinical studies. Cancer Res 65:671-80 (2005)). Фармакологические эффекты монотерапии против VEGF были лучше всего выражены, когда лечение начинали на ранних стадиях роста опухоли. Если лечение откладывали до тех пор, когда опухоль хорошо развивалась, типично ингибиторные эффекты были временными и опухоли, в конце концов, развивали устойчивость. См., например, Klement, G. et al. Differences in therapeutic indexes of combination metronomic chemotherapy and an anti-VEGFR-2 antibody in multidrug-resistant human breast cancer xenografts. Clin. Cancer Res 8:221-32 (2002). Клеточные и молекулярные события, лежащие в основе такой устойчивости к лечению против VEGF, носят комплексный характер. См., например, Casanovas, O., Hicklin, D. J., Bergers, G. & Hanahan, D. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell 8:299-309 (2005); и Kerbel, R.S. et al. Possible mechanisms of acquired resistance to anti-angiogenic drugs: implications for the use of combination therapy approaches. Cancer Metastasis Rev 20:79-86 (2001). Может быть вовлечено множество факторов. Например, сочетание лечения соединениями, направленными на передачу сигналов посредством VEGF и фактора роста фибробластов (FGF), повышало эффективность и задерживало наступление устойчивости у опухолей на поздних стадиях в генетической модели канцерогенеза в панкреатическом островке. См., Casanovas, O., Hicklin, D. J., Bergers, G. & Hanahan, D. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell 8, 299-309 (2005). Другие исследователи выделяли стромальные фибробласты, которые инфильтрируют опухоли, в качестве возможного источника альтернативных проангиогенных факторов. См., например, Dong, J. et al. VEGF-null cells require PDGFR alpha signaling-mediated stromal fibroblast recruitment for tumorigenesis. Embo J 23:2800-10 (2004); и Orimo, A. et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell 121:335-48 (2005).
Воспалительные клетки могут участвовать в ангиогенезе посредством секреции воспалительных цитокинов, которые могут влиять на активацию клеток эндотелия, их пролиферацию, миграцию и выживаемость (рассмотрено в Albini et al. и Balkwill et al. in Albini, A., Tosetti, F., Benelli, R. & Noonan, D. M. Tumor inflammatory angiogenesis and its chemoprevention. Cancer Res 65: 10637-41 (2005); и Balkwill, F., Charles, K. A. & Mantovani, A. Smoldering and polarized inflammation in the initiation and promotion of malignant disease. Cancer Cell 7:211-7 (2005)). Некоторые воспалительные клетки, которые инфильтрируют опухоли, секретируют проангиогенные факторы, включая моноциты/макрофаги (см., например, De Palma, M. et al. Tie2 identifies a hematopoietic lineage of pro-angiogenic monocytes required for tumor vessel formation and a mesenchymal population of pericyte progenitors. Cancer Cell 8:211-26 (2005); и, Yang, L. et al. Expansion of myeloid immune suppressor Gr+CD11b+ cells in tumor-bearing host directly promotes tumor angiogenesis. Cancer Cell 6:409-21 (2004)), T- и B-лимфоциты (см., например, Freeman, M. R. et al. Peripheral blood T-lymphocytes and lymphocytes infiltrating human cancers express vascular endothelial growth factor: a potential role for T-cells in angiogenesis. Cancer Res 55:4140-5 (1995)), васкулярные лейкоциты (см., например, Conejo-Garcia, J. R. et al. Vascular leukocytes contribute to tumor vascularization. Blood 105:679- 81 (2005)), дендритные клетки (см., например, Conejo-Garcia, J. R. et al. Tumor-infiltrating dentritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A. Nat Med 10:950-8 (2004)), нейтрофилы (см., например, Coussens, L.M., Tinkle, C.L., Hanahan, D. & Werb, Z. MMP-9 supplied by bone marrow-derived cells contributes to skin carcinogenesis. Cell 103:481-90 (2000)) и тучные клетки (см., например, Coussens, L. M. et al. Inflammatory mast cells upregulate angiogenesis during squamous epithelial carcinogenesis. Genes Dev 13:382-97 (1999); и (рассмотрено в de Visser and Coussens in de Visser, K.E., Eichten, A. & Coussens, L. M. Paradoxical roles of the immune system during cancer development. Nat. Rev. Cancer. 6:24-37 (2006)). Было выдвинуто предположение о том, что эндотелиальные клетки-предшественники, полученные из костного мозга (EPC (см., например, Lyden, D. et al. Impaired recruitment of bone-marrow-derived endothelial and hematopoietic precursor cells blocks tumor angiogenesis and growth. Nat Med 7, 1194-201 (2001)), и периваскулярные клетки-предшественники (см., например, Song, S., Ewald, A.J., Stallcup, W., Werb, Z. & Bergers, G. PDGFRbeta+ perivascular progenitor cells in tumours regulate pericyte differentiation and vascular survival. Nat. Cell. Biol. 7:870-9 (2005)) вносят вклад в образование сосудов в некоторых экспериментальных моделях опухолевого роста (рассмотрено в Rafii et al. in Rafii, S., Lyden, D.. Benezra, R., Hattori, K. & Heissig, B. Vascular and haematopoietic stem cells: novel targets for anti-angiogenesis therapy? Nat. Rev. Cancer 2:826-35 (2002)). Было показано, что миелоидная линия дифференцировки гематопоэтических клеток, включая связанные с опухолью макрофаги (TAM), стимулирует ангиогенез или напрямую посредством секреции ангиогенных факторов, или опосредованно через продукцию протеаз, расщепляющих внеклеточный матрикс, которые, в свою очередь, высвобождают изолированные ангиогенные факторы (рассмотрено в Lewis, CE. & Pollard, J. W. Distinet role of macrophages in different tumor microenviroments. Cancer Research 66:605-612 (2006); и Naldini, A. & Carraro, F. Role of inflammatory mediators in angiogenesis. Curr Drug Targets Inflamm Allergy 4:3-8 (2005)). Среди миелоидных клеточных линий дифференцировки клетки-предшественники CD11b+Gr1+, выделенные из селезенок мышей, несущих опухоли, ускоряли ангиогенез при совместной инъекции с опухолевыми клетками (см., например, Yang, L. et al. Expansion of myeloid immune suppressor Gr+CD11b+ cells in tumor-bearing host directly promotes tumor angiogenesis. Cancer Cell 6:409-21 (2004)), и количество макрофагов, которые инфильтрируют опухоли, коррелировало с неблагоприятным прогнозом в некоторых опухолях человека (рассмотрено в Balkwill et al., в Balkwill, F., Charles, K.A. & Mantovani, A. Smoldering and polarized inflammation in the initiation and promotion of malignant disease. Cancer Cell 7:211-7 (2005)). Однако в другом исследовании макрофаги ингибировали рост экспериментальных опухолей у мышей, что указывает на то, что они обладают потенциалом для противораковой терапии. См., например, Kohchi, C. et al. Utilization of macrophages in anticancer therapy: the macrophage network theory. Anticancer Res 24:3311-20 (2004). В Shojaei, F. Wu, et al. Tumor refractoriness to anti-VEGF therapy is mediated by CD11b(+)Gr1(+) myeloid cells. Nat Biotechnology 2007 25(8):911-20 сообщалось о роли миелоидных клеток CD11b(+)Gr1(+) в устойчивости опухолей к лечению антителами против VEGF. Подобные открытия раскрыты в одновременно рассматриваемой заявке США с серийным номером 11/692681, которая подана 28 марта 2007 года.
Несмотря на относительный избыток миелоидных клеток и их способность продуцировать проангиогенные факторы, их роль в устойчивости опухоли к лечению против VEGF остается неизвестной. Существует необходимость узнать и понять биологические функции миелоидных клеток, устойчивых опухолей и факторов, которые они продуцируют. Настоящее изобретение исследует эти и другие потребности, что будет ясно из обзора следующего раскрытия.
Сущность изобретения
Настоящее изобретение основано, по меньшей мере частично, на экспериментальных данных, которые указывают на то, что Bv8 регулирует мобилизацию клеток CD11b+Gr1+ из костного мозга (КМ) в процессе развития опухоли и способствует опухолевому ангиогенезу. Таким образом, настоящее изобретение относится к способам и композициям для диагностики и лечения опухолей, устойчивых к лечению с помощью антагонистов VEGF.
В одном из аспектов изобретение относится к способу лечения опухоли, который включает введение млекопитающему субъекту, такому как субъект-человек, который обладает опухолью, которую предварительно лечили антагонистом фактора роста эндотелия сосудов (VEGF), эффективного количества антагониста Bv8. Субъект-человек может быть, но не обязан быть, рефрактерным к лечению антагонистом VEGF.
В одном из вариантов осуществления антагонист VEGF представляет собой антитело против VEGF или его фрагмент, где антитело против VEGF может представлять собой, например, бевацизумаб или его фрагмент или вариант.
В другом варианте осуществления антагонист Bv8 представляет собой моноклональное антитело против Bv8 или против рецептора Bv8 или его фрагмента, где рецептор Bv8 может представлять собой PKR-1/EG-VEGFR1 или PKR-2/EG-VEGFR2. Bv8, с которым связывается антитело, представляет собой полипептид Bv8 с нативной последовательностью млекопитающего, подвергавшегося лечению. Сходным образом рецептор Bv8, с которым связывается антитело, представляет собой рецептор Bv8 с нативной последовательностью млекопитающего, подвергавшегося лечению.
Антитела или фрагменты антител могут быть химерными, гуманизированными или человеческими. В дополнительном варианте осуществления субъекту дополнительно вводили антитело против VEGF, где VEGF может представлять собой любую молекулу VEGF, в частности, включая без ограничения 165-аминокислотный фактор роста эндотелиальных клеток сосудов, и родственные 121-, 145-, 189- и 206-аминокислотные факторы роста эндотелиальных клеток сосудов, вместе с встречающимися в природе их аллельными и процессированными формами. В конкретном варианте осуществления антитело против VEGF представляет собой бевацизумаб или его фрагмент или вариант.
В другом варианте осуществления в дополнение к введению антагониста Bv8 и необязательно антагониста VEGF млекопитающего субъекта, такого как пациент-человек, лечат с помощью одного или нескольких дополнительных средств, снижающих миелоидные клетки, таких как антагонист Gr1, ингибитор эластазы, антагонист MCP-1 и/или антагонист MIP-1 альфа.
В еще одном варианте осуществления, подвергавшийся лечению млекопитающий субъект, такой как субъект-человек, подвергается химиотерапии и/или лучевой терапии, где химиотерапия может включать, например, введение цитотоксического средства. Предпочтительно, дополнительное лечение представляет собой лечение, которое известно как «мера заботливости» для лечения специфической целевой опухоли.
Опухоль может представлять собой любой вид доброкачественной или злокачественной опухоли, включая без ограничения карциному, включая аденокарциному, лимфому, бластому, меланому, саркому и лейкемию. Предпочтительным раком в настоящем документе является рак толстого кишечника, рак прямой кишки, рак легких и рак молочной железы, в частности, метастатическая карцинома толстой или прямой кишки или несквамозный немелкоклеточный рак легких (НМКРЛ).
В конкретном варианте осуществления вышеупомянутый способ дополнительно содержит стадию мониторинга эффективности лечения посредством определения количества и/или частоты циркулирующих и/или костномозговых клеток CD11b+Gr1+ в биологическом образце, полученном из млекопитающего субъекта, такого как человек, по отношению к количеству или частоте до лечения.
В другом аспекте изобретение относится к способу лечения опухоли, который включает
(a) введение млекопитающему субъекту, который несет опухоль, такому как человек, эффективного количества антагониста Bv8, и
(b) мониторинг эффективности указанного лечения посредством определения количества и/или частоты циркулирующих и/или костномозговых клеток CD11b+Gr1+ в биологическом образце, который получен от млекопитающего субъекта, такого как человек, по отношению к количеству или частоте до лечения, где сниженное количество или частота указывает на то, что лечение является эффективным.
В дополнительном аспекте изобретение относится к способу ингибирования ангиогенеза, опосредованного воспалительными клетками, у млекопитающего, такого как субъект-человек, включающий введение субъекту эффективного количества антагониста Bv8.
Антагонист может представлять собой, например, моноклональное антитело против Bv8 или против рецептора Bv8 или его фрагмент, которое может быть химерным, гуманизированным или человеческим. Bv8, с которым связывается антитело, представляет собой Bv8 с нативной полипептидной последовательностью млекопитающего, подвергавшегося лечению. Сходным образом рецептор Bv8, с которым связывается антитело, представляет собой рецептор Bv8 с нативной последовательностью млекопитающего, подвергавшегося лечению.
Способ может дополнительно содержать стадию мониторинга эффективности лечения посредством определения количества и/или частоты циркулирующих и/или костномозговых клеток CD11b+Gr1+ в биологическом образце, полученном от млекопитающего субъекта, такого как человек, по отношению к количеству или частоте до лечения.
В другом варианте осуществления способ может дополнительно содержать введение дополнительного ингибитора ангиогенеза, такого как, например, антитело к ангиогенному фактору.
Примеры ангиогенных факторов включают без ограничения фактор роста эндотелия сосудов (VEGF), ангиопоэтины, фактор роста гепатоцитов (HGF) и основной фактор роста фибробластов (bFGF).
В еще одном аспекте изобретение относится к способу для идентификации субъекта-человека, который несет опухоль, для лечения с помощью антагониста Bv8, который включает определение рефрактерности к лечению антагонистом VEGF.
В еще одном дополнительном аспекте изобретение относится к ингибированию мобилизации нейтрофилов, которая стимулируется с помощью G-CSF, посредством введения только антагониста Bv8 или его сочетания с антагонистом G-CSF.
Также изобретение касается ингибирования миграции клеток миелоидной линии дифференцировки, которая опосредована Bv8, с помощью антагонистов Bv8.
Также изобретение касается снижения количества миелоидных клеток CD11b+Gr1+ для ингибирования развития и/или роста опухоли посредством введения антагониста Bv8.
В другом аспекте изобретение относится к способу лечения опухоли, который включает введение субъекту-человеку, который несет опухоль, эффективного количества антагониста G-CSF.
В конкретном варианте осуществления антагонист G-CSF представляет собой антитело против G-CSF или фрагмент антитела. Антитело или фрагмент антитела могут быть химерными, гуманизированными или человеческими. Необязательно антагонист G-CSF вводят в сочетании с антагонистом Bv8 и/или антагонистом VEGF, такими как, например, антитело против Bv8 и/или антитело против VEGF.
В другом варианте осуществления антагонист G-CSF вводят в сочетании с другим противоопухолевым средством и/или схемой лечения, например, с химиотерапией и/или лучевой терапией.
В еще одном аспекте изобретение относится к способу для ингибирования миграции нейтрофилов у субъекта-человека, включающему введение субъекту эффективного количества антагониста Bv8.
В дополнительном аспекте изобретение относится к способу для лечения ненеопластического состояния, который благоприятным образом следует из антиангиогенной терапии и включает введение субъекту-человеку, у которого предварительно диагностировали такое ненеопластическое состояние и которого лечили антагонистом фактора роста эндотелия сосудов (VEGF), эффективного количества антагониста Bv8.
В одном из вариантов осуществления ненеопластическое состояние представляет собой рефрактерность к лечению антагонистом VEGF.
Ненеопластическое состояние может быть выбрано, например, из группы, состоящей из нежелательной или аберрантной гипертрофии, артрита, ревматоидного артрита (РА), псориаза, псориатических бляшек, саркоидоза, атеросклероза, атеросклеротических бляшек, эдемы при инфаркте миокарда, диабетических и других пролиферативных ретинопатий, ретролентальной фиброплазии, неоваскулярной глаукомы, возрастной дегенерации желтого пятна, диабетического отека желтого пятна, роговичной неоваскуляризации, неоваскуляризации трансплантата роговицы, отторжения трансплантата роговицы, неоваскуляризации сетчатки/хороидальной оболочки, неоваскуляризации угла (краснота), неоваскулярного заболевания глаза, васкулярного рестеноза, артериовенозных мальформаций (АВМ), менингиомы, гемангиомы, ангиофибромы, гиперплазий щитовидной железы (включая базедову болезнь), трансплантации роговицы и другой ткани, хронического воспаления, воспаления легких, острого повреждения легких/ОРДС, сепсиса, первичной легочной гипертензии, злокачественных экссудатов легких, отека мозга (например, связанного с острым нарушением мозгового кровообращения/закрытым повреждением головы/травмой), синовиального воспаления, образования паннуса при РА, оссифицирующего миозита, гипертрофического остеогенеза, остеоартрита (OA), рефрактерного асцита, поликистоза яичника, эндометриоза, болезней, связанных с жидкостями «третьего пространства» (панкреатита, синдрома межфасциального пространства, ожогов, заболевания кишечника), фибромы матки, преждевременных родов, хронического воспаления, такого как ВЗК (болезнь Крона и язвенный колит), отторжения аллотрансплантата почки, воспалительного заболевания кишечника, нефротического синдрома, нежелательного или аберрантного роста тканевой массы (не раковой), ожирения, роста массы жировой ткани, гемофилической артропатии, гипертрофированных рубцов, ингибирования роста волос, синдрома Ослера-Вебера, пиогенной глаукомы, ретролентальных фиброплазий, склеродермии, трахомы, слипания сосудов, синовита, дерматита, предэклампсии, асцита, перикардиального выпота и плеврального выпота.
В еще одном дополнительном аспекте изобретение относится к нейтрализующему антителу против Bv8 и композиции, которая содержит такое антитело.
В конкретном варианте осуществления нейтрализующее антитело связывается по существу с тем же эпитопом или с тем же эпитопом, что и мышиное антитело 3F1 или 2B9 против Bv8. Как и ранее, антитело может представлять собой фрагмент антитела и может быть химерным, гуманизированным или человеческим.
Краткое описание чертежей
На всем протяжении описания, КМ=костный мозг и ПК=периферическая кровь.
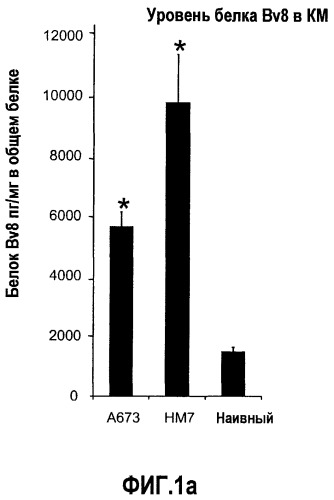
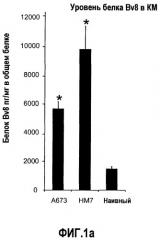
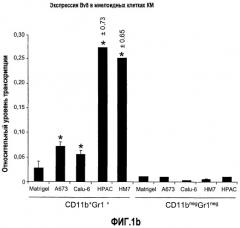
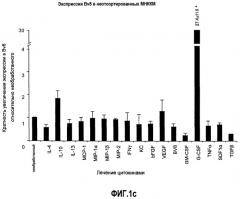
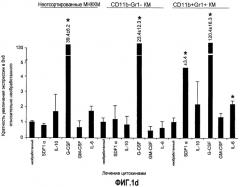
Фиг.1. Регулирование экспрессии Bv8 и активности в клетках КМ. a. Опухоли индуцируют экспрессию белка Bv8 в КМ. Бежевым голым мышам имплантировали опухолевые клетки A673 или HM7. Специфический ELISA показал более высокие (p<0,05) уровни Bv8 в МНККМ у мышей с имплантированной опухолью по отношению к мышам с имплантированным Matrigel™ через шесть дней. b. Экспрессия Bv8 в особенности апрегулировалась в подклассе CD11b+Gr1+ клеток КМ. Бежевым голым мышам имплантировали клетки A673, HM7, HPAC, Calu-6 и Jurkat. Через 10 дней миелоидные клетки CD11b+Gr1+ выделяли из КМ мышей и Taqman™-анализ определил экспрессию Bv8 в миелоидных и немиелоидных (CD11b-Gr1-) подклассах. Сноски указывают на значительные различия (p<0,05) при сравнении CD11b+Gr+ для каждой опухоли в соответствующей CD11b-Gr1- популяции, c. G-CSF является основным индуктором экспрессии Bv8. МНККМ выделяли из наивных мышей и инкубировали с сериями цитокинов и хемокинов и экспрессию Bv8 оценивали с помощью Taqman™, как описано в способах. d. G-CSF является основным индуктором Bv8 в клетках CD11b+Gr1+. МНККМ выделяли из мышей Balb-c и сортировали на CD11b+Gr1+ и CD11b-Gr1- подклассы с помощью клеточного сортера с возбуждением флуоресценции. Цельный КМ, популяции CD11b+Gr1+ и CD11b-Gr1- обрабатывали с использованием SDF1α, G-CSF и GM-CSF, как описано в способах. e. Гипоксия увеличивает апрегуляцию Bv8 посредством G-CSF в миелоидных клетках. КМ CD11b+Gr1+ инкубировали с G-CSF в концентрациях 20 или 2500 пг/мл как в условиях нормоксии, так и гипоксии (1% O2) в течение 4 часов. f. Уровни Bv8 значительно повышены в КМ после инъекции G-CSF. Мышам Balb-c делали подкожную инъекцию G-CSF в день 0 и затем ежедневно в течение 8 дней. Образцы КМ забирали в дни 1, 3, 6 и 8 и уровни белка Bv8 измеряли, как описано. g. Лечение антагонистом G-CSF ингибирует апрегуляцию Bv8, которую вызвал G-CSF. Свежевыделенные МНККМ инкубировали с опухолевым лизатом HM7 и различными концентрациями антагониста G-CSF, как указано. Экспрессию Bv8 наблюдали в МНККМ с помощью Taqman™. h. Антагонист G-CSF снижает уровень Bv8 в КМ мышей, которые не несут опухоль. Голых мышей Balb/c обрабатывали с использованием PBS, контрольного IgG и антагониста G-CSF и уровни Bv8 в МНККМ измеряли посредством ELISA, как описано в способах. i. Антагонист G-CSF снижает уровень Bv8 в КМ мышей, которые несут опухоль HM7. Подробности см. в способах. Через сорок восемь часов после имплантации опухоли или Matrigel™, уровни белка Bv8 измеряли в МНККМ, как описано. j. Bv8 играет роль в мобилизации нейтрофилов, которая вызвана G-CSF. Голых мышей Balb/c лечили интраперитонеально с использованием нескольких средств, включая антитела против G-CSF, против Bv8, контрольные мАТ и контрольный IgG дважды за 12 часов, как описано в способах. У всех мышей было кровотечение через 6 часов после последней инъекции, и частоту клеток CD11b+Gr1+ определяли на проточном цитометре FACSCalibur (Becton Dickinson), как описано.
Фиг.2. Влияние антител против Bv8 на рост линий опухолевых клеток, которые трансплантировали в голых мышей. Опухолевые клетки A673 (a), HM7 (b), HPAC (c) и Jurkat (d) имплантировали в голых мышей Balb-c, как описано в тексте. Лечение с использованием контрольных мАТ (против Ragweed), мАТ против Bv8 или против VEGF-A (n~10) инициировали через 24-48 часов после инокулирования опухолевых клеток. Объем опухолей измеряли дважды в неделю. Массу опухоли определяли в конце эксперимента. Данные приведены в виде средних значений + средняя квадратичная ошибка средней (SEM). Сноски указывают на значительную разницу для мАТ против Bv8 или против VEGF по сравнению с контрольными группами лечения (p<0,05). e. МАТ против Bv8 и против VEGF обладают дополнительным эффектом по ингибированию роста опухолей, устойчивых к мАТ против VEGF. Бежевым голым мышам имплантировали клетки TIB42 и обрабатывали с использованием контрольных антител, антител против Bv8, антител против VEGF и антител против Bv8 плюс антитела против VEGF. На вложенной диаграмме приведены конечные массы опухолей во всех четырех группах лечения. C: контроль, AV: АТ против VEGF, AB: АТ против Bv8.
Фиг.3. Лечение с использованием АТ против Bv8 снижает клетки CD11b+Gr1+ в ПК и в опухолях в некоторых моделях, a и b. Голым мышам (n=5) имплантировали клетки A673, Calu6, HM7, HPAC и Jurkat. Затем мышей лечили с использованием мАТ против Bv8 или контрольных мАТ, как описано в способах. Анализ осуществляли через 10 дней после имплантирования опухоли, и частоту клеток CD11b+, Gr1+ и CD11b+Gr1+ измеряли в ПК (a) и опухолях (b), как описано. На вложенной диаграмме в части a приведена частота клеток CD11b+, Gr1+ и CD11b+Gr1+ в мышах Matrigel™. c и d. Внутриопухолевая инъекция КМ CD11b+Gr1+ может превосходить ингибирование роста при лечении с использованием мАТ против Bv8. Голым мышам имплантировали опухоли A673 (c) и HM7 (d) и их лечили с использованием мАТ против Bv8 или контрольных мАТ. На 7-й день (обозначено стрелками) клетки CD11b+Gr1+ выделяли из КМ мышей, праймировали опухолями A673 и HM7 с использованием бус с CD11b+. Очищенную популяцию инъецировали непосредственно в мышей, несущих опухоли, и лечение продолжали, как описано.
Фиг.4. Bv8 регулирует опухолевый ангиогенез. Иммунодефицитным мышам имплантировали 5·106 клеток HM7, как описано. Через 5 дней после имплантации мышам инъецировали 107 КОЕ Av-Bv8, Av-VEGF или Av-LacZ. a. Измерение конечного объема опухоли во всех группах лечения указывает на значительную разницу объемов опухолей Av-Bv8 и Av-VEGF по сравнению с опухолями Av-LacZ, b. Частота клеток CD11b+Gr1+ в периферической крови (ПК) была выше в мышах с Av-Bv8 по сравнению с животными с Av-VEGF и Av-LacZ. с и d. Анализ микро-КТ показал увеличенный объем сосудов (c) у мышей, которым инъецировали Bv8- и VEGF- аденовирусы по сравнению с мышами с инъекциями LacZ. e. Приведены репрезентативные изображения опухолей с инъекциями Av-LacZ, Av-VEGF и Av-Bv8. Сосудистые сети и опухоли показаны красным и серым, соответственно. f. Лечение с использованием мАТ против Bv8 ингибирует рост опухоли посредством влияния на сосуды опухоли. Голым мышам имплантировали клетки HM7 и их лечили с использованием антител против Bv8, против VEGF или контрольных антител. В соответствии с данными на фиг.2b, лечение с использованием как АТ против Bv8, так и АТ против VEGF привело к значительному ингибированию роста опухоли по сравнению с контролем. g. Лечение с использованием АТ против Bv8 снижает частоту циркулирующих CD11b+Gr1+ в ПК по сравнению с АТ против VEGF и контролем. h и i. Анализ микро-КТ, описанный выше, показал значительное снижение объема сосудов (h) и плотности сосудов (i) для АТ против Bv8 по сравнению с контрольными мышами. Степень ингибирования схожа с таковой, обеспечиваемой при лечении с использованием мАТ против VEGF. j. Репрезентативные ангиографические данные микро-КТ приведены для лечения с использованием мАТ против Bv8, против VEGF и контроля. Сосудистые сети и опухоли показаны красным и серым, соответственно.
Фиг.5. Лечение с использованием мАТ против VEGF индуцирует экспрессию Bv8. a-d. Голым мышам имплантировали клетки HM7 и обрабатывали с использованием мАТ против VEGF или контрольных мАТ, как описано. Концентрации белка Bv8 измеряли в КМ (a), ПК (b), селезенке (c) и опухолях (d) на 1, 3, 6, 9, 12 и 15 день после имплантирования опухоли. Все эксперименты осуществляли параллельно с наивными мышами, которым имплантировали Matrigel™. e. Данные ИГХ, дополнительно подтверждающие инфильтрацию нейтрофилами у животных с имплантированными A673 и HM7. Предоставлены фиксированные в формалине срезы из мышей, которые несли A673 или HM7 и которых лечили с использованием контроля, антител против Bv8 или против VEGF в течение 15 дней. Срезы окрашивали антителами против Gr1, как описано в «Способах». f. Клетки CD11b+ являются основными источником Bv8 в опухолях. Бежевым голым мышам имплантировали клетки A673, Calu-6, HM7, HPAC и Jurkat и их умерщвляли через 10 дней после трансплантации опухолевых клеток. Популяции клеток, обогащенных CD11b+, выделяли с использованием микробус CD11b, как описано. Экспрессию Bv8 анализировали с использованием праймеров Taqman™, которые специфичны к мышиным транскриптам Bv8. Данные нормализовали с использованием мышиной GAPDH.
Фиг.6. АТ против Bv8 обладало дополнительными эффектами при использовании с АТ против VEGF или цитотоксической химиотерапией. a и b. Лечение с использованием АТ против Bv8 является наиболее эффективным, когда лечение инициируют на ранней стадии развития опухоли. Голым мышам имплантировали опухоли HM7 (a) и A673 (b) и не назначали какого-либо лечения до тех пор, пока опухоли не достигали ~400 мм3. Затем мышей лечили контролем, антителами против Bv8, против VEGF или сочетанием (АТ против VEGF плюс АТ против Bv8). Объем опухоли измеряли, как описано. *Обозначает значительную разницу (p<0,05) объемов опухолей при комбинированном лечении по сравнению с монотерапией с использованием АТ против VEGF. c и d. АТ против Bv8 обладает дополнительным действием на опухоли, устойчивые к лечению АТ против VEGF, при использовании в сочетании с АТ против VEGF. Голым мышам (c) и мышам C57B1/6 (d) имплантировали клетки EL4 и подвергали лечению с использованием контроля, АТ против Bv8, АТ против VEGF или сочетания. Объем опухоли и конечную массу опухоли измеряли, как описано. *Обозначает значительную разницу (p<0,5) объемов опухолей в контроле по сравнению с каждым видом монотерапии или комбинированным лечением. Разницы объемов опухолей также значительны при сравнении сочетания с каждым видом монотерапии. e. Лечение цисплатином и антителом против VEGF увеличивает концентрацию Bv8 в сыворотке. Бежевым голым мышам имплантировали клетки A673 и их лечили с использованием PBS, цисплатина (5 мг/кг) плюс контрольное антитело, цисплатина плюс АТ против Bv8 или цисплатина плюс АТ против VEGF или сочетания цисплатина, АТ против Bv8 и АТ против VEGF. Концентрации белка Bv8 в сыворотке измеряли с помощью ELISA. f. Химиотерапия плюс АТ против VEGF и АТ против Bv8 могут эффективно подавлять рост опухоли в установившихся опухолях A673. Бежевым голым мышам инъецировали клетки A673 и назначали лечение, как указано выше, через 13 дней после имплантации опухолевых клеток. *Обозначает значительную разницу (p<0,05) между способами комбинированного лечения и цисплатином плюс контроль.
Фиг.7. Нуклеотидная последовательность (SEQ ID NO:1) кДНК, которая кодирует гомолог Bv8 человека. Жирным и подчеркнутым шрифтом обозначены позиции, которые соответствуют стартовому кодону и стоп-кодону.
Фиг.8. Аминокислотная последовательность (SEQ ID NO:2) полипептида гомолога Bv8 человека, которая получена из кодирующей последовательности из SEQ ID NO:1. Предполагаемая сигнальная последовательность состоит из аминокислот с 1 по 21.
Фиг.9. Нуклеотидная последовательность (SEQ ID NO:3) кДНК, которая кодирует вариант альтернативного сплайсинга гомолога Bv8 человека. Жирным и подчеркнутым