Способ получения мороновой кислоты
Иллюстрации
Показать всеИзобретение относится к органической химии, а именно к усовершенствованному способу получения мороновой кислоты в три стадии из аллобетулина с выходом 58%. Результаты могут быть использованы в химии, медицинской химии, фармации. Способ получения мороновой кислоты заключается в обработке 3β,28-диацетоксиолеан-18(19)-ена спиртовым раствором щелочи при кипячении, последующем выделении образующегося 3β,28-дигидроксиолеан-18(19)-ена, который обрабатывают реактивом Джонса при мольном соотношении 3β,28-дигидроксиолеан-18(19)-ен : реактив Джонса, равном 1:10 в ацетоне, с последующим перемешиванием реакционной смеси в течение 4-5 часов при температуре при 0-+5°С и выделении целевого продукта, где 3β,28-диацетоксиолеан-18(19)-ен получают взаимодействием аллобетулина с уксусным ангидридом в присутствии каталитического количества хлорной кислоты при мольном соотношении аллобетулин:уксусный ангидрид:хлорная кислота, равном 1:100:0,1 при кипячении в течение 15-20 часов с последующим выделением продукта. 1 з.п. ф-лы, 1 пр.
Реферат
Изобретение относится к органической химии, а именно к способу получения мороновой кислоты (3-оксоолеан-18(19)-ен-28-овой кислоты) формулы (1):
Мороновая кислота и ее производные обладают разнообразной биологической активностью. Показано, что отвар корней растения Ozoroa mucronata (семейство Сумаховых), содержащий в качестве активного компонента мороновую кислоту, используется в африканской народной медицине для лечения кишечных расстройств, дизентерии, диареи [Hostettmann-Kaldas M., Nakanishi К. название // J. Med. Plant. Res., 1979, Vol.37, p.358-360]. Мороновая кислота обладает противовирусной активностью в отношении вируса герпеса ВГП-1 (ЕС50 3.9 мкМ, TI 10.3-16.3) [Kurokawa M., Basnet P., Ohsugi M., Hozumi Т., Kadota S., Namba Т., Kawana Т., Shiraki K. Anti-herpes simplex virus activity of moronic acid purified from Rhus javanica in vitro and in vivo. // J. Pharm. Exp.Ther., 1999, Vol.289, p.72-78], вируса иммунодефицита человека ВИЧ-1 (ЕС50<0.1 мкМ, TI>186) [Sun I.C., Kashiwada Y., Morris-Natschke S.L., Lee K.-H. Plant-derived terpenoids and analogues as anti-HIV agents. // Curr. Top.Med. Chem., 2003, Vol.3, p.155-169], является новым агентом, ингибирующим лизирующий цикл вируса Эпштейна-Барра [Chang F.-R., Hsieh Y.-Ch., Chang Y.-F., Lee K.-H., Wu Y.-Ch., Chang L.-K. Inhibition of the Epstein-Barr virus lytic cycle by moronic acid. // Antiviral Res., 2010, Vol.85, No.3, p.490-495]. Производные мороловой кислоты, особенно амид 3',3'-диметилсукцинилмороловой кислоты с L-лейцином, являются новыми перспективными анти-ВИЧ-агентами [Yu D., Sakurai Y., Chen C.H., Chang F.R., Huang L., Kashiwada Y., Lee K.-H. Anti-AIDS agents 69. Moronic acid and other triterpene derivatives as novel potent anti-HIV agents. // J. Med. Chem., 2006, Vol.49, No.18, p.5462-5469; Lee K.-H., Chang F.R., Sakurai Y., Chen C.H. Anti-retroviral moronic acid derivatives. Patent WO 2006001964 (2006)]. Среди производных мороловой кислоты обнаружены ингибиторы гликогенфосфорилазы [Zhang P. Hao J., Liu J., Jun L., Zhang L., Sun H. Efficient synthesis of morolic acid and related triterpenes starting from betulin. // Tetrahedron, 2009, Vol.65, No.22, p.4304-4309]. Выделенная из растения вида aulacocarpa (род Акация) 3,21-диоксоолеан-18(19)-еновая кислота стала первым природным небелковым ингибитором Тiе2-киназы [Zhou B.-N., Johnson R.K., Mattern M.R., Fisher P.W., Kingston D.G. I. The first naturally occurring tie2 kinase inhibitor. // Org. Lett., 2001, Vol.3, No.25, p.4047-4049].
В то же время содержание мороновой и мороловой кислот в природных источниках очень незначительно [Kurokawa M., Basnet P., Ohsugi M., Hozumi Т., Kadota S., Namba Т., Kawana Т., Shiraki K. Anti-herpes simplex virus activity of moronic acid purified from Rhus javanica in vitro and in vivo. // J. Pharm. Exp. Ther., 1999, Vol.289, No.1, p.72-78; Ito J., Chang F.-R., Wang H.-K., Park Y.K., Ikegaki M., Kilgore N., Lee K.-H. Anti-AIDS Agents. 48. Anti-HIV activity of moronic acid derivatives and the new melliferone-related triterpenoid isolated from brasilian propolis. // J. Nat Prod., 2001, Vol.64, No.10, p.1278-1281; Rios M.Y., Salinas D., Villarreal M.L.Cytotoxic activity of moronic acid and identification of the new triterpene 3,4-seco-olean-18-ene-3,28-diolic acid from Phoradendron reichenbachianum. // Planta Med., 2001, Vol.67, No.5, p.443-446], поэтому представляется актуальной разработка методов их синтеза из доступного сырья. Наиболее привлекательным исходным соединением для синтеза мороновой кислоты на сегодняшний день является бетулин - тритерпеноид, широко распространенный в природе и легко получаемый практически в любом количестве [Cinta Pinzaru S., Leopold N., Kiefer W. Vibrational spectroscopy ofbetulinic acid HIV inhibitor and of its birch bark natural source. // Talanta, 2002, Vol.57, p.625-631; Hayek E.W.H., Jordis U., Moche W., Sauter F. A bicentennial of betulin. // Phytochemistry, 1989, Vol.28, No.9, p.2229-2242].
Результаты изобретения могут быть использованы в химии, медицинской химии, фармации.
Известные способы получения мороновой кислоты основаны на использовании в качестве исходных соединений бетулина или его производных (28-оксоаллобетулона). Выход мороновой кислоты в пять стадий из 28-оксоаллобетулона составляет 34% [Флехтер О.Б., Медведева H. И., Толстиков Г.А., Галин Ф.З., Юнусов М.С., Нгуен Тхи Май X., Лье Вьет Т., Савинова О.В., Бореко Е.И., Титов Л.П., Глухов И.В. Синтез производных олеан-18(19)-ена из бетулина. // Биоорганическая химия, 2009, Т.35, №2, с.233-239]. Выход мороновой кислоты в 10 стадий из бетулина составляет 30% [Zhang P., Нао J., Liu J., Zhang L., Sun H. Efficient synthesis of morolic acid and related triterpenes starting from betulin. // Tetrahedron, 2009, Vol.,65, No.22, p.4304-4309].
Задача, на решение которой направлено заявляемое изобретение, заключается в разработке более простого способа получения мороновой кислоты из аллобетулина.
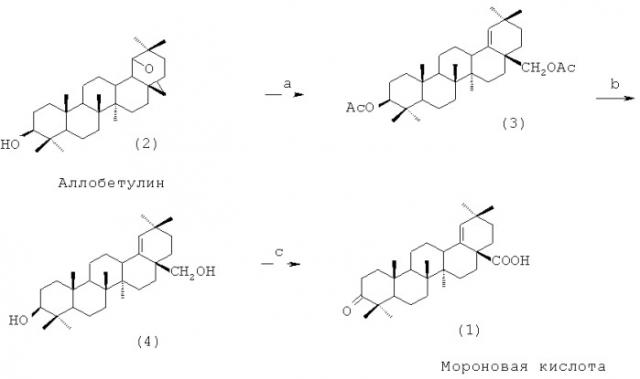
Предлагаемый трехстадийный способ получения мороновой кислоты (1) заключается в превращении аллобетулина (2), получаемого согласно [RU 2402561 27.10.2010], в 3β,28-диацетоксиолеан-18(19)-ен (3) с выходом 73% путем воздействия на аллобетулин (2) уксусного ангидрида и каталитического количества хлорной кислоты при кипячении в течение 15-20 ч; превращении 3β,28-диацетоксиолеан-18(19)-ена (3) в 3β,28-дигидроксиолеан-18(19)-ен (4) согласно [Флехтер О.Б., Медведева H. И., Толстиков Г.А., Галин Ф.З., Юнусов М.С., Нгуен Тхи Май X., Лье Вьет Т., Савинова О.В., Бореко Е.И., Титов Л.П., Глухов И.В. Синтез производных олеан-18(19)-ена из бетулина. // Биоорганическая химия, 2009, Т.35, №2, с.233-239] с последующим превращением 3β,28-дигидроксиолеан-18(19)-ена (4) в 3-оксоолеан-18(19)-ен-28-овую (мороновую) кислоту (1) согласно [Флехтер О.Б., Медведева H.И., Толстиков Г.А., Галин Ф.З., Юнусов М.С., Нгуен Тхи Май X., Лье Вьет Т., Савинова О.В., Бореко Е.И., Титов Л.П., Глухов И.В. Синтез производных олеан-18(19)-ена из бетулина. // Биоорганическая химия, 2009, Т.35, №2, с.233-239]. Общий выход мороновой кислоты (1) из расчета на аллобетулин (2) составляет 58%. В литературе упоминается об образовании производного олеан-18(19)-ена как минорного соединения (выход не более 8%) в смеси из четырех продуктов реакции, полученных в результате воздействия на аллобетулин бензоилхлорида [Klinot J., Vystrcil A. Nebenprodukte bei der umsetzung von allobetulin zu heterobetulin. // Collect. Czech. Chem. Commun., 1964, Vol.29, p.516-530].
Условия: а. Ас2О, HClO4, кипячение, 15-20 ч; b. 5% KOH/EtOH, кипячение; с. реактив Джонса, ацетон, 0 - +5°С
Сущность изобретения состоит в том, что аллобетулин (2), полученный из бетулина согласно [RU 2402561 27.10.2010], растворяют в уксусном ангидриде, прикалывают каталитическое количество хлорной кислоты при мольном соотношении аллобетулин:уксусный ангидрид:хлорная кислота, равном 1:100:0.1, реакционную массу кипятят в течение 15-20 ч с обратным холодильником. Растворитель упаривают, продукт реакции промывают водой, сушат на воздухе, очищают колоночной хроматографией и получают 3β,28-диацетоксиолеан-18(19)-ен (3) с выходом 73%. Далее 3β,28-диацетоксиолеан-18(19)-ен (3), согласно [Флехтер О.Б., Медведева Н.И., Толстиков Г.А., Галин Ф.З., Юнусов М.С., Нгуен Тхи Май X., Лье Вьет Т., Савинова О.В., Бореко Е.И., Титов Л.П., Глухов И.В. Синтез производных олеан-18(19)-ена из бетулина. // Биоорганическая химия, 2009, Т.35, №2, с.233-239], кипятят в 5% растворе KOH в этаноле с контролем окончания реакции методом тонкослойной хроматографии, после выделения реакционной массы получают 3β,28-дигидроксиолеан-18(19)-ен (4) с выходом 93%. Далее 3β,28-дигидроксиолеан-18(19)-ен (4), согласно [Флехтер О.Б., Медведева Н.И., Толстиков Г.А., Галин Ф.З., Юнусов М.С., Нгуен Тхи Май X., Лье Вьет Т., Савинова О.В., Бореко Е.И., Титов Л.П., Глухов И.В. Синтез производных олеан-18(19)-ена из бетулина. // Биоорганическая химия, 2009, Т.35, №2, с.233-239], растворяют в ацетоне и прибавляют реактив Джонса при мольном соотношении 3β,28-дигидроксиолеан-18(19)-ен:реактив Джонса, равном 1:10. Реакционную массу перемешивают при 0 - +5°C в течение 4-5 ч, обрабатывают, продукт перекристаллизовывают и получают мороновую кислоту (1) с выходом 85%. Общий выход мороновой кислоты (1) из расчета на аллобетулин (2) составляет 58%.
Таким образом, предложенный способ получения мороновой кислоты в три стадии из аллобетулина с выходом 58% имеет следующие преимущества перед известными методами: минимальное количество стадий, повышение общего выхода, возможность масштабирования синтеза до сотен граммов.
Сущность изобретения демонстрируется следующим примером.
Пример
3β,28-Диацетоксиолеан-18(19)-ен (3). К раствору 1 ммоль (0.53 г) аллобетулина (2), полученного из бетулина, как описано выше, в 10 мл (100 ммоль) уксусного ангидрида прикалывают 0.008 мл (0.1 ммоль) хлорной кислоты и кипятят с обратным холодильником в течение 15 ч. Реакционную массу упаривают, остаток промывают водой до нейтральной реакции, сушат на воздухе, продукт хроматографируют на колонке с окисью алюминия, элюируя последовательно петролейным эфиром, смесью петролейный эфир - бензол (1:1). Выход 0.38 г (73%). Rf 0.90. Т.пл. 272-273°C (CHCl3-МеОН). (с 0.12, CHCl3). (Лит. [Barton D.H.R, Brooks C.J.W. //J. Chem. Soc. 1951. P.257-277.]: т.пл. 273°C. ). Найдено, %: C 77.95; H 10.61. C34H54O4 (Mr 526.797). Вычислено, %: C 77.52; H 10.33. Спектр 1Н-ЯМР: 0.76, 0.83, 0.83, 0.90, 0.95, 0.96, 1.04 (21 H, 6 с, 7 CH3), 1.10-1.90 (23 Н, м, CH2, CH), 2.00 и 2.01 (6 Н, 2 с, 2 OAc), 3.45 и 3.60 (по 1 Н, два д, J 10.7, H28), 4.43 (1 Н, дд, J6, J9, H3), 5.05 (1 Н, уш. с, H19). Спектр 13С-ЯМР: 14,9, 16.3, 16.6, 16.9, 18.5, 21.4, 21.4, 24.0, 25.5, 26.6, 27.7, 28.0, 29.9, 30.7, 31.5, 31.8, 32.5, 33.6, 34.9, 37.5, 38.1, 39.0, 39.1, 39.9, 41.2, 43.4, 51.4, 55.9, 65.5 (С28), 81.1 (С3), 134.4 (С18), 139.3 (С19), 171.0, 171.2.
3β,28-Дигидроксиолеан-18(19)-ен (морадиол) (4). Раствор 1 ммоль (0.51 г) соединения (3) в 30 мл 5% KOH/EtOH кипятят с обратным холодильником с контролем по ТСХ. Реакционную массу нейтрализуют 5% раствором HCl, осадок отфильтровывают, промывают водой, сушат на воздухе. Выход 0.47 г (93%). Rf 0.43. Т.пл. 248-249°C (CHCl3-МеОН). (с 1.00, CHCl3). (Лит. [Barton D.H.R., Brooks C.J.W. // J. Chem. Soc. 1951. P.257-277.]: т.пл. 220°C. ). Найдено, %: С 81.02; Н 11.45. C30H50O2 (Мr 442.723). Вычислено, %: C 81.39; H 11.38. Спектр 1Н-ЯМР: 0.77, 0.78, 0.88, 0.95, 0.98, 1.06 (21 Н, 6 с, 7 CH3), 1.10-1.85 (25 Н, м, СН2, СН), 3.21 (1 Н, дд, J 5.5, 11, H3), 3.47 и 3.65 (2 Н, оба д,.J 11, Н28), 5.15 (1 Н, с, Н19). Спектр 13С-ЯМР: 14.8, 15.6, 16.1, 16.6, 18.2, 20.9, 25.3, 26.2, 27.4, 27.9, 29.8, 30.4, 30.9, 31.3, 31.7, 32.5, 33.3, 34.6, 37.2, 38.6, 38.9, 39.5, 40.8, 43.5, 51.4, 55.8, 65.4 (С28), 78.9 (С3), 134.5 (С19), 138.6 (С18).
3-Oксоолеан-18(19)-ен-28-овая (мороновая) кислота (1). К раствору 0.46 г (1 ммоль) соединения (4) в 30 мл ацетона прибавляют 5.71 мл (10 ммоль) реактива Джонса и перемешивают 4 ч при 0°C. Далее добавляют 3 мл EtOH, растворитель упаривают в вакууме, остаток разбавляют 50 мл воды, осадок отфильтровывают, промывают водой, высушивают и перекристаллизовывают из смеси хлороформ-метанол. Выход 0.39 г (85%). Rf 0.46. Т.пл. 213-214°C (EtOH). (с 1.00, CHCl3). (Лит. [Hostettmann-Kaldas М., Nakanishi К. // J. Med. Plant. Res. 1979. V.37. P.358-360.]: т.пл. 210-212°C, Найдено, %: C 79.40; H 10.56. C30H46O3 (Mr 54.690). Вычислено, %: C 79.25; H 10.20. Спектр 1H-ЯМР: 0.78, 0.93, 0.97, 1.00, 1.02, 1.05, 1.08 (21 Н, 7 с, 7 CH3), 1.10-2.20 (23 Н, м, CH2, CH), 2.50-2.55 (1 Н, м, H2), 5.10 (1 Н, с, Н19). Спектр 13С-ЯМР: 14.7, 15.7, 16.4, 19.5, 20.8, 21.4, 25.9, 26.7, 29.0, 29.2, 30.2, 31.9, 33.1, 33.3, 33.4, 33.6, 33.9, 36.8, 39.7, 40.4, 41.3, 42.4, 47.1,47.8, 50.3, 54.7, 133.3 (С19), 136.4 (С18), 181.9 (С28), 218.3 (С3).
1. Способ получения мороновой кислоты путем обработки 3β,28-диацетоксиолеан-18(19)-ена спиртовым раствором щелочи при кипячении, последующего выделения образующегося 3β,28-дигидроксиолеан-18(19)-ена, который обрабатывают реактивом Джонса при мольном соотношении 3β,28-дигидроксиолеан-18(19)-ен: реактив Джонса, равном 1:10 в ацетоне, с последующим перемешиванием реакционной смеси в течение 4-5 ч при температуре при 0-5°С и выделением целевого продукта, отличающийся тем, что 3β,28-диацетоксиолеан-18(19)-ен получают взаимодействием аллобетулина с уксусным ангидридом в присутствии каталитического количества хлорной кислоты при мольном соотношении аллобетулин:уксусный ангидрид:хлорная кислота, равном 1:100:0,1 при кипячении в течение 15-20 ч с последующим выделением продукта.
2. Способ по п.1, отличающийся тем, что в качестве спиртового раствора щелочи используют 5%-ный раствор едкого кали в этаноле.