Универсальный способ селективного извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных растворов с помощью нанопористых материалов
Иллюстрации
Показать всеГруппа изобретениий относится к области производства переходных, редкоземельных и актиноидных металлов и их солей. Способ включает селективное извлечение солей в объемах нанопор нанопористых электропроводящих материалов за счет эффекта электростатического взаимодействия дипольных моментов сольватированных ионных комплексов переходных, редкоземельных и актиноидных элементов с электрическим полем двойного электрического слоя границы раздела "стенка нанопоры - раствор". Способ ведут путем последовательного заполнения нанопоры нанопористого электропроводящего материала раствором, содержащим ионные комплексы переходных, и/или редкоземельных, и/или актиноидных элементов, вытеснения из нанопоры слабо локализованных в нанопорах ионных комплексов переходных, редкоземельных и актиноидных элементов давлением газов или жидкостей, заполнения нанопоры раствором неорганической кислоты высокой концентрации, извлечения из нанопор остаточных ионных комплексов переходных, редкоземельных и актиноидных элементов давлением газов или жидкостей. Способ можно вести в электрохимической ячейке. Техническим результатом является получение дешевых и конкурентоспособных соединений вышеупомянутых элементов высокой технической чистоты. 2 н. и 43 з.п. ф-лы, 18 ил., 5 пр.
Реферат
Область техники
Изобретение относится к области производства переходных, редкоземельных и актиноидных металлов и их соединений, в частности к технологии селективного извлечения солей из многокомпонентных растворов с получением соединений или концентратов высокой чистоты указанных элементов.
Предшествующий уровень техники
Известны различные химические, физические, электрохимические и другие способы извлечения переходных, редкоземельных и актиноидных элементов из их соединений и растворов, которые широко применяются на практике для получения солей переходных, редкоземельных и актиноидных элементов. В основе получения указанных элементов лежит использование особенностей их химических, физических, электрохимических и других свойств. Достаточно распространенным способом является селективное извлечение из растворов солей, полученных из руд с низким содержанием переходных, редкоземельных и актиноидных элементов, а также из промышленных и золошлаковых отходов. Способ селективного извлечения из растворов позволяет получить переходные, редкоземельные и актиноидные металлы и их соли высокой чистоты.
Обычно для селективного извлечения из растворов соединений каждого конкретного элемента используют отдельные способы, принципы селективного извлечения которых базируются на индивидуальных свойствах ионных комплексов конкретного элемента. Это, как следствие, приводит к существенному усложнению технологии извлечения, увеличению количества и перечня используемых химических реактивов и вспомогательных материалов, что удорожает стоимость извлеченных материалов. В настоящее время нет универсального способа извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных растворов. Очевидно, что наличие универсального способа извлечения элементов из раствора приведет, во-первых, к широкому применению этого способа и, во-вторых, к существенному снижению стоимости и повышению конкурентоспособности полученных материалов.
В настоящее время известны различные способы селективного извлечения переходных, редкоземельных и актиноидных элементов, которые по сущности являются наиболее близкими аналогами предлагаемого изобретения.
В патенте US 6,471,743 авторы раскрывают способы извлечения титана Ti и других переходных металлов (Со, Ni, Cu, Mo, Zn, Au и Ag) из руды путем растворения руды с использованием кислот, в частности серной кислоты с концентрацией до 500 г/л. Время растворения в серной кислоте составляет от 50 до 120 часов. Для селективного извлечения элементов с серной кислотой дополнительно используются галиды щелочных металлов и углеродные материалы, как добавка. Также используют процессы измельчения руды и подбор температуры проведения процесса. Добавка углеродных материалов служит для ускорения кинетики реакции. В качестве углеродного материала используют графит или активированный уголь.
В патенте RU №2255128 предложен способ извлечения палладия из отходов путем растворения в водном растворе, содержащем 100-140 г/л иодида калия, 60-80 г/л йода, 20-40 г/л триэтаноламина и 5-20 г/л гидроксида калия. Процесс извлечения ведут при кислотности и температуре раствора рН=7-11 и 20-40°С, соответственно. Данный способ позволяет получить палладий из отходов электронной, химической, электрохимической и ювелирной промышленности.
Способ, предложенный в патенте RU №2194801, включает электрохимическое растворение золота и/или серебра в водном растворе при температуре 10-70°С в присутствии комплексообразователя. В качестве комплексообразователя используют этилендиаминтетраацетат натрия, концентрация которого составляет 5-150 г/л. Растворение ведут при кислотности раствора рН=7-14 и плотности тока 0,2-10 А/дм2.
Авторы изобретения RU №2097438 запатентовали способ извлечения металлов из отходов, включающий выщелачивание отходов йодидными растворами, содержащими йод, отмывку выщелоченного продукта, электрохимическое выделение золота из продукционного раствора, регенерацию выщелачивающего раствора и использование его при выщелачивании. Перед выщелачиванием производят химическое обогащение последовательным извлечением из отходов тяжелых, цветных металлов и серебра, а выщелачивание ведут в две стадии. Первая стадия проводится слабокислыми йодидными растворами с повышенной концентрацией йода для извлечения основной массы золота, а вторая стадия - с пониженным содержанием йода для доизвлечения золота. Из полученных растворов электрохимическим способом извлекают золото и одновременно генерируют необходимое количество йода. Отмывку продукта от йодида и связанного йода ведут щелочными растворами с одновременной конверсией нерастворимых йодидов металлов в гидроокиси, последующей водной отмывкой и электродиализной обработкой промышленной водой. При этом выщелачивание ведут агитационным методом и при отмывке выщелоченного продукта в качестве щелочного раствора используют регенерированный продукционный раствор.
Способ извлечения и разделения цветных и редких металлов из водных растворов, состоящий из двух стадий, предложен в патенте RU №2103388. На первой стадии исходный раствор обрабатывают неорганическими осадителями с получением осадка карбонатов или гидроксидов или гидроксокарбонатов тех элементов, у которых рН осаждения более низкий. Полученный фильтрат, содержащий элементы с более высоким значением рН осаждения, выводят из процесса как готовый продукт. Полученный осадок на второй стадии используют в качестве осадителя и им обрабатывают исходный раствор. Выделенный на второй стадии осадок, содержащий чистые элементы с более низким значением рН, выводят из процесса, а фильтрат обрабатывают неорганическим осадителем так же, как и на первой стадии. На первой стадии рН осаждения поддерживают равной 2-5, на второй стадии 0,5-3.
Способ извлечения редкоземельных и радиоактивных металлов из окисленного технологически упорного сырья предложен авторами патента RU№2170775. Согласно этому изобретению, для получения редкоземельных и радиоактивных металлов из золошлаковых отходов и раствора серной кислоты приготавливают пульпу, затем подвергают ее обработке в катодной зоне электролизера в условиях, поддерживающих выделение на катоде водорода. При осуществлении способа приготавливают пульпу с соотношением твердой и жидкой фаз 5-10 и используют раствор серной кислоты концентрацией 50-30 г/л. Электровыщелачивание проводят в течение 0,25-1,5 часов, при катодной плотности тока 0,5-5 мА/см2 и температуре 18-80°С. Золошлаковый отход предварительно обрабатывают щелочным раствором при условиях концентрации 150-250 г/л и температуры 80-90°С. Время обработки находится в диапазоне 2,0-3,0 часов, а соотношение твердых и жидких фаз составляет 1/5. В качестве катода используют титан, медь, платину, никель, кобальт, хром или их сплавы.
Известен способ выделения европия, самария и гадолиния из хлоридных растворов в виде солей, показанный авторами патента SU 1774670 А1. Сущность изобретения заключается в том, что в исходную смесь РЗЭ подают серную кислоту. Полученный раствор обрабатывают в двух фильтр-прессных электролизерах. В первом электролизере раствор прокачивают через пористый углеграфитовый катод при кажущейся плотности тока 0.95-1.0 А/см2. Отделяют осадок образовавшегося сульфата европия. Маточный раствор обрабатывают во втором электролизере при кажущейся плотности тока 5-6.5 А/см2, отделяют осадок сульфата самария и получают раствор, содержащий гадолиний.
В патенте US 7,282,187 авторы раскрывают процесс селективного извлечения металлов (U, Th, Zr и Sc) из исходного сырья, содержащего указанные металлы, путем перевода их в растворимое состояние. Процесс извлечения включает следующие операции: обработка исходного сырья первой минеральной кислотой, для растворения части металлов; отделение нерастворимых осадков; обработка осадка второй минеральной кислотой для растворения оставшейся части металлов и экстракция растворенного металла из водного раствора.
Авторы патента US 5,384,104 раскрывают способы извлечения урана из осадков прямым растворением осадков в азотной кислоте и обработкой раствора карбонатом (бикарбонатом) натрия. Процесс извлечения урана состоит из следующих операций: окисление урансодержащих осадков, измельчение, сортировка по размерам частиц, растворение частиц в кислоте, нейтрализация раствора карбонатом (бикарбонатом), получение брикетов фильтрацией, промывка брикетов с получением урансодержащего фильтрата и выделение урана из фильтрата.
Согласно патенту RU 2094512 С1, для селективного извлечения урана из руды, руду подвергают дроблению, мокрому измельчению с получением пульпы и ведут при рН=4,2-2,2 в одном или нескольких аппаратах выщелачивание. Далее без проведения операции нейтрализации при рН=4,6-2,0 процесс выщелачивания совмещают с противоточной сорбцией урана, поддерживая рН в головном по ходу пульпы аппарате ионитной обработки рН 4,6-2,6 и при рН в хвостовом аппарате ионитной обработки 3,4-2,0. Температуру кислотной и ионитной обработки пульпы поддерживают 30-70°С. В качестве окислителя используют соединения марганца, десорбцию урана с насыщенного ионита осуществляют серно-азотнокислыми растворами.
В патенте US 4,341,602 авторы раскрывают способы электрохимического извлечения урана с использованием окисления и восстановления в электрохимической разделительной ячейке. Изобретение относится к процессу извлечения и увеличения концентрации урана(V1), содержащегося в органической фазе. Органическая фаза непрерывно обрабатывается в контактной зоне с водным раствором, содержащим окисляюще-восстанавливающий агент в восстановленном состоянии, и данный агент способен восстанавливать U+6 до U+4 в водном растворе. Водный раствор, используемый в процессе, выходит частично или полностью из катодной части электрохимической разделительной ячейки, находящейся под потенциалом постоянного тока, а водная фаза, выходящая из контактной зоны, частично или полностью поступает в анодную часть электрохимической разделительной ячейки.
Вышеприведенные известные способы селективного извлечения переходных, редкоземельных и актиноидных элементов и их солей из многокомпонентных растворов обладают недостатками, которые являются основными причинами, ограничивающими их широкое применение. Во-первых, очевидно, что отсутствует универсальный способ извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных растворов. Для получения предлагаемого результата используют многостадийные и сложные схемы селективного извлечения элементов или их соединений. Это существенно удорожает полученный продукт и снижает его конкурентоспособность. Во-вторых, в основном используют химические и электрохимические способы селективного извлечения, что приводит к большим расходам технологических и вспомогательных химических реагентов, а также электроэнергии. Химические и электрохимические способы селективного извлечения часто осуществляют в присутствии растворов высокой токсичности, что требует дополнительных расходов для обеспечения безопасности персонала, утилизации отходов и оказывает негативное влияние на экологию. Все вышеизложенные способы не позволяют решить задачу получения сверхвысокой чистоты извлекаемых элементов и их индивидуальных соединений.
Наиболее близким к заявляемому изобретению по технической сущности является способ разделения трехвалентного таллия (III) и трехвалентного золота (III) с помощью активированного углерода, предложенного авторами научной публикации [1]. Для разделения указанных элементов приготавливались отдельные растворы таллия (III) и золота (III). Раствор таллия (III) приготавливался растворением нитрата таллия Tl(NO)3 в 0,05 М серной кислоте. Для получения раствора с золотом (III) металлическое золото было растворено в царской водке. Далее, сухой остаток, полученный термическим испарением указанного раствора золота (III), был растворен в 1 М соляной кислоте.
Активированный углерод в количестве 100 мг был тщательно пропитан 20 мл раствором 1 М соляной кислоты, содержащего 0,02-0,2 мг Т1(III) и 0,02-2 мг Au(III). Пропитанный смешанным раствором активированный углерод был отфильтрован бумажным фильтром для удаления избыток раствора. Далее углеродная масса тщательно промывалась растворами 0,1 М соляной кислоты и 1 М азотной кислоты, а полученный раствор использовался для элементного анализа методом спектроскопии. После промывания углеродного материала он подвергался термической обработке, при температуре 600°С в течение 1 часа. Полученная зола растворялась в царской водке для элементного анализа методом спектроскопии.
Результаты элементного анализа показали, что золото Au(III) из раствора соляной кислоты в течение двух часов практически полностью абсорбируется в порах активированного углерода. При этом активированный углерод в течение одного часа абсорбирует весьма малое количество таллия Т1(III), из-за низкой скорости абсорбции Т1(III). Повторение процессов разделения золота и таллия с различными содержаниями Au(III) и Т1(III) в смешанном растворе показало, что содержание золота в золе составляет около 97%, а таллия в 1 М азотной кислоте, полученного после промывки активированного углерода, - более 98%.
Как видно из вышеуказанного способа, после термической обработки активированного углерода, атомы углерода окисляются до диоксида углерода, а золото Au(III) остается в саже. Зольность активированных углеродов обычно составляет 1-5%, в зависимости от типа использованного исходного материала и технологий для синтеза и активации. Очевидно, что содержание золота Au(III) в золе составит 0,4-20%, в зависимости от концентрации золота Au(III) в растворе и содержания золы в активированном углероде. Зола различных активированных углеродных материалов состоит, в основном, из оксидов и карбидов переходных и других элементов. Поэтому для извлечения золота из золы активированного углерода, содержащей 0,4-20% Au(III), требуется другой и достаточно трудоемкий способ селективного извлечения золота Au(III) из золы. Следовательно, несмотря на высокую эффективность извлечения Au(III) и Tl(III) из смешанного раствора с помощью активированного углерода, использование этого способа для извлечения золота и таллия в больших объемах не целесообразно. Кроме этого данный способ не позволяет получить Au(III) высокой чистоты.
Краткое описание изобретения
В настоящем изобретении раскрывается универсальный способ селективного извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных кислых растворов, содержащих ионные комплексы переходных и/или редкоземельных и/или актиноидных элементов. Селективность процесса извлечения упомянутых солей из растворов обеспечивает электростатический эффект взаимодействия дипольных моментов сольватированных ионных комплексов упомянутых элементов с электрическим полем, созданным двойным электрическим слоем (EDL) границы раздела "стенка нанопоры - раствор" в объеме нанопор нанопористых электропроводящих материалов. Согласно предложенному изобретению, селективное извлечение солей осуществляется двумя способами.
Первый способ включает следующие процессы: заполнение нанопор нанопористого материала раствором, содержащим ионные комплексы упомянутых элементов; вытеснение из нанопор слабо локализованных в нанопорах ионных комплексов упомянутых элементов давлением газов или жидкостей; заполнение нанопор нанопористого материала неорганической кислотой высокой концентрации; извлечение из нанопор остаточных ионных комплексов упомянутых элементов давлением газов или жидкостей.
Второй способ осуществляется с помощью двухэлектродной электрохимической ячейки, которая состоит из поляризуемого электрода с двойным электрическим слоем, на основе нанопористого электропроводящего материала, противоэлектрода, пористого сепаратора, разделяющего электроды ячейки, и корпуса. Второй способ включает процессы: заполнение корпуса электрохимической ячейки раствором, содержащим ионные комплексы упомянутых элементов; заполнение нанопор электрода на основе нанопористого электропроводящего материала электрохимической ячейки упомянутым раствором; вытеснение из корпуса электрохимической ячейки раствора давлением газов или жидкостей; заполнение корпуса электрохимической ячейки неорганической кислотой высокой концентрации; извлечение из нанопор остаточных ионных комплексов упомянутых элементов путем поляризации потенциала двойного электрического слоя поляризуемого нанопористого электрода электрохимической ячейки.
Согласно данному изобретению, для селективного извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных растворов используются электропроводящие нанопористые материалы. Размеры и удельный объем нанопор упомянутых нанопористых материалов находятся в диапазоне 0,2-5 нм и 0,5-1,5 см3/г, соответственно. Удельная площадь поверхности нанопористых материалов находится в диапазоне 600-1800 м2/г, а удельное электрическое сопротивление - 0,01-1000 Ом·см. Для достижения желаемых результатов селективного извлечения солей переходных, редкоземельных и актиноидных элементов из различных многокомпонентных растворов в качестве нанопористого материала используется нанопористый углеродный электропроводящий материал, или нанопористый материал из электропроводящего оксида титана, или нанопористый материал из карбида титана, или их различные смеси с различными комбинациями.
Сущность универсального способа селективного извлечения состоит в том, что, при заполнении нанопор нанопористого материала раствором, содержащим сольватированные положительные ионные комплексы переходных или/и редкоземельных или/и актиноидных элементов, которые обладают дипольным моментом µ, указанные ионные комплексы локализуются в нанопорах. Это происходит благодаря статическому взаимодействию дипольного момента µ ионных комплексов с электрическим полем Е, созданным отрицательным электрическим зарядом EDL нанопор в объеме заполненных раствором нанопор. Согласно данному изобретению, электрохимический потенциал двойного электрического слоя нанопористого материала, содержащего в нанопорах многокомпонентные кислые растворы, содержащие ионные комплексы переходных и/или редкоземельных и/или актиноидных элементов, имеет положительное значение относительно потенциала стандартного водородного электрода сравнения (SHE).
В основе предложенного универсального способа селективного извлечения лежат химические, электрохимические, физические, а также и другие свойства ионных комплексов переходных, редкоземельных, актиноидных элементов и нанопористых материалов. Тщательный выбор указанных параметров нанопористых материалов и растворов позволяет создать условия для сильной локализации в нанопорах нанопористого материала конкретного выбранного типа ионного комплекса из множества ионных комплексов упомянутых элементов, находящихся в многокомпонентном растворе. Увеличение количества процессов вытеснения смешанного раствора из нанопор нанопористого материала обеспечивает высокую селективность процесса извлечения и позволяет получить соли высокой чистоты упомянутых элементов.
Предлагаемый уникальный способ извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных растворов с помощью нанопористых материалов позволяет проводить каскадный процесс извлечения. При этом в каждом каскаде могут использоваться нанопористые материалы, как с одинаковыми, так и с различными параметрами. Каскадный процесс извлечения позволяет получить соли упомянутых элементов сверхвысокой чистоты.
Диэлектрическая проницаемость и длина экранирования Дебая растворителя многокомпонентных кислых растворов, содержащих ионные комплексы переходных, редкоземельных и актиноидных элементов, составляет от 25 до 100 и от 0,2 нм до 200 нм, соответственно. Процесс заполнения нанопор нанопористого порошкового материала раствором проводится механическим смешиванием нанопористого материала с раствором, и полученная смесь выдерживается при нормальных условиях в течение от 1 часа до 20 часов. Для максимального заполнения нанопор нанопористого материала раствором упомянутая смесь подвергается вакуумированию. Процесс заполнения нанопор нанопористого материала электрода с EDL электрохимической ячейки раствором, содержащим ионные комплексы переходных или/и редкоземельных или/и актиноидных элементов, проводится путем заполнения ячейки раствором и выдерживанием при нормальных условиях в течение от 5 часа до 20 часов. Для максимального заполнения нанопор упомянутого электрода с EDL раствором электрохимическая ячейка подвергается вакуумированию. Желаемые результаты селективного извлечения по двум способам достигаются при отношении объема раствора к суммарным объемам нанопор нанопористого порошкового материала и электродного материала с EDL электрохимической ячейки, соответственно, от 0,5 до 1,2 и от 0,8 до 1,2.
Вытеснение из нанопор нанопористого углеродного материала ионных комплексов проводится давлением газов (например - воздух, азот, двуокись углерода или их различные смеси), что приводит к удалению из нанопор слабо локализованных ионных комплексов упомянутых элементов. В нанопорах остаются, в основном, только ионные комплексы тех элементов, которые сильно локализованы в нанопорах, а слабо локализованные ионные комплексы концентрируются в вытесненном из нанопор растворе. То есть происходит селективное разделение ионных комплексов исходного раствора. При этом ионные комплексы одних типов элементов остаются в нанопорах, а других типов элементов переходят в вытесненный раствор.
Процесс извлечения остаточных в нанопорах ионных комплексов осуществляется с помощью водного раствора неорганических кислот высокой концентрации (например - водные растворы соляной кислоты, серной кислоты, фосфорной кислоты, фтористоводородной кислоты и их различных смесей) или поляризацией потенциала нанопористого материала. Поляризация потенциала нанопористого материала в противоположную область от равновесного потенциала изменяет направление напряженности электрического поля Е. Поэтому взаимодействие дипольного момента µ ионных комплексов элементов с полем Е выталкивает их из объемов нанопор. Данный вариант извлечения ионных комплексов элементов из нанопор нанопористого материала обладает высокой управляемостью, производительностью, а также экономичен и удобен для промышленного применения.
Данное изобретение относится к селективному извлечению солей переходных, редкоземельных и актиноидных элементов из растворов с помощью электропроводящих нанопористых материалов. Универсальный способ предназначен для извлечения переходных, редкоземельных и актиноидных элементов из соответствующих руд с низким содержанием извлекаемых элементов, а также из различных промышленных и золошлаковых отходов. Предлагаемый универсальный способ позволяет получить переходные, редкоземельные и актиноидные металлы и их соли высокой и сверхвысокой чистоты. При этом нанопористый материал используется многократно.
Благодаря оригинальным технологическим, техническим и конструкторским решениям, а также универсальности способа селективного извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных растворов с помощью нанопористых материалов, предлагаемый способ, в отличие от известных способов селективного извлечения, позволяет получить соли вышеуказанных элементов в промышленных объемах необходимой высокой чистоты и низкой стоимостью. Также предлагаемый универсальный способ позволяет обогащать многокомпонентные растворы, содержащие ионные комплексы переходных, редкоземельных и актиноидных элементов, выбранным компонентом ионного комплекса.
Сущность предлагаемого универсального способа селективного извлечения различных солей переходных, редкоземельных и актиноидных элементов из многокомпонентных кислых растворов с помощью нанопористых электропроводящих материалов поясняется нижеследующим подробным описанием физических процессов заполнения нанопор нанопористого материала раствором и селективного извлечения из нанопор солей заданных элементов. Раскрытие сущности предлагаемого изобретения также поясняется подробным описанием особенностей взаимодействия дипольных моментов сольватированных ионных комплексов переходных, редкоземельных и актиноидных элементов с электрическим полем двойного электрического слоя границы раздела "стенка нанопоры - раствор", конкретными примерами селективного извлечения солей переходных и редкоземельных элементов, подробным анализом полученных результатов и нижеследующими фигурами.
Краткое описание фигур
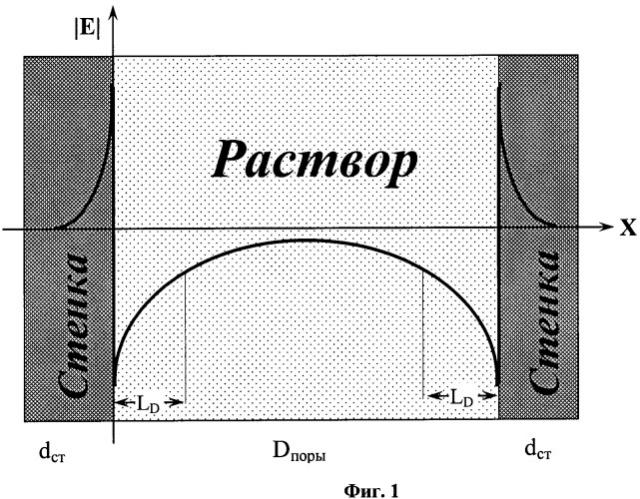
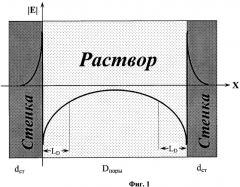
Фиг.1. Изменение модуля напряженности электрического поля |Е| двойного электрического поля вдоль диаметра заполненной раствором нанопоры нанопористого материала. Обозначения: dcm - толщина стенки нанопоры; Dпоры - диаметр нанопоры и LD - длина экранирования Дебая в объеме нанопоры.
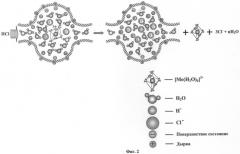
Фиг.2. Схема извлечения шестикоординационного ионного комплекса трехвалентного иона металла Me3+ из нанопор нанопористого материала с помощью водного раствора соляной кислоты высокой концентрации.
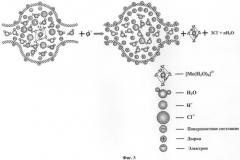
Фиг.3. Схема извлечения шестикоординационного ионного комплекса трехвалентного иона металла Me3+ из нанопор нанопористого углеродного материала методом поляризации потенциала его двойного электрического слоя.
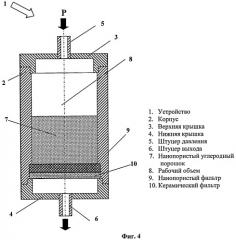
Фиг.4. Конструкция устройства для селективного извлечения переходных и редкоземельных элементов с помощью нанопористого углеродного порошка.
Фиг.5. Спектры поглощения 1% смешанного исходного водного раствора хлоридов NiCl2+CrCl3 (1), после первого (2), шестого (3), восьмого (4) и десятого (5) процессов вытеснения раствора из нанопор NPC-порошка, в спектральном диапазоне 200-1000 нм.
Фиг.6. Спектры поглощения тестовых водных растворов хлоридов NiCl2 (1), CrCl3 (2) и смешанного водного раствора NiCl2+CrCl3 (3) в спектральном диапазоне 200-1000 нм.
Фиг.7. Спектры поглощения 1% смешанного исходного водного раствора хлоридов CoCl2+NiCl2+CrCl3 (1), после первого (2) и пятого (3) процессов вытеснения раствора из нанопор NPC-порошка, в спектральном диапазоне 200-1000 нм.
Фиг.8. Спектры поглощения тестовых водных растворов хлоридов CoCl2 (1), NiCl2 (2), CrCl3 (3) и 1% смешанного водного раствора CoCl2+NiCl2+CrCl3 (4) в спектральном диапазоне 200-1000 нм.
Фиг.9. Спектры поглощения 1,5% смешанного исходного водного раствора хлоридов NiCl2+TiCl3 (1), после первого (2), второго (3), третьего (4) и четвертого (5) процессов вытеснения растворов из нанопор NPC-порошка, в спектральном диапазоне 200-1100 нм.
Фиг.10. Спектры поглощения тестовых 1,5% водных растворов хлоридов NiCl2 (1), TiCl3 (2) и смешанного водного раствора NiCl2+TiCl3 (3), в спектральном диапазоне 200-1100 нм.
Фиг.11. Спектры поглощения дистиллированной воды (1), 37% водного раствора соляной кислоты (2) и пустой кюветы К10 (3), в спектральном диапазоне 200-1100 нм. Измерения пропускания растворов проводились относительно воздуха.
Фиг.12. Структура октаэдрического комплекса гидратированного трехвалентного иона титана и схема расщепления терма 2D свободного иона Ti3+ (d1) в октаэдрическом поле лигандов H2O с учетом эффекта Яна-Теллера (b).
Фиг.13. Спектры поглощения гексагональных комплексов и в водных растворах 1% (1), 5% (2) и 37% соляной кислоты, в спектральном диапазоне 200-1100 нм.
Фиг.14. Конструкция двухэлектродной электрохимической ячейки с нанопористыми угольными пластинами.
Фиг.15. Кинетика напряжения U, потенциалов EDL нанопористой угольной пластины φCP и противоэлектрода из Grafoil φGR (относительно потенциала электрода сравнения SHE) ЕС-ячейки, при длительном хранении ячейки с 1,5% водным раствором трихлорида титана.
Фиг.16. Спектры поглощения 1,5% исходного водного раствора трихлорида титана TiCl3 (1), раствора ЕС-ячейки после 55 часового хранения (2), после поляризации угольной пластины (3), в спектральном диапазоне 200-1100 нм.
Фиг.17. Спектры поглощения водных растворов сульфатов Eu2(SO4)3 (1), Nd2(SO4)3 (2) и Eu2(SO4)3+Nd2(SO4)3 (3) в спектральном диапазоне 380-600 нм.
Фиг.18. Спектры поглощения исходного водного раствора сульфатов Eu2(SO4)3+Nd2(SO4)3 (1) и вытесненного из нанопор нанопористого порошка раствора (2), в спектральном диапазоне 380-610 нм.
Подробное описание изобретения
В настоящее время известны различные химические, физические, электрохимические и другие способы извлечения переходных, редкоземельных и актиноидных элементов из их различных соединений и растворов. Указанные способы широко применяются на практике для получения различных солей и чистых материалов переходных, редкоземельных и актиноидных элементов. В основе получения переходных, редкоземельных и актиноидных элементов лежит использование их химических, физических, электрохимических и других свойств. Для извлечения переходных, редкоземельных и актиноидных элементов из соответствующих руд с низким содержанием извлекаемых элементов, а также из различных промышленных и золошлаковых отходов, используют, в основном, способ селективного извлечения из растворов. Этот способ позволяет получить переходные, редкоземельные и актиноидные металлы и их соли высокой чистоты. В основе известных способов лежат химические, электрохимические, физические, а также и другие свойства ионных комплексов переходных, редкоземельных и актиноидных элементов.
Химические, электрохимические, физические и другие свойства, которые обычно используются на практике для селективного извлечения многих ионных комплексов переходных элементов в различных растворах являются достаточно схожими. Например, указанные свойства ионных комплексов всех редкоземельных элементов практически не отличаются. Также близкие свойства проявляет основная часть актиноидных элементов. Этими особенностями обусловлено отсутствие в настоящее время универсального способа извлечения соединений переходных, редкоземельных и актиноидных элементов из многокомпонентных растворов. Обычно для селективного извлечения из растворов соединений каждого конкретного элемента на практике используют отдельные способы, принципы селективного извлечения которых базируются на индивидуальных свойствах ионных комплексов отдельных элементов. Это часто приводит к существенному усложнению технологии извлечения, увеличению количества и перечня используемых химических реактивов и вспомогательных материалов, что удорожает стоимость извлеченных материалов.
В настоящем изобретении предложены два универсальных способа селективного извлечения солей переходных, редкоземельных и актиноидных элементов из многокомпонентных кислых растворов, содержащих ионные комплексы упомянутых элементов. В отличие от известных способов селективного извлечения, предлагаемые способы позволяют с высокой селективностью извлекать из многокомпонентных растворов различные соединения с весьма близкими химическими, электрохимическими, физическими и другими свойствами переходных, редкоземельных и актиноидных элементов.
Переходные металлы весьма широко используются практически во всех областях техники, энергетики, транспорта, космоса, связи и т.д. Наиболее распространенные и используемые переходные металлы получают, в основном, из их различных соединений химическим способом, путем промежуточной обработки и восстановления соответствующим восстановителем. Также на практике используют способы получения переходных металлов электрохимическим восстановлением из растворов их растворимых солей и электролизом из расплавов соответствующих соединений металлов.
С быстрым развитием технологий микроэлектронных приборов, химических источников тока, атомной энергетики, а также и других технологий, потребовались переходные металлы и их соединения высокой чистоты. Для обеспечения потребности промышленности разработаны такие важные методы очистки как: перегонка в вакууме; зонная плавка; термическое разложение летучих соединений переходных металлов; йодидный способ. Все указанные способы являются достаточно трудоемкими способами. Несмотря на возможность получения ряда переходных металлов (Ti, Ni, Zr и другие) достаточно высокой чистоты йодидным способом, полученные металлы имеют высокую цену, и данный способ имеет высокую токсичность, обусловленную использованием йода.
Редкоземельные элементы (РЗЭ) широко используются в различных областях техники, технологии и науки. Основную часть РЗЭ и их оксидов применяют в металлургии, машиностроении, атомной технике, химической промышленности, радиоэлектронной промышленности и приборостроении. Механические, тепловые и электрохимические свойства многих сплавов существенно улучшаются при применении добавок из РЗЭ. С применением оксидов редкоземельных элементов изготавливают специальные стекла, которые обладают высокой прозрачностью оптического излучения в видимой и инфракрасной области оптического излучения. Различные соединения РЗЭ в химической промышленности применяют в производстве лаков, пигментов и красок. Особенность поглощения РЗЭ водорода и азота позволяет их использовать в качестве газопоглотителей. Благодаря особым квантовым свойствам 4f-4f переходов редкоземельных элементов они нашли широкое применение во многих квантовых генераторах, в производствах активных нелинейных элементов оптоэлектроники и различных люминофоров.
Поскольку основные свойства редкоземельных элементов, с атомными номерами Z=58-71, кроме церия, достаточно сходные, то технология разделения указанных элементов является достаточно сложным и трудоемким процессом. Обычно, основную часть соединений редкоземельных элементов извлекают из различных растворов путем осаждения в виде оксалатов или двойных сульфатов редкоземельных элементов и натрия. Далее, соли редкоземельных элементов, с необходимой степенью технической чистоты, получают из указанных соединений. Для отделения церия от других редкоземельных элементов, которые в соединениях находятся в трехвалентном состоянии, используется способность церия находиться в четырехвалентном состоянии. Поэтому обычно церий от других редкоземельных элементов отделяют путем его окисления до четырехвалентного состояния. Европий от других РЗЭ отделяют с использованием низкой растворимости двухвалентного сульфата европия. Трехвалентный сульфат европия, который имеет высокую растворимость, восстанавливают до двухвалентного сульфата.
Обычно, для получения металлических редкоземельных элементов в промышленности распространен метод восстановления галоидов соответствующих элементов электролизом расплавов или кальцием. Для получения металлических РЗЭ высокой чистоты требуются способы получения их галоидов высокой чистоты.
Важными химическими элементами для применения в энергетике, вооружении, науке, технике, а также в медицине являются актиноиды с атомными номерами Z=90-103. Из указанных актиноидов в природе распространенными являются практически только элементы U и Th, а также в незначительных количествах встречается Ра. Другие актиноиды не встречаются в природе и их синтезируют искусственно. Элементы U и Th являются исходным источником для синтеза других важных элементов, например, Pu и Np, для их практического применения. Актиноиды U, Th, Pu и Np используют в ядерной энергетике, ядерном оружии, ядерных источниках электроэнергии для космических аппаратов и систем, а также в различных областях науки и техники.
Известно, что элементы актиноидов с атомными номерами Z=90-103 во многих соединениях проявляют различные валентности. При этом величины энергии Гиббса ионных комплексов актиноидов в различных степенях окисл