Слитые белки гормона роста
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к полипептиду и его гомодимеру, которые обладают агонистической активностью в отношении рецептора гормона роста, молекуле нуклеиновой кислоты, их кодирующей, вектору, который включает данную нуклеиновую кислоту, клетке для экспрессии данного полипептида, фармацевтической композиции и способу с применением вышеуказанных полипептидов для лечения дефицита гормона роста. Полипептид имеет аминокислотную последовательность, представленную в SEQ ID NO:11 или 12. Гомодимер состоит из двух полипептидов, состоящих из SEQ ID NO:11 или 12. Молекула нуклеиновой кислоты состоит из последовательности нуклеиновой кислоты, представленной в SEQ ID NO:4. Фармацевтическая композиция для применения в лечении дефицита гормона роста содержит указанный выше полипептид или гомодимер и эксципиент или носитель. Способ лечения дефицита гормона роста включает введение эффективного количества указанного выше полипептида или гомодимера. Предложенное изобретение позволяет создать полипептид, который обладают агонистической активностью в отношении рецептора гормона роста и эффективен при лечении дефицита гормона роста. 8 н. и 9 з.п. ф-лы, 9 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к слитым белкам гормона роста; к молекулам нуклеиновой кислоты, кодирующим вышеуказанные белки, и способам лечения, в которых используют вышеуказанные белки.
Лиганды, которые взаимодействуют с рецепторами для индукции биохимического ответа, известны как агонисты, а лиганды, которые предотвращают или замедляют биохимический ответ, известны как антагонисты. Например, клеточные ростовые факторы представляют собой лиганды, которые действуют в качестве агонистов и связываются с рецепторами, расположенными на поверхности клетки. Активация рецепторов в результате лиганд-специфического связывания стимулирует пролиферацию клеток посредством активации внутриклеточных сигнальных каскадов, которые приводят, среди прочего, к экспрессии специфических генов клеточного цикла и активации пролиферации покоящихся клеток.
Группа ростовых факторов, называемых цитокинами, вовлечена во множество различных клеточных функций. Они включают в себя модуляцию иммунной системы, регуляцию энергетического обмена и контроль за ростом и развитием. Цитокины осуществляют свое воздействие посредством рецепторов, экспрессирующихся на клеточной поверхности клеток-мишеней. Рецепторы цитокинов можно разделить на три отдельные подгруппы. Рецепторы 1 типа (семейство гормона роста) характеризуются четырьмя консервативными остатками цистеина в аминоконцевой части их внеклеточного домена и присутствием консервативного мотива Trp-Ser-Xaa-Trp-Ser в С-концевой части. Повторяющийся Cys-мотив также присутствует во 2-м типе (семейство интерферонов) и 3-м типе (семейство фактора некроза опухолей).
Гормон роста (GH) представляет собой анаболический цитокиновый гормон, важный для линейного роста в детстве и нормального состава тела у взрослых. Для современного терапевтического режима восполнения GH требуются подкожные инъекции один раз в сутки, что неудобно и дорого. Были предприняты различные подходы для создания препаратов длительного действия, включая пэгилирование [2] и препараты с замедленным высвобождением [3-5]. Недостаток пэгилирования состоит в том, что оно уменьшает сродство гормона к рецептору [2], а химическая модификация с последующей очисткой является дорогостоящей. Эффективность [4-7] препаратов с замедленным высвобождением была доказана, но такие препараты GH характеризуются преобладающим профилем досрочного высвобождения, который приводит к надфизиологическим уровням [3] GH, изготовление является дорогостоящим и инъекции могут быть болезненными [4]. Существует потребность в препаратах цитокинов, которые минимизируют производственные затраты, имеют хорошие фармакокинетические профили, являются удобными для применения и приемлемы для пациентов.
GH действует через цитокиновый рецептор типа 1 (GHR), расположенный на клеточной поверхности. Так же, как и другие цитокиновые рецепторы, внеклеточный домен GHR протеолитически отщепляется и циркулирует в качестве связывающего белка (GHBP) [8]. При физиологических условиях GH частично связывается в кровотоке с GHBP в молярном соотношении 1:1, и этот комплекс, по-видимому, является биологически неактивным, защищенным от элиминации и деградации [9-10]. Поперечно-сшитый комплекс GH и GHBP имеет замедленный клиренс, но не имеет биологической активности [11]. Совместное введение отдельно очищенных GHBP и GH в соотношении 1:1 может увеличивать анаболические воздействия GH [12]. Таким образом, подобно многим гормональным системам, связывание в кровотоке обеспечивает неактивный циркулирующий резервуар, находящийся в равновесии с активным свободным гормоном [13].
Цитокиновые гормоны, подобные гормону роста, имеют короткий период полувыведения из плазмы и требуют частого введения. Например, восполнение гормона роста (GH) подразумевает ежесуточные инъекции. Наряду с другими цитокинами внеклеточный домен рецептора GH циркулирует в качестве связывающего белка и естественным образом продлевает биологический период полувыведения GH.
Такое описание относится к биологическим действиям лиганд-рецепторного слияния (LR-слияния) GH с его внеклеточным доменом рецептора. Такой полученный посредством генной инженерии LR-слитый белок очищали из культуры клеток млекопитающих. У крыс LR-слияние имеет в 300 раз меньший клиренс по сравнению с нативным GH, и однократное введение стимулировало гораздо лучший рост в течение 10 суток по сравнению с нативным GH. Пониженный клиренс воспроизводится в модели приматов. LR-слияние образует реципрокный димер по типу "голова-к-хвосту", который обеспечивает источник неактивного гормона, как это происходит естественным образом с GH и его связывающим белком.
Согласно одному из аспектов изобретения предложена молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, выбранную из:
1) последовательности нуклеиновой кислоты, представленной в SEQ ID NO:1;
2) последовательности нуклеиновой кислоты, представленной в SEQ ID NO:2;
3) последовательности нуклеиновой кислоты, представленной в SEQ ID NO:3;
4) последовательности нуклеиновой кислоты, представленной в SEQ ID NO:4; или
5) молекулы нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, которая гибридизуется в жестких условиях гибридизации с SEQ ID NO:1, SEQ ID NO:2; SEQ ID NO:3 или SEQ ID NO:4 и которая кодирует полипептид, обладающий агонистической активностью в отношении рецептора гормона роста.
Гибридизация молекулы нуклеиновой кислоты происходит, когда между двумя комплементарными молекулами нуклеиновых кислот образуется значительное количество водородных связей. Точность гибридизации может варьировать в зависимости от условий, окружающих нуклеиновые кислоты, способа гибридизации, состава и длины используемых молекул нуклеиновых кислот. Расчеты, касающиеся условий гибридизации, необходимых для достижения определенных степеней точности, обсуждаются в Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2001); и Tijssen, Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes Part I, Chapter 2 (Elsevier, New York, 1993). Tm представляет собой температуру, при которой 50% данной цепи молекулы нуклеиновой кислоты гибридизуется с ее комплементарной цепью. Ниже приведен примерный набор условий гибридизации, который не является ограничивающим.
Гибридизация в очень жестких условиях (позволяет гибридизоваться последовательностям с по меньшей мере 90%-ной идентичностью)
Гибридизация: 5х SSC при 65°С в течение 16 часов
Промывка два раза: 2х SSC при комнатной температуре (КГ), каждая в течение 15 минут
Промывка два раза: 0,5х SSC при 65°С, каждая в течение 20 минут
Гибридизация в жестких условиях (позволяет гибридизоваться последовательностям с по меньшей мере 80%-ной идентичностью)
Гибридизация: 5х-6х SSC при 65°С-70°С в течение 16-20 часов
Промывка два раза: 2х SSC при КГ, каждая в течение 5-20 минут
Промывка два раза; 1х SSC при 55°С-70°С, каждая в течение 30 минут
Гибридизация в условиях пониженной жесткости (требует последовательностей, которые имеют по меньшей мере 50% идентичности для гибридизации)
Гибридизация: 6х SSC при температуре от КГ до 55°С в течение 16-20 часов
Промывка два раза: 2х-3х SSC при КТ-55°С, каждая в течение 20-30 минут.
В предпочтительном воплощении изобретения указанная молекула нуклеиновой кислоты содержит последовательность, представленную в SEQ ID NO:1, или состоит из нее.
В предпочтительном воплощении изобретения указанная молекула нуклеиновой кислоты содержит последовательность, представленную в SEQ ID NO:2, или состоит из нее.
В предпочтительном воплощении изобретения указанная молекула нуклеиновой кислоты содержит последовательность, представленную в SEQ ID NO:3, или состоит из нее.
В предпочтительном воплощении изобретения указанная молекула нуклеиновой кислоты содержит последовательность, представленную в SEQ ID NO:4, или состоит из нее.
Согласно одному из аспектов изобретения предложен полипептид, кодируемый нуклеиновой кислотой по изобретению.
Согласно другому аспекту изобретения предложен полипептид, содержащий аминокислотную последовательность, выбранную из:
1) аминокислотной последовательности, представленной в SEQ ID NO:5;
2) аминокислотной последовательности, представленной в SEQ ID NO:6;
3) аминокислотной последовательности, представленной в SEQ ID NO:7;
4) аминокислотной последовательности, представленной в SEQ ID NO:8;
5) аминокислотной последовательности, представленной в SEQ ID NO:9;
6) аминокислотной последовательности, представленной в SEQ ID NO:10;
7) аминокислотной последовательности, представленной в SEQ ID NO:11;
8) аминокислотной последовательности, представленной в SEQ ID NO:12; где указанный полипептид обладает агонистической активностью в отношении рецептора гормона роста.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:5, или состоит из нее.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:6, или состоит из нее.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:7, или состоит из нее.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:8, или состоит из нее.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:9, или состоит из нее.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:10, или состоит из нее.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:11, или состоит из нее.
В предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO:12, или состоит из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:5, или состоящих из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:6, или состоящих из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:7, или состоящих из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:8, или состоящих из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:9, или состоящих из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:10, или состоящих из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:11, или состоящих из нее.
Согласно другому аспекту изобретения предложен гомодимер, содержащий два полипептида, содержащих SEQ ID NO:12, или состоящих из нее.
Согласно другому аспекту изобретения предложен вектор, содержащий молекулу нуклеиновой кислоты по изобретению.
В предпочтительном воплощении изобретения указанный вектор по изобретению представляет собой экспрессирующий вектор, адаптированный для экспрессии молекулы нуклеиновой кислоты по изобретению.
Вектор, включающий нуклеиновую(ые) кислоту(ы) по изобретению, не обязательно включает промотор или другую регуляторную последовательность, в частности, если вектор используют для введения нуклеиновой кислоты в клетки для встраивания в геном при стабильной трансфекции. Предпочтительно нуклеиновая кислота в векторе функциональным образом связана с соответствующим промотором или другими регуляторными элементами для транскрипции в клетке-хозяине. Вектор может представлять собой бифункциональный экспрессирующий вектор, который функционирует в многочисленных хозяевах. Под "промотором" подразумевают нуклеотидную последовательность, расположенную выше сайта инициации транскрипции и содержащую все регуляторные участки, необходимые для транскрипции. Подходящие промоторы включают в себя конститутивные, тканеспецифические, индуцибельные, связанные с развитием или другие промоторы для экспрессии в эукариотических или прокариотических клетках. "Функциональным образом связанные" означает присоединенные как часть той же молекулы нуклеиновой кислоты, надлежащим образом расположенные и ориентированные для инициации транскрипции с промотора. ДНК, функциональным образом связанная с промотором, находится "под контролем инициации транскрипции" с данного промотора.
В предпочтительном воплощении промотор представляет собой конститутивный, индуцибельный или регулируемый промотор.
Согласно другому аспекту изобретения предложена клетка, трансфицированная или трансформированная молекулой нуклеиновой кислоты или вектором по изобретению.
Предпочтительно указанная клетка представляет собой эукариотическую клетку. Альтернативно, указанная клетка представляет собой прокариотическую клетку.
В предпочтительном воплощении изобретения указанная клетка выбрана из группы, состоящей из грибковой клетки (например, Pichia spp, Saccharomyces spp, Neurospora spp); клетки насекомого (например, Spodoptera spp); клетки млекопитающего (например, клетка COS, клетка СНО); растительной клетки.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, содержащая полипептид по изобретению, включающая эксципиент или носитель.
В предпочтительном воплощении изобретения указанную фармацевтическую композицию объединяют с другим терапевтическим агентом.
При введении фармацевтическую композицию по настоящему изобретению вводят в виде фармацевтически приемлемых препаратов. Такие препараты обычно могут содержать фармацевтически приемлемые концентрации солей, буферных агентов, консервантов, совместимых носителей и, возможно, других терапевтических агентов.
Фармацевтические композиции можно вводить любым стандартным способом, включая инъекцию. Введение и применение может быть, например, пероральным, внутривенным, интраперитонеальным, внутримышечным, внутриполостным, внутрисуставным, подкожным, местным (глаза), дермальным (например, прокладка с жирорастворимым кремом на кожу и слизистую оболочку), трансдермальным или интраназальным.
Фармацевтические композиции по изобретению вводят в эффективных количествах. "Эффективное количество" представляет собой такое количество препаратов/композиций, которое отдельно или вместе с дополнительными дозами или синергическими лекарственными средствами производит желаемый эффект. Оно может приводить лишь к временному замедлению развития заболевания, хотя более предпочтительно оно приводит к прекращению развития заболевания. Это можно контролировать стандартными способами или в соответствии с диагностическими способами.
Дозы фармацевтических композиций, принимаемых пациентом, могут быть выбраны в соответствии с различными параметрами, в частности в соответствии с используемым способом введения и состоянием пациента (т.е. возраст, пол). При применении фармацевтические композиции по изобретению используют в фармацевтически приемлемых количествах или в фармацевтически приемлемых композициях. При использовании в медицине соли должны быть фармацевтически приемлемыми, но фармацевтически неприемлемые соли обычно могут быть использованы для получения их фармацевтически приемлемых солей и не исключены из объема изобретения. Такие фармакологически и фармацевтически приемлемые соли включают, но не ограничиваются этим, соли, полученные из следующих кислот: соляной, бромистоводородной, серной, азотной, фосфорной, малеиновой, уксусной, салициловой, лимонной, муравьиной, малоновой, янтарной и тому подобного. Кроме того, фармацевтически приемлемые соли могут быть получены в виде солей щелочных и щелочноземельных металлов, таких как соли натрия, калия и кальция.
Фармацевтические композиции могут быть объединены, при желании, с фармацевтически приемлемым носителем. Термин "фармацевтически приемлемый носитель", как он используется здесь, означает один или более совместимых твердых или жидких наполнителей, растворителей или инкапсулирующих веществ, которые подходят для введения человеку. Термин "носитель" означает органический или неорганический ингредиент, природный или синтетический, с которым объединяют активный ингредиент для облегчения применения. Компоненты фармацевтических композиций также могут быть смешаны с молекулами по настоящему изобретению и друг с другом таким образом, чтобы не было взаимодействия, которое существенным образом могло бы снизить желаемую фармацевтическую эффективность.
Фармацевтические композиции могут содержать подходящие буферные агенты, включая: уксусную кислоту в соли, лимонную кислоту в соли, борную кислоту в соли и фосфорную кислоту в соли.
Фармацевтические композиции также могут, возможно, содержать подходящие консерванты, такие как бензалкония хлорид; хлорбутанол; парабены и тимеросал.
Фармацевтические композиции для удобства могут быть представлены в стандартной лекарственной форме и могут быть получены любым из способов, хорошо известных в области фармации. Все способы включают стадию приведения активного агента в ассоциацию с носителем, который представляет собой один или более вспомогательных ингредиентов. Как правило, композиции получают путем равномерного и непосредственного приведения активного компонента в ассоциацию с жидким носителем, мелкодисперсным носителем или и тем, и другим и затем, при необходимости, придания продукту формы.
Композиции, подходящие для перорального применения, могут быть представлены в виде дискретных единиц, таких как капсулы, таблетки, пастилки, каждая из которых содержит заданное количество активных соединений. Другие композиции включают суспензии в водных жидкостях или неводных жидкостях, таких как сироп, эликсир или эмульсия.
Композиции, подходящие для парентерального введения, соответственно содержат стерильный водный и неводный препарат, который преимущественно является изотоническим для крови пациента. Этот препарат может быть получен в соответствии с известными способами с использованием подходящих распылителей или увлажнителей и суспендирующих агентов. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутан-диоле. Приемлемые растворители, которые могут быть использованы, представляют собой воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели может быть использовано любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в инъецируемом препарате могут быть использованы жирные кислоты, такие как олеиновая кислота. Состав носителя, подходящего для перорального, подкожного, внутривенного, внутримышечного и т.д. введений, можно найти в Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA.
Согласно еще одному аспекту изобретения предложен способ лечения субъекта-человека, страдающего от дефицита гормона роста, включающий введение эффективного количества по меньшей мере одного полипептида по изобретению.
В предпочтительном способе по изобретению указанный полипептид вводят внутривенно.
В альтернативном предпочтительном способе по изобретению полипептид вводят подкожно.
В еще одном предпочтительном способе по изобретению указанный полипептид вводят с двухсуточными интервалами, предпочтительно указанный полипептид вводят с недельными, двухнедельными или месячными интервалами.
В предпочтительном способе по изобретению указанный дефицит гормона роста представляет собой дефицит гормона роста у детей.
В предпочтительном способе по изобретению указанный дефицит гормона роста представляет собой дефицит гормона роста у взрослых.
Лечение дефицита гормона роста включает, например, лечение синдрома Тернера, синдрома Прадера-Вилли, задержки внутриутробного развития плода, идиопатической низкорослости, почечной недостаточности, катаболических состояний, например, во время химиотерапевтического лечения и лечения СПИДа.
В описании изобретения и формуле изобретения слова "включать" и "содержать" и варианты этих слов, например "содержащий" и "содержит", означают "включая, но не ограничиваясь этим" и не предполагают исключения других группировок, вспомогательных веществ, компонентов, целых чисел или стадий.
В описании изобретения и формуле изобретения единственное число охватывает множественное число, если контекст не подразумевает иного. В частности, когда используют неопределенный артикль, то следует понимать, что в описании подразумевается как множественность, так и единственность в зависимости от контекста.
Свойства, целые числа, характеристики, соединения, химические группировки или группы, описанные в связи с конкретным аспектом, воплощением или примером изобретения, следует понимать применительно к любому другому аспекту, воплощению или примеру, описанному здесь, в случае совместимости с ними.
Воплощение изобретения теперь будет описано с помощью примера и со ссылкой на следующие фигуры.
На Фиг.1 показана схема взаимосвязи между GH, GH-связывающим белком (GHBP), LR-слиянием и GHR на основе опубликованных структур [27] (pdb3HHR): (а) Природная конфигурация GH, связывающегося с GHBP в комплексе в соотношении 1:1. (б) GH, высвобожденный из комплекса GHBP, связывается с рецептором GH на поверхности клетки, (в) LR-слитая молекула в мономерной форме с GH, связанным с exGHR. (г) Модель LR-слияния, образующего реципрокный димер по типу "голова-к-хвосту", где GH в одной молекуле связывается с exGHR в другой молекуле. Наконец, в (д) LR-слияние в мономерной форме может связывать и активировать рецептор GH.
На Фиг.2 показана характеристика и биологическая активность LR-слияния: (а) показывает LR-слияние, разделенное с помощью ДСН-ПААГ (электрофорез в полиакриламидном геле с додецилсульфатом натрия), с последующим окрашиванием Кумасси (CS) и вестерн-блоттингом (WB) с использованием специфического антитела к GH. LR-слияние составляет приблизительно 75 кДа и разделяется на две полосы на расстоянии приблизительно 5 кДа друг от друга, (б) показывает LR-слияние, разделенное с помощью нативного ПААГ, демонстрирующее, что существуют две формы белка: быстрая (F) и медленная (S). (в) Отдельные полосы (F и S), полученные с помощью нативного ПААГ, вырезали и разделяли дополнительно с помощью ДСН-ПААГ в восстанавливающих условиях с последующим вестерн-блоттингом с использованием специфического антитела к GH. Обе полосы (F и S) перемещаются на уровне приблизительно 75 кДа и разделяются в виде дублета, продемонстрированного ранее. Это говорит о том, что две отдельные полосы, полученные в результате нативного ПААГ, состоят из 75 кДа LR-слияния и могут существовать в нативных условиях в равновесии в виде мономеров и димеров. (г) Демонстрирует профиль элюции LR-слияния после гель-фильтрации. Разделение 2 отдельных пиков еще раз указывает на присутствие LR-слияния в виде мономера и димера в растворе. (е) Биологический анализ GHR-сигнального пути с использованием клеток для GH и LR-слияния. На оси ординат показана кратная индукция скорректированной люциферазы из анализа Stat 5 люциферазы-репортера. Стандартная кривая для GH варьирует от 0; 0,25; 0,5; 1,0; 2,0 до 5 нМ: стандартная кривая для LR-слияния варьирует от 0; 1; 2; 5; 10; 25; 50; 100 до 250 нМ. Максимальный ответ для GH достигается при 5 нМ, тогда как максимальный ответ с LR-слиянием требует от 50 до 250 нМ.
На Фиг.3 показаны профили GH и LR-слияния, измеренные после подкожного (п/к) и внутривенного (в/в) введения: (а) Показана ранняя стадия (5 часов) после п/к введения; (б) Показана поздняя стадия (8 суток) после в/в; и (в) поздняя стадия после п/к введения.
На Фиг.4 показано изменение массы тела после подкожного лечения GH и LR-слиянием: (а) после ежесуточного приема GH по сравнению с плацебо (только носитель); (б) после инъекций через сутки; (в) после двух инъекций в 1-е и 5-е сутки; (г) после одной инъекции в сутки; и (е) обобщение изменений массы тела после различных схем лечения. ***=р<0,0001 GH против LR-слияния.
На Фиг.5 показана активность 1B7v0, 1B7v1, 1B7v2 и 1B7v3 in vivo.
На Фиг.6 показана динамика увеличения массы тела у крыс после введения 1B7v0, 1B7v1, 1B7v2 и 1B7v3.
На Фиг.7 показана фармакокинетика 1B7v0, 1B7v1, 1B7v2 и 1B7v3 после подкожного введения.
На Фиг.8 показана фармакокинетика 1B7v0, 1B7v1, 1B7v2 и 1B7v3 после внутривенного введения.
На Фиг.9 показаны фармакокинетические профили 1B7v2 и 1B7v3 после последовательного п/к введения дозы 1 мг/кг макакам-резус. Красной пунктирной линией показана минимальная эффективная концентрация гормона роста человека.
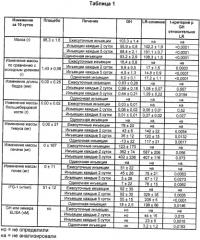
В таблице 1 приведены результаты (среднее ± стандартная ошибка) после 10 суток лечения GH и LR-слиянием у крыс с удаленным гипофизом.
Материалы и методы
Использование животных и человеческих образцов. Использование человеческих образцов было одобрено местным комитетом по этике, и пациенты дали информированное согласие. Все эксперименты были проведены в соответствии с французским законодательством (Директива Совета №86/609/ЕЕС от 24 ноября 1986 года), касающегося защиты животных, используемых для экспериментальных или иных научных целей.
Материалы. Все материалы были приобретены в Sigma (Poole, UK), если не указано иначе. Рекомбинантный GH был приобретен у компании Pfizer, рекомбинантный GH-связывающий белок человека, клонированный в Е.coli и используемый для анализов связывания, был подарком от DSL (DSL Research Reagents, Oxfordshire, UK), и йодированный GH был подарком от NovoNordisk (NovoNordisk Park, Denmark). Моноклональные антитела (mAbs) к GH и GHR, используемые для очистки и характеристики, представляли собой внутрифирменные материалы за исключением mAbs B07b и В24а, которые были подарком от д-ра Skriver (NovoNordiskp Park, Denmark), и mAb 263 (AbD Serotec, Kidlington, Oxford, UK).
Очистка GH-exGHR LR-слияний. Человеческий GH и рецептор GH амплифицировали с помощью ПЦР из человеческого гипофиза и печени соответственно и клонировали в вектор pSecTag-VS/FRT/Hist-TOPO (Invitrogen, Paisley, UK) под контролем человеческой сигнальной последовательности для секреции GH. Четыре повтора линкера Gly4Ser использовали для связывания нативного С-конца человеческого GH с нативным N-концом человеческого GHR. Стабильные клоны получали из клеток СНО Flp-ln (Invitrogen, Paisley, UK), адаптированных к среде без белка и растущих в суспензионной культуре. Экспрессию LR-слияния подтверждали с использованием внутрифирменной ELISA (твердофазный иммуноферментный анализ). Аффинную очистку осуществляли с использованием колонки с mAb к GH.
Биологические анализы транскрипции. Их осуществляли, как описано ранее в человеческих клетках 293, стабильно экспрессирующих человеческий GHR [16].
ELISA. Внутрифирменный ELISA-анализ GH и LR-слияния осуществляли в "сэндвич"-формате. Во время анализа стандарты (GH или LR-слияние), контроли и неизвестные образцы инкубировали с биотин-меченым мышиным антителом к человеческому GH (mAb 7F8) в лунках, предварительно покрытых мышиным антителом к человеческому антителу против GH (mAb 10A7). Предел обнаружения в данном анализе составляет 2,5 пг, и вариабельность результатов (CV) одного анализа и разных анализов составляет менее 10%. IGF-I ELISA был приобретен у компании DSL (набор DSL-10-2900 ACTIVE mouse/rat IGF-I; DSL Research Reagents, Oxfordshire, UK).
Фармакокинетические исследования. Для фармакокинетических исследований использовали нормальных крыс Sprague Dawley в возрасте семи недель от компании Janvier (Le Genest Saint Isle, France). Подкожное и внутривенное введение (вена полового члена) и кровопускание (орбитальный синус) проводились под наркозом изофлураном. Крысам (N=4-6/группа) вводили в/в или п/к по 0,1 мг/кг rhGH или LR-слияния. Образцы крови собирали из ретроорбитального сплетения. Сыворотку собирали и хранили при -70°С до анализов. Фармакокинетические параметры оценивали путем подгонки концентрации гормона относительно времени в компартментальных моделях с использованием нелинейного регрессионного анализа методом наименьших квадратов. Значения клиренса стандартизировали к массе животного. Уровень клиренса на массу животного и конечные периоды полувыведения (t1/2) рассчитывали, используя коэффициент и экспоненты, полученные в моделях с в/в болюсом.
Фармакокинетическое исследование на приматах
Тестируемые вещества IB7v2 и IB7v3 готовили в растворах, содержащих 11,9 мМ фосфатов натрия и калия, 137 мМ хлорида натрия, 2,7 мМ хлорида калия, 0,01% полисорбата 80, pH раствора доводили до 7,4.
План исследования
Животных распределили на 4 группы обработки (1 носитель, 1 IВн7v2 тест-группа, 1 IB7v3 тест-группа), содержащих 3 самца в группе носителя и по 4 самца в 2 группах обработки. Вводимые уровни доз и объемы указаны в таблице ниже.
| Группа | Обработка | # Обезьяны (самцы) | Доза (м г/кг/доза) | Объем дозы |
| 1 | Носитель (контроль) | 3 | 0 | 0,2 мл/кг, на 1-е, 15-е сутки |
| 2 | IB7v2 | 4 | 1 | 0,2 мл/кг, на 1-е, 15-е сутки |
| 3 | IB7v3 | 4 | 1 | 0,2 мл/кг, на 1-е, 15-е сутки |
Образцы крови получали от всех животных на протяжении всего исследования с целью определения концентрации соответствующего тестируемого материала в сыворотке. Эти образцы отбирали в различные моменты времени на протяжении исследования.
Клинические результаты и измерения
Концентрацию IB7v2 и IB7v3 в сыворотке определяли с использованием ELISA метода. Фармакокинетический профиль для каждого белка определяли путем нанесения на график концентрации каждого белка в сыворотке относительно времени с использованием программного обеспечения WinNonlin Pro (v4.0.1),
Исследования роста. Исследования роста с использованием гипофизэктомированных крыс проводили на крысах Sprague Dawley от Charles River Laboratories (Larbresle, France). Крысы в возрасте 4 недель подвергались гипофизэктомии под изофлурановой анестизией специалистом по разведению животных и доставлялись через одну неделю после селекции по критериям массы тела в отношении успешной операции. Животных размещали в отдельных клетках и оставляли еще на неделю отдыха перед экспериментальной фазой. Объем растворов для инъекций с эксципиентом, rhGH и LR-слиянием никогда не превышал 2 мл/кг. Крыс взвешивали каждые сутки, и в зависимости от протокола введения они получали инъекции тестируемых веществ в течение 10 суток.
Характеристика LR-слияний. Конформацию LR-слияния исследовали с использованием панели из 16 конформационно чувствительных mAbs к рецептору hGH. Денатурирующий, нативный гели и вестерн-блоттинг использовали для анализа LR-слияния и вестерн-блоттинг осуществляли с использованием конформационно нечувствительного mAb к GH. Форму LR-слитого белка в растворе определяли посредством гель-фильтрации с использованием аналитической колонки с Superose G200 и аналитического ультрацентрифугирования. Аналитическое ультрацентрифугирование (AUC) осуществляли с использованием скоростной седиментации (Analytical service, д-р Andy Barry, Astbury, Leeds University, Leeds, UK).
Статистика. Две группы сравнивали с использованием критерия Стьюдента в случае нормального распределения их дисперсий или критерия Стьюдента-Саттертвайта в случае ненормального распределения. Распределение оценивали с помощью F-критерия. Односторонний ANOVA (дисперсионный анализ) использовали для сравнения средних из 3 или более групп и при условии, что уровень значимости составлял p<0,05, отдельные сравнения осуществляли с помощью критериев Дуннетта. Все статистические критерии были двухсторонними при уровне значимости 5%, и восстановления недостающих данных не проводили.
Примеры
Конструирование и характеристика LR-слияния
Получили рекомбинантный ген, кодирующий человеческий GH, связанный с А- и В-доменами внеклеточного домена GHR (exGHRI-238) посредством гибкого линкера (Gly4Ser)4 (Фиг.1в). Это LR-слияние экспрессировали в клетках СНО и очищали с использованием моноклонального антитела со сродством к GH до чистоты более 95% (Фиг.2а). LR-слияние подвергали скринингу с помощью ELISA с использованием 16 конформационно-чувствительных mAbs. Все эти mAbs связывались с LR-слиянием со сродством, сравнимым со сродством к GHBP, полученным для человеческой сыворотки. Окрашивание Кумасси и вестерн-блоттинг ДСН-ПААГ гелей показали, что LR-слитый белок разделяется в виде дублета приблизительно 75 кДа с разницей приблизительно 5 кДа между двумя полосами. Анализ с использованием нативного ПААГ-геля (Фиг.2б) не выявил агрегации. LR-слияние, по-видимому, имеет две разные формы. Эти разные белковые формы, быструю (F) и медленную (S), вырезали из нативного ПААГ-геля и затем снова анализировали посредством ДСН-ПААГ в восстанавливающих условиях. Обе формы F и S из нативного ПААГ состояли из 75 кДа дублета (Фиг.2в). Существование двух форм LR-слияния в растворе подтвердили посредством аналитической гель-фильтрации (Фиг.2г). Эти результаты согласуются с существованием LR-слияния в виде димера в растворе. Это было подтверждено аналитическим ультрацентрифугированием, где размер мономера составил 75 кДа.
Биологический анализ in vitro и фармакокинетика
Биологическую активность LR-слияния in vitro определяли с использованием анализа GH-специфического люциферазного репортера [16]. Биологическая активность LR-слияния составляла приблизительно 10% по сравнению с GH в этой системе статического анализа, хотя LR-слияние способно стимулировать максимальный ответ, но при более высокой концентрации, чем GH (Фиг.2е). Фармакокинетический профиль LR-слияния исследовали у нормальных крыс после однократной подкожной (п/к) или внутривенной (в/в) инъекции (Фиг.3). LR-слияние продемонстрировало замедленный клиренс независимо от пути введения и замедленную абсорбцию после п/к введения. После в/в болюса конечный период полувыведения LR-слияния составил 21±2 ч и клиренс 3,3±0,9 мл·ч-1·кг-1. Клиренс LR-слияния был в 300 раз медленнее, чем для GH [2,12]. После однократного п/к введения LR-слияние имело отсроченный пик по сравнению с GH (30 против 1 часа). LR-слияние все еще можно было выявить на 8-е сутки, тогда как GH не определялся через 6 часов. Авторы изобретения исследовали, связана ли исключительная фармакокинетика LR-слияния с размером. Тестировали две различные LR-слитые молекулы с идентичными линкерами: одна - LR-слияние GH только с В-доменом exGHR (55 кДа), и другая - тандем (GH, связанный с GH), связанный с exGHR (100 кДа). Оба белка 55 кДа и 100 кДа показали повышенную агонистическую активность в биологическом анализе по сравнению с первоначальным LR-слиянием 75 кДа, но для обоих период полувыведения из кровотока составляло менее 4 часов после в/в введения (точное определение периода полувыведения невозможно, так как используемый протокол предполагает более продолжительный период полувыведения). Результаты подтверждают, что исключительная фармакокинетика первоначального LR-слияния 75 кДа не связана только с молекулярной массой.
Фармакокинетические профили в исследовании на приматах для IB7v2 и IB7v3 после двух подкожных доз 1 мг/кг при t-0 и t-336 часов (14 суток) показаны на Фиг.9. Следует отметить, что уровни быстро достигают максимума и снижаются в течение значительно более длительного периода времени по сравнению с нативным человеческим фактором роста, который имеет период полувыведения менее 1 часа. Уровни также поддерживаются значительно выше минимальной эффективной концентрации, как это определено по пунктирной линии в течение продолжительности последовательного введения.
Преимущество LR-слияния по сравнению с GH в индукции роста
Для определения биологической активности LR-слияние и GH вводили гипофизэктомированных крысам (с дефицитом GH). Ежесуточное введение GH индуцировало непрерывный рост в течение 10 суток. LR-слияние затем сравнивали с GH либо при п/к введении через сутки, либо при двух инъекциях в течение 10 суток, либо при однократной инъекции. Для всех экспериментов использовали эквимолярные дозы GH и LR-слияния с одинаковой суммарной дозой, вводимой в течение 10-суточного периода: 220 мкг/кг/сутки, приблизительно 10 нмоль в течение 10 суток приравниваются к дозе, использовавшейся ранее для получения