Антитела против c3b и способы профилактики и лечения связанных с комплементом нарушений
Иллюстрации
Показать всеНастоящее изобретение относится к иммунологии и биотехнологии. Предложены варианты антител против С3b, каждое из которых характеризуется наличием шести CDR и не связывает С3. Описана фармацевтическая композиция на основе антитела и набор, используемые для профилактики или лечения комплемент-зависимого заболевания. Использование изобретения обеспечивает новые антитела против С3b, Fab-фрагмент которых ингибирует альтернативный каскад комплемента с IС50 около 100 нМ, что может найти применение в медицине для профилактики и лечения связанного с комплементом нарушения, например воспалительного или дегенеративного заболевания. 4 н. и 25 з.п. ф-лы, 21 ил., 1 табл., 11 пр.
Реферат
Область изобретения
Настоящее изобретение относится к антителам к C3b и к профилактике и лечению связанного с комплементом нарушения с использованием таких антител.
Предпосылки изобретения
Система комплемента представляет собой комплексный каскад ферментов, состоящий из серии сывороточных гликопротеинов, которые в норме существуют в неактивной форме проферментов. Комплемент могут активировать два основных каскада, классический и альтернативный, которые объединяются на уровне C3, где две сходных C3-конвертазы расщепляют C3 до C3a и C3b.
Макрофаги представляют собой специализированные клетки, у которых развита присущая им способность распознавать тонкие различия в структуре экспрессируемых на клеточной поверхности идентификационных меток, так называемых молекулярных паттернов (Taylor et al., Eur J Immunol 33, 2090-2097 (2003); Taylor et al., Annu Rev Immunol 23, 901-944 (2005)). Хотя прямое распознавание этих поверхностных структур является фундаментальным аспектом врожденного иммунитета, опсонизация позволяет характерным для макрофагов рецепторам опосредовать поглощение, повышая эффективность и внося разнообразие в репертуар распознавания фагоцита (Stuart and Ezekowitz, Immunity 22, 539-550 (2005)). Процесс фагоцитоза вовлекает множество взаимодействий лиганд-рецептор, и в настоящие время очевидно, что различные опсонины, включая иммуноглобулины, коллектины и компоненты комплемента, регулируют клеточную активность, требуемую для интернализации патогена, через взаимодействие с рецепторами клеточной поверхности макрофагов (рассмотрено Aderem and Underhill, Annu Rev Immunol 17, 593-623 (1999); Underhill and Ozinsky, Annu Rev Immunol 20, 825-852 (2002)). Хотя природные иммуноглобулины, кодируемые генами зародышевой линии, могут распознавать широкое множество патогенов, большинство опсонизирующих IgG образуются путем адаптивного иммунитета, и, таким образом, эффективное выведение через Fc-рецепторы не является прямым (Carroll, Nat Immunol 5, 981-986 (2004)). Комплемент, с другой стороны, быстро распознает патогенные поверхностные молекулы и запускает поглощение частицы с помощью рецепторов комплемента (Brown, Infect Agents Dis 1, 63-70 (1991)).
Комплемент состоит из более чем 30 белков сыворотки, которые опсонизируют широкое множество патогенов для распознавания рецепторами комплемента. В зависимости от исходного пускового фактора каскада можно выделить три каскада (рассмотрены (Walport. N Engl J 344, Med 1058-1066 (2001)). Все три каскада имеют общую стадию активации центрального компонента C3, однако они отличаются способом распознавания и исходными биохимическими стадиями, ведущими к активации C3. Классический каскад активируется антителами, связанными с поверхностью патогена, которые в свою очередь связывают C1q-компонент комплемента, запуская каскад сериновых протеаз, который в конечном итоге расщепляет C3 до его активной формы, C3b. Каскад лектина активируется после распознавания углеводных мотивов белками лектинами. К настоящему времени, идентифицированы три члена этого каскада: связывающие маннозу лектины (MBL), семейство лектинов SIGN-R1 и фиколины (Pyz et al., Ann Med 38, 242-251 (2006)). Как MBL, так и фиколины ассоциированы с сериновыми протеазами, которые действуют подобно C1 в классическом каскаде, активируя компоненты C2 и C4, что ведет к центральной стадии C3. Альтернативный каскад отличается как от классического, так и от лектинового каскадов тем, что он активируется вследствие прямой реакции внутреннего сложного эфира C3 с распознаваемыми мотивами на поверхности патогена. Первоначальное связывание C3 с активирующей поверхностью приводит к быстрому усилению накопления C3b под действием протеаз альтернативного каскада, фактора B и фактора D. Важно, что C3b, накапливаемый путем либо классического, либо лектинового каскада, также может привести к усилению накопления C3b под действием факторов B и D. Во всех трех каскадах активация комплемента, главная стадия опсонизации, представляет собой превращение компонента C3 в C3b. Расщепление C3 ферментами каскадов комплемента экспонирует сложный тиоэфир для нуклеофильной атаки, позволяя ковалентное присоединение C3b к поверхности антигена через домен сложного тиоэфира. Это является начальной стадией опсонизации комплементом. Последующий протеолиз связанного C3b приводит к образованию фрагментов iC3b, C3c и C3dg, которые распознаются различными рецепторами (Ross and Medof, Adv Immunol 37, 217-267 (1985)). Это расщепление устраняет способность C3b к последующему усилению накопления C3b и активации поздних компонентов каскада комплемента, включая мембраноатакующий комплекс, способный прямо повреждать мембрану. Однако фагоцитарные рецепторы макрофагов предпочтительно распознают C3b и его фрагменты; вследствие универсальности образования сложноэфирной связи опосредуемая C3 опсонизация является центральной для распознавания патогена (Holers et al., Immunol Today 13, 231-236 (1992)), и, таким образом, рецепторы для различных продуктов деградации C3 играют важную роль в иммунном ответе хозяина.
C3 сам по себе представляет собой комплексный и гибкий белок, состоящий из 13 отдельных доменов. Центральная часть молекулы состоит из 8 так называемых макроглобулиновых (MG) доменов, которые формируют плотно упакованные α- и β-цепи C3. В эту структуру встроены CUB- (C1r/C1s, Uegf и белок морфогенеза костей-1) и TED-домены, которые содержат тиосложноэфирную связь, которая позволяет ковалентное связывание C3b с поверхностями патогенов. Остальные домены включают C3a или действуют в качестве линкеров и спейсеров центральных доменов. Сравнение структур C3b и C3c с C3 демонстрирует, что молекула претерпевает значительные конформационные перестройки при каждом протеолизе, которые экспонируют не только TED, но также дополнительные новые поверхности молекулы, которые могут взаимодействовать с клеточными рецепторами (Janssen and Gros, Mol Immunol 44, 3-10 (2007)). Для предотвращения нежелательной активации комплемента большинство клеток млекопитающих снабжены регуляторами, которые блокируют усиление комплемента на собственных клетках хозяина (Hourcade et al. Adv Immunol 45:381 (1989)). В отсутствие этих собственных регуляторов обнажение для сыворотки приводит к образованию продукта расщепления комплемента, который, в свою очередь, способствует воспалению и повреждению ткани (Oglesby et al. J Exp Med 175: 1 547 (1992) и Oglesby et al., Trans Assoc. Am. Physicians 104: 164 (1991)). Неклеточные поверхности, которые лишены собственных регуляторов комплемента, таким образом, особенно подвержены атаке комплемента и полностью зависят от защиты растворимыми регуляторами комплемента в сыворотке. Неконтролируемая активация комплемента вследствие отсутствия соответствующей регуляции комплемента ассоциирована с различными хроническими воспалительными заболеваниями и дегенеративными заболеваниями. Доминирующими в этом воспалительном каскаде являются продукты расщепления комплемента C3a и C5a, которые функционируют в качестве хемоаттрактантов и активаторов нейтрофилов и воспалительных макрофагов через рецепторы для C3a и C5a (Mollnes et al., Trends Immunol. 23:61 (2002)). Пропердин, высвобождаемый из нейтрофилов, далее усиливает воспалительный каскад через стабилизацию AP-конвертазы (Lutz and Jelezarova, Mol. Immunol. 43:2 (2006)). Было показано, что активация комплемента является важным компонентом, запускающим воспаление при опосредуемых иммунными комплексами заболеваниях, таких как мембранопролиферативный гломерулонефрит, нефротоксический нефрит и артрит (Walport, N. Engl. J. Med. 344: 1058 (2001); Thurman and Holers, J Immunol 176: 1305 (2006): Banda et al., J Immunol 171: 2109 (2003); Weisman et al., Science 249: 146 (1990); Morgan and Harris, Mol. Immunol, 40: 159 (2003)), а также связанная со старением дегенерация желтого пятна (Anderson et al. Am. J. Ophthalmol. 134: 411 (2002); Donoso et al., Surv. Ophthalmol. 51: 137 (2006); Gold et al., Natl. Genet 38: 458 (2006); Hageman et al., Proc. Natl. Acad. Sci. USA 102: 7227 (2005); Hageman et al., Ann. Med. 38: 592 (2006); Hageman et al., Prog. Retin. Eye Res. 20: 705 (2001)).
Большинство регуляторов активации комплемента действуют на уровне C3b, центрального компонента конвертаз комплемента. Эти природные регуляторы активации комплемента, как правило, имеют большие размеры (>100 кДа) и их трудно конструировать в качестве терапевтического реагента. Таким образом, существует необходимость в лекарственных средствах для профилактики и лечения ассоциированных с комплементом нарушений путем блокирования C3b.
Сущность изобретения
Настоящее изобретение относится к разработке антител, которые специфично распознают фрагменты расщепления C3 и не распознают нативный C3, таким образом, избегая действия нативного C3 в качестве "груза" для антител. Более конкретно, изобретение относится к специфичным к C3b антителам и фрагментам антител и к их применению для лечения связанных с комплементом заболеваний.
В одном аспекте изобретение относится к способу профилактики или лечения связанного с комплементом нарушения, включающему введение субъекту, нуждающемуся в эффективном количестве антагониста C3b, который является селективным ингибитором альтернативного каскада комплемента.
В одном варианте осуществления субъектом является млекопитающее. В другом варианте осуществления субъектом является человек. В следующем варианте осуществления антагонист C3b представляет собой антитело, распознающее эпитоп на активном продукте деградации C3, но не на C3.
В другом варианте осуществления антагонист C3b представляет собой антитело или фрагмент антитела, селективно связывающиеся с C3b.
В другом варианте осуществления антитело ингибирует связывание C5 с C3b. В другом варианте осуществления антитело связывается с эпитопом, включая остатки эпитопа C3b, распознаваемого антителом S77.
В другом варианте осуществления антитело связывается по существу с тем же эпитопом, что и антитело S77.
В следующем варианте осуществления антитело конкурентно ингибирует связывание антитела S77.
В другом варианте осуществления антитело связывается с эпитопом C3b, содержащим остатки, которые контактируют с антителом S77.
В дополнительном варианте осуществления антитело содержит антигенсвязывающий центр, содержащий остатки антитела S77, которые контактируют с C3b.
В предпочтительном варианте осуществления антитело содержит последовательности CDR тяжелой (SEQ ID NO:1-4) и/или легкой (SEQ ID NO:5-8) цепей антитела S77 и/или представляет собой антитело S77 или его фрагмент.
В различных вариантах осуществления антитело может быть человеческим, гуманизированным или химерным.
В других вариантах осуществления фрагмент антитела выбран из группы, состоящей из Fab, Fab', F(ab')2, scFv, (scFv)2, dAb, фрагментов определяющих комплементарность областей (CDR), линейных антител, молекул одноцепочечных антител, миниантител, антител-димеров и полиспецифических антител, образованных из фрагментов антител.
Способы по настоящему изобретению включают профилактику или лечение любого связанного с комплементом нарушения, включая воспалительные и аутоиммунные заболевания, например, такие как ревматоидный артрит (RA), острый респираторный дистресс-синдром (ARDS), отдаленное повреждение ткани после ишемии и реперфузии, активация комплемента в ходе хирургической операции с искусственным кровообращением, дерматомиозит, пемфигус, волчаночный нефрит и являющиеся его следствиями гломерулонефрит и васкулит, искусственное кровообращение, индуцируемая кардиоплегией дисфункция эндотелия коронарных артерий, мембранопролиферативный гломерулонефрит типа II, IgA-нефропатия, острая почечная недостаточность, криоглобулинемия, антифосфолипидный синдром, дегенеративные заболевания желтого пятна, такие как связанная со старением дегенерация желтого пятна (AMD), хориоидальная неоваскуляризация (CNV), увеит, диабетическая и другие связанные с ишемией ретинопатии, эндофтальмит и другие связанные с внутриглазной неоваскуляризацией заболевания, такие как диабетический отек желтого пятна, патологическая миопия, болезнь фон Гиппеля-Линдау, гистоплазмоз глаза, окклюзия центральной вены сетчатки (CRVO), неоваскуляризация роговицы, неоваскуляризация сетчатки, а также аллотрансплантация, сверхострое отторжение, гемодиализ, хронический легочный дистресс-синдром (COPD), астма и аспирационная пневмония.
В конкретном варианте осуществления связанное с комплементом нарушение представляет собой связанное с комплементом состояние глаза, такое как связанная со старением дегенерация желтого пятна (AMD) или хориоидальная неоваскуляризация (CNV).
В другом аспекте изобретение относится к антителу против C3b, селективно связывающемуся с C3b и не связывающемуся с C3 и ингибирующему связывание C5 с C3b. В одном варианте осуществления антитело связывается с эпитопом, включающим остатки эпитопа C3b, распознаваемые антителом S77.
В другом варианте осуществления антитело связывается по существу с тем же эпитопом, что и антитело S77.
В другом варианте осуществления антитело конкурентно ингибирует связывание антитела S77.
В другом варианте осуществления антитело связывается с эпитопом C3b, включающим остатки, которые контактируют с антителом S77.
В следующем варианте осуществления антитело содержит антигенсвязывающий центр, содержащий остатки антитела S77, которые контактируют с C3b.
В следующем варианте осуществления антитело содержит последовательности CDR тяжелой (SEQ ID NO:1-4) и/или легкой (SEQ ID NO:5-8) цепей антитела S77 или представляет собой антитело S77 или его фрагмент.
В различных вариантах осуществления антитело представляет собой антитело человека, гуманизированное или химерное антитело.
Фрагмент антитела может быть выбран, например, из группы, состоящей из Fab, Fab', F(ab')2, scFv, (scFv)2, dAb, фрагментов определяющих комплементарность областей (CDR), линейных антител, молекул одноцепочечных антител, миниантител, антител-димеров и полиспецифических антител, образованных из фрагментов антител.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей антагонист C3b, такой как антитело против C3b, в смеси с фармацевтически приемлемым носителем.
В конкретном варианте осуществления фармацевтическая композиция предназначена для применения при лечении связанного с комплементом нарушения.
В следующем аспекте изобретение относится к набору, содержащему контейнер, содержащий антагонисты C3b или антитело против C3b по настоящему изобретению, или фармацевтическую композицию, содержащую такой антагонист или антитело, и инструкции по введению антитела или фармацевтической композиции для лечения связанного с комплементом нарушения.
Краткое описание рисунков
Фиг.1. Результаты пэннига C3b в фаговой библиотеке антител.
Фиг. 2. Результаты конкуренции фага с различными клонами антител против C3b.
Фиг.3. Кристаллическая структура C3b в комплексе с Fab антитела YW144.2.43.S77 (в дальнейшем в настоящем документе обозначаемого как S77). Бета-цепь C3b указана зеленым цветом, альфа-цепь указана оранжевым. Тяжелая цепь (HC) и легкая цепь (EC) S77 указаны темно-зеленым и желтым соответственно. CRIg размещен на комплексе C3b:Fab исходя из структуры сокристалла C3b:CRIg и показан фиолетовым цветом.
Фиг. 4. Увеличенный масштаб связывающего взаимодействия антитела S77 с C3b. C3b показан с помощью представления поверхности, ленточная диаграмма голубого цвета соответствует наложению C3 на структуру C3b. HC и LC в S77 указаны в качестве ленточной диаграммы темно-зеленым и желтым. Поверхность C3b окрашена в соответствии с расстоянием до S77. Все атомы, расположенные ближе 4,7 Å, 4,0 Å и 3,5 Å, окрашены желтым, оранжевым и красным соответственно. Следует отметить, что LC в S77 совпадает на C3. Однако петля C3 может быть способна к движению.
Фиг. 5. Аминокислотные последовательности тяжелых (SEQ ID NO:1-4) и легких (SEQ ID NO:5-8) цепей Fab-фрагмента антитела S77. Красным указаны остатки, которые непосредственно контактируют с C3b.
Фиг. 6A и 6B. Аффинность связывания Fab исходного антитела YW144.2.43 и его варианта после созревания аффинности: Fab 144.2.43.S77 (S77 Fab).
Фиг. 7A, 7B и 7С. Сенсограммы SPR и аффинность связывания S77 с C3 и C3b.
Фиг. 8A и 8B. S77 распознает C3b, но не промолекулу C3. Очищенный C3b или C3 иммобилизовывали на микропланшетах для титрования с использованием поликлонального антитела против C3. Связывание S77 (A) или поликлонального антитела против C3 (B) с иммобилизованным C3b или C3 определяли с использованием вторичного конъюгированного с HRPO антитела. Цвет проявляли с помощью TMB (KPL), проявление останавливали 2 н. H2SO4 и поглощение считывали при 450 нм.
Фиг. 9A, 9B и 9С. Антитело IgG S77 селективно ингибирует альтернативный, но не классический каскад комплемента. Эритроциты кролика и эритроциты овцы инкубировали в сыворотке с истощением C1q и фактором B и проводили мониторинг гемолиза в присутствии возрастающей концентрации ингибитора или контрольного белка. Величину гемолиза выражали в качестве процента от максимального гемолиза в отсутствие ингибитора.
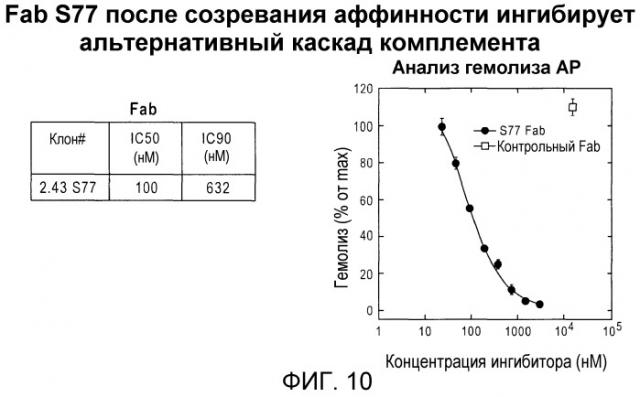
Фиг. 10. Fab S77 после созревания аффинности ингибирует альтернативный каскад комплемента.
Фиг. 11. Fab против C3b (S77) ингибирует C5-конвертазу. C5-конвертазу получали, как описано (Rawal, N и Pangburn, M. J Immunol. 2001 Feb 15; 166(4):2635-42).
Фиг. 12. Антитело IgG S77 и его Fab-фрагмент ингибируют C5-конвертазу блокированием связывания C5 с C3b, некаталитической субъединицей конвертазы. C5 в присутствии возрастающих концентраций ингибитора добавляли в планшеты, покрытые C3b. C5 связывалась с мультимерами C3b.
Фиг. 13. S77 не вызывает распад конвертазы, в противоположность фактору H. Анализ распада проводили по образованию иммобилизованной на планшете C3-конвертазы в присутствии возрастающих концентраций S77 или фактора H (положительный контроль).
Фиг. 14A и 14B. S77 ингибирует связывание профактора B с C3b и ингибирует образование C3bBb-конвертазы.
Фиг. 15A и 15B. S77 может связывать C3b в присутствии связанного fBb и не вызывает распад C3-конвертазы.
Фиг. 16 и 16B. S77 ингибирует связывание фактора H с C3b и ингибирует активность кофактора H.
Фиг. 17. S77 ингибирует связывание CR1 с C3b.
Фиг. 18A и 18B. Аминокислотные последовательности вариабельных областей легкой (SEQ ID NO:13) и тяжелой (SEQ ID NO:14) цепей антитела против HER2 rhuMAB 4D5-8.
Добавочная фиг. 1. Остатки на C3b, контактирующие с HC и LC в Fab S77 (остатки 833-839 охватывают SEQ ID NO:15; остатки 895-899 охватывают SEQ ID NO:16).
Добавочная фиг. 2. Остатки на Fab S77, контактирующие с C3b (остатки 1030-1033 охватывают SEQ ID NO:17; остатки 1098-1107 охватывают SEQ ID NO:18).
Добавочная фиг. 3. Аминокислотные последовательности C3-фактора комплемента человека (SEQ ID NO:9) и C3-фактора комплемента мыши (SEQ ID NO:10).
Подробное описание предпочтительного варианта осуществления
I. Определения
Термины "C3" и "C3-компонент комплемента" используют взаимозаменяемо, и они относятся к полипептидам C3 с нативной последовательностью.
"C3 с нативной последовательностью" представляет собой полипептид, имеющий такую же аминокислотную последовательность, что и природный C3-полипептид, независимо от способа его получения. Таким образом, C3 с нативной последовательностью может быть выделен из природного источника или он может быть получен рекомбинантными и/или синтетическими способами. Термин "C3 с нативной последовательностью" конкретно охватывает встречающиеся в природе формы вариантов (например, альтернативно сплайсированные формы) и встречающиеся в природе аллельные варианты C3, а также структурные конформационные варианты, имеющие аминокислотную последовательность, как у полипептида C3 из природного источника. Полипептиды C3 с нативной последовательностью конкретно включают C3 человека с нативной последовательностью (добавочная фигура 3, SEQ ID NO:9; также см. De Bruijn and Fey, Proc. Natl. Acad. Sci. USA 82:708-712) и полипептиды не являющихся человеком животных, включая высших приматов и других не являющихся человеком млекопитающих, такие как последовательность C3 мыши, представленная на добавочной фигуре 3, SEQ ID NO:10).
Термины "C3b" используют в настоящем документе для обозначения полипептида C3b с нативной последовательностью, образующегося из C3b после расщепления C3-конвертазой, высвобождающей фрагмент анафилатоксина C3a с N-конца α-цепи C3 и оставляющей C3b. Термин "нативная последовательность" имеет такое же значение, как определено в связи с C3, и конкретно включает C3b человека с нативной последовательностью SEQ ID NO:9.
Термин "антагонист C3b" используют в наиболее широком значении, и он включает любую молекулу, которая способна нейтрализовывать, блокировать, частично или полностью ингибировать, устранять, снижать биологическую активность C3 или препятствовать ей. Антагонисты C3b включают, но не ограничиваются ими, антитела против C3b и их антигенсвязывающие фрагменты, другие связывающие полипептиды, пептиды и непептидные низкомолекулярные соединения, которые связываются с C3b и способны нейтрализовывать, блокировать, частично или полностью ингибировать, устранять, снижать биологическую активность C3 или препятствовать биологической активности C3, такой как способность C3b участвовать в патологии связанного с комплементом нарушения. Антагонисты C3b, такие как антитела против C3b, представленные в настоящем документе, специфично распознают C3b и не распознают его предшественника, C3.
"Низкомолекулярное соединение" определяют в настоящем документе как соединение, имеющее молекулярную массу менее приблизительно 600, предпочтительно менее приблизительно 1000 дальтон.
"Активный", или "активность", или "биологическая активность" в контексте антагониста C3b, такого как антитело против C3b, по настоящему изобретению, представляет собой способность осуществлять антагонизм (частично или полностью ингибировать) биологической активности C3b. Предпочтительная биологическая активность антагониста C3b представляет собой способность достигать улучшения состояния, например при патологии, в случае связанного с C3b заболевания или состояния, например, такого как связанное с комплементом нарушение. Активность можно определять в тестах in vitro или in vivo, включая анализы связывания, с использованием соответствующей модели на животных или клинических испытаний у человека.
Термин "связанное с комплементом нарушение" используют в настоящем документе в наиболее широком значении, и он включает все заболевания и патологические состояния, патогенез которых вовлекает нарушение активации системы комплемента, например, такие как дефициты компонентов комплемента. Конкретно термин включает заболевания и патологические состояния, при которых является полезным ингибирование C3-конвертазы. Кроме того, термин включает заболевания и патологические состояния, при которых является полезным ингибирование, включая селективное ингибирование, альтернативного каскада комплемента. Связанные с комплементом нарушения включают, но не ограничиваются ими, воспалительные заболевания и аутоиммунные заболевания, например, такие как ревматоидный артрит (RA), острый респираторный дистресс-синдром (ARDS), отдаленное повреждение ткани после ишемии и реперфузии, активация комплемента в ходе хирургической операции с искусственным кровообращением, дерматомиозит, пемфигус, волчаночный нефрит и являющиеся его следствиями гломерулонефрит и васкулит, искусственное кровообращение, индуцируемая кардиоплегией дисфункция эндотелия коронарных артерий, мембранопролиферативный гломерулонефрит типа II, IgA-нефропатия, острая почечная недостаточность, криоглобулинемия, антифосфолипидный синдром, дегенеративные заболевания желтого пятна, такие как связанная со старением дегенерация желтого пятна (AMD), хориоидальная неоваскуляризация (CNV), увеит, диабетическая и другие связанные с ишемией ретинопатии, эндофтальмит и другие связанные с внутриглазной неоваскуляризацией заболевания, такие как диабетический отек желтого пятна, патологическая миопия, болезнь фон Гиппеля-Линдау, гистоплазмоз глаза, окклюзия центральной вены сетчатки (CRVO), неоваскуляризация роговицы, неоваскуляризация сетчатки, а также аллотрансплантация, сверхострое отторжение, гемодиализ, хронический легочный дистресс-синдром (COPD), астма и аспирационная пневмония.
Термин "связанное с комплементом состояние глаза" используют в настоящем документе в наиболее широком значении, и он включает все состояния и заболевания глаза, патология которых вовлекает комплемент, включая классический и альтернативный каскады, и, в частности, альтернативный каскад комплемента. Конкретно, в эту группу включены все состояния и заболевания глаза, ассоциированные с альтернативным каскадом, возникновение, развитие или прогрессирование которых можно контролировать ингибированием альтернативного каскада. Связанные с комплементом состояния глаза включают, но не ограничиваются ими, дегенеративные заболевания желтого пятна, такие как все стадии связанной со старением дегенерации желтого пятна (AMD), включая сухую и влажную (неэкссудативную и экссудативную) формы, хориоидальную неоваскуляризацию (CNV), увеит, диабетическую и другие связанные с ишемией ретинопатии, эндофтальмит и другие связанные с внутриглазной неоваскуляризацией заболевания, такие как диабетический отек желтого пятна, патологическая миопия, болезнь фон Гиппеля-Линдау, гистоплазмоз глаза, окклюзию центральной вены сетчатки (CRVO), неоваскуляризацию роговицы, неоваскуляризацию сетчатки. Предпочтительная группа связанных с комплементом состояний глаза включает связанную со старением дегенерацию желтого пятна (AMD), включая экссудативную (влажную) и неэкссудативную (сухую или атрофическую) AMD, хориоидальную неоваскуляризацию (CNV), диабетическую ретинопатию (DR) и эндофтальмит.
Термин "воспалительное заболевание" и "воспалительное нарушение" используют взаимозаменяемо, и он означает заболевание или нарушение, при котором компонент иммунной системы млекопитающего вызывает, опосредует или иным образом вносит вклад в воспалительный ответ, приводящий к заболеваемости млекопитающего. Также к этим терминам относятся заболевания, при которых снижение воспалительного ответа оказывает улучшающий эффект на прогрессирование заболевания. В этот термин включены иммуноопосредуемые воспалительные заболевания, включая аутоиммунные заболевания.
Термин "опосредуемое T-клетками" заболевание означает заболевание, при котором T-клетки прямо или непрямо опосредуют или иным образом вносят вклад в заболеваемость у млекопитающего. Опосредуемое T-клетками заболевание может быть ассоциировано с клеточно-опосредуемыми эффектами, опосредуемыми лимфокинами эффектами и т.д. и даже эффектами, связанными с B-клетками, если B-клетки стимулируются, например, лимфокинами, секретируемыми T-клетками.
Примеры связанных с иммунной системой и воспалительных заболеваний, некоторые из которых являются опосредуемыми T-клетками, включают, но не ограничиваются ими, воспалительное заболевание кишечника (IBD), системную красную волчанку, ревматоидный артрит, ювенильный хронический артрит, спондилоартропатии, системную склеродермию (склеродермию), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), синдром Шегрена, системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (панцитопения клеток иммунной системы, пароксизмальная ночная гемоглобинурия), аутоиммунную тромбоцитопению (идиопатическая тромбоцитопеническая пурпура, иммуноопосредуемая тромбоцитопения), тиреоидит (болезнь Грэйва, тиреоидит Хашимото, ювенильный лимфоцитарный тиреоидит, атрофический тиреоидит), сахарный диабет, иммуноопосредуемое заболевание почек (гломерулонефрит, тубулоинтерстициальный нефрит), демиелинизирующие заболевания центральной и периферической нервной системы, такие как рассеянный склероз, идиопатическая полиневропатия, заболевания печени и желчевыводящих путей, такие как инфекционный гепатит (гепатит A, B, C, D, E и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный биллиарный цирроз, гранулематозный гепатит и склерозирующий холингит, воспалительные и фиброзные заболевания легких (например, кистозный фиброз), глютензависимую энтеропатию, болезнь Уиппла, аутоиммунные или иммуноопосредуемые заболевания кожи, включая буллезные заболевания кожи, полиформную эритему и контактный дерматит, псориаз, аллергические заболевания легкого, такие как эозинофильная пневмония, идиопатический фиброз легких и связанный с гиперчувствительностью пневмонит, связанные с трансплантацией заболевания, включая отторжение трансплантата, реакцию "трансплантат против хозяина", болезнь Альцгеймера и атеросклероз.
"Лечение" представляет собой вмешательство, проводимое с намерением предотвращения развития или изменения патологии нарушения. Таким образом, "лечение" относится как к терапевтическому лечению, так и к профилактическим или предупредительным мерам. Субъекты, нуждающиеся в лечении, включают субъектов, уже имеющих нарушение, а также субъектов, у которых нарушение подлежит профилактике. При лечении связанного с иммунной системой заболевания лекарственное средство может прямо изменять силу ответа компонента иммунного ответа, или оно может обеспечивать повышенную восприимчивость заболевания к лечению другими лекарственными средствами, например антибиотиками, противогрибковыми средствами, противовоспалительными средствами, химиотерапевтическими средствами и т.д.
"Патология" заболевания, такого как связанное с комплементом нарушение, включает все явления, которые нарушают здоровье пациента. Она включает, но не ограничивается ими, аномальный или неконтролируемый рост клеток (нейтрофильных, эозинофильных, моноцитарных, лимфоцитарных клеток), продукцию антител, продукцию аутоантител, продукцию комплемента, препятствие нормальному функционированию соседних клеток, высвобождение цитокинов или других секретируемых продуктов на аномальных уровнях, подавление или усиление воспалительного или иммунологического ответа, инфильтрацию воспалительных клеток (нейтрофильных, эозинофильных, моноцитарных, лимфоцитарных) в клеточные пространства и т.д.
Термин "млекопитающее", как используют в настоящем документе, относится к любому животному, классифицируемому как млекопитающее, включая, но не ограничиваясь ими, человека, высших приматов, домашних и сельскохозяйственных животных, животных зоопарков, спортивных животных или комнатных животных, таких как лошади, свиньи, крупный рогатый скот, собаки, кошки, хорьки и т.д. В предпочтительном варианте осуществления изобретения млекопитающее представляет собой человека.
Введение "в сочетании с" одним или несколькими дополнительными лекарственными средствами включает одновременное (совместное) и последовательное введение в любом порядке.
"Терапевтически эффективное количество" представляет собой количество "антагониста C3b", такого как "антитело против C3b", которое требуется для достижения измеримого улучшения состояния, например при патологии, в случае определенного заболевания или состояния, например, такого как связанное с комплементом нарушение.
Термин “последовательности контроля” относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Последовательности контроля, которые пригодны для прокариот, включают, например, промотор, необязательно последовательность оператора и участок связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является "функционально связанной", если она находится в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или секреторной лидерной последовательности функционально связана с ДНК полипептида, если она экспрессируется в качестве пребелка, который участвует в секреции полипептида; промотор или энхансер является функционально связанным с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания рибосом является функционально связанным с кодирующей последовательностью, если он расположен таким образом, чтобы облегчить трансляцию. Как правило, "функционально связанный" означает, что связанные последовательности ДНК являются смежными и, в случае секреторной лидерной последовательности, являются смежными и находятся в рамке считывания. Однако энхансеры не должны быть смежными. Связывание осуществляют посредством лигирования в соответствующих участках рестрикции. Если таких участков нет, используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с общепринятой практикой.
"Строгость" реакций гибридизации легко определяет специалист в данной области, и, как правило, она представляет собой эмпирическое вычисление, зависящее от длины зонда, температуры промывания и концентрации соли. Как правило, для надлежащего отжига более длинные зонды требуют более высоких температур, в то время как более короткие зонды требуют более низких температур. Гибридизация, как правило, зависит от способности денатурированной ДНК к повторному отжигу, когда комплементарные цепи присутствуют в окружающей среде при температуре ниже их температуры отжига. Чем более высокой является степень требуемой гомологии между зондом и гибридизуемой последовательностью, тем более высокой является относительная температура, которую можно использовать. В результате, из этого следует, что более высокие относительные температуры будут обеспечивать тенденцию к более строгим условиям реакции, в то время как более низкие температуры снижают строгость. Для дополнительных деталей и разъяснения строгости реакций гибридизации см. Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995).
"Строгие условия" или "условия высокой строгости", как определено в настоящем документе, можно определить как условия, в которых: (1) используют низкую ионную силу и высокую температуру промывания, например 0,015 M хлорид натрия/0,0015 M цитрат натрия/0,1% додецилсульфат натрия при 50°С; (2) используют в ходе гибридизации денатурирующее средство, такое как формамид, например 50% (об./об.) формамид с 0,1% бычьим сывороточным альбумином/0,1% Ficoll/0,1% поливинилпирролидоном/50 мМ натрий-фосфатным буфером при pH 6,5 с 750 мМ хлоридом натрия, 75 мМ цитратом натрия при 42°C; или (3) проводят гибридизацию в течение ночи в растворе, в котором используется 50% формамид, 5 × SSC (0,75 M NaCl, 0,075 M цитрат натрия), 50 мМ фосфат натрия (pH 6,8), 0,1% пирофосфат натрия, 5 × раствор Денхардта, облученная ультразвуковым облучением ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфат декстрана при 42°C, с промыванием в течение 10 минут при 42°C в 0,2 × SSC (хлорид натрия/цитрат натрия) с последующим промыванием высокой строгости в течение 10 минут, состоящим из 0,1 × SSC, содержащего EDTA, при 55°C.
"Условия умеренной строгости" можно определить, как описано в Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989, и они включают применение менее строгого раствора для промывания и условий гибридизации (например, температуры, ионной силы и %SDS), чем раствор для промывания и условия гибридизации, описанные выше. Примером умеренно строгих условий является инкубация в течение ночи при 37°C в растворе, содержащем: 20% формамид, 5 × SSC (150 мМ NaCl, 15 мМ трицитрат натрия), 50 мМ фосфат натрия (pH 7,6), 5 × раствор Денхардта, 10% сульфат декстрана и 20 мг/мл денатурированной расщепленной ДНК спермы лосося, с последующим промыванием фильтров в 1 × SSC при приблизительно 37-50°С. Специалисту будет понятно, каким образом корректировать температуру, ионную силу и т.д., в случае необходимости приспосабливания к таким факторам, как длина зонда и т.п.
Термин "меченный эпитопом", при применении в настоящем документе, относится к химерному полипептиду, содержащему полипептид по изобретению, слитый с "полипептидом-меткой". Полипептид-метка имеет достаточное количество остатков для обеспечения эпитопа, против которого можно получать антитело, но в то же время является достаточно коротким, чтобы не препятствовать активности полипептида, с которым он слит. Также полипептид-метка предпочтительно является совершенно уникальным, так что антитело по существу не вступает в перекрестные реакции с другими эпитопами. Пригодные полипептиды-метки, как правило, имеют по меньшей мере шесть аминокислотных остатков и, как правило, между приблизительно 8 и 50 аминокислотных остатков (предпочтительно между приблизительно 10 и 20 аминокислотных остатков).
Термин "антитело" используют в наиболее широком значении, и конкретно он включает, но не ограничивается ими, отдельные антитела, распознающие фрагмент распада C3, но не нативный C3, такие как моноклональные антитела