Способ получения селенсодержащего препарата биомассы laetiporus sulphureus mz-22
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ предусматривает культивирование штамма Laetiporus sulphureus BKM-F-4276D на капустной среде, содержащей глюкозу в количестве 2%, молочную сыворотку в количестве 1%, с добавлением селенита натрия в концентрации 15-25 мг/л. Изобретение позволяет увеличить содержание селена в мицелии штамма, которое составляет 3,50-4,38 мкг/г высушенного мицелия. 8 ил., 5 табл., 6 пр.
Реферат
Изобретение относится к биотехнологической, медицинской, фармацевтической, пищевой и косметической промышленности, а именно к способам получения биологически активных веществ, которые могут использоваться в качестве биологически активных добавок (БАД).
Известны способы получения биодоступного органического селена, предусматривающие получение селенсодержащей биомассы спирулины, согласно которым обогащение биомассы осуществляют культивированием спирулины на питательной среде, содержащей неорганическую соль селена. Запатентован способ получения селенсодержащей биомассы спирулины, при котором в колбы на 100 мл с объемом 50 мл питательной водно-солевой среды Заррука, содержащую минеральные соли, засевают инокулят спирулины (Spirulina platensis) в количестве 10% от объема среды, помещают в люминостат, где инкубируют при температуре 30°С и освещенности 2000 лк. Неорганическую соль селена Nа2SеО3 вводят в питательную среду на 5-10 сут в начале и первой половине логарифмической фазы роста культуры спирулины. После инкубации в течение 30 сут. при введении соли неорганического селена в среду в концентрации 50 мг/л [Патент №2096037 (РФ). Способ получения селенсодержащего препарата биомассы спирулины / Тамбиев А.Х., Кирикова Н.Н., Мазо Е.К., Скальный А.В. от 20.11.1997].
Недостатками способа являются затраты на использование источников дневного света, необходимость замера оптической плотности клеток фотоколориметрическим методом.
Наряду с ним запатентован способ, сущность которого заключается в том, что в процессе культивировании спирулины вводят неорганическую соль селена двумя порциями - первую в последней четверти логарифмической фазы роста, вторую - в стационарной фазе роста. Спирулину выращивают в накопительном, интенсивном режиме в полупромышленных культиваторах объемом 80 л, оснащенных лампами дневного света, с освещенностью 12-15 тыс.эрг/см2, температурой 28-30°С, рН среды 8,0-8,5. Путем замера оптической плотности культуральной жидкости на ФЭКе определяют по калибровочной кривой концентрацию клеток спирулины в процессе роста. Первую порцию селенсодержащей соли вносят в момент достижения концентрации клеток 0,8-1 г/л, которая характеризует выход культуры в последнюю четверть логарифмической фаза роста. Концентрация клеток при выходе на стационарную фазу роста составляет 1,2-1,5 г/л. По достижении этой концентрации повторно вносят селенсодержащую соль. По истечении 7 суток отделяют биомассу фильтрованием, промывают физиологическим раствором (в пятикратном объеме), сушат и измельчают. Получают продукт, содержание биодоступного селена в котором 6,15-6,5 г/кг. Для использования его в качестве биологически активной добавки к пище полученный концентрат смешивают с сухой биомассой спирулины, чтобы довести содержание селена до разрешенных фармакопийных норм [Патент №2146287 (РФ). Способ получения селенсодержащей спирулины / Нечаева С.В., Булгаков Ш.Х., Колодяжная Е.Ю., Горонкова О.И. от 10.03.2000].
Известно, что в присутствии Nа2SеO3 в концентрации 30 мг/л в питательной среде наблюдается снижение скорости роста Spirulina platensis на линейной фазе, значительное снижение максимальной плотности суспензии при более раннем выходе на стационарную фазу роста. Содержание клеточного селена находится в прямой зависимости от концентрации селенита в среде, что свидетельствует о неспособности клеток лимитировать его накопление вплоть до летальных величин. При высоком содержании селенита натрия (100-170 мг/л) S. platensis восстанавливает Se(IV) до Se(0), который выделяется на поверхность клетки и в среду культивирования. Высокие концентрации Na2SeO3 вызывают подкисление цитоплазматического рН, при этом снижается содержание белка в биомассе, однако содержание углеводов и липидов несколько повышается, что характерно для стрессовых реакций S.platensis [Пронина Н.А. и др. Получение биомассы Spirulina platensis, обогащенной микроэлементами/ Пронина Н.А., Ковшова Ю.И., Попова В.В., Цоглин Л.Н. // Химия и компьютерное моделирование. Бутлеровские сообщения. 2001, №5].
Известен способ получения селеновых органических веществ. В качестве исходных продуктов используют зеленую массу белковосодержащих растений, например злаковых и бобовых, а также богатые белками листья кукурузы. Зеленую массу предварительно высушивают и измельчают. С помощью экстракции в течение 3 дней из полученного сырья извлекают белковоорганические комплексы. Экстракцию осуществляют с помощью эфира, спирта или димексида. Полученный экстракт выпаривают и производят лиофильную сушку. Полученный порошок растворяют в 60-90% спирте. После этого к раствору добавляют селен в виде ионов (ионизированная соль селена), получаемых при электролизе селеномочевины из расчета 6-12 мкг на 1 мл раствора и ко всему этому добавляют определенное количество органических структур (углеводов, фосфолипидов, фосфолипоуглеводов, каротиноуглеводов и цианоуглеводов). Полученные вещества помещают в электромагнитное (плотность потока мощности 510-3 Вт/см2) синусоидальное высокочастотное поле 20-30 МГц на 5 минут. В результате происходит соединение селена с аминокислотами растительного белка [Патент RU 2161034 С1. Иммунокорригирующее протеоселеновое средство и способ иммунокоррекции / Новицкий Ю.А., Новицкий М.Ю. от 27.12.2000].
Недостатками способа являются его сложность в целом, длительность экстракции белковоорганических комплексов (3 дня) из растительного сырья, получение ионизированной соли селена, а также затраты на применение электромагнитного высокочастотного поля.
Наиболее близким по технической сущности и достигаемому результату является изобретение, описанное в патенте (RU 2086645 С 12, 1997). Одной из основных форм существования органического селена в грибных тканях является селенметионин (SeMet) [Whanger P.D. Selenocompounds in plants and animals and their biological significance / Journal of the American College of Nutrition, Vol.21, No. 3, 223-232 (2002)]. При стандартизированных условиях выращивания дрожжевых культур около 85% селена содержится в них в виде SeMet [Ip С., Birringer M., Block E., Kotrebai M., Tyson J.F., Uden P.C., Lisk D.J. Chemical speciation influences comparative activity of selenium-enriched garlic and yeast in mammary cancer prevention / J Agric Food Chem., 2000 Jun; 48(6):2062-70]. Культура пекарских дрожжей Saccharomyces cerevisiae способна ассимилировать до 3 мг/г биомассы Se [Demirci A., Pometto A.L., Сох D.J. Enhanced organically bound seleniumy production by fed-bBatch fermentation / J. Agric. Food Chem., 1999, 47 (6), pp 2496-2500], при этом более 90% общего Se находится в форме SeMet и лишь 0,5% - селенцистеина (SeCys) [Schauzer G.N. Selenomethionine: A review of its nutritional significance, metabolism and toxicity / J. Nutr. 2000, 130, 1653-1656]. Такая же картина наблюдается у высших съедобных грибов - культивируемых базидиомицетов.
Предлагаемый способ заключается в следующем. Дрожжи рода Candida или Saccharomyces cerevisiae культивируют непрерывно в условиях интенсивной аэрации и перемешивания среды при заданном значении рН, равном предпочтительно 4,0-4,2, которое регулируют путем титрования среды аммиачной водой, на питательной среде, содержащей н-парафины или этанол, или мелассу в качестве источника углерода, источники азота, фосфора, калия и серосодержащие соли, магния железа, цинка, марганца, необходимые для роста дрожжей, и дополнительно введенные соединения селена в количестве 0,01-0,6 мМ/л среды из расчета на селен, с последующим выделением целевого продукта белково-витаминного концентрата паприна, эприна или хлебопекарских дрожжей, обогащенных дополнительно селеном [Патент №2086645 (РФ). Способ получения препарата, обогащенного селеном / Исакова Е.П., Градова Н.Б., Ерошин В.К., Белов А.П., Шерова Т.Л., Горпенко Л.В., Жильцова Т.С. от 10.08.1997].
Недостатком данного способа является необходимость создания условий хемостата для культивирования культур дрожжей и несбалансированный состав белка дрожжей рода Candida или Saccharomyces cerevisiae.
Общепризнано, что селен является необходимым для жизни микроэлементом. Его биологическая роль в организме весьма значительна. Селен обеспечивает функционирование защитной глутатионпероксидазной системы, входя в активный центр глутатионпероксидазы, вызывающей разрушение избыточных перекисей в организме; защищает витамин Е и липиды биологических мембран от аберрантного, окислительного разрушения, предотвращает образование избыточных количеств свободных радикалов, стимулирует реакционную способность SH-групп ферментов, усиливает процессы биологического окисления и фосфорилирования, способствует нормальному питанию мышцы и формированию физиологической функции мышечной ткани. Кроме того, селен повышает иммунитет и играет важную роль в поддержании нормального состояния органов эндокринной системы зрительного анализатора. Тяжелый дефицит селена смещает равновесие в организме в пользу перекисей, что приводит к тяжелым последствиям - массовому разрушению клеток крови и тканей - оксидативному стрессу. Вот почему селен - наиболее важный микроэлемент, от которого зависит состояние иммунной системы. Как неспицифический иммуномодулятор селен оказывает хороший лечебный эффект при бронхиальной астме, атопических дерматитах. Селен защищает организм от токсического действия ртути, кадмия, свинца, мышьяка, таллия и теллура, от нитратов и нитритов, обладающих канцерогенным и эмбриотоксическим действием. Доказано радиопротекторное действие селена [Савченко М.Ф., Решетник Л.А., Парфенова Е.О., Прокопьева О.В., Скальный А.В. Клинико-гигиеническая оценка обеспеченности селеном населения Иркутской области // Пособие для врачей и специалистов медико-биологического профиля. - Иркутск, 2001. - 26 с.]. Селенодефицит может приводить к патологиям сердечно-сосудистой и иммунной систем. С дефицитом селена связан патогенез ряда вирусных заболеваний (СПИД, гепатит В, рак, грипп).
Недостаточность селена в питании является весьма распространенным состоянием, влекущим за собой различные неблагоприятные последствия. Это ставит на повестку дня вопрос о снабжении соединениями биодоступного селена достаточно широких групп населения. В естественных условиях селен поступает в организм человека и животных, главным образом, в органическом виде (селенсодержащих аминокислот -селенометионина и селеноцистеина). Селенометионин - главная органическая форма селена, присутствующая в злаковых, масличных культурах. Он синтезируется микроорганизмами и растениями, но не синтезируется высшими животными и человеком. Искусственное снабжение организма селеном при его пищевом дефиците может осуществляться:
- в форме неорганического селена (селенита или селената натрия);
- в форме органических соединений селена микробиального либо дрожжевого происхождения.
Неорганический селен, поступающий в организм в форме селенат- и селенит-анионов, быстро восстанавливается до селеноводорода. Избыточные количества селеноводорода крайне медленно подвергаются утилизации с образованием спиртосодержащих соединений селена. Лишь определенное количество селена, входящего в состав селеноводорода, включается в процесс синтеза специальных селенсодержащих белков, таких как глутатионпероксидаза. У человека селен входит в состав этих белков исключительно в виде селена, связанного с аминокислотой цистеином, т.е. в виде селеноцистеина. При поступлении в организм избыточных количеств неорганического селена, не обеспеченного достаточным количеством цистеина, он может накапливаться в тканях в форме свободного гидроселениданиона, который крайне токсичен. По этой причине рекомендуется принимать только органически связанный селен как более предпочтительную форму снабжения организма селеном.
Основным преимуществом органического селена перед его неорганической формой, кроме низкой токсичности, являются его широкие возможности по накоплению и депонированию в человеческом организме. При потреблении избытка органического селена (селенометионина и селеноцистеина) они легко занимают «свободные места» одноименных аминокислот в обыкновенных белках. Емкость этого «консервативного депо» селена в организме очень велика. С этим обстоятельством связана низкая токсичность селенометионина в сравнении с селенитом и другими формами неорганического селена. Однако нормальное поступление органически связанного селена с пищей маловероятно.
Для коррекции селендефита человека применяют биологически активные добавки к пище (БАД) (содержание селена до 100 мкг в сутки) или лекарственные препараты. Адекватная суточная доза селена - 1 мкг/кг. Минимальная физиологическая суточная доза для взрослого человека - 50 мкг органического селена.
Задачей предлагаемого изобретения является получение биомассы мицелия штамма MZ-22 Laetiporus sulphurous (BKM-F-4276D) с повышенным содержанием органического селена.
Штамм выделен 18.07.1996 г. из плодового тела, собранного с пораженного древостоя Larix sibirica L. в республике Тыва, авторами Т.И.Громовых и Н.В.Пашеновой. Способ получения штамма: тканевый метод. Штамм является «диким» типом. Штамм идентифицирован как Laetiporus sulphurous (Bull.) Murrill, 1920. Дата идентификации 25.10.1996 г. [Определитель грибов России. Порядок Афиллофоровые. Вып.2. С-Пб.: Наука, 1998. - 391 с.].
Культурально-морфологические и микроскопические особенности штамма
Макроморфологические признаки:
на агаризованных средах образует колонии с ватообразным мицелием; воздушный мицелий высокий, край колонии бахромчатый (фиг.1); воздушный мицелий желто-оранжевого цвета; цвет субстратного мицелия: розовато-оранжевый; цвет обратной стороны колонии ярко-оранжевого цвета; пигмент, экссудат и т.д. не образует; при росте на жидких питательных средах образует пеллеты и пленку оранжевого цвета, синтезирует каротиноиды, количество которых зависит от состава питательной среды и условий освещения.
Микроморфологические признаки:
мицелий состоит из длинных дикариофитных гиф с простым ветвлением, без образования пряжек, штамм образует овальные шарообразные и грушевидные бластоконидии, расположенные на гифах терминально или интеркалярно (фиг.2).
Среды для культивирования штамма: капустная с добавлением 1, 2 и 5% молочной сыворотки. Капустная среда (г/л): 200 г капусты кипятят в 1 литре воды 10 мин; отжимают; доводят до 1 литра; разбавляют водой в 2 раза и добавляют в фильтрат 2% глюкозы. Сусло неохмеленное (г/л): 250-300 г солода заливают 1 л воды, нагревают до 48-50°С, помешивают и поддерживают данную температуру в течение 30 мин. Затем нагревают до t=55-58°C; через 30 мин до 62,5-63°С до полного осахаривания. Среду отжимают, фильтруют через бумажный фильтр. В фильтрате определяли концентрацию сухих веществ при 20°С по сахарометру. Она должна составлять 18-20%. До нужной концентрации разбавляют водой, которая должна быть равна 3- 4%. При необходимости для уплотнения добавляют 2% агара. Стерилизацию капустной среды проводят 30 мин при 1 атм. Для сусло-агара стерилизацию проводят при 0,5 атм.
Условия для культивирования штамма: объем лабораторной установки для культивирования - 1 л, объем культуральной жидкости - 250 мл; рН - 5; аэрация - 1 л/мин с подачей воздуха в пространство над жидкостью при избыточном давлении 0.1 атм; частота вращения мешалки - 250 об/мин; концентрация биомассы 5-8 г/л а.с.м.; температура 26-28°С. Максимальная удельная скорость роста составляет µм=0.042±0.005 ч-1. Мицелий штамма при глубинном культивировании без освещения имеет желто-оранжевый цвет, в условиях освещения с фотопериодом 12:12 час цвет мицелия оранжево-красный. При глубинном культивировании без освещения количество каротиноидов в мицелии составляет 74.5, а в условиях освещения 1787.8 мг% (фиг.3).
Хранение штамма рекомендуется на сусло-агаре в течение 6 месяцев для сохранения 50% жизнеспособных бластоконидий; для образования пигмента необходимо естественное освещение.
Из научно-технической и патентной литературы авторам не известны технические решения, которые могли бы в предлагаемой совокупности существенных признаков позволить получить приведенный в данной заявке технический результат. Следовательно, предлагаемое изобретение соответствует критериям новизны и патентоспособности. При изучении других технических решений признаки, отличающие предлагаемое изобретение от прототипа, не были выявлены из уровня техники, и поэтому они обеспечивают предлагаемому изобретению соответствие критерию изобретательского уровня.
Одним из перспективных объектов создания пищевых добавок и лекарственных препаратов на основе высших грибов и продуктов их метаболизма, получения биологически активных веществ является гриб серно-желтый трутовик Laetiporus sulphurous (Bull.) Murrill. Широкое использование мицелиальных базидиомицетов, в том числе Laetiporus sulphureus, обусловлено их способностью сорбировать различные микроэлементы.
В мицелии Laetiporus sulphureus присутствует целый комплекс физиологически активных соединений белковой, углеводной, липидной природы, каротиноидов и витаминов. Носителем биологической активности мицелия гриба является липокаротиноидный комплекс [Гвоздкова Т.С., Мишин Л.Т., Черноок Т.В., Пленина Л.В., Капич А.Н. Глубинный мицелий ксантофилсодержащего гриба Laetiporus sulphurеus - основа биологически активной добавки // Успехи медицинской микологии. - 2003. Т.З. - С.218-220; Гвоздкова Т.С., Черноок Т.В., Филимонова Т.В., Рожкова З.А., Осадчая О.В., Смирнов Д.А., Щерба В.В., Бабицкая В.Г. Оценка возможности использования базидиальных грибов в качестве источников биоактивных липидных компонентов. // Успехи медицинской микологии. Т.9, 2007. С.151-154; Феофилова Е.П. Каротиноиды грибов: биологические функции и практическое использование // Прикладная биохимия и микробиология. - 1994. - Т.30, вып.2. - С.181-195; Феофилова Е.П., Терешина В.М., Меморская А.С. Достижения и проблемы новой области биотехнологии: получение медицинских препаратов на основе биологически активных веществ мицелиальных грибов // Успехи медицинской микологии. - 2001. Т.1. - С.254-256].
Наличие в мицелии гриба L.sulphureus целого комплекса биологически активных липофильных соединений: каротиноидов, полиеновых жирных кислот, стероидных соединений (эргостерин, тритерпеновые кислоты), фосфолипидов и др., обладающих антиоксидантными свойствами, может послужить основой для разработки технологии получения биологически активной добавки [Капич А.Н., Гвоздкова Т.С., Квачева З.Б. и др. Антиоксидантные, радиозащитные и противовирусные свойства экстрактов мицелия гриба Laetiporus sulphureus в условиях глубинного культивирования // Успехи медицинской микологии. - 2004. - 3. - С.146-148].
На основе штаммов L. sulphureus уже разработана биологически активная добавка «Летипорин», представляющая собой сухой порошкообразный мицелий красно-оранжевого цвета, полученный путем глубинного культивирования штамма базидиального гриба Laetiporus sulphureus на питательной среде с использованием доступного и относительно дешевого сырья [Бабицкая В.Г., Щерба В.В., Гвоздкова Т.С. Новые биологические активные добавки на основе глубинного мицелия базидиальных грибов // Успехи медицинской микологии. - 2006. Т.7. - С. - 178-180].
Высокое содержание белка со сбалансированным аминокислотным составом, каротиноидов, липидов и витаминов не требует какой-либо дополнительной обработки биомассы мицелия и позволяет использовать мицелий Laetiporus sulphureus как белковую пищевую добавку в различные продукты для повышения содержания в них белка и в целом биологической ценности многих пищевых продуктов (табл.1, 2).
Биотехнологическое производство белка на основе биомассы Laetiporus sulphurеus не требует посевных площадей, не зависит от климатических условий, поддается высокому уровню механизации и автоматизации, позволяет получать продукцию стандартного качества [Тихонова О.В., Лурье Л.М., Ершова Е.Ю., Ефременкова О.В., Дудник Ю.В. Изучение глубинной культуры Laetiporus sulphureus (Fr) Bond, et Sing // I съезд микологов России. М.: Национальная академия микологии, 2002. С.257; Ершова Е.Ю., Ефременкова О.В., Камзолкина О.В., Тихонова О.В., Лурье Л.М., Дудник Ю.В. Выделение в культуру и изучение антимикробной активности представителей вида Laetiporus sulphurеus // Антибиотики и химиотерапия. 2003. - №1. С.3-7].
В составе сухого мицелия содержится 22-24% сырого протеина. В состав белковых компонентов входят все незаменимые аминокислоты, на долю которых приходится 35-40% от суммы аминокислот. Содержание нуклеиновых кислот составляет от 2,0 до 2,5% (табл. 1 и 2) [Гвоздкова Т.С., Черноок Т.В., Филимонова Т.В., Рожкова З.А., Осадчая О.В., Смирнов Д.А., Щерба В.В., Бабицкая В.Г. Оценка возможности использования базидиальных грибов в качестве источников биоактивных липидных компонентов. // Успехи медицинской микологии. Т.9., 2007. С.151-154].
| Таблица 1 | |
| Химический состав мицелиальной массы L. sulphureus | |
| Основные компоненты | Серно-желтый трутовик |
| Содержание, % от а.с.м. | |
| Труднорастворимые структурные белки | 11±4 |
| Растворимый белок | 27±4 |
| Углеводы | 30±4 |
| Липиды | 8,4±0,3 |
| Нуклеиновые кислоты | 2,7±0,3 |
| Минеральные вещества (зольность) | 7,7±0,3 |
| Таблица 2 | ||||
| Состав незаменимых кислот белка L. sulphureus | ||||
| Название аминокислоты | Эталонный белок | Серно-желтый трутовик, % | Скор., % | |
| Незаменимые аминокислоты | Изолейцин | 4,0 | 4,7 | 117 |
| Лейцин | 7,0 | 17,2 | 245 | |
| Лизин | 5,5 | 4,0 | 72 | |
| Метионин+цистин | 3,5 | 1,9 | 54 | |
| Треонин | 4,0 | 3,7 | 92 | |
| Валин | 5,0 | 7,2 | 144 | |
| Фенилаланин+тирозин | 6,0 | 6,5 | 108 | |
| Триптооан | 1 | - | - |
Содержание каротиноидных пигментов в сухом мицелии L. sulphureus достигает 0,8-1,0%. В составе каротиноидных пигментов мицелия гриба L. sulphureus выявлены три фракции, которые являются ксантофиллами, а точнее, кетокаротиноидными кислотами. Количественное соотношение каротиноидных фракций в общей их компоненте составляет 6,4:86,7:6,9. Наиболее высокий удельный вес приходится на пигмент, получивший тривиальное название лэтипорксантин [Феофилова Е.П. Каротиноиды грибов: биологические функции и практическое использование // Прикладная биохимия и микробиология. -1994. - Т.30, вып.2. - С.181-195].
Способ получения обогащенной селеном биомассы мицелия штамма MZ-22 Laetiporus sulphurous осуществляют следующим образом.
1. Получение селеносодержащей среды
Подготовка питательной среды.
1) Капустная среда (г/л): 200 г капусты кипятят в 1 литре воды 10 мин; отжимают; доводят до 1 литра; разбавляют в 2 раза и добавляют в фильтрат 2% глюкозы и 1% молочной сыворотки [Громовых Т.И., Кузнецова Л.С. Общая биотехнология. Микробиологическая биотехнология. Культивирование микроорганизмов. - М.: МГУПБ, 2009. - С.31].
2) Капустная среда (г/л): 200 г капусты кипятят в 1 литре воды 10 мин; отжимают, доводят до 1 литра, разбавляют в 2 раза и добавляют в фильтрат 2% глюкозы и 2% молочной сыворотки [Громовых Т.И., Кузнецова Л.С. Общая биотехнология. Микробиологическая биотехнология. Культивирование микроорганизмов. - М.: МГУПБ, 2009. - С.31].
3) Капустная среда (г/л): 200 г капусты кипятят в 1 литре воды 10 мин; отжимают, доводят до 1 литра, разбавляют в 2 раза и добавляют в фильтрат 2% глюкозы и 5% молочной сыворотки [Громовых Т.И., Кузнецова Л.С. Общая биотехнология. Микробиологическая биотехнология. Культивирование микроорганизмов. - М.: МГУПБ, 2009. - С.31].
4) Обогащение среды селеном
В питательную среду добавляются концентрации соли 15 мг/л, 20 мг/л, 25 мг/л селенита натрия и все перемешивается в течение 5 минут.
Далее селенированная среда разливается по колбам емкостью 100 мл, стерилизуется в автоклаве при давлении Р=1 атм в течение 30-40 мин.
2. Получение биомассы мицелия штамма MZ-22 Laetiporus sulphureus
Засев культуры Laetiporus sulphureus проводится блочным методом в стерильном боксе. В качестве инокулюма используют цилиндрические блоки диаметром 5 мм, вырезанные с помощью пробойника из зоны роста семисуточной культуры штамма. После чего колбы помещаются в термостат и культивируются при температуре 30°С в течение 20-22 сут.
3. Получение сухой формы мицелия
По истечении 20 сут колбы вынимают из термостата. Культура извлекается на бумажный фильтр, помещается в чашку Петри и сушится в термостате при температуре 40°С до постоянной массы.
4. Оценка количества селена в мицелии
Для определения количества селена в биомассе мицелия проводили кислотную минерализацию полученной биомассы. Способ основан на экстракции элементов из пробы продукта кипячением с разбавленной азотной кислотой.
Экстракция проб продукта
В термостойкую колбу с навеской продукта массой 5-10 вносили цилиндром 40 см3 раствора азотной кислоты (1:2) по объему. В колбу добавляли несколько стеклянных шариков, вставляли в нее холодильник, помещали на электроплитку, покрытую асбестом и кипятили в течение 1,5 ч с момента закипания. Затем содержимое колбы медленно охлаждали до комнатной температуры, не вынимая холодильника.
Подготовка экстрактов для атомно-абсорбционного анализа
Экстракционную смесь фильтровали в кварцевую или фарфоровую чашку. Жидкость осторожно выпаривали, затем обугливали на электроплитке. Далее чашку помещали в электропечь и продолжали минерализацию. Параллельно в двух колбах проводили экстракцию и подготовку экстрактов к анализу добавляемых к навеске реактивов для контроля их чистоты (контрольный опыт).
Концентрацию селена в высушенном мицелии вешенки измеряли методом атомно-абсорбционной спектрометрии (МУК 4.1.991-00, атомно-абсорбционный спектрометр «Квант-Z.ЭТА») [МУК 4.1.991-00 Методика выполнения измерений массовой доли меди и цинка в пищевых продуктах и продовольственном сырье метом электротермической атомно-абсорционной спектрометрии. - М., 2000. - 34 с.].
Пример 1.
Проводят определение динамики роста колоний штамма MZ-22 Laetiporus sulphureus на агаризованной капустной питательной среде. В качестве источника селена в эксперименте использовали селенит натрия, который добавляли в питательную среду с концентрациями селена 15, 20 и 25 мг/л. В контроле культивирование мицелия проводили на среде без селена с концентрациями молочной сыворотки 1, 2 и 5%.
Следующие материалы иллюстрируют достижение технических результатов (табл. 3).
| Таблица 3 | |||||
| Среднесуточная скорость роста (СР) штамма Laetiporus sulphureus MZ-22 на капустной питательной среде (см/сут) | |||||
| Концентрация молочной сыворотки, % | Продолжительность культивирования, сутки | Средняя СР | |||
| 5 | 8 | 12 | 15 | ||
| 1 | 4,4 | 7,6 | 8,5 | 9,0 | 7,37 |
| 2 | 4,5 | 7,7 | 8,5 | 9,1 | 7,38 |
| 5 | 4,8 | 8,5 | 9,5 | 11,9 | 7,57 |
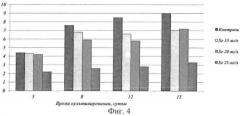
Измерение показателей среднесуточной скорости роста на питательной среде с добавлением молочной сыворотки в количестве 1, 2 и 5% показало, что показатель скорости роста штамма достоверно не отличается при использовании в питательной среде 1, 2 и 5% молочной сыворотки. Для получения биомассы мицелия целесообразно использовать среду, содержащую 1% молочной сыворотки (таблица 3).
Пример 2.
Проводят определение динамики роста колоний штамма MZ-22 Laetiporus sulphurous на агаризованной селеносодержащей капустной питательной среде, содержащей 1% молочной сыворотки. В качестве источника селена в эксперименте использовали селенит натрия, которую добавляли в питательную среду с концентрациями селена 15 мг/л, 20 мг/л, 25 мг/л. В контроле культивирование мицелия проводили на среде без селена с концентрациями молочной сыворотки 1%. Следующие материалы иллюстрируют достижение технических результатов (табл. 4).
| Таблица 4 | |||||
| Среднесуточная скорость роста штамма Laetiporus sulphureus MZ-22 на капустной питательной среде (см/сут) | |||||
| Концентрация соли селена, мг/л | Продолжительность культивирования, сутки | Средняя СР | |||
| 5 | 8 | 12 | 15 | ||
| 15 мг/л | 4,3 | 6,8 | 6,6 | 7,05 | 6,2 |
| 20 мг/л | 4,2 | 5,9 | 5,8 | 7,2 | 5,77 |
| с 25 мг/л | 2,2 | 2,6 | 2,8 | 3,3 | 2,72 |
| Контроль | 4,8 | 8,5 | 9,5 | 11,9 | 8,57 |
Присутствие соли селена ингибирует этот показатель (табл. 4), причем с увеличением концентрации рост ингибируется сильнее.
Пример 3.
Проводят оценку влияния селена на продуктивность биомассы мицелия культивированием штамма на жидкой капустной среде с добавлением соли селенит натрия в концентрациях 15, 20 и 25 мкг/л. Продуктивность биомассы мицелия определили на 20-е сутки, когда гриб достиг стационарной фазы роста (фиг.2). Продуктивность биомассы так же, как и рост колоний, снизилась в присутствии соли селенит натрия.
Выход биомассы, полученный на среде, не содержащей селена составил 13,1 г/л среды. Выход биомассы, содержащей концентрации селена 15, 20 и 25 мг/л, составил 13,04, 12,9 и 12,35 г/л соответственно. Результаты выхода биомассы штамма Laetiporus sulphureus MZ-22 при росте на селенсодержащей среде с концентрациями 15 и 20 мг/л достоверно не различаются от контроля. Из вышеуказанного следует, что с повышением концентрации селена до 25 мг/л увеличивается его ингибирующее действие на рост мицелия Laetiporus sulphureus.
Пример 4.
Проводят засев культуры штамма MZ-22 Laetiporus sulphureus блочным методом в капустную среду с добавлением соли натрия из расчета на селен 15 мг/л. После чего колбы помещают в термостат и культивируют при температуре 30°С в течение 20 сут. По истечении 20 сут культуру переносят на бумажный фильтр в чашку Петри и сушат в термостате при температуре 40°С в течение пяти дней. Затем измеряют концентрацию селена в высушенном мицелии штамма MZ-22 Laetiporus sulphureus методом атомно-абсорбционной спектрометрии. Количество селена в высушенном мицелии Laetiporus sulphureus MZ-22 составляет 4,25 мкг/г
Пример 5.
Проводят засев культуры штамма MZ-22 Laetiporus sulphureus блочным методом в капустную среду с добавлением соли натрия из расчета на селен 20 мг/л. После чего колбы помещают в термостат и культивируют при температуре 30°С в течение 20 сут. По истечении 20 сут культуру переносят на бумажный фильтр в чашку Петри и сушат в термостате при температуре 40°С в течение пяти дней. Затем измеряют концентрацию селена в высушенном мицелии штамма MZ-22 Laetiporus sulphureus методом атомно-абсорбционной спектрометрии. Количество селена в высушенном мицелии Laetiporus sulphureus MZ-22 составляет 4,38 мкг/г.
Пример 6.
Проводят засев культуры штамма MZ-22 Laetiporus sulphureus блочным методом в капустную среду с добавлением соли натрия из расчета на селен 25 мг/л. После чего колбы помещают в термостат и культивируют при температуре 30°С в течение 20 сут. По истечении 20 сут культуру переносят на бумажный фильтр в чашку Петри и сушат в термостате при температуре 40°С в течение пяти дней. Затем измеряют концентрацию селена в высушенном мицелии штамма MZ-22 Laetiporus sulphureus методом атомно-абсорбционной спектрометрии. Количество селена в высушенном мицелии Laetiporus sulphureus MZ-22 составляет 3,50 мкг/г.
Предлагаемый способ в результате культивирования на питательной среде с концентрацией соли неорганического селена 15 и 20 мкг/л обеспечивает достижение технического результата при получении биомассы мицелия штамма MZ-22 Laetiporus sulphureus с высоким содержанием органического селена, в форму которого переходит неорганический селен, поглощенный из среды. Получаемый продукт может быть использован в пищевой и микробиологической промышленности как селенсодержащий препарат «Летипор-селен» с количеством белка от 16,8%, ценным составом аминокислот (табл. 5) и каротиноидов 1.72±0.13 мг/г сухого веса.
| Таблица 5 | |||
| Общее содержание аминокислот в биомассе белка препарата «Летипор-селен», г/100 г белка | |||
| Название аминокислоты | Содержание аминокислот, г/100 г белка | ||
| Эталонный белок | Серно-желтый трутовик z-22 | Скор | |
| Asp | - | 8,45 | - |
| Тrр | 1,0 | 1,82 | 182 |
| Thr | 4,0 | 4,11 | 102,7 |
| Ser | - | 4,34 | - |
| Glu | - | 12,26 | - |
| Pro | - | 4,40 | - |
| Gly | - | 4,82 | - |
| Ala | - | 5,89 | - |
| Cys | - | 0,12 | - |
| Val | 5,0 | 5,89 | 117,8 |
| Met | 3,5 | 0,59 | 17 |
| Ile | 4,0 | 3,33 | 83,2 |
| Leu | 7,0 | 5,95 | 85 |
| Tyr | 6,0 | 2,26 | 37,6 |
| Phe | 6,0 | 4,28 | 71,3 |
| OH-Lys | - | 1,13 | - |
| Orn | - | 0,83 | - |
| Lys | 5,5 | 4,94 | 89,8 |
| EA | - | 0,12 | - |
| His | - | 2,91 | - |
| Arg | - | 82 |
Количество каротиноидов определяли спектрофотометрическим методом, описанным авторами [Bulda O.V., Rassadina V.V., Alekseichuk H.N., Laman N.A. Spectrophotometric measurements of carotenes, xanthophylls and chlorophylls in extracts from plant seeds. Russ. J. Plant Physiol. (2008) 45: 544-551].
Способ позволяет увеличить содержание биодоступного селена в мицелии штамма и количество вводимой соли селена. Технический результат, полученный при использовании предлагаемого способа, заключается в содержания селена в биомассе, а также включении селена в биополимеры мицелия штамма MZ-22 Laetiporus sulphureus. Общее содержание белка у штамма Z-22 Laetiporus sulphureus составляет 16,8% на абсолютно сухую биомассу. Истинное содержание белка по аминокислотному составу составляет 14,0%.
Полученный биопрепарат представляет собой сухой порошок желто-оранжевого цвета (фиг.5).
Таким образом, с помощью предлагаемого способа достигается включение селена в клетки мицелия штамма MZ-22 Laetiporus sulphureus, добавляемого в среду культивирования, и обогащение им биомассы. При этом используемый для обогащения биомассы селен прочно закреплен в органических компонентах клетки и не удаляется из биомассы в процессах сушки и хранения биомассы.
Преимуществом данного изобретения являются: наличие селена в биодоступной форме, присутствие в препарате биологически активных соединений каротиноидов и белка.
Таким образом, способ позволяет получать селенсодержащий препарат, используемый как биологически активная добавка, содержащая селен в биополимерах мицелия. Препарат может быть использован в пищевой и косметической промышленности.
На фиг.1-8 представлены следующие иллюстрации:
Фиг.1. Морфология мицелия штамма MZ-22 Laetiporus sulphureus на капустном агаре.
Фиг.2. Микрофотографии мицелия (а) и бластоконидий (б) штамма MZ-22 Laetiporus sulphureus.
Фиг.3. Мицелий штамма Laetiporus sulphureus MZ-22 при погруженном культивировании: а - без освещения, б - при освещении.
Фиг.4. Динамика роста колоний штамма Laetiporus sulphureus MZ-22 на агаризованной питательной среде с различными концентрациями селена.
Фиг.5. Продуктивность биомассы штамма Laetiporus sulphureus MZ-22 с добавлением соли селенита натрия на капустной среде при поверхностном жидкофазном культивировании.
Фиг.6. Рост штамма Laetiporus sulphureus MZ-22 на 14-е сутки культивирования на капустной среде: А - контроль; Б - концентрация селена 15%; В - концентрация селена 20%; Г - концентрация селена 25%.
Фиг.7. Хроматограмма аминокислот белка мицелия штамма MZ-22 Laetiporus sulphureus.
Фиг.8. Препарат «Летипор-селен» на основе мицелия штамма MZ-22 Laetiporus sulphureus.
Способ получения обогащенной селеном биомассы мицелия штамма Laetiporus sulphureus BKM-F-4276D, предусматривающий культивирование штамма на капустной среде, содержащей глюкозу в количестве 2%, молочную сыворотку в количестве 1%, с добавлением селенита натрия в концентрации 15-25 мг/л.