Набор и способ для ускоренной идентификации чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов y.pestis, определением их плазмидного профиля
Иллюстрации
Показать всеИзобретение относится к области медицины и молекулярной биологии. Набор включает праймеры и флуоресцентно меченные зонды к участкам генов 3а, caf1, pla, irp2, hmsH и lcrV в составе двух разных ПЦР-смесей. Набор используют для ускоренной идентификации штаммов чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов Y.pestis и определением их плазмидного профиля. Способ с использованием набора предусматривает проведение мультиплексной ПЦР в двух пробирках с регистрацией результатов по сигналам от меток зондов. Изобретение позволяет повысить эффективность диагностики штаммов Y.pestis. 2 н.п. ф-лы, 8 ил., 10 табл., 1 пр.
Реферат
Изобретение относится к области биотехнологии и может быть использовано при диагностике возбудителя чумы, а именно для идентификации штаммов возбудителя чумы, а также для решения научно-исследовательских задач.
В настоящее время эпидемиологическая обстановка по чуме во всем мире остается достаточно сложной. Это обусловлено активностью природных очагов чумы, возможностью заноса возбудителей с эндемичных территорий на эпидемически благополучные в связи хозяйственной деятельностью человека. Кроме того, Y.pestis отнесен к наиболее опасным из возможных агентов биотерроризма благодаря высокой контагиозности и летальности [1]. Поэтому быстрая и четкая диагностика возбудителя чумы позволит в короткий срок оценить эпидемическую ситуацию и своевременно в необходимом объеме провести противоэпидемические мероприятия с целью предотвращения распространения инфекции.
Вирулентность возбудителя чумы - полидетерминантный признак, который контролируется большим числом генов, локализованных на хромосоме и плазмидах. На хромосоме чумного микроба расположена область пигментации (pgm-область), которая включает hms-локус, кодирующий белки аккумуляции гемина и остров высокой патогенности (ОВП) с генами утилизации железа. Гены плазмиды pCad кодируют синтез белка LcrV (V-антиген), эффекторных белков Yop, входящих в систему секреции III типа, действие которой направлено на подавление фагоцитарной активности клеток иммунной системы млекопитающих. Наиболее важными факторами патогенности возбудителя чумы являются продукты экспрессии генов хромосомного острова высокой патогенности (ОВП) и уор-оперона. плазмиды pCad. Потеря любого из указанных маркеров приводит к утрате штаммами вирулентности для лабораторных животных.
Для идентификации выделенных культур используют микробиологические, биохимические, биологические методы. К одним из основных признаков, изучаемых при идентификации культур Y.pestis, относится определение вирулентности, которое выполняется с помощью биологического метода и посева на плотные питательные среды с гемином. Такие исследования являются трудоемкими и длительными.
В настоящее время все большее распространение получают молекулярно-генетические методы, особенно полимеразная цепная реакция (ПЦР), которая обладает высокой чувствительностью, специфичностью и позволяет получать результат в течение 3-5 часов. Существуют различные способы изучения свойств возбудителя чумы с использованием ПЦР.
Известен способ определения утраты вирулентности штаммами чумного микроба вследствие потери области пигментации путем проведения ПЦР с использованием праймеров IH и IY [2].
Описанный способ направлен только на выявление авирулентных штаммов чумного микроба, лишенных хромосомной области пигментации, и не может быть использован при оценке плазмидного профиля штаммов Y.pestis.
Известен также способ идентификации и внутривидовой дифференциации штаммов вида Y.pestis методом ПЦР с применением праймеров к трем хромосомным мишеням: «3а» размером 276 п.н., «vlm12for/ISrev 216» размером 390 п.н., «YP02258» размером 130 п.н. и к двум мишеням плазмиды pFra - «CDS39» размером 418 п.н., «traA» размером 472 п.н., а также к одной мишени Y.pseudotuberculosis «JS» - 223 п.н. [3].
Данный способ позволяет идентифицировать принадлежность штаммов к видам Y.pestis и Y.pseudotuberculosis, выполнять внутривидовую дифференциацию штаммов, выделенных в очагах Африки, Центральной Азии и Закавказья, но не предусмотрен для оценки вирулентности возбудителя и определения его плазмидного профиля.
В литературе описан способ диагностики и идентификации маркеров вирулентности возбудителя чумы с использованием праймеров к фрагментам генов caf1 - 506 п.н., lcrV - 800 п.н., pla - 920 п.н., irp2 - 300 п.н. в мультилокусной ПЦР с электрофоретическим учетом результатов [4].
Однако сами авторы высказывают в описании неуверенность в высокой специфичности и чувствительности этого способа. Кроме того, для выявления Yersinia pestis необходимо использование праймеров к видоспецифичным ДНК-мишеням хромосомной локализации, так как предлагаемые авторами праймеры при исследовании штаммов чумного микроба, лишенных обеих указанных плазмид (а случаи выделения таких штаммов известны), не позволят дифференцировать возбудитель чумы от других патогенных иерсиний. Более того, при наличии в исследуемой пробе ДНК Yersinia pseudotuberculosis или Yersinia enterocolitica с сохраненным островом высокой патогенности и плазмидой pCad будет получен ложно-положительный результат, что может привести к необоснованным противоэпидемическим мероприятиям. Использование для учета результатов метода электрофореза в агарозном геле требует выделения дополнительного отдельного помещения в ПЦР-лаборатории и соответствующего дополнительного персонала, а перенос ПЦР-продукта в гель для электрофореза повышает риск возникновения ДНК-контаминации, что может привести к снижению качества анализа.
Известен набор полинуклеотидов, специфичных для Yersinia pestis и метод детекции Yersinia pestis, включающий 18 последовательностей праймеров и зондов, а также 6 ампликонов. Четыре из использованных авторами ДНК-мишеней локализованы на плазмиде pFra, две - на хромосоме [5].
Этот набор предназначен только для выявления возбудителя чумы, но не для определения вирулентности и плазмидного профиля штаммов.
Известны также коммерческие диагностические наборы для выявления Yersinia pestis методом ПЦР в реальном времени фирмы «Invitrogen» - «PathAlert™ Detection Kit for Yersinia pestis» кат. № BD1001 и фирмы «Applied Biosystems» - «TaqMan Yersinia pestis detection kit», кат. №4382488. Однако наборы предназначены только для детекции ДНК Yersinia pestis без определения свойств возбудителя.
Известен коммерческий набор для выявления ДНК Yersinia pestis «ГенПест», выпускаемый РосНИПЧИ «Микроб». Однако использование этого набора не предусматривает идентификацию выделенных культур и определение вирулентности и плазмидного профиля штаммов.
Проведенный поиск по патентам и научно-техническим источникам информации показал отсутствие способа и набора для ускоренной идентификации штаммов Y.pestis с возможностью исследования ряда свойств возбудителя - вирулентности и плазмидного профиля.
Задачей предлагаемого изобретения является создание высокоспецифичного чувствительного набора и способа ускоренной идентификации штаммов чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов Y.pestis и определением их плазмидного профиля методом мультилокусной ПЦР с гибридизационно-флуоресцентным учетом результатов в режиме реального времени.
Технический результат заключается в повышении эффективности диагностических исследований за счет высокоспецифичной, быстрой видовой идентификации Y.pestis и дифференциации вирулентных и авирулентных штаммов, а также определения их плазмидного профиля.
Технический результат достигается набором для ускоренной идентификации чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов Y.pestis и определением их плазмидного профиля, включающим ПЦР-смесь №1, содержащую праймеры SEQ ID N:7, 8, 10, 11, 13, 14 и зонды с различными флуоресцентными метками на 5′-конце и гасителем на 3′-конце: SEQ ID N:9 с меткой R6G и гасителем RTQ1, SEQ ID N:12 с меткой ROX и гасителем BHQ2, SEQ ID N:15 с меткой FAM и гасителем RTQ1, ПЦР-смесь 2, содержащую праймеры SEQ ID N:16, 17, 19, 20, 22, 23 и зонды: SEQ ID N: 18 с меткой R6G и гасителем RTQ1, SEQ ID N:21 с меткой FAM и гасителем RTQ1, SEQ ID N:24 с меткой ROX и гасителем BHQ2 при соотношении праймеров/зондов в каждой смеси 2:1. При этом каждая из смесей содержит азид натрия, четыре дезоксинуклеотидтрифосфата. Набор также содержит реагенты для проведения мультиплексной ПЦР: ТЕ-буфер, Taq-полимеразу, положительный контрольный образец и смесь реагентов: магния хлорид, 10-кратный ПЦР-буфер, деионизованная вода.
Технический результат достигается также способом ускоренной идентификации чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов Y.pestis и определением их плазмидного профиля, при котором для постановки мультиплексной ПЦР используется набор, содержащий ПЦР-смесь 1 и ПЦР-смесь 2 из праймеров SEQ ID N:7, 8, 10, 11, 13, 14, 16, 17, 19, 20, 22, 23 и зондов SEQ ID N:9, 12,15, 18, 21, 24 к участкам генов: 3а SEQ ID N:l, cafl SEQ ID N:2,pla SEQ ID N:3, irp2 SEQ ID N:4, hmsH SEQ ID N:5, lcrV SEQ ID N:6, обеспечивающих амплификацию фрагментов размером 147 п.н., 138 п.н., 127 п.н., 107 п.н., 127 п.н., 114 п.н. соответственно, амплифицирующиеся по следующим параметрам: 95°С - 15 мин, 95°С - 30 с, 60°С - 30 с, 72°С - 30 с, цикл повторить - 10 times/ раз, 95°С - 20 с, 56°С - 20 с - детекция, 72°С -20 с, цикл повторить - 35 times/ раз, с измерением флуоресценции при 56°С (в течение 35 последних циклов) и учетом результатов по каналу FAM для флуоресцентной метки FAM, по каналу JOE для метки R6G, по каналу ROX для метки ROX; идентификацию возбудителя, его дифференциацию и плазмидный профиль оценивают по нарастанию сигналов флуоресценции в различных сочетаниях. Культуру оценивают как относящуюся к виду Y. pestis в реакции с ПЦР смесью 1 по каналам FAM, JOE и ROX, или по FAM и JOE, либо по JOE и ROX, или по JOE. Культуру оценивают как вирулентный штамм Y.pestis в реакции с ПЦР-смесью 2 по каналам FAM, JOE, ROX, или по JOE и ROX. Плазмиду pPst в штамме выявляют в реакции с ПЦР-смесью 1 по одному каналу FAM, плазмиду pFra - по каналу ROX, а в реакции с ПЦР-смесью 2 плазмиду pCad выявляют по каналу ROX.
При конструировании набора особое значение придавали выбору фрагментов ДНК-мишеней и, соответственно, праймеров к ним. Так как для создания высокоспецифичных мультиплексных систем требуется сочетание праймеров с определенными характеристиками (отсутствие термодинамически значимых вторичных структур), не вызывающих при их совместном применении снижения эффективности хотя бы одного из них. Синтез олигонуклеотидов выполняли фофсфоамидитным методом, например, на синтезаторе ДНК ASM-800 фирмы «Биосет».
Обоснование выбора праймеров и зондов
Для специфичной детекции ДНК Yersinia pestis многими разработчиками генодиагностических препаратов использовались гены видоспецифичных плазмид pFra (гены caf1, ymt) и pPst (pla, pst) [6, 7, 8, 9, 10, 11]. Нами в качестве маркеров плазмид pFra и pPst выбраны гены caf1 и pla, соответственно, поскольку обширный международный опыт, накопленный к настоящему времени, позволяет судить о высокой специфичности и стабильности указанных ДНК-мишеней.
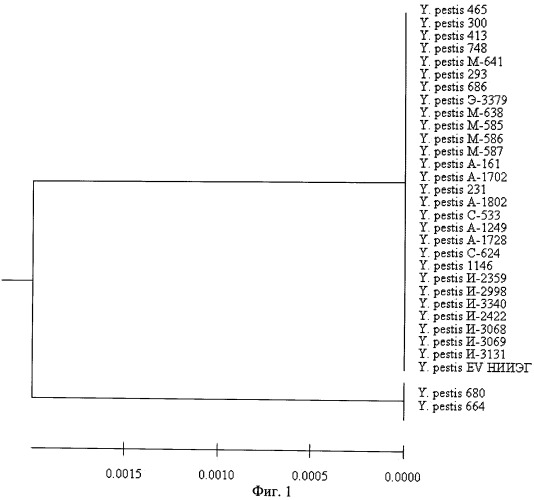
Вместе с тем, для выявления штаммов чумного микроба, лишенных плазмиды pFra и/или pPst, перспективным является детекция фрагментов, расположенных на хромосоме возбудителя чумы. Одной из таких матриц может быть специфичный для Y.pestis стабильный хромосомный локус размером 41,7 т.п.н. (NCBI GenBank № AF350075), который по данным L. Radnedge et al. (2001) делегирован у других представителей рода Yersinia. Авторами установлено, что часть указанной области, а именно регион 3а, присутствует в геноме всех исследованных ими штаммов чумного микроба, который и был выбран в качестве видоспецифичной для Y.pestis ДНК-мишени хромосомной локализации. Однако данные о мономорфности данного участка в геноме штаммов чумного микроба различного географического происхождения, особенно выделенных на территории России, отсутствовали.
Поэтому нами было проведено секвенирование фрагмента 3a-локуса размером 522 п.н. у 31 штамма возбудителя чумы, выделенных на территории России и стран СНГ. Установлено, что геномный полиморфизм данного генетического элемента составил 0,4% по отношению ко всему фрагменту (фиг.1).
Для подбора специфичных праймеров использовали гомологичные участки секвенированных фрагментов 3a-локуса.
Патогенность чумного микроба определяется двумя основными генетическими детерминантами: наличием хромосомного острова высокой патогенности и плазмиды pCad, которая несет оперон системы секреции III типа. Хромосомный остров высокой патогенности возбудителя чумы содержит гены системы ассимиляции железа и состоит из двух регионов: ybt-региона, обеспечивающего синтез иерсиниабактина, который хелатирует железо, связанное с белками эукариот, и транспортирует его в бактериальную клетку [12], и hms-региона, содержащего оперон hmsHFRS системы сорбции гемина и экзогенных красителей на поверхности клетки [13]. В качестве маркера наличия ybt-региона нами выбран ген irp2, отвечающий за синтез высокомолекулярного белка HMWP 2 (190 кДа). Для детекции hms-локуса в качестве ДНК-мишени выбран структурный ген hmsH, обладающий высокой мономорфностью.
Одним из наиболее часто используемых маркеров наличия плазмиды pCad у штаммов Y. pestis является V-антиген или гены, его кодирующие. V-антиген (или LcrV-белок) - мультифункциональная детерминанта патогенности, регулирующая секрецию цитотоксических белков из бактериальной клетки в цитозоль клеток человека или животных и обладающая высокими протективными свойствами [14]. Исследования, проведенные Т. С. Leal-Balbino et al. (2004) показали, что pCad и, в частности, ген lcrV обладают высокой стабильностью как у вновь выделяемых штаммов чумного микроба, так и у культур, подвергавшихся длительному хранению. Поэтому в качестве маркера плазмиды кальцийзависимости выбран ген lcrV.
В результате тщательной проверки качества определения нуклеотидных последовательностей были выведены следующие консенсусные последовательности фрагментов генов:
3а SEQ ID №1 размером 147 п.н.
caf1 SEQ ID №2 размером 138 п.н.
pla SEQ ID №3 размером 127 п.н.
irp2 SEQ ID №4 размером 107 п.н.
hmsH SEQ ID №5 размером 127 п.н.
lcrV SEQ ID №6 размером 114 п.н.
На основании последовательностей выбранных фрагментов генов 3а (хромосома), caf1 (тшазмида pFra), pla (плазмида pPst), irp2 (остров высокой патогенности хромосомной области пигментации), hmsH (hms-локус хромосомной области пигментации), lcrV (плазмида pCad) с помощью программы Primer Premier-V5 (Premier Bio Soft International) и алгоритма BLAST подобраны олигонуклеотидные праймеры, обеспечивающие амплификацию фрагментов указанных локусов размером 147 п.н., 138 п.н., 127 п.н., 107 п.н., 127 п.н., 114 п.н. соответственно. Выбор праймеров осуществляли с учетом возможности их использования в мультиплексной ПЦР с регистрацией результатов в режиме «реального времени», а гибридизационные зонды формата Taq Man подбирали в онлайн-режиме на интернет-сайте www.genscript.com.
К участку гена SEQ ID №1 подобраны праймеры SEQ ID №7; SEQ ID №8 и зонд SEQ ID №9, с флуоресцентной меткой R6G и гасителем флуоресценции RTQ1;
К участку гена SEQ ID №2 подобраны праймеры SEQ ID №10; SEQ ID №11 и зонд SEQ ID №12, с флуоресцентной меткой ROX и гасителем флуоресценции BHQ2;
К участку гена SEQ ID №3 подобраны праймеры SEQ ID №13; SEQ ID №14 и зонд SEQ ID №15, с флуоресцентной меткой FAM и гасителем флуоресценции RTQ1;
К участку гена SEQ ID №4 подобраны праймеры SEQ ID №16; SEQ ID №17 и зонд SEQ ID №18, с флуоресцентной меткой R6G и гасителем флуоресценции RTQ1;
К участку гена SEQ ID №5 подобраны праймеры SEQ ID №19; SEQ ID №20 и зонд SEQ ID №21, с флуоресцентной меткой FAM и гасителем флуоресценции RTQ1;
К участку гена SEQ ID №6 подобраны праймеры SEQ ID №22; SEQ ID №23 и зонд SEQ ID №24, с флуоресцентной меткой ROX и гасителем флуоресценции BHQ2.
Указанные последовательности представлены на фиг.2.
Указанные праймеры и зонды обеспечивают высокую специфичность реакции, не образуют вторичных структур (шпилек) и димеров, что способствует эффективному связыванию их с матричной ДНК. Экспериментально установлен оптимальный состав реакционной смеси для выполнения мультиплексной ПЦР. В ПЦР-смесях №№1 и 2 подобранные концентрации праймеров и зондов составили 2:1, соответственно, количество фермента Taq-полимеразы в концентрации 1,0 ед. достаточно для обеспечения высокой специфичности и эффективности проведения реакции.
Экспериментально подобран режим отжига праймеров и эффективное число циклов амплификации (таблица 1).
Аналитические характеристики
Предварительная оценка аналитической специфичности используемых праймеров и зондов с помощью on-line алгоритма BLAST показала отсутствие гомологии выбранных последовательностей с другими микроорганизмами при уровне значимости Е=10.
Для экспериментальной оценки чувствительности и специфичности мультиплексной ПЦР с гибридизационно-флуоресцентным учетом результатов в режиме реального времени использовали количественно охарактеризованные разведения ДНК Y.pestis в концентрации 1×103-1×107 м.к./мл (таблица 2).
Для характеристики специфичности ПЦР применяли выборку штаммов из целевой коллекции различных микроорганизмов. Данные представлены в таблице 3.
В результате проведенной оценки установлено, что выбранные праймеры и зонды для идентификации чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов Y.pestis и определением их плазмидного профиля методом мультиплексной полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов обладают высокой чувствительностью - 1×104 м.к./мл и специфичностью 100%.
На основе указанных праймеров и зондов сконструирован набор, который включает 9 пробирок с завинчивающимися крышками с компонентами: 1 микропробирку с ПЦР-смесью №1, 1 микропробирку с ПЦР-смесью №2, 2 микропробирки со смесью реагентов для проведения мультиплексной ПЦР, 1 микропробирку с Taq полимеразой, 3 микропробирки с ТЕ-буфером, 1 микропробирку с положительным контрольным образцом (ПКО) ДНК Y.pestis.
Смесь реагентов для проведения мультиплексной ПЦР включают магния хлорид, 10-кратный ПЦР-буфер, деионизованную воду.
ПЦР-смесь №1 содержит праймеры SEQ ID №№7, 8, 10, 11, 13, 14 и зонды SEQ ID №№9,12,15, четыре дезоксинуклеотидтрифосфата, азид натрия.
ПЦР-смесь №2 содержит праймеры SEQ ID №№16, 17, 19, 20, 22, 23 и зонды SEQ ID №№18, 21, 24, четыре дезоксинуклеотидтрифосфата, азид натрия.
Набор предназначен для видовой идентификация штаммов чумного микроба, дифференцирования вирулентных и авирулентных штаммов Y.pestis, определения их плазмидного профиля методом мультиплексной полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов. Набор рассчитан на проведение 50 определений, включая контрольные образцы. Набор прошел государственные испытания и внедряется в производство.
Заявляемый способ ускоренной идентификации чумного микроба после выделения ДНК по общепринятым методам включает следующие этапы:
а) проведение мультиплексной ПЦР;
б) оценка полученных результатов.
Проведение ПЦР исследований с набором включает одномоментную постановку реакции в двух пробирках для каждой исследуемой пробы или контрольного образца. В одной пробирке используется ПЦР-смесь №1, во второй ПЦР-смесь №2. Taq полимераза и смесь реагентов применяются с обеими реакционными смесями одинаково.
Из холодильной камеры извлекают ПЦР-смеси №1 и №2, смесь реагентов; из морозильной камеры извлекают Taq полимеразу, ПКО ДНК Y.pestis, полностью оттаивают, перемешивают на микроцентрифуге/встряхиватиле и центрифугируют при 3000-5000 об/мин в течение 30 с для осаждения капель со стенок пробирки.
Для проведения реакции в отдельной пробирке объемом 0,6 мл или 1,5 мл готовят реакционную смесь, содержащую: ПЦР-смесь №1-5 мкл, смесь реагентов - 10 мкл, Taq-полимеразу - 0,2 мкл. Полученную смесь тщательно перемешивают и переносят по 15 мкл в подготовленные заранее пробирки объемом 0,2 мл, число которых соответствует количеству исследуемых проб плюс положительный и отрицательный контрольный образец. Аналогичным образом готовят реакционную смесь для проведения реакции с ПЦР-смесью №2.
Затем в микропробирки вносят по 10 мкл ДНК из исследуемых проб. В микропробирку для отрицательного контрольного образца добавляют 10 мкл ТЕ-буфера, а для положительного контрольного образца - 10 мкл ПКО ДНК Y.pestis. Все пробирки помещают в термоциклер типа «Rotor Gene».
Для работы с прибором «Rotor Gene» 3000 используют программу «Rotor Gene 6», с прибором. «Rotor Gene» 6000 - программу «Rotor Gene 6000» версия 1,7 (build 67) или выше.
Регистрацию результатов реакции с использованием ПЦР-смеси №1 и ПЦР-смеси №2 проводят единообразно.
Результаты учитывают на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, а цифровое значение порогового цикла «Ct» указано в соответствующей графе таблицы результатов на панели прибора.
Пороговое значение Ct для положительных проб по каналам FAM, JOE, ROX составляет не более 33. При получении значения не более 33 результат считают положительным.
Оценка полученных результатов.
Учет результатов, полученных с ПЦР-смесью №1 и ПЦР-смесью №2, выполняют последовательно. В случае получения положительных результатов с ПЦР-смесью №1 учитывают результаты, полученные с ПЦР-смесью №2. В случае отрицательного результата с ПЦР-смесью №1, результаты с ПЦР-смесью №2 не учитывают.
Время проведения ПЦР составляет 2 ч.
Учет и оценка результатов позволяет:
- определять видовую принадлежность к Y.pestis исследуемых культур на основании регистрации сигналов по каналам FAM, JOE, ROX с ПЦР-смесью №1 по оценочной таблице 4;
- дифференцировать вирулентные и авирулентные штаммы Y.pestis на основании регистрации сигналов по каналам FAM, JOE, ROX с ПЦР-смесью №2 по оценочной таблице 5;
- определять плазмидный профиль штаммов Y.pestis на основании регистрации сигналов по каналам FAM и ROX с ПЦР-смесью №1 и каналу ROX с ПЦР-смесью №2 по оценочной таблице 6.
Пример
Материалом для исследования служили 5 зашифрованных проб, в которых присутствовали возбудитель чумы и представители другого рода.
Подготовку проб бактериальных суспензий выполняли в соответствии с требованиями СП 13.1285-03 «Безопасность работы с микроорганизмами I-II групп патогенности» (Москва, 2003 г.).
Обеззараживание исследуемых бактериальных суспензий проводили в соответствии с МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» (Москва, 2009 г.).
Выделение ДНК выполняли по общепринятой схеме с использованием зарегистрированного коммерческого набора «Рибо-сорб», в соответствии с инструкцией к набору.
Мультиплексную ПЦР осуществляли одномоментно в двух пробирках для каждой исследуемой пробы или контрольного образца. Из холодильной камеры извлекали ПЦР-смесь №1, ПЦР-смесь №2, смесь реагентов, а из морозильной камеры - Taq-полимеразу, ПКО Y. pestis полностью оттаивали, перемешивали на микроцентрифуге/встряхивателе и центрифугировали при 3000-5000 об/мин в течение 30 с для осаждения капель со стенок пробирки.
Для проведения реакции с ПЦР-смесью №1 отбирали 6 микропробирок объемом 0,2 мл, соответствующих числу исследуемых проб для отрицательного контроля выделения ДНК (ОКБ), и еще 2 - для положительного и отрицательного контролей. Таким же образом отбирали микропробирки для проведения реакции с ПЦР-смесью №2.
В отдельной микропробирке объемом 0,6 мл готовили реакционную смесь из расчета: ПЦР-смесь №1 - 40 мкл, ПЦР-смесь №2 - 80 мкл, Taq-полимераза - 1,6 мкл. Подготовленную смесь тщательно перемешивали и переносили по 15 мкл в 6 подготовленных пробирок объемом 0,2 мл. Аналогичным образом готовили реакционную смесь для проведения реакции с ПЦР-смесью №2.
Затем в 5 пробирок с ПЦР-смесью №1 вносили по 10 мкл ДНК из исследуемых проб. В микропробирку с отрицательным контролем амплификации (К-) вносили 10 мкл ТЕ-буфера, в микропробирку с положительным контролем амплификации (К+) - 10 мкл ПКО ДНК Y.pestis и ОКВ. Аналогично проводили реакцию с ПЦР-смесью №2. Подготовленные микропробирки помещали в термоциклер типа RotorGene.
Задавали следующую программу амплификации:
| 1) Hold/Удерж. температуры - | 95°С - 5 мин |
| 2) Cycling/Циклирование - | 95°С - 30 сек |
| 60°С - 30 сек | |
| 72°С - 30 сек |
Cycle repeats/Цикл повторить - 10 times/раз.
| 3) Сусling2/Циклирование2 | 95°С - 20 сек |
| 56°С - 20 сек - Детекция | |
| 72°С - 20 сек |
Cycle repeats/Цикл повторить - 35 times/раз.
Флуоресценцию измеряли при 56°С (во втором блоке циклирования) по каналам FAM/Green, JOE/Yellow, ROX/Orange.
Задавали параметры калибровки: для каналов FAM/Green, JOE/Yellow и ROX/Orange указывают в графе Min Reading/Миним. Сигнал значение 5, а в графе Мах Reading/Максим. Сигнал значение 10.
Регистрацию результатов реакции с использованием ПЦР-смеси №1 и ПЦР-смеси №2 проводили единообразно.
Регистрация результатов амплификации по каналу FAM/Green
1. Активировали режимы «Dynamic tube»/«Динамич.фон», «Slope Correct»/«Коррек. уклона», «Ignore First - 10 Cycles»/«Игнор. первые - 10 циклов».
2. Задавали параметры «Outlier Removal»/«Устранение выбросов» - 30%.
3. Задавали значение пороговой линии = 0,05, активировали опцию «Eliminate Cycles Before - 8»/«Исключить циклы до - 8».
4. В таблице результатов фиксировали значения порогового цикла (Ct) для каждой пробы.
Регистрация результатов амплификации по каналу JOE/Yellow
1. Активировали режимы «Dynamic tube»/«Динамич. фон», «Slope Correct»/«Коррек. уклона», «Ignore First - 10 Cycles»/«Игнор. первые - 10 циклов».
2. Задавали параметры «Outlier Removal»/«Устранение выбросов» - 15%.
3. Задавали значение пороговой линии = 0,05, активировали опцию «Eliminate Cycles Before - 8»/«Исключить циклы до - 8».
4. В таблице результатов фиксировали значения порогового цикла (Ct) для каждой пробы.
Регистрация результатов амплификации по каналу ROX/Orange
1. Активировали режимы «Dynamic tube »/«Динамич. фон», «Slope Correct»/«Коррек. уклона», «Ignore First - 10 Cycles»/«Игнор. первые - 10 циклов».
2. Задавали параметры «Outlier Removal»/«Устранение выбросов» - 15%.
3. Задавали значение пороговой линии = 0,05, активировали опцию «Eliminate Cycles Before - 8»/«Исключить циклы до - 8».
4. В таблице результатов фиксировали значения порогового цикла (Ct) для каждой пробы.
Полученные результаты ПЦР представлены на фигурах и таблицах. Определение видовой принадлежности исследуемых культур на основании регистрации сигналов по каналам FAM, JOE и ROX с ПЦР-смесью №1 отражены на фиг.3-5 и таблице 7.
На основании полученных результатов сделано заключение, что в пробе №1 не содержится культура, относящаяся к виду Y.pestis (отрицательный результат), и результаты, полученные в ПЦР с данной пробой, не подлежат дальнейшему учету с ПЦР-смесью №2.
Штаммы, присутствующие в пробах №№2, 3, 4, 5, относятся к виду Y.pestis (положительный результат), и для них будет проведен учет результатов с ПЦР-смесью №2.
Дифференцирование вирулентных штаммов чумного микроба от авирулентных в пробах №№2, 3, 4, 5 проводили на основании регистрации сигналов по каналам FAM, JOE и ROX с ПЦР-смесью №2 (фиг.6-8, таблица 8).
На основании полученных результатов сделано заключение, что штаммы чумного микроба, присутствующие в пробах №2 и №3, являются вирулентными, тогда как в пробах №3 и №4 содержатся авирулентные штаммы Y.pestis.
Определение плазмидного профиля штаммов Y.pestis проводили на основании регистрации сигналов по каналам FAM и ROX с ПЦР-смесью №1 и каналу ROX с ПЦР-смесью №2 (таблица 9).
Полученные данные показали, что штамм Y.pestis в пробе №2 содержит плазмиды pPst, pFra, pCad; штамм в пробе №3 содержит плазмиды pFra и pCad, но лишен плазмиды pPst; штамм в пробе №4 содержит плазмиду pPst, но лишен плазмид pFra и pCad; штамм в пробе №5 содержит плазмиды pPst, pFra, pCad.
Итоговое заключение по результатам мультиплексного ПЦР-анализа 5 шифрованных проб с использованием разработанного набора и способа
Проба №1 - не содержит Y.pestis.
Проба №2 - содержит вирулентный штамм Y.pestis с плазмидами pPst, pFra, pCad.
Проба №3 - содержит вирулентный штамм Y.pestis с плазмидами pFra и pCad, но лишен плазмиды pPst.
Проба №4 - содержит авирулентный штамм Y.pestis с плазмидой pPst, но лишен плазмид pFra и pCad.
Проба №5 - содержит авирулентный штамм Y.pestis с плазмидами pPst, pFra, pCad.
После расшифровки проб, полученные результаты во всех случаях совпадали с характеристиками штаммов, использованных для приготовления шифрованных проб при изучении их в бактериологических, серологических и биологических методах. Штаммы получены из Государственной коллекции патогенных бактерий ФГУЗ РосНИПЧИ «Микроб» (таблица 10).
Таким образом, заявляемая группа изобретений обладает новизной. Выбраны ДНК-мишени - последовательности фрагментов генов 3а SEQ ID №1 размером 147 п.н., ответственный за видоспецифичность; caf1 SEQ ID №2 размером 138 п.н. (плазмида pFra); pla SEQ ID №3 размером 127 п.н. (плазмида pPst); irp2 SEQ ID №4 размером 107 п.н.; hmsH SEQ ID №5 размером 127 п.н.; lcrV SEQ ID №6 размером 114 п.н. Подобраны праймеры и гибридизационные зонды, определен оптимальный состав реакционных смесей для выполнения мультиплексной ПЦР в режиме «реального времени» и оптимальные условия проведения реакции, особенности учета и оценки результатов, что позволяет идентифицировать культуру, определять ее вирулентность и плазмидный профиль, а также достигать высокого уровня чувствительности и специфичности, сокращать время анализа. Набор находится на стадии внедрения в производство - прошел предварительные, технические и медицинские испытания. В настоящее время проводится дополнительная экспертиза и регистрация в Росздравнадзоре.
Источники информации
1. Воробьев А.А., Боев Б.В., Бондаренко В.М., Гинзбург А.Л. Проблема биотерроризма в современных условиях // ЖМЭИ. - 2002. - №3. - С.3-12.
2. Патент на изобретение RU 2288275, МПК C12Q 1/68, C12N 15/10. Способ определения утраты вирулентности штаммами чумного микроба вследствие потери области пигментации / Булгакова Е.Г., Сухоносов И.Ю., Кутырев В.В. Опубл. 27.11.2006 // Бюл.-2006.-№33.
3. Патент на изобретение RU 2404251, МПК C12Q 1/00. Способ идентификации и внутривидовой дифференциации штаммов вида Yersinia pestis / Трухачев А.Л., Лебедева С.А., Васильева Е.А., Иванова В.С., Ракин А.В.. Опубл. 20.11.2010 // Бюл. №32.
4. Leal N. С., de Almeida A. М. P. Diagnosis of plague and identification of virulence markers in Yersinia pestis by multiplex-PCR // Rev. Inst. Med. Trop.S. Paulo. - 1999. - Vol.41, No.6. - P.339-342.
5. Патент US 7494772, МПК С01Н 21/02, С01Н 21/04, C12Q 1/68. Nucleotide sequences specific to Yersinia pestis and methods for the detection of Yersinia pestis / McCready paula m, Radnedge Lyndsay et al. Опубл. 24.02.2009.
6. Куличенко А.П., Норкина О.В., Гинцбург А.Л., Попов Ю.А., Дроздов И.Г. Оптимизация способа детекции штаммов чумного микроба при помощи полимеразной цепной реакции // Генетика. - 1994. - т.30, №2, - с.167-171.
7. Campbell J., Lowe J., Walz S., Ezzell J. Rapid and specific identification of Yersinia pestis by using a nested polymerase chain reaction procedure // J. Clin. Microbiol. - 1993. - Vol.31, №3. - P.758-759.
8. Higgins J.A., Ezzell J., Hinnebusch B.J., et al. 5' nuclease PCR assay to detect Yersinia pestis // J. Clin. Microbiol. - 1998. - Vol.36, №8. - P.2284-2288.
9. Engelthaler D. M., Gage K. L., Montenieri J. A., et al. PCR detection of Yersinia pestis in fleas: comparison with mouse inoculation // J. Clin. Microbiol. - 1999. - Vol.37, №6. - P.1980-1984.
10. Rahalison L., Vololonirina Е., Ratsitorahina M., Chanteau S. Diagnosis of bubonic plague in Madagascar under field conditions // J. Clin. Microbiol. - 2000. - Vol.38, №1. - P.260-263.
11. Loiez С., Herwegh S., Wallet F., et al. Detection of Yersinia pestis in sputum by real-time PCR // J. Clin. Microbiol. - 2003. - Vol.41, №10. - P.4873-4875.
12. Bearden S.W., Fetherston J.D., Perry R.D. Genetic organization of the yersiniabactin biosynthetic region and construction of avirulent mutants in Yersinia pestis // Infect. Immun. - 1997. - Vol.65. - P.1659-1668.
13. Buchrieser С., Prentice M., Carniel E. The 102-kilobase unstable region of Yersinia pestis comprises a high-pathogenicity island linked to a pigmentation segment which undergoes internal rearrangement // J. Bacteriol. - 1998. - Vol.180. - P.2321-2329.
14. Carniel E., Guilvout I., Prentice M. Characterization of a large chromosomal "high-pathogenicity island" in biotype 1B Yersinia enterocolitica // J. Bacteriol. - 1996. - Vol.178. - P.743-6751.
| Таблица 1 | ||
| Температура отжига праймеров | Наличие однородной амплификации по каналам FAM, JOE и ROX | |
| ПЦР-смесь №1 | ПЦР-смесь №2 | |
| 62°С | - | - |
| 60°С | - | - |
| 58°С | ± | ± |
| 56°С | + | + |
| 54°С | ± | ± |
| 52°С | - | - |
| 50°С | - | - |
| Количество циклов амплификации | Эффективная амплификация ДНК Yersinia pestis в концентрации 1×104 м.к./мл | |
| ПЦР-смесь №1 | ПЦР-смесь №2 | |
| 25 | - | - |
| 30 | ± | ± |
| 35 | + | + |
| 40 | + | + |
| Таблица 2 | ||
| Концентрация Y.pestis в пробе | Наличие амплификации по каналам FAM, JOE и ROX | |
| ПЦР-смесь №1 | ПЦР-смесь №2 | |
| 1×102 м.к./мл | - | - |
| 5×102 м.к./мл | - | - |
| 1×103 м.к./мл | - | - |
| 5×103 м.к./мл | ± | ± |
| 1×104 м.к./мл | + | + |
| 5×104 м.к./мл | + | + |
| 1×105 м.к./мл | + | + |
| Таблица 3 | |||
| Вид микроорганизма | Количество штаммов | Наличие амплификации по каналам FAM, JOE и ROX | |
| ПЦР-смесь №1 | ПЦР-смесь №2 | ||
| Y.pestis | 31 | + | + |
| Y.pseudotuberculosis | 2 | - | - |
| Y.enterocolitica | 2 | - | - |
| E.coli | 2 | - | - |
| Таблица 4 | ||||
| ПЦР-смесь | ПЦР-смесь №1 | Результаты | ||
| Канал учета флуоресценции | FAM | JOE | ROX | |
| Генетический маркер | pla (плазмида pPst) | 3а (хромосома) | caf1 (плазмида pFra) | |
| Пробы | Значения порогового цикла (Ct) | |||
| ОКВ, К- | Отсутствие флуоресценции | Отсутствие флуоресценции | Отсутствие флуоресценции | Результаты анализа подлежат учету |
| Наличие флуоресценции хотя бы по одному из каналов | Результаты анализа учету не подлежат | |||
| К+ | ≤33 | ≤33 | ≤33 | Результаты анализа подлежат учету |
| Отсутствие флуоресценции хотя бы по одному из каналов | Результаты анализа учету не подлежат | |||
| Исследуемые пробы | ≤33 | ≤33 | ≤33 | Культура относится к виду Yersinia pestis |
| ≤33 | ≤33 | Отсутствие флуоресценции | ||
| Отсутствие флуоресценции | ≤33 | ≤33 | ||
| Отсутствие флуоресценции | ≤33 | Отсутствие флуоресценции | ||
| Отсутствие флуоресценции | Отсутствие флуоресценции | Отсутствие флуоресценции | Культура не относится к виду Yersinia pestis |
| Таблица 5 | ||||
| ПЦР-смесь | ПЦР-смесь №2 | Результаты | ||
| Канал учета флуоресценции | FAM | JOE | ROX | |
| Генетический маркер | hmsH (хромосомная область пигментации) | irp2 (хромосомная область пигментации) | lcrМ (плазмида pCad) | |
| Пробы | Значения порогового цикла (Ct) | |||
| ОКВ, К- | Отсутствие флуоресценции | Отсутствие флуоресценции | Отсутствие флуоресценции | Результаты анализа подлежат учету |
| Наличие флуоресценции хотя бы по одному из каналов | Результаты анализа учету не подлежат | |||
| ПКО ДНК Y.pestis | ≤33 | ≤33 | ≤33 | Результаты анализа подлежат учету |
| Отсутствие флуоресценции хотя бы по одному из каналов | Результаты анализа учету не подлежат | |||
| Исследуемые пробы | ≤33 | ≤33 | Отсутствие флуоресценции | Штамм Yersinia pestis авирулентный |
| ≤33 | Отсутствие флуоресценции | ≤33 | ||
| ≤33 | Отсутствие флуоресценции | Отсутствие флуоресценции | ||
| Отсутствие флуоресценции | ≤33 | Отсутствие флуоресценции | ||
| Отсутствие флуоресценции | Отсутствие флуоресценции | ≤33 | ||
| Отсутствие флуоресценции | Отсутствие флуоресценции | Отсутствие флуоресценции | ||
| ≤33 | ≤33 | ≤33 | Штамм Yersinia pestis вирулентный | |
| Отсутствие флуоресценции | ≤33 | ≤33 |
| Таблица 6 | ||||
| ПЦР-смесь | ПЦР-смесь №1 | ПЦР-емесь №2 | Результаты | |
| Канал учета флуоресценции | FAM | ROX | ROX | |
| Генетический маркер | pla | caf1 | lcrV | |
| Пробы | Значения порогового цикла (Ct) | |||
| ОКВ, К- | Отсутствие флуоресценции | Отсутствие флуоресценции | Отсутствие флуоресценции | Результаты анализа подлежат учету |
| Наличие флуоресценции хотя бы по одному из каналов | Результаты анализа учету не подлежат | |||
| К+ | ≤33 | ≤33 | ≤33 | Результаты анализа подлежат учету |
| Отсутствие флуоресценции хотя бы по одному из каналов | Результаты анализа учету не подлежат | |||
| Исследуемые пробы | ≤33 | ≤33 | ≤33 | Штамм содержит плазмиды pCad, pPst, pFra |
| ≤33 | Отсутствие флуоресценции | ≤33 | Штамм содержит плазмиды pCad, pPst | |
| Отсутствие флуоресценции | ≤33 | ≤33 | Штамм содержит плазмиды pCad, pFra | |
| ≤33 | ≤33 | Отсутствие флуоресценции | Штамм содержит плазмиды pPst, pFra | |
| Отсутствие флуоресценции | Отсутствие флуоресценции | ≤33 | Штамм содержит плазмиду pCad | |
| ≤33 | Отсутствие флуоресценции | Отсутствие флуоресценции | Штамм содержит плазмиду pPst | |
| Отсутствие флуоресценции | ≤33 | Отсутствие флуоресценции | Штамм содержит плазмиду pFra | |
| Отсутствие флуоресценции | Отсутствие флуоресценции | Отсутствие флуоресценции | Штамм не содержит плазмид pCad, pPst, pFra |