Осаждение и очистка белков полиэлектролитами
Иллюстрации
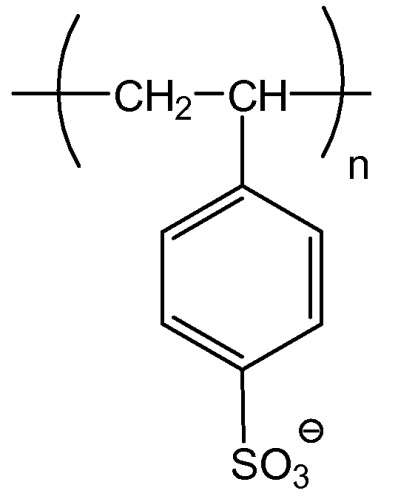
Показать всеНастоящее изобретение относится к области биохимии. Предложен способ очистки антител посредством добавления отрицательно заряженного полиэлектролита, такого как поливинилсульфоновая кислота, поливинилсульфонат, полистиролсульфоновая кислота или полиакриловая кислота, к смеси, содержащей антитело, и выделения получаемого преципитата, содержащего антитело. Использование изобретения может найти дальнейшее применение в технологии выделения антител из биологических жидкостей и их очистки. 12 з.п. ф-лы, 13 табл., 38 ил., 13 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей непредварительной заявке, поданной по 37 CFR § 1.53(b), по 35 USC §119(e), испрашивается приоритет предварительной заявки США серийный №60/886068, поданной 22 января 2007 г., и предварительной заявки США серийный №61/013446, поданной 13 декабря 2007 г., полное содержание которых приведено здесь в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам очистки белков.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Крупномасштабная, экономически выгодная очистка белков является все в большей степени важной проблемой для биотехнологической промышленности. Как правило, белки продуцируют в культуре клеток, с использованием линий клеток либо млекопитающих, либо бактерий, сконструированных для продукции интересующего белка посредством введения рекомбинантной плазмиды, содержащей ген этого белка. Поскольку используемые линии клеток являются живыми организмами, их необходимо подпитывать комплексной средой для роста, содержащей сахара, аминокислоты и факторы роста, обычно дополненной препаратами из сыворотки животных. Отделение желаемого белка от смеси соединений, питательных для клеток, и от побочных продуктов самих клеток до чистоты, достаточной для использования в качестве терапевтических средств для человека, составляет сложную задачу.
Рекомбинантные терапевтические белки обычно продуцируют в нескольких линиях клеток-хозяев млекопитающих, включая клетки миеломы мыши NS0 и клетки яичника китайского хомячка (CHO) (Anderson, D.C. and Krummen, L. (2002) Curr. Opin. Biotech. 13: 117-123; Chu, L. and Robinson, D.K. (2001) Curr. Opin. Biotechnol. 12:180-187). Каждая линия клеток обладает преимуществами и недостатками с точки зрения продуктивности и характеристик белков, продуцируемых клетками. Выборы линий клеток для коммерческой продукции часто уравновешивают необходимость высокой продуктивности со способностью обеспечивать показатели качества продукта, необходимые для данного продукта. Одним важным классом терапевтических рекомбинантных белков, для которых часто необходимы способы с высоким титром, являются моноклональные антитела. Для некоторых моноклональных антител необходимы эффекторные функции, опосредованные через Fc-область, чтобы активировать их биологические функции. Примером является ритуксимаб (РИТУКСАН®, Genentech, Inc. и Biogen-Idec), химерное моноклональное антитело, которое связывается с CD-20 поверхности клеток и приводит к элиминации B-клеток (Cartron et al. (2002) Blood 99: 754-758; Idusogie et al. (2000) J. Immunol. 164: 4178-4184). Для других антител, таких как бевацизумаб (АВАСТИН™, Genentech, Inc.), гуманизированное антитело против VEGF (фактор роста эндотелия сосудов), не требуются эффекторные функции Fc для их активности.
Успехи в способах ферментации и культивирования клеток сильно увеличили титры намеченных белков в культуральной жидкости. Это увеличение эффективности на более ранних стадиях создало трудности при более поздней переработке на стадии сбора клеток. Сбор клеток или осветление собранной культуральной жидкости является важным процессом почти во всех последующих очистках продуктов на биотехнологической основе. Когда продукт является внутренним для клеток, сбор клеток используют для уменьшения жидкого объема клеток, подлежащего переработке на стадиях выделения продукта. Когда продукт является внеклеточным, сбор клеток используют для отделения продукта от клеток и клеточного дебриса, например, для выделения внеклеточного антитела из культуры клеток млекопитающих (Anthony S. Lubiniecki, Ed. (1990) Large-Scale Mammalian Cell Culture Technology, Marcel Dekker; Hansjoerg Hauser, Roland Wagner, Eds. (1997) Mammalian Cell Biotechnology in Protein Production, Walter Gruyter Publishing).
Способы для очистки белков от клеточного дебриса исходно зависят от места экспрессии белка. Некоторые белки можно заставить секретироваться непосредственно из клетки в окружающую среду для роста; другие оставляют внутри клетки. В случае последних белков первая стадия способа очистки включает в себя лизис клеток, который можно осуществлять множеством способов, включая механическое разрезание, осмотический шок или ферментативные обработки. Такое разрушение высвобождает все содержимое клетки в гомогенат, и, кроме того, образует субклеточные фрагменты, которые трудно удалить из-за их малого размера. Их, как правило, удаляют дифференциальным центрифугированием или фильтрацией. Та же самая проблема возникает, хотя и в меньшей степени, с непосредственно секретирующимися белками из-за естественной гибели клеток и высвобождения внутриклеточных белков клетки-хозяина в ходе прохождения продукции белка.
Во время очистки терапевтических антител, примеси, включая белки клетки-хозяина, варианты продукта, ДНК клетки-хозяина, малые молекулы, связанные с процессом загрязнения, эндотоксины и вирусные частицы необходимо удалить (Fahrner, R.L. et al. (2001) Biotechnol. Genet. Eng. Rev. 18:301-327). Используемые способы очистки должны являться масштабируемыми, эффективными, экономически эффективными, надежными, и соответствовать жестким требованиям чистоты конечного продукта. Современные способы очистки, как правило, включают в себя множественные хроматографические разделения, включающие в себя ортогональные режимы разделения. Типичный способ может включать в себя некоторые из следующих стадий: преципитация (US 7169908), диализ, электрофорез, ультрафильтрация, аффинная хроматография, катионообменная хроматография, анионообменная хроматография и/или хроматография гидрофобного взаимодействия. Общепринятые стадии колоночной хроматографии являются эффективными и надежными, однако, как правило, обладают низкой производительностью для продукта (переработанных кг/ч). Поскольку моноклональные антитела становятся используемыми более широко, необходима более эффективная продукция в масштабе способа.
В способах хроматографии используют химические и физические свойства белков для достижения высокой степени очистки. Эти химические и физические свойства, как правило, включают в себя размер, изоэлектрическую точку, распределение заряда, гидрофобные участки и аффинность для лигандов (Janson, J. C. and L. Ryden (eds.). (1989) Protein Purification: Principles, High Resolution Methods and Applications. VCH Publishers, Inc., New York). Различные способы разделения в хроматографии включают в себя: ионообменную хроматографию, хроматофокусировку, гель- фильтрацию (эксклюзионную), хроматографию гидрофобного взаимодействия, обращеннофазовую и аффинную хроматографию. Ионообменная хроматография (IEX), включая анионообменную и катионообменную хроматографию, разделяет аналиты (например, белки) по различиям в их суммарных поверхностных зарядах. IEX является первичным средством для отделения экспрессированных белков от клеточного дебриса и других примесей. В настоящее время IEX является одним из наиболее часто используемых способов для очистки белков, пептидов, нуклеиновых кислот и других заряженных биомолекул, предоставляя высокоразрешающие и групповые разделения с высокой емкостью загрузки. Способ способен разделять виды молекул, обладающие только незначительными различиями в свойствах их зарядов, например, два белка, различающиеся одной заряженной аминокислотой. Эти свойства делают IEX хорошо подходящей для захвата, промежуточной очистки или окончательных стадий в протоколе очистки, и способ используют от очистки и анализа в микромасштабе до очистки килограммов продукта.
Способы хроматографии являются надежными, однако емкость и производительность могут являться проблематичными для крупномасштабных применений. Общепринятые стадии колоночной хроматографии являются эффективными и надежными, однако, как правило, обладают низкой производительностью для продукта (переработанных кг/час). Поскольку рекомбинантные белки становятся более широко используемыми, необходима более эффективная продукция в масштабе процесса. Производительность стадии хроматографии, как правило, ограничена емкостью хроматографической смолы для интересующего белка. При увеличении загрузки белка на колонку отделение интересующего белка от примесей часто уменьшается.
Известно, что полиэлектролиты образуют комплексы с белками, которые принимают формы растворимых комплексов (Dellacherie, E. (1991) Am. Chem. Soc, Div. Polym. Chem. Prepr. 32(1):602), аморфных преципитатов (Mattiasson et al. (1998) Polym. Plast. Technol. Eng. 37(3):303-308; Clark et al. (1987) Biotech. Progress 3(4):241; Fisher et al. (1988) Biotechnol. Bioeng. 32:777; Shieh et al. (1991) Am. Chem. Soc, Div. Polym. Chem. Prepr. 32(1)606; Sternberg et al. (1974) Biochimica et Biophysica Acta 342:195-206; WO 2004/014942) или коацерватов (Wang et al. (1996) Biotechnol. Prog. 12:356-362; Veis, A. (1991) Am. Chem. Soc. Div. Polym. Chem. Prepr. 32(1) 596). Протеолиз папаином моноклональных антител в присутствии антигена-поликатиона (полиметакриловая кислота) образует Fab-фрагменты (Dainiak et al. (2000) Analytical Biochem. 277:58-66).
Комплексы белок-полиэлектролит образуют коацерваты, т.е. разделяются на две отдельные жидкие фазы, где коацерватная фаза содержит большинство комплексов, а другая фаза представляет собой равновесную фазу (Burgess, D.J. «Complex Coacervation: Microcapsule Formation» in Macromolecular Complexes in Chemistry and Biology, Dubin, P. L., et al. Eds. (1994) Springer-Verlag, Berlin; Dubin et al. (1994) Sep. Purif. Complexes 23:1-16). Коацервация белков полиэлектролитами представляет собой сложный процесс и не является применимой для широкого диапазона белков. Межмолекулярные связи в комплексах белок-полиэлектролит обусловлены электростатическими взаимодействиями, водородными связями и гидрофобными силами (Cooper et al. (2005) Current Opinion in Colloid & Interface Science 10:52-78; Mattison et al. (1999) Macromol. Symp. 140:53-76). В то время как является известным, что добавление полиэлектролита к раствору белка может приводить к образованию комплексов белок-полиэлектролит и более крупных кластеров, и в конечном счете, к образованию коацерватов и/или преципитации, обратный процесс может возникать при дальнейшем добавлении полиэлектролита, в результате чего происходит повторное растворение белка, препятствуя выделению или очистке белка (Carlsson et al. (2003) J. Am. Chem. Soc. 125:3140-3149). Преципитация белков с использованием полиэлектролитов может обеспечивать экономически эффективную альтернативу хроматографическому разделению. С использованием этого способа возможно использовать функциональную химию хроматографических способов для достижения сходного уровня очистки белка в растворе. В частности, производительность стадии преципитации больше не будет ограниченной емкостью конкретной хроматографической смолы.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение относится к способам, относящимся к выделению и очистке белков, полученных из жидкостей культур клеток.
Одним аспектом изобретения является способ очистки белка посредством преципитации белка с помощью полиэлектролита, такого как полианионный полиэлектролит.
Изобретение относится также к способу очистки белка посредством преципитации примесей жидкости культуры клеток с помощью поликатионного полиэлектролита. За стадией преципитации могут следовать стадии катионообменной хроматографии, анионообменной хроматографии и другой преципитации.
Способы по изобретению включают в себя неаффинный способ для очистки антитела.
Одним аспектом изобретения является способ очистки антител, включающий в себя:
(a) регуляцию кислотности или концентрации соли в смеси, содержащей антитело, где антитело получено из собранной жидкости культуры клеток;
(b) добавление отрицательно заряженного полиэлектролита, в результате чего образуется преципитат белок-полиэлектролит;
(c) отделение преципитата белок-полиэлектролит от примесей, выбранных из агрегатов белка, фрагментов белка, белков клетки-хозяина, инсулина, гентамицина, ДНК и вымываемого белка A;
(d) выделение преципитата белок-полиэлектролит; и
(e) ресуспендирования преципитата белок-полиэлектролит в водном растворе.
Другим аспектом изобретения является способ очистки антител, включающий в себя:
(a) регуляцию кислотности или концентрации соли в смеси, содержащей антитело, где антитело получено из жидкости культуры клеток;
(b) добавление положительно заряженного, поликатионного полиэлектролита к смеси, в результате чего образуется преципитат, содержащий положительно заряженный, поликатионный полиэлектролит и примеси, выбранные из агрегатов белка, фрагментов белка, белков клетки-хозяина, инсулина, гентамицина и ДНК; и
(c) отделение преципитата от смеси, содержащей антитело.
КРАТКОЕ ОПИСАНИЕ ФИГУР
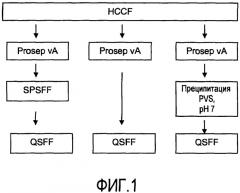
На фигуре 1 показаны стадии способа для очистки пула белка A, очищенного из собранной жидкости культуры клеток (HCCF), с последующими: левая колонка - катионообменной хроматографией (Sepharose™ fast flow, SPSFF) затем анионообменной хроматографией (QSFF); средняя колонка - QSFF; или правая колонка - преципитацией поливинилсульфоновой кислотой (PVS) при pH 7, затем QSFF.
На фигуре 2 показаны стадии способа очистки пула SPSFF, очищенного из собранной жидкости культуры клеток (HCCF), с последующими: левая колонка - QSFF; или правая колонка - преципитацией PVS при pH 7, затем QSFF.
На фигуре 3 показаны стадии способа для непосредственного захвата и очистки антитела из HCCF: левая колонка - преципитацией PVS при pH 5, с последующими QSFF, затем SPSFF; или преципитацией PVS при pH 7, с последующими QSFF, затем SPSFF.
На фигуре 4 показаны кривые растворимости rhuMab 2H7 в PVS (1800 Да) при pH 5 при 3,0 и 5,6 мСм/см (пул белка A). мСм = миллисименс, единица проводимости.
На фигуре 5 показаны кривые растворимости rhuMab 2H7 в PVS (1800 Да) при pH 7 при 0,7, 1,5, 3,0 и 4,7 мСм/см (пул белка A).
На фигуре 6 показаны кривые растворимости rhuMab 2H7 в PVS (1800 Да) при pH 7 при 0,8; и 1,5 мСм/см (пул захвата SPSFF).
На фигуре 7 показаны кривые растворимости rhuMab 2H7 в PVS (1800 Да) при pH 5 и 3,0 мСм/см; и при pH 7 и 0,7 мСм/см (HCCF).
На фигуре 8 показаны кривые растворимости, сравнивающие преципитацию PVS (1800 Да) с преципитацией PAA (1200 и 8000 Да) при pH 5, 5 мСм/см для антитела против CD20, 2H7.
На фигуре 9 показаны кривые растворимости, сравнивающие преципитацию PVS (1800 Да) с преципитацией PAA (1200 и 8000 Да) при pH 7, 1,5 мСм/см для антитела против CD20, 2H7.
На фигуре 10 показаны кривые растворимости антитела против CD20 (ритуксимаб) при pH 7, 1,5 мСм/см, сравнивающие PAA с молекулярными массами в диапазоне от 1200 до 1100000 Да.
На фигуре 11 показана таблица краткого изложения результатов последующей переработки для анти-CD20 rhuMab 2H7: (a) HCCF, пропущенная через белок A; (b) HCCF, пропущенная через SPSFF; (c) преципитация HCCF PVS.
На фигуре 12 показаны кривые растворимости Апомаб в PVS (1800 Да) при pH 5,5 и 5,1 мСм/см; pH 6,0 и 3,0 мСм/см; pH 6,0 и 5,5 мСм/см.
На фигуре 13 показаны кривые растворимости Апомаб в PVS (1800 Да) при pH 6,5 и 1,5 мСм/см; pH 6,5 и 3,2 мСм/см; и pH 7,0 и 0,7 мСм/см.
На фигуре 14 показана фотография флаконов, содержащих пулы белка A для Апомаб при pH 5,5, с содержанием: (слева) в отсутсвие PVS (0%), (в центре) 0,1% PVS (масс./об.), и (справа) 1% PVS (масс./об.).
На фигуре 15 показаны кривые растворимости анти-cMet в PVS (1800 Да) при pH 4 и 2 мСм/см; pH 5 и 1 мСм/см; pH 5 и 2,4 мСм/см; pH 6 и 0,5 мСм/см; pH 7 и 0,5 мСм/см.
На фигуре 16 показаны стадии способа для прямого захвата и очистки антитела rhuMab 2H7 из CCF: левая колонка - центрифугирование HCCF с последующей преципитацией антитела с помощью PVS, затем QSFF; правая колонка - флокуляция/преципитация примесей полиаргинином, центрифугирование HCCF, преципитация антитела с помощью PVS, затем QSFF.
На фигуре 17 показаны стадии способа для очистки антитела rhuMab 2H7 из собранной жидкости культуры клеток (HCCF) с последующими: левая колонка - Prosep vA, катионообменной хроматографией (SEPHAROSE™ fast flow, SPSFF) затем анионообменной хроматографией (QSFF); правая колонка - преципитацией полиаргинином, Prosep vA, SPSFF, затем QSFF.
На фигуре 18 показан такой же способ очистки антитела rhuMab 2H7 из собранной жидкости культуры клеток (HCCF), как на фигуре 17, с исключением стадии Prosep vA: левая колонка - SPSFF, затем QSFF; правая колонка - преципитация полиаргинином, SPSFF, затем QSFF.
На фигуре 19 показаны стадии способа для очистки антитела rhuMab 2H7 из собранной жидкости культуры клеток (HCCF) с последующими: левая колонка - преципитацией антитела с помощью PVS, затем QSFF; правая колонка - преципитацией полиаргинином, преципитацией антитела с помощью PVS, затем QSFF.
На фигуре 20 показана кривая растворимости rhuMab 2H7 CCF с полиаргинином 110 кДа.
На фигуре 21 показаны кривые растворимости rhuMab 2H7 HCCF - полиаргинин 42 кДа.
На фигуре 22 показаны кривые растворимости rhuMab 2H7 HCCF - полиаргинин 110 кДа.
На фигуре 23 показаны кривые растворимости rhuMab 2H7, анти-CD22, rhuMab C2B8 HCCF - полиаргинин 42 кДа.
На фигуре 24 показаны кривые растворимости rhuMab 2H7, анти-CD22, rhuMab C2B8 HCCF - полиаргинин 110 кДа.
На фигуре 25 показаны кривые растворимости для преципитации PVS rhuMab 2H7 CCF, флокулированной с помощью 0,075% масс./об. полиаргинина 110 кДа.
На фигуре 26 показаны кривые проскока на SPSFF для пула белка A, полученного из преципитированной полиаргинином HCCF в качестве загрузки.
На фигуре 27 показаны кривые проскока на SPSFF для HCCF, полученной при преципитации полиаргинином, в качестве загрузки.
На фигуре 28 показан гель-электрофорез для ингибирования восстановления антитела для 2H7 Mab. HCCF 4-12% BT, буфер MOPS, краситель Sypro рубиновый, загрузка 2 мкг HCCF, 5 мин 70°C, экспозиция 9 с, 2 F/T прогон 7, инкубация при RT в SS мини-флаконах, образцы по 500 мкл (микролитров), немедленно замороженные при -70°C.
На фигуре 29 показаны кривые растворимости пула белка A rhuMab C2B8 - полилизин 2,5 кДа.
На фигуре 30 показаны кривые растворимости пула белка A rhuMab C2B8 - полилизин 50 кДа.
На фигуре 31 показаны кривые растворимости rhuMab C2B8 HCCF - полилизин 50 кДа.
На фигуре 32 показаны кривые растворимости rhuMab C2B8 HCCF - полилизин 225 кДа.
На фигуре 33 показаны кривые растворимости гуманизированного анти-CD20 с образцами от 1800 Да до 1132 кДа от 0,00% до 0,20% полистиролсульфоната (PSS) при pH 7 и проводимости 12 мСм/см.
На фигуре 34 показан график Vmax емкости (измеренной в граммах антитела на площадь фильтра) в зависимости от понижения давления для каждого фильтрующего материала: A1HC, B1HC, C0HC, 45CE, 20CE, 30CE.
На фигуре 35 показан эффект изменения количества пропускаемой жидкости на выход в пересчете на объем буфера, необходимого для полного повторного растворения преципитата белок-полиэлектролит 2H7-PVS с фильтрующей среды C0HC MILLISTAK+®. LMH = литров на квадратный метр в час, измерение скорости потока.
На фигуре 36 показаны эффекты двух диапазонов интенсивности протока (потока буфера для повторного растворения в LMH) на повторное растворение белка с фильтра C0HC MILLISTAK+® (преципитат белок-полиэлектролит 2H7-PVS).
На фигуре 37 показан схематический способ поточной настройки кондиционирования HCCF/преципитации PVS.
На фигуре 38 показаны выходы выделения антитела при кондиционировании/преципитации с непрерывной подачей.
ПОДРОБНОЕ ОПИСАНИЕ ПРИМЕРНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Здесь будет сделана подробная ссылка на конкретные варианты осуществления изобретения, примеры которых проиллюстрированы в сопутствующих структурах и формулах. В то время как изобретение будет описано в соответствии с перечисленными вариантами осуществления, следует понимать, что они не предназначены для ограничения изобретения этими вариантами осуществления. И напротив, изобретение предназначено, чтобы включать все альтернативы, модификации и эквиваленты, которые можно включать в объем настоящего изобретения, как определено посредством формулы изобретения. Специалисту в данной области будут известны много методов и материалов, сходных с описанными здесь или эквивалентных им, которые можно использовать в осуществлении настоящего изобретения на практике. Настоящее изобретение никаким образом не является ограниченным описанными методами и материалами. В случае, когда одно или несколько из включенной литературы, патентов и сходных материалов отличаются от этой заявки или противоречат ей, включая в качестве неограничивающих примеров определенные термины, использование терминов, описанные способы или т.п., эта заявка имеет преимущественную силу.
ОПРЕДЕЛЕНИЯ
Если не указано иначе, следующие термины и фразы, как применяют здесь, предназначены, чтобы обладать следующими значениями.
Термин «собранная жидкость культуры клеток», также обозначаемая как HCCF, обозначает жидкость культуры прокариотических или эукариотических клеток, из которой клетки удалили средствами, включающими центрифугирование или фильтрацию. Культивирование клеток представляет собой способ, посредством которого либо прокариотические, либо эукариотические клетки выращивают в контролируемых условиях. Термин «культура клеток» относится к культивированию клеток, полученных из многоклеточных эукариот, включая клетки животных, или одноклеточных прокариот, включая бактерии и дрожжи. Культуры эукариотических клеток включают в себя клетки млекопитающих, такие как клетки яичника китайского хомячка, гибридомы и клетки насекомых. При наличии подходящего сосуда для культивирования клеток секретированные белки можно получить из субстратзависимых клеток или суспензионных линий клеток. Культуры клеток млекопитающих включают в себя клетки яичника китайского хомячка (CHO).
Термин «микробиологическая ферментация» обозначает культивирование клеток бактерий или дрожжей, которые являются генетически модифицированными для продукции химических веществ, таких как белки. Ферментацию используют для размножения клонированных бактерий и дрожжей, так же как других микроорганизмов, и продукции ценных белков. Продуктивность клеток и рост этих организмов максимизируют предоставлением конкретной среды для роста и контролем различных факторов внешней среды (таких как pH, температура, и аэрация). Жидкость после бактериальной ферментации можно получать от E. Coli.
Термин «антитело» используют здесь в самом широком смысле и конкретно распространяют на интактные моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антитела, пока они обладают желаемой биологической активностью. Антитела могут являться мышиными, человеческими, гуманизированными, химерными или полученными из других видов.
Антитело представляет собой белок, образованный иммунной системой, который является способным узнавать и связывать специфический антиген (Janeway, et al. (2001) «Immunobiology», 5th Ed., Garland Publishing, New York). Антиген-мишень, как правило, обладает многочисленными участками связывания, также называемыми эпитопами, узнаваемыми CDR на многих антителах. Каждое антитело, которое специфически связывается с отличающимся эпитопом, обладает отличающейся структурой. Таким образом, один антиген может обладать более чем одним соответствующим антителом.
Термин «антитело», как применяют здесь, также относится к полноразмерной молекуле иммуноглобулина или иммунологически активной части полноразмерной молекулы иммуноглобулина, т.е. к молекуле, содержащей антигенсвязывающий участок, который иммуноспецифически связывает антиген из интересующей мишени или ее части, где такие мишени включают в качестве неограничивающих примеров, раковую клетку или клетки, продуцирующие аутоиммунные антитела, связанные с аутоиммунным заболеванием. Иммуноглобулин, описанный здесь, может принадлежать любому типу (например, IgG, IgE, IgM, IgD и IgA), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу молекулы иммуноглобулина. Иммуноглобулины можно получать из любых видов. В одном аспекте, однако, иммуноглобулин происходит из человека, мыши или кролика.
«Фрагменты антител» содержат часть полноразмерного антитела, как правило, его антигенсвязывающий участок. Примеры фрагментов антител включают в себя фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела; фрагменты, продуцированные экспрессирующей библиотекой Fab, антиидиотипические (анти-Id) антитела, CDR (определяющую комплементарность область), ECD (внеклеточный домен), и эпитопсвязывающие фрагменты любого из вышеуказанного, которые иммуноспецифически связываются с антигенами раковой клетки, вирусными антигенами или микробными антигенами, одноцепочечные молекулы антител; и мультиспецифические антитела, сформированные из фрагментов антител.
Термин «моноклональное антитело», как применяют здесь, относится к антителу, полученному из популяции по существу однородных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высоко специфичными, являясь направленными против отдельного антигенного участка. Кроме того, в отличие от препаратов поликлональных антител, которые содержат различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональные антитело направлено против одной детерминанты антигена. В дополнение к их специфичности, моноклональные антитела являются преимущественными в том, что их можно синтезировать без загрязнения другими антителами. Определение «моноклональное» указывает на характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует рассматривать как требование получения антитела каким-либо конкретным способом. Например, моноклональные антитела для применения по настоящему изобретению можно получить способом гибридомы, первоначально описанным Kohler et al. (1975) Nature 256:495, или можно получить способами рекомбинантной ДНК (US 4816567). «Моноклональные антитела» можно выделить также из фаговых библиотек антител с применением способов, описанных, например, в Clackson et al. (1991) Nature, 352:624-628; Marks et al. (1991) J. Mol. Biol, 222:581-597.
Применимые моноклональные антитела представляют собой однородные популяции антител к конкретной антигенной детерминанте (например, антигену раковой клетки, вирусному антигену, микробному антигену, белку, пептиду, углеводу, химическому веществу, нуклеиновой кислоте или их фрагментам). Моноклональное антитело (Mab) к интересующему антигену можно получать с использованием любого способа, известного в данной области, который обеспечивает продукцию молекул антитела стабильными клеточными линиями в культуре. Они включают в себя в качестве неограничивающих примеров способ гибридомы, первоначально описанный Köhler and Milstein (1975) Nature 256:495-497), способ гибридомы B-клетки человека (Kozbor et al. (1983) Immunology Today 4:72), и способ EBV-гибридомы (Cole et al. (1985) in Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96). Такие антитела могут принадлежать любому классу иммуноглобулинов, включая IgG, IgM, IgE, IgA, и IgD и любому их подклассу. Гибридому, продуцирующую Mab для применения по этому изобретению, можно культивировать in vitro или in vivo.
Терапевтические моноклональные антитела, применимые в способах по изобретению, включают в себя трастузумаб (ГЕРЦЕПТИН®, Genentech, Inc., Carter et al. (1992) Proc. Natl. Acad. Sci. USA, 89:4285-4289; US 5725856); антитела против CD20, такие как химерные анти-CD20 «C2B8» (US 5736137); ритуксимаб (РИТУКСАН®), окрелизумаб, химерный или гуманизированный вариант антитела 2H7 (US 5721108; WO 04/056312), или тозитумомаб (БЕКСАР®); анти-IL-8 (St John et al. (1993) Chest, 103:932, и WO 95/23865); антитела против VEGF, включая гуманизированные и/или аффинно зрелые антитела против VEGF, такие как гуманизированное антитело против VEGF huA4.6.1 бевацизумаб (АВАСТИН®, Genentech, Inc., Kim et al. (1992) Growth Factors 7:53-64, WO 96/30046, WO 98/45331); антитела против PSCA (WO 01/40309); антитела против CD40, включая S2C6 и его гуманизированные варианты (WO 00/75348); анти-CD11a (US 5622700; WO 98/23761; Steppe et al. (1991) Transplant Intl. 4:3-7; Hourmant et al. (1994) Transplantation 58:377-380); анти-IgE (Presta et al. (1993) J. Immunol. 151:2623-2632; WO 95/19181); анти-CD18 (US 5622700; WO 97/26912); анти-IgE, включая E25, E26 и E27 (US 5714338; US 5091313; WO 93/04173; US 5714338); антитело против рецептора Apo-2 (WO 98/51793); антитела против TNF-альфа, включая cA2 (РЕМИКЕЙД®), CDP571 и MAK-195 (US 5672347; Lorenz et al. (1996) J. Immunol. 156(4): 1646-1653; Dhainaut et al. (1995) Crit. Care Med. 23(9): 1461-1469); против тканевого фактора (TF) (EP 0 420 937 B1); против интегрина альфа-4 бета-7 человека (WO 98/06248); анти-EGFR, химеризованное или гуманизированное антитело 225 (WO 96/40210); антитела против CD3, такие как OKT3 (US 4515893); антитела против CD25 или против tac, такие как CHI-621 СИМУЛЕКТ® и ЗЕНАПАКС® (US 5693762); антитела против CD4, такие как антитело cM-7412 (Choy et al. (1996) Arthritis Rheum 39(l):52-56); антитела против CD52, такие как КАМПАТ-1H (Riechmann et al. (1988) Nature 332:323-337); антитела против рецептора Fc, такие как антитело M22, направленное против RI Fc-гамма, как в Graziano et al. (1995) J. Immunol. 155(10):4996-5002; антитела против карциноэмбрионального антигена (CEA), такие как hMN-14 (Sharkey et al. (1995) Cancer Res. 55(23Suppl): 5935s-5945s; антитела, направленные против эпителиальных клеток молочной железы, включая huBrE-3, hu-Mc 3 и CHL6 (Ceriani et al. (1995) Cancer Res. 55(23):5852s-5856s; и Richman et al. (1995) Cancer Res. 55(23 Supp): 5916s-5920s); антитела, связывающиеся с клетками карциномы толстой кишки, такие как C242 (Litton et al. (1996) Eur J. Immunol. 26(1): 1-9); антитела против CD38, например, AT 13/5 (Ellis et al. (1995) J. Immunol. 155(2):925-937); антитела против CD33, такие как Hu M195 (Jurcic et al. (1995) Cancer Res 55(23 Suppl):5908s-5910s и CMA-676 или CDP771; антитела против CD22, такие как LL2 или лимфоцид (Juweid et al. (1995) Cancer Res 55(23 Suppl):5899s-5907s); антитела против EpCAM, такие как 17-1A (ПАНОРЕКС®); антитела против GpIIb/IIIa, такие как абциксимаб или c7E3 Fab (РЕОПРО®); антитела против RSV, такие как MEDI-493 (СИНАГИС®); антитела против CMV, такие как ПРОТОВИР®; антитела против HIV, такие как PRO542; антитела против гепатита, такие как антитело против Hep B ОСТАВИР®; антитело против CA 125 оварекс; антиидиотипическое антитело против эпитопа GD3 BEC2; антитело ВИТАКСИН® против альфа-v бета-3; антитело против почечноклеточного рака человека, такое как ch-G250; ING-1; антитело против 17-1A человека (3622W94); антитело против опухоли ободочной и прямой кишки человека (A33); антитело против меланомы человека R24, направленное против ганглиозида GD3; против плоскоклеточной карциномы человека (SF-25); и антитела против лейкоцитарного антигена человека (HLA), такие как Smart ID10 и антитело против HLA DR Онколим (Lym-1).
Применимые моноклональные антитела включают в себя в качестве неограничивающих примеров, человеческие моноклональные антитела, гуманизированные моноклональные антитела, фрагменты антител или химерные моноклональные антитела человек-мышь (или другие виды). Человеческие моноклональные антитела можно получать любым из множества способов, известных в данной области (Teng et al. (1983) Proc. Natl. Acad. Sci. USA 80:7308-7312; Kozbor et al. (1983) Immunology Today 4:72-79; и Olsson et al. (1982) Methods in Enzymology 92:3-16).
Антитело может также представлять собой биспецифическое антитело. Биспецифические антитела могут обладать гибридной тяжелой цепью иммуноглобулина с первой специфичностью связывания на одном плече, и гибридной парой тяжелая цепь - легкая цепь иммуноглобулина (обеспечивающей вторую специфичность связывания) на другом плече. Эта ассиметричная структура облегчает отделение желательного биспецифического соединения от нежелательных сочетаний цепей иммуноглобулинов, поскольку наличие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает легкий способ разделения (WO 94/04690; Suresh et al. (1986) Methods in Enzymology, 121:210; Rodrigues et al. (1993) J. of Immunology 151:6954-6961; Carter et al. (1992) Bio/Technology 10:163-167; Carter et al. (1995) J. of Hematotherapy 4:463-470; Merchant et al. (1998) Nature Biotechnology 16:677-681). Способы получения биспецифических антител известны в данной области (Milstein et al. (1983) Nature 305:537-539; WO 93/08829; Traunecker et al. (1991) EMBO J. 10:3655-3659). С использованием таких способов биспецифические антитела можно получить для конъюгации в качестве ADC для лечения или предупреждения заболевания, как определено здесь.
Согласно другому способу, вариабельные домены антител с желаемыми специфичностями связывания (участками объединения антитело-антиген) сливают с последовательностями константного домена иммуноглобулина. Слитый белок может обладать константным доменом тяжелой цепи иммуноглобулина, содержащей по меньшей мере часть шарнирной, CH2 и CH3 областей. Первая константная область тяжелой цепи (CH1) может содержать участок, необходимый для связывания легкой цепи, присутствующий по меньшей мере в одном из слитых белков. Нуклеиновые кислоты с последовательностями, кодирующими слитые белки с тяжелой цепью иммуноглобулина и, если желательно, с легкой цепью иммуноглобулина, вставляют в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозяин. Это предоставляет большую гибкость в регулировании взаимного соотношения трех полипептидных фрагментов в вариантах осуществления, когда с неравными соотношениями трех полипептидных цепей, применяемых в конструкции, достигают оптимального выхода. Однако можно вставлять кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или когда соотношения не являются особенно важными.
Гибридные или бифункциональные антитела можно получать либо биологически, т.е. способами слияния клеток, либо химически, особенно с помощью перекрестно-сшивающих средств или формирующих дисульфидный мостик реагентов, и они могут содержать целые антитела или их фрагменты (EP 105360; WO 83/03679; EP 217577).
Антитело может представлять собой функционально активный фрагмент, производное или аналог антитела, которые иммуноспецифически связываются с антигенами раковой клетки, вирусными антигенами или микробными антигенами, или другими антителами, связанными с опухолевыми клетками или матриксом. В этом отношении, «функционально активный» означает, что фрагмент, производное или аналог является способным вызывать образование анти-антиидиотипических антител, которые узнают тот же самый антиген, который узнавало антитело, из которого получен фрагмент, производное или аналог. В частности, в примерном варианте осуществления антигенность идиотипа молекулы иммуноглобулина можно увеличить делецией последовательностей каркаса и CDR, которые находятся на C-конце от последовательности CDR, которая специфически узнает антиген. Чтобы определить, какие последовательности CDR связывают антиген, синтетические пептиды, содержащие последовательности CDR, можно использовать в анализах связывания с антигеном посредством любого способа анализа связывания, известного в данной области, например анализа BIA core (Kabat et al., (1991) in Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md; Kabat et al. (1980) J. of Immunology 125(3):961-969).
Другие применимые антитела включают в себя фрагменты антител, например, в качестве неограничивающих примеров, фрагменты F(ab')2, содержащие вариабельную область, константную область легкой цепи и домен CH1 тяжелой цепи, можно получить расщеплением пепсином молекулы антитела, и фрагменты Fab, которые можно получить восстановлением дисульфидных мостиков фрагментов F(ab')2. Другие применимые антитела представляют собой димеры тяжелой цепи и легкой цепи антител, или любой их минимальный фрагмент, такой как Fv или одноцепочечные антитела (SCA) (например, как описано в US 4946778; Bird (1988) Science 242:423-42; Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; и Ward et al. (1989) Nature 334:544-54), или любую молекулу с той же самой специфичностью, что и антитело.
Моноклональные антитела здесь конкретно включают в себя «химерные» антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как остаток цепи(цепей) является идентичным или гомологичным соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, так же как фрагменты таких антител, пока они обладают желательной биологической активностью (US 4816567; и Morrison et al. (1984) Proc. Natl. Acad. Sci. USA, 81:6851-6855). Химерное антитело представляет собой молекулу, в которой различные части происходят из различных видов животных, такую как молекулы, обладающие вариабельной областью, происходящей из мышиного моноклонального иммуноглобулина, и константными областями человеческого иммуноглобулина (US 4816567; US 4816397). Химерные антитела включают в себя «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, происходящие из не относящегося к человеку примата (например, обезьяны Старого Света, человекообразной обезьяны и т.д.), и последовательности константных областей человека.
Химерные и гуманизированные моноклональные антитела, содержащие как человеческие, так и не относящиеся к человеку части, можно получать с использованием общепринятых способов рекомбинантной ДНК (WO 87/02671; EP 184187; EP 171496; EP 173494; WO 86/01533; US 4816567; EP 12023; Berter et al. (1988) Science 240:1041-1043; Liu et al. (1987) Proc. Natl. Acad. Sci. USA 84:3439-3443; Liu et al. (1987) J. Immunol. 139:3521-3526; Sun et al. (1987) Proc. Natl. Acad. Sci. USA 84:214-218; Nishimura et al. (1987) Cancer. Res. 47:999-1005; Wood et al. (1985) Nature 314:446-449 и Shaw et al. (1988) J. Natl. Cancer Inst. 80:1553-1559; Morrison (1985) Science 229:1202-1207; Oi et al. (1986) BioTechniques 4:214; US 5225539; Jones et al. (1986) Nature 321:552-525; Verhoeyan et al. (1988) Science 239:1534 и Beidler et al. (1988) J. Immunol. 141:4053-4060; полное содержание каждого из которых приведено здесь в качестве с