Гуманизированные антитела к фактору d и их применения
Иллюстрации
Показать всеПредложенное изобретение относится к области иммунологии. Описаны варианты гуманизированных моноклональных антител к фактору D или их функциональные фрагменты. Предложены: кодирующая нуклеиновая кислота, вектор экспрессии, а также клетка для получения антитела, содержащая вектор. Описан способ получения антитела к фактору D путем культивирования клетки и очистки экспрессируемого антитела. Кроме того, предлагаются: композиция на основе антител и применение антител для лечения нарушений, опосредованных системой комплемента. Использование изобретения может найти применение в медицине для лечения заболеваний, связанных с избыточной или неконтролируемой активацией системы комплемента. 18 н. и 14 з.п. ф-лы, 9 ил., 4 табл., 6 пр.
Реферат
Уровень техники
Система комплемента играет центральную роль в процессах клиренса иммунных комплексов и иммунного ответа на инфекционные агенты, чужеродные агенты, инфицированные вирусом клетки и опухолевые клетки. Однако комплемент также вовлечен в патологическое воспаление и в аутоиммунные заболевания. Таким образом, ингибирование избыточной или неконтролируемой активации каскада комплемента могло бы принести клиническую пользу пациентам с такими заболеваниями и состояниями.
Система комплемента охватывает два отдельных пути активации, называемых классическим и альтернативным путями (V.M. Holers, In Clinical Immunology: Principles and Practice, ed. R.R. Rich, Mosby Press; 1996, 363-391). Классический путь представляет собой кальций/магнийзависимый каскад, который обычно активируется за счет образования комплексов антиген - антитело. Альтернативный путь представляет собой магнийзависимый каскад, который активируется путем депонирования и активации C3 на определенных чувствительных поверхностях (например, на полисахаридах клеточной стенки дрожжей и бактерий и на определенных биополимерных материалах). Активация пути комплемента генерирует биологически активные фрагменты белков комплемента, например, анафилатоксинов C3a, C4a и C5a и мембраноатакующих комплексов C5b-9 (MAC), которые опосредуют активности воспаления, включающие хемотаксис лейкоцитов, активацию макрофагов, нейтрофилов, тромбоцитов, тучных клеток и эндотелиальных клеток, проницаемость сосудов, цитолиз и повреждение тканей.
Фактор D представляет собой высокоспецифичную сериновую протеазу, необходимую для активации альтернативного пути комплемента. Она расщепляет фактор B, связанный с C3b, генерируя фермент C3b/Bb, который является активным компонентом конвертаз C3/C5 альтернативного пути. Фактор D может представлять собой подходящую мишень для ингибирования, поскольку его концентрация в плазме людей является очень низкой (1,8 мкг/мл), и было показано, что он является ограничивающим ферментом для активации альтернативного пути комплемента (P.H. Lesavre and H.J. Müller-Eberhard. J. Exp. Med., 1978; 148: 1498-1510; J.E. Volanakis et al., New Eng. J. Med., 1985; 312: 395-401).
Было продемонстрировано на животных-моделях и в исследованиях ex vivo, что подавление (даун-регуляция) активации системы комплемента является эффективным при лечении некоторых симптомов заболеваний, например, при системной красной волчанке и гломерулонефрите (Y. Wang et al., Proc. Natl. Acad. Sci.; 1996, 93: 8563-8568), ревматоидном артрите (Y. Wang et al., Proc. Natl. Acad. Sci., 1995; 92: 8955-8959), искусственном кровообращении и гемодиализе (C.S. Rinder, J. Clin. Invest, 1995; 96: 1564-1572), сверхостром отторжении при трансплантации органов (T.J. Kroshus et al., Transplantation, 1995; 60: 1194-1202), инфаркте миокарда (J.W. Homeister et al., J. Immunol., 1993; 150: 1055-1064; H.F. Weisman et al., Science, 1990; 249: 146-151 ), реперфузионном повреждении (E.A. Amsterdam et al., Am. J. Physiol., 1995; 268: H448-H457) и при синдроме нарушения дыхания у взрослых (R. Rabinovici et al., J. Immunol., 1992; 149: 1744-1750). Кроме того, другие воспалительные состояния и заболевания аутоиммунного/иммунного комплекса также тесно ассоциированы с активацией системы комплемента (V.M. Holers, ibid., B.P. Morgan. Eur. J. Clin. Invest, 1994: 24: 219-228), включая термическое повреждение, тяжелое астматическое состояние, анафилактический шок, воспаление кишечника, крапивницу, агниоэдему, васкулит, рассеянный склероз, миастению гравис, мембранопролиферативный гломерулонефрит и синдром Шегрена.
Существует потребность в терапии с помощью антител в области нарушений, опосредованных системой комплемента, и гуманизированные антитела по настоящему изобретению представляют собой высокоаффинные антитела, используемые для удовлетворения этой потребности.
Сущность изобретения
Настоящее изобретение относится, в основном, к антителам, включающим последовательности вариабельных доменов тяжелой цепи и легкой цепи мышиного антитела 166-32, которое представляет собой антитело, способное к ингибированию биологических активностей, ассоциированных с фактором D. Например, можно наблюдать существенное ингибирование активности альтернативного пути комплемента при концентрации, составляющей 18 мкг/мл (эквивалентно примерно превышению в 1,5 раза молярной концентрации фактора D в крови; молярное соотношение антитела к фактору D и фактора D составляет примерно 1,5:1)(см., например, патент США №6956107).
Настоящее изобретение также относится к гуманизированным антителам мышиного антитела MAb 166-32. Изобретение включает аминокислотные последовательности вариабельных участков тяжелой и легкой цепи антител и их соответствующие нуклеотидные последовательности. Другой вариант осуществления изобретения включает последовательности CDR этих антител.
Другой вариант осуществления настоящего изобретения включает композиции, включающие антитело по изобретению. В другом варианте осуществления изобретение представляет клеточные линии и векторы, несущие последовательности антител по настоящему изобретению. В одном аспекте изобретение включает способ получения антител и композиций по изобретению.
Другим вариантом осуществления настоящего изобретения является применение этих гуманизированных антител для получения лекарственного средства или композиции для лечения нарушений, ассоциированных с избыточной или неконтролируемой активацией системы комплемента. Они включают активацию системы комплемента во время операций искусственного кровообращения; активацию системы комплемента по причине ишемии-реперфузии после острого инфаркта миокарда, аневризмы, инсульта, геморрагического шока, повреждения с размозжением тканей, полиорганной недостаточности, гиповолемического шока, кишечной ишемии или других событий, вызывающих ишемию. Также было показано, что активация системы комплемента ассоциирована с воспалительными состояниями, такими как тяжелые ожоги, эндотоксемия, септический шок, синдром нарушения дыхания у взрослых, гемодиализ; анафилактический шок, тяжелое астматическое состояние, ангиоэдема, болезнь Крона, серповидно-клеточная анемия, постстрептококковый гломерулонефрит и панкреатит. Нарушение может быть результатом побочного действия лекарственного средства, аллергии на лекарственное средство, индуцированного с помощью IL-2 синдрома просачивания из сосудов или аллергии на рентгеноконтрастные средства. Нарушение также включает аутоиммунное заболевание, такое как системная красная волчанка, миастения гравис, ревматоидный артрит, болезнь Альцгеймера и рассеянный склероз. Активация системы комплемента также ассоциирована с отторжением трансплантата. Активация системы комплемента также ассоциирована с глазными заболеваниями, такими как возрастная дегенерация желтого пятна, диабетическая ретинопатия.
Краткое описание фигур
На фиг.1А и 1В изображена аминокислотная последовательность вариабельного участка тяжелой цепи мышиного антитела MAb 166-32 (фиг.1А) и вариабельного участка легкой цепи (фиг.1В).
На фиг.2А и 2В изображена нуклеотидная последовательность вариабельного участка тяжелой цепи мышиного антитела MAb 166-32 (фиг.2А) и вариабельного участка легкой цепи (фиг.2В).
На фиг.3 изображено сравнение тяжелой цепи мышиного антитела MAb 166-32.
На фиг.4 изображено сравнение легкой цепи мышиного антитела MAb 166-32.
На фиг.5 изображены аминокислотные последовательности вариабельного участка тяжелой цепи и вариабельного участка легкой цепи для каждого клона #56, #111, #250 и #416 гуманизированного антитела.
На фиг.6 изображены результаты гемолитического анализа для клонов #56, #111, #250 и #416 гуманизированного антитела Fab.
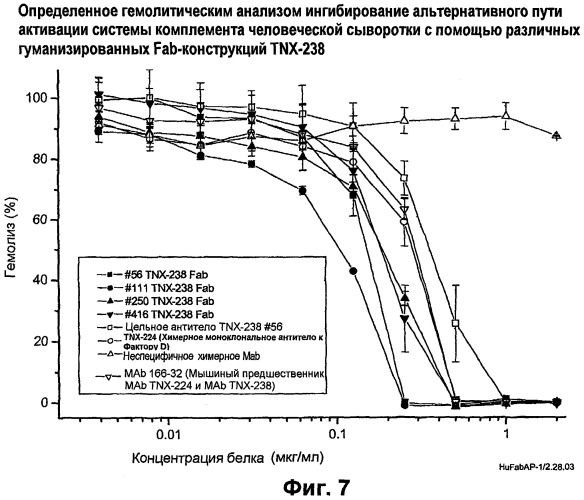
На фиг.7 изображено ингибирование активности альтернативного пути комплемента с помощью клонов #56, #111, #250 и #416 гуманизированного антитела Fab.
На фиг.8A-B (консенсусные каркасные участки вариабельных участков тяжелой цепи (VH)) и фиг.9A-B (консенсусные каркасные участки вариабельных участков легкой цепи (VL)) изображены характерные акцепторные человеческие консенсусные каркасные последовательности, которые могут быть использованы в практическом применении настоящего изобретения со следующими признаками последовательностей: (фиг.8A-B) подгруппа I человеческих консенсусных каркасных последовательностей VH в отсутствие CDR-участков по Kabat (SEQ ID NO: 28), подгруппа I человеческих консенсусных каркасных последовательностей VH в отсутствие протяженных гипервариабельных участков (SEQ ID NO: 29-31), подгруппа II человеческих консенсусных каркасных последовательностей VH в отсутствие CDR-участков по Kabat (SEQ ID NO: 32), подгруппа II человеческих консенсусных каркасных последовательностей VH в отсутствие протяженных гипервариабельных участков (SEQ ID NO: 33-35), подгруппа III человеческих консенсусных каркасных последовательностей VH в отсутствие CDR-участков по Kabat (SEQ ID NO: 36), подгруппа III человеческих консенсусных каркасных последовательностей VH в отсутствие протяженных гипервариабельных участков (SEQ ID NO: 37-39), подгруппа VII человеческих консенсусных каркасных последовательностей VH в отсутствие CDR-участков по Kabat (SEQ ID NO: 55), подгруппа VII человеческих консенсусных каркасных последовательностей VH в отсутствие протяженных гипервариабельных участков (SEQ ID NO: 56-58), подгруппа человеческого акцепторного каркасного участка VH в отсутствие CDR-участков по Kabat (SEQ ID NO: 40), подгруппа человеческого акцепторного каркасного участка VH в отсутствие протяженных гипервариабельных участков (SEQ ID NO: 41-42), подгруппа 2 человеческого акцепторного каркасного участка VH в отсутствие CDR-участков по Kabat (SEQ ID NO: 43) и подгруппа 2 человеческого акцепторного каркасного участка VH в отсутствие протяженных гипервариабельных участков (SEQ ID NO: 44-46) и (Фиг.9А-В) подгруппа I человеческого консенсусного каркасного участка цепи VL каппа (SEQ ID NO: 47), подгруппа II человеческого консенсусного каркасного участка цепи VL каппа (SEQ ID NO: 48), подгруппа III человеческого консенсусного каркасного участка цепи каппа (SEQ ID NO: 49) и подгруппа IV человеческого консенсусного каркасного участка цепи каппа (SEQ ID NO: 50).
Подробное описание изобретения
Определения
Термины, используемые по всему тексту заявки, следует истолковывать с помощью обычного и типичного значения для специалистов в данной области. Однако авторам настоящего изобретения желательно, чтобы следующим терминам были даны конкретные определения, как определено ниже.
Фраза "по существу идентичный" по отношению к полипептидной последовательности цепи антитела может быть истолкована как цепь антитела, идентичная эталонной полипептидной последовательности, по меньшей мере, на 70% или на 80% или на 90% или на 95%. Термин «по отношению к нуклеотидной последовательности» может быть истолкован как последовательность нуклеотидов, идентичная эталонной нуклеотидной последовательности, по меньшей мере, примерно на 85% или на 90%, или на 95%, или на 97%.
Термин "идентичность" или "гомология" следует истолковывать как обозначение процента аминокислотных остатков в кандидатной последовательности, которые идентичны остатку соответствующей последовательности, с которой ее сравнивают, после выравнивания последовательностей и введения пробелов, если необходимо, для достижения максимального процента идентичности с цельной последовательностью, и не рассматривая никаких консервативных замен в виде части идентичности последовательности. Ни N-концевые, ни C-концевые удлинения, ни вставки не следует истолковывать как уменьшающие идентичность или гомологию. Методы и компьютерные программы для выравнивания хорошо известны в данной области. Идентичность последовательности может быть измерена с использованием пакета программного обеспечения для анализа последовательностей.
Термин "антитело" используется в широком смысле и, конкретно, охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и мультиспецифичные антитела (например, биспецифичные антитела). Антитела (Ab) и иммуноглобулины (Ig) представляют собой гликопротеины, обладающие одинаковыми структурными характеристиками. В то время как антитела демонстрируют специфичность связывания со специфичной мишенью, иммуноглобулины включают как антитела, так и другие антитело-подобные молекулы, которые лишены специфичности к мишени. Нативные антитела и иммуноглобулины обычно представляют собой гетеротетрамерные гликопротеины молекулярной массы, составляющей примерно 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым следуют константные домены. Каждая легкая цепь содержит на одном конце вариабельный домен (VL) и константные домены на ее другом конце.
Как используется в данном описании, термин "антитело к фактору D человека" обозначает антитело, которое специфично связывается с фактором D человека таким образом, чтобы ингибировать или по существу уменьшать активацию системы комплемента.
Термин "вариабельный" в контексте вариабельного домена антител означает тот факт, что определенные участки вариабельных доменов существенно отличаются среди антител по последовательности и используются при связывании и определении специфичности каждого конкретного антитела для его конкретной мишени. Однако вариабельность не распределена равномерно по вариабельным доменам антител. Она концентрируется в трех сегментах, называемых участками, определяющими комплементарность (CDR), также известными как гипервариабельные участки (HVR) в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные участки называют каркасными участками (FR). Каждый из вариабельных доменов нативных тяжелых и легких цепей включает четыре FR-участка, по большей части принимающих конфигурацию β-листа, связанных тремя участками CDR, которые образуют петли, связывающие и, в некоторых случаях, образующие часть структуры β-листа. Участки CDR в каждой цепи содержатся вместе в тесной близости с участками CDR из другой цепи с помощью FR-участков, способствуя образованию сайта связывания антител с мишенью (см. публикацию Kabat et al.). Как используется в данном описании, нумерацию аминокислотных остатков иммуноглобулинов проводят согласно системе нумерации аминокислотных остатков иммуноглобулинов по Kabat et al. (Sequences of Proteins of Immunological Interest, National Institute of Health, Bethesda, Md. 1987), если не указано иначе.
Термин "гипервариабельный участок", "HVR" или "HV", при использовании в данном описании, относится к участкам вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют определенные структурой петли. Как правило, антитела включают шесть гипервариабельных участков: три в области VH (H1, H2, H3) и три в области VL (L1, L2, L3). Используется ряд описаний гипервариабельных участков, которые включены в данный документ. Участки, определяющие комплементарность по Kabat (CDR), определяются на основе вариабельности последовательности и имеют широкое применение (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Chothia вместо этого использует обозначение локализации структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Гипервариабельные участки антитела AbM представляют собой компромисс между определением CDR по Kabat и определением структурных шпилек по Chothia и используются в Оксфордском пакете программного обеспечения для молекулярного моделирования антител AbM. "Контактные" гипервариабельные участки определяются на основе анализа доступных кристаллических структур комплексов. Остатки каждого из этих гипервариабельных участков указаны ниже.
| Петля | Kabat | AbM | Chothia | Контакт |
| L1 | L24-L34 | L24-L34 | L26-L32 | L30-L36 |
| L2 | L50-L56 | L50-L56 | L50-L52 | L46-L55 |
| L3 | L89-L97 | L89-L97 | L91-L96 | L89-L96 |
| H1 | H31-H35B | H26-H35B | H26-H32 | H30-H35B |
| (Нумерация по Kabat) | ||||
| H1 | H31-H35 | H26-H35 | H26-H32 | H30-H35 |
| (Нумерация по Chothia) | ||||
| H2 | H50-H65 | H50-H58 | H53-H55 | H47-H58 |
| H3 | H95-H102 | H95-H102 | H96-H101 | H93-H101 |
Гипервариабельные участки могут включать следующие "протяженные гипервариабельные участки": 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельных доменов пронумерованы согласно Kabat et al., как описано выше, для каждого из этих классов.
Остатки "каркасного участка" или "FR-участка" представляют собой остатки вариабельного домена, отличные от остатков гипервариабельного участка или от остатков участка CDR, определенных в данном описании.
Термин "нумерация по Kabat остатков вариабельного домена" или "нумерация по Kabat положения аминокислоты" и их вариации означает систему нумерации, используемую для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи в компиляции антител по Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991). При использовании этой системы нумерации действительная линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, соответствующие укороченным FR- или CDR-участкам вариабельного домена или вставкам в FR- или CDR-участки вариабельного домена. Например, вариабельный домен тяжелой цепи может включать одну аминокислотную вставку (остаток 52a согласно Kabat) после остатка 52 из H2 и вставленные остатки (например, остатки 82a, 82b, и 82c и т.д. согласно Kabat) после остатка 82 FR-участка тяжелой цепи. Нумерация остатков по Kabat может быть определена для данного антитела путем сравнения гомологичных участков последовательности антитела со "стандартной" последовательностью с нумерацией по Kabat.
Систему нумерации по Kabat, как правило, используют при обозначении остатка в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991 )). "EU-система нумерации" или "EU-индекс", как правило, используется для обозначения остатка в константном участке тяжелой цепи иммуноглобулина (например, EU-индекс, описанный выше у Kabat et al.; шарнирный участок в константном домене тяжелой цепи приблизительно представляет собой остатки 216-230 (EU-нумерация) тяжелой цепи). "EU-индекс по Kabat" обозначает нумерацию остатков человеческого антитела IgG1 EU. Если в данном описании не указано иначе, обозначения номеров остатков в вариабельном домене антител означают нумерацию остатков по системе нумерации Kabat. Если в данном описании не указано иначе, обозначения номеров остатков в константном домене антител означают нумерацию остатков по EU-нумерации (например, см. предварительную заявку США No. 60/640323, фигуры для EU-нумерации).
Термин "фрагмент антитела" обозначает часть полноразмерного антитела, как правило, участок связывания с мишенью или вариабельный участок. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и Fv-фрагменты. Фраза "функциональный фрагмент или аналог" антитела относится к соединению, обладающему качественной биологической активностью подобно полноразмерному антителу. Например, функциональный фрагмент или аналог антитела к фактору D человека представляет собой фрагмент, который может связываться с фактором D таким образом, чтобы предотвратить или по существу уменьшить активацию системы комплемента. Как используется в данном описании, "функциональный фрагмент" по отношению к антителам относится к фрагментам Fv, F(ab) и F(ab')2. Фрагмент "Fv" представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания и связывания с мишенью. Этот участок состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, которые находятся в тесной нековалентной ассоциации (димер VH-VL). Он находится в такой конфигурации, что три CDR-участка каждого вариабельного домена взаимодействуют с установлением сайта связывания с мишенью на поверхности димера VH-VL. Суммарно, шесть участков CDR придают антителу специфичность связывания с мишенью. Однако даже один вариабельный домен (или половина фрагмента Fv, включающего только три участка CDR, специфичных для мишени) обладает способностью распознавать мишень и связываться с ней. "Одноцепочечный фрагмент Fv" или фрагмент "sFv" антитела включает домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Как правило, Fv-полипептид дополнительно включает полипептидный линкер между доменами VH и VL, который дает возможность фрагменту sFv образовывать целевую структуру для связывания с мишенью.
Fab-фрагмент содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов несколькими добавленными остатками на карбоксильном конце домена CH1 тяжелой цепи, включающего один или более цистеинов из шарнирного участка антитела. F(ab')-фрагменты получают путем расщепления дисульфидной связи шарнирных цистеинов продукта гидролиза пепсином F(ab')2. Дополнительные химические связывания фрагментов антитела известны специалистам в данной области.
Используемый в данном описании термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, включенные в популяцию, являются идентичными, за исключением возможных естественных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, причем направлены против одного целевого сайта. Кроме того, в отличие от традиционных препаратов антител (поликлональных), которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на мишени. В дополнение к их специфичности преимущество моноклональных антител заключается в том, что они могут быть синтезированы с помощью гибридомной культуры, не содержащей примесей других иммуноглобулинов. Обозначение "моноклональное" указывает на характер антитела, которое было получено из по существу гомогенной популяции антител и не должно быть истолковано как необходимость получения антитела каким-либо конкретным методом. Например, моноклональные антитела, предназначенные для применения по настоящему изобретению, могут быть выделены из фаговых библиотек антител с использованием хорошо известных методов. Родительские моноклональные антитела, предназначенные для применения согласно настоящему изобретению, могут быть получены гибридомным методом, впервые описанным в публикации Kohler and Milstein, Nature 256, 495 (1975), или могут быть получены рекомбинантными методами.
"Гуманизированные" формы отличных от человеческих (например, мышиных) антител представляют собой иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие фрагменты последовательностей антител, связывающиеся с мишенью), которые содержат минимальную последовательность, выделенную из отличного от человеческого иммуноглобулина. Как правило, гуманизированное антитело включает по существу все из, по меньшей мере, одного, а обычно из двух вариабельных доменов, в которых все или по существу все из участков CDR соответствуют участкам CDR отличного от человеческого иммуноглобулина, и все или по существу все из участков FR представляют собой консенсусную последовательность человеческого иммуноглобулина. Гуманизированное антитело также может включать, по меньшей мере, часть константного участка (Fc) иммуноглобулина, обычно из выбранного в качестве матрицы человеческого иммуноглобулина.
Методы гуманизации отличных от человеческих антител хорошо известны в данной области. Как правило, гуманизированное антитело содержит один или более аминокислотных остатков, введенных в него из источника, отличного от человека. Эти отличные от человеческих аминокислотные остатки часто обозначаются как "импортированные" остатки, которые обычно берутся из "импортированного" вариабельного домена. Гуманизацию можно по существу осуществлять согласно методу Винтера и сотрудников [Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)] путем замены участков CDR грызунов или последовательностей CDR на соответствующие последовательности человеческого антитела. Соответственно, такие "гуманизированные" антитела являются химерными антителами (патент США №4816567), где участок, по существу меньший, чем человеческий интактый вариабельный домен, заменяли на соответствующую последовательность из отличного от человека вида. На практике гуманизированные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки участка CDR и, возможно, некоторые остатки участка FR заменяют на остатки из аналогичных сайтов антител грызунов.
Выбор человеческих вариабельных доменов обеих цепей, легкой и тяжелой, которые будут использовать при получении гуманизированных антител, в некоторых случаях может быть важным с точки зрения уменьшения антигенности и/или реакции на HAMA (человеческое антимышиное антитело), когда антитело предназначено для использования в терапии человека. Уменьшение или исключение реакции на HAMA, как правило, представляет собой существенный аспект клинической разработки подходящих терапевтических агентов. См., например, Khaxzaeli et al., J. Natl. Cancer Inst. (1988), 80:937; Jaffers et al., Transplantation (1986), 41:572; Shawler et al., J. Immunol. (1985), 135:1530; Sears et al., J. Biol. Response Mod. (1984), 3:138; Miller et al., Blood (1983), 62:988; Hakimi et al., J. Immunol. (1991), 147:1352; Reichmann et al., Nature (1988), 332:323; Junghans et al., Cancer Res. (1990), 50:1495. Как описано в данном документе, в изобретении предлагаются антитела, которые гуманизированы так, чтобы реакция на HAMA была уменьшена или исключена. Варианты этих антител дополнительно могут быть получены с использованием обычных способов, известных в данной области, некоторые из которых дополнительно описаны ниже. Согласно так называемому "оптимизированному" методу последовательность вариабельного домена антитела грызуна скринировали против полной библиотеки известных человеческих последовательностей вариабельных доменов. Идентифицировали последовательность человеческого V-домена, которая является близкой такой последовательности грызуна, и человеческий каркасный участок (FR) внутри нее акцептировали для гуманизированного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). В другом методе используют конкретный каркасный участок, выделенный из консенсусной последовательности всех человеческих антител конкретной подгруппы легкой и тяжелой цепей. Такой же каркасный участок может быть использован для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993)).
Например, как описано в данном документе, аминокислотная последовательность из антитела служит в качестве стартовой (родительской) последовательности для разнообразия каркасных и/или гипервариабельных последовательностей. Выбранная каркасная последовательность, с которой связывается стартовая гипервариабельная последовательность, обозначается в данном описании как человеческий акцепторный каркасный участок. В то время как человеческие акцепторные каркасные участки могут быть из человеческого иммуноглобулина или могут быть выделены из человеческого иммуноглобулина (его участков VL и/или VH), человеческие акцепторные каркасные участки могут быть из консенсусной последовательности человеческого каркасного участка или могут быть выделены из консенсусной последовательности человеческого каркасного участка, в качестве таковых были продемонстрированы каркасные участки, которые обладают минимальной иммуногенностью, или она отсутствует у пациентов-людей. "Человеческий акцепторный каркасный участок", предназначенный для целей настоящего изобретения, представляет собой каркасный участок, включающий аминокислотную последовательность каркасного участка VL или VH, выделенного из каркасного участка человеческого иммуноглобулина или из консенсусной последовательности человеческого каркасного участка. Акцепторный человеческий каркасный участок, "выделенный из" каркасного участка человеческого иммуноглобулина или из консенсусной последовательности человеческого каркасного участка, может включать их аминокислотную последовательность, или может содержать ранее существующие аминокислотные замены. Там где присутствуют ранее существующие аминокислотные замены, они присутствуют в количестве, составляющем, предпочтительно, не более чем 5 и, предпочтительно, 4 или менее, или 3 или менее. В одном варианте осуществления человеческий акцепторный каркасный участок VH идентичен последовательности каркасного участка VH человеческого иммуноглобулина или консенсусной последовательности человеческого каркасного участка. В одном варианте осуществления человеческий акцепторный каркасный участок VL идентичен последовательности каркасного участка VL человеческого иммуноглобулина или консенсусной последовательности человеческого каркасного участка. "Консенсусная последовательность человеческого каркасного участка" представляет собой каркасный участок, который представляет собой наиболее часто встречающиеся аминокислотные остатки в выборке каркасных последовательностей VL или VH человеческого иммуноглобулина. Как правило, выборка последовательностей VL или VH человеческого иммуноглобулина представлена из подгруппы последовательностей вариабельного домена. Как правило, подгруппа последовательностей представляет собой подгруппу по Kabat et al. В одном варианте осуществления, для VL, подгруппа представляет собой подгруппу каппа I по Kabat et al. В одном из вариантов осуществления, для VH, подгруппа представляет собой подгруппу III по Kabat et al.
Там где акцепторная последовательность выделена из человеческого иммуноглобулина, специалист необязательно может выбрать последовательность человеческого каркасного участка, которая выбирается на основе ее гомологии с донорной последовательностью каркасного участка путем сравнения донорной последовательности каркасного участка с разнообразными последовательностями человеческого каркасного участка из коллекции последовательностей человеческого каркасного участка, и выбрать наиболее гомологичную последовательность каркасного участка в качестве акцептора. Акцепторная последовательность человеческого каркасного участка может быть из зародышевых последовательностей человеческого антитела или может быть выделена из зародышевых последовательностей человеческого антитела, доступных из общих баз данных.
В одном варианте осуществления представленные в данном описании человеческие консенсусные последовательности каркасного участка представляют собой последовательности из подгруппы VH VII и/или из подгруппы VL каппа I консенсусных последовательностей каркасного участка, или представляют собой последовательности, выделенные из подгруппы VH VII и/или из подгруппы VL каппа I консенсусных последовательностей каркасного участка.
В одном варианте осуществления матрица человеческого каркасного участка, используемая для получения антитела к фактору D, может включать последовательности каркасного участка из матрицы, включающие комбинацию VI-4.1 b+ (семейство VH7) и JH4d для VH цепи (фиг.3) и/или комбинацию DPK4 (семейство VκI) и JK2 для VL цепи (фиг.4).
Таким образом, акцепторный человеческий каркасный участок VH может включать одну, две, три или все из следующих последовательностей каркасного участка: FR1, включающий QX1QLVQSGX2ELKKPGASVKVSCKAS (аминокислоты 1-25 последовательности SEQ ID NO: 27), где X1 представляет собой I или V, X2 представляет собой P или S; FR2, включающий WVX3QAPGQGLE (аминокислоты 36-46 последовательности SEQ ID NO: 27), где X3 представляет собой K или R; FR3, включающий RFVFSLDTSVSTAYLQISSLKAEDTAX4YYCX5R (аминокислоты 67-98 последовательности SEQ ID NO: 27), где X4 представляет собой T или V, X5 представляет собой E или A; FR4, включающий WGQGTLVTVSS (аминокислоты 105-115 последовательности SEQ ID NO: 8 или аминокислоты 105-115 последовательности SEQ ID NO: 27).
Примеры консенсусных каркасных участков VH включают:
подгруппу VH I консенсусной последовательности человеческого каркасного участка без участков CDR по Kabat (SEQ ID NO: 28);
подгруппу VH I консенсусной последовательности человеческого каркасного участка без протяженных гипервариабельных участков (SEQ ID NO: 29-31);
подгруппу VH II консенсусной последовательности человеческого каркасного участка без участков CDR по Kabat (SEQ ID NO: 32);
подгруппу VH II консенсусной последовательности человеческого каркасного участка без протяженных гипервариабельных участков (SEQ ID NO: 33-35);
подгруппу VH III консенсусной последовательности человеческого каркасного участка без участков CDR по Kabat (SEQ ID NO: 36);
подгруппу VH III консенсусной последовательности человеческого каркасного участка без протяженных гипервариабельных участков (SEQ ID NO: 37-39);
подгруппу VH VII консенсусной последовательности человеческого каркасного участка без участков CDR по Kabat (SEQ ID NO: 55);
подгруппу VH VII консенсусной последовательности человеческого каркасного участка без протяженных гипервариабельных участков (SEQ ID NO: 56-58);
акцепторный человеческий каркасный участок VH без участков CDR по Kabat (SEQ ID NO: 40);
акцепторный человеческий каркасный участок VH без протяженных гипервариабельных участков (SEQ ID NO: 41-42);
акцепторный человеческий каркасный участок VH 2 без участков CDR по Kabat (SEQ ID NO: 43); или акцепторный человеческий каркасный участок VH 2 без протяженных гипервариабельных участков (SEQ ID NO: 44-45).
В одном варианте осуществления акцепторный человеческий каркасный участок VH включает одну, две, три или все из следующих последовательностей каркасного участка:
FR1, включающий QVQLVQSGPELKKPGASVKVSCKAS (аминокислоты 1-25 последовательности SEQ ID NO: 8),
FR2, включающий WVRQAPGQGLE (аминокислоты 36-46 последовательности SEQ ID NO: 8),
FR3, включающий RFVFSLDTSVSTAYLQISSLKAEDTAVYYCER (аминокислоты 67-98 последовательности SEQ ID NO: 8),
RFVFSLDTSVSTAYLQISSLKAEDTAVYYCE (аминокислоты 67-97 последовательности SEQ ID NO: 8),
RFVFSLDTSVSTAYLQISSLKAEDTAVYYC (аминокислоты 67-96 последовательности SEQ ID NO: 8),
RFVFSLDTSVSTAYLQISSLKAEDTAVYYCS (SEQ ID NO: 51) или
RFVFSLDTSVSTAYLQISSLKAEDTAVYYCSR (SEQ ID NO: 52);
FR4, включающий WGQGTLVTVSS (аминокислоты 105-115 последовательности SEQ ID NO: 8 или аминокислоты 105-115 последовательности SEQ ID NO: 27).
Акцепторный человеческий каркасный участок VL может включать одну, две, три или все из следующих последовательностей каркасного участка:
FR1, включающий DIQX6TQSPSSLSX7SVGDRVTITC (аминокислоты 1-23 последовательности SEQ ID NO: 26), где X6 представляет собой V или M, X7 представляет собой M или A;
FR2, включающий WYQQKPGKX8PKLLIX9 (аминокислоты 35-49 последовательности SEQ ID NO: 26), где X8 представляет собой P или V, X9 представляет собой S или Y;
FR3, включающий GVPSRFSX10SGSGX11DFTLTISSLQPEDVATYYC (аминокислоты 57-88 последовательности SEQ ID NO: 26), где X10 представляет собой S или G, X11 представляет собой A или T;
FR4, включающий FGQGTKX12EIK (SEQ ID NO: 54), где X12 представляет собой V или L.
Примеры консенсусных последовательностей каркасных участков VL включают:
подгруппу VL каппа I консенсусной последовательности человеческого каркасного участка (SEQ ID NO: 47);
подгруппу VL каппа II консенсусной последовательности человеческого каркасного участка (SEQ ID NO: 48);
подгруппу VL каппа III консенсусной последовательности человеческого каркасного участка (SEQ ID NO: 49); или
подгруппу VL каппа IV консенсусной последовательности человеческого каркасного участка (SEQ ID NO: 50).
В одном варианте осуществления акцепторная последовательность человеческого каркасного участка может включать одну, две, три или все из следующих последовательностей каркасного участка:
FR1, включающий DIQVTQSPSSLSASVGDRVTITC (аминокислоты 1-23 последовательности SEQ ID NO: 7),
FR2, включающий WYQQKPGKVPKLLIS (аминокислоты 35-49 последовательности SEQ ID NO: 7),
FR3, включающий GVPSRFSGSGSGTDFTLTISSLQPEDVATYYC (аминокислоты 57-88 последовательности SEQ ID NO: 7),
FR4, включающий FGQGTKLEIK (аминокислоты 98-107 последовательности SEQ ID NO: 7) или FGQGTKVEIK (SEQ ID NO: 53).
В то время как акцепторная последовательность может быть идентична выбранной последовательности человеческого каркасного участка или той, которая из человеческого иммуноглобулина, или той, которая из консенсусной последовательности человеческого каркасного участка, в настоящем изобретении предполагается, что акцепторная последовател