Новые производные гемина с антибактериальной и противовирусной активностью
Иллюстрации
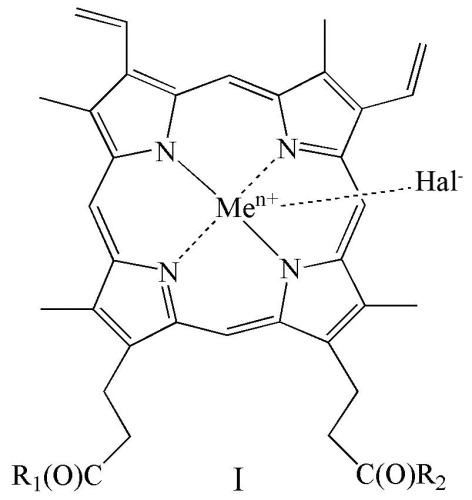
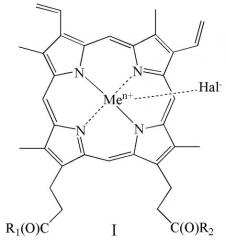
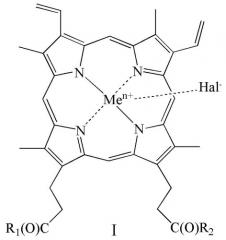
Показать всеИзобретение относится к новым производным гемина общей формулы (I)
где R1 и R2 оба представляют собой ArgNH2, Arg(NO2)OMe, GlyNH2, SerNH2, SerOH, GlyOH, Glu(OH)OH, Glu(ArgNH2)ArgNH2, Glu(SerOMe)SerOMe, Glu(NHCH2CH2OH)NHCH2CH2OH, Glu(SerNH2)SerNH2, Glu(GlyNH2)GlyNH2 или Glu(GlyOMe)GlyOMe; Men+ представляет собой Fe2+ или Fe3+; Hal- представляет собой F-, Cl-, Br- или I-, или его фармацевтически приемлемой соли. Также предложены фармацевтическая композиция, лекарственное средство, способ получения соединения общей формулы (I) (варианты). Предлагаемые в настоящем изобретении новые производные гемина обладают повышенными водорастворимостью, антибактериальной и противовирусной активностью, при отсутствии токсичности. 5 н. и 23 з.п. ф-лы, 1 ил., 4 табл., 18 пр.
Реферат
Область техники
Изобретение относится к области биоорганической химии и направлено на получение новых производных гемина и на разработку антибактериальных и противовирусных средств и композиций на их основе.
Уровень техники
Как известно, многие опасные заболевания человека и животных вызываются бактериями и вирусами. Бактерии вызывают такие заболевания эпидемического характера, как холера, брюшной тиф, паратифы, чума, дифтерия, туляремия, бруцеллез, а также туберкулез, заражение крови (сепсис), проказа, сифилис и др. У животных бактерии вызывают сап, сибирскую язву, туберкулез и др. Борьба с бактериями основывается на применении антибактериальных средств, в том числе антибиотиков. Однако многие известные средства обладают рядом недостатков, такими как токсичность, чувствительность к действию протеолитических ферментов, гемолитический эффект, недостаточная широта антибактериального действия. Очень серьезную проблему представляет постоянное появление резистентных штаммов, т.е. штаммов, устойчивых к действию известных антибактериальных средств. Так, например, на сегодняшний день большую опасность представляет метициллинрезистентный стафилококк (MRSA), который устойчив к большой группе антибиотиков - бета-лактамов. Метициллинрезистентный стафилококк вызывает трудновылечиваемые заболевания у людей, такие как заболевания крови, пневмонии. Он адаптировался к выживанию в присутствии метициллина, диклоксацина и оксациллина. Наиболее часто именно с ним связаны внутрибольничные (нозокомиальные) инфекции. От метициллинрезистентной стафилококковой инфекции умирает около 18000 американцев ежегодно.
Поэтому проблема поиска новых антибактериальных средств, в том числе, активных в отношении резистентных штаммов, не теряет своей актуальности.
Вирусы также являются причиной различных заболеваний, таких как грипп, ОРВИ, вирусные гепатиты и др. Вирусы простого герпеса - наиболее известные представители герпесвирусов (семейство Herpesviridae), так как вызывают поражения практически у каждого человека. Имеются две разновидности вируса простого герпеса - ВПГ-1 (лабиальный герпес) и ВПГ-2 (генитальный герпес). Вирусы герпеса могут вызывать поражение нервной системы, глаз и внутренних органов. В США герпес - самая частая из причин острого вирусного энцефалита. Более чем в 95% случаев возбудителем герпетического энцефалита служит вирус простого герпеса типа 1. Широко известным средством борьбы с вирусами герпеса является ацикловир. Однако, поскольку в настоящее время уже существуют резистентные к ацикловиру штаммы вируса герпеса, то поиск новых противогерпетических агентов является весьма актуальным.
Известно, что гемин обладает антимикробной активностью в отношении золотистого стафилококка [Y.Nitzan, H.Ladan, S.Gozansky, Z.Malik. Characterization of hemin antibacterial action on Staphylococcus aureus // FEMS Microbiol. Lett., 1987, V.48 (3), p.401-406]. Однако использование гемина в качестве антибактериального средства затруднено вследствие его нерастворимости в воде, гемолитической активности, а также кратковременности антибактериального эффекта.
Ранее предпринимались попытки модификации гемина путем его конъюгации с аминокислотами, пептидами и их производными с целью создания биологически активных производных. В результате модификации карбоксильных групп гемина путем получения соответствующих амидов были получены и исследованы соединения общей формулы (I),
где R1 и R2, одинаковые или различные, представляют собой -ОН или остаток аминокислоты или пептида, причем R1 и R2 не могут одновременно обозначать -ОН. Men+ представляет собой Fe2+ или Fe3+; Hal- представляет собой F-, Cl-, Br- или I- [патент RU №2250906, опубликованный 27.04.2005]. У этих производных были выявлены разные виды биологической активности, включая нуклеазную [Патент RU №2404191, опубликованный 20.11.2010], [Патент RU №2250906, опубликованный 27.04.2005], пероксидазную, каталитическую [Патент RU №2404191, опубликованный 20.11.2010] и вирулицидную [Патент RU №2404191, опубликованный 20.11.2010]
Среди синтезированных ранее авторами изобретения производных гемина формулы (1) был выявлен ряд конкретных соединений, обладающих антимикробной (в том числе антибактериальной) активностью. [Патент RU 2415868 C1, опубликованный 10.04.2011]. Эти соединения представляют собой, в основном, конъюгаты гемина с эфирами аминокислот и антимикробными пептидами, где, в частности, для производных гемина с R1=R2=-GlyOMe, R1=R2=-NHCH2CH2OH, SerOMe или -Glu(ArgOMe)-ArgOMe была обнаружена антибактериальная активность. Однако лишь небольшое число производных гемина проявило активность в отношении резистентных штаммов бактерий, к тому же эти соединения были плохо растворимы в воде, а их активность была не слишком высока.
В настоящее время обнаружены новые производные гемина, обладающие антибактериальным и противовирусным действием, которые обладают улучшенными свойствами, в частности проявляют активность в отношении штаммов MRSA.
Сущность изобретения
Настоящее изобретение относится к новым производным гемина общей формулы (I)
,
где R1 и R2 оба представляют собой ArgNH2, Arg(NO2)OMe, GlyNH2, SerNH2, SerOH, GlyOH, Glu(OH)OH, Glu(ArgNH2)ArgNH2, Glu(SerOMe)SerOMe, Glu(NHCH2CH2OH)NHCH2CH2OH, Glu(SerNH2)SerNH2, Glu(GlyNH2)GlyNH2, Glu(GlyOMe)GlyOMe, Men+ представляет собой Fe2+ или Fe3+; Hal- представляет собой F-, Cl-, Br- или I-,
или их фармацевтически приемлемым солям.
Кроме того, изобретение относится к фармацевтической композиции на основе указанных соединений и к применению указанных соединений для получения лекарственных средств, обладающих антибактериальной и/или противовирусной активностью.
Краткое описание фигур чертежей
На фиг.1 приведено сравнение CLogP заявляемых и известных ранее соединений общей формулы 1.
Подробное описание изобретения
Авторы настоящего изобретения обнаружили, что новые соединения приведенной выше формулы (I) являются более эффективными по сравнению с ранее описанными аналогами.
Преимуществами новых производных гемина формулы (I) являются их большая водорастворимость, а также высокая антибактериальная эффективность, в том числе против резистентных штаммов.
Отличие новых заявляемых соединений от ранее известных - активность против опасных резистентных штаммов грамположительных бактерий St.aureus №5 и MRSA St.aureus №3797 MRSA и грамотрицательных E.coli 4300. Неожиданно оказалось, что производные гемина общей формулы I, имеющие в составе заместителей незащищенный карбоксил или соответствующий амид, проявляют более высокую активность против бактерий. Так, соединения II, IV, X проявили при прочих равных условиях более высокую антибактериальную активность, чем соответствующие сложные эфиры, описанные в патенте RU 2415868 C1, опубликованном 10.04.2011.
При этом токсичность новых соединений осталась невысокой. Следует отметить, что вещества, содержащие амидированный карбоксил, лучше растворимы в воде, нежели их аналоги, содержащие карбоксильную или сложноэфирную группировку. По-видимому, это связано с большей гидрофильностью заместителей этих соединений, характеризуемой коэффициентами распределения октанол-вода.
В настоящей работе были получены и исследованы следующие новые соединения формулы (I):
Соединение (II): R1=R2=-ArgNH2;
Соединение (III): R1=R2=-Arg(NO2)OMe;
Соединение (IV): R1=R2=-GlyNH2;
Соединение (V): R1=R2=-SerNH2 ;
Соединение (VI): R1=R2=-SerOH;
Соединение (VII): R1=R2=-GlyOH;
Соединение (VIII): R1=R2=-Glu(OH)OH;
Соединение (IX): R1=R2=-Glu(ArgNH2)ArgNH2;
Соединение (X): R1=R2=-Glu(SerOMe)SerOMe;
Соединение (XI): R1=R2=-Glu(NHCH2CH2OH)NHCH2CH2OH;
Соединение (XII): R1=R2=-Glu(SerNH2)SerNH2;
Соединение (XIII): R1=R2=-Glu(GlyNH2)GlyNH2;
Соединение (XIV): R1=R2=-Glu(GlyOMe)GlyOMe,
Все аминокислоты, входящие в состав производных гемина, представляют собой L-аминокислоты, если не указано иное.
Соединения формулы (I) могут быть использованы как в виде солей с фармацевтически приемлемыми кислотами, например молочной, винной, лимонной, хлористоводородной и др., так и в виде солей по карбоксильным группам с ионами щелочных и щелочноземельных металлов, таких как натрий, калий, кальций, или, например, с фармацевтически приемлемыми основаниями, такими как аммиак, этаноламин.
Представленные выше соединения формулы (I) проявляют активность против бактерий, таких как бактерии рода Staphylococcus (например, Staphylococcus aureus), Bacillus (например, Bacillus subtilis), Enterococcus (например, Enterococcus faecalis), Micrococcus (например, Micrococcus luteus) и Escherichia (например, Escherichia coli) в том числе резистентных, т.е. обладающих устойчивостью к действию известных антибактериальных средств. Предпочтительно, указанные бактерии относятся к штаммам Bacillus subtilis BKM B-501, Staphylococcus aureus 209P, Enterococcus faecalis ВКМ В-871 или Micrococcus luteus ВКМ Ac-2230. Еще более предпочтительно, указанные соединения проявляют антибактериальную активность против резистентных штаммов Staphylococcus aureus №25923 ATCC, Staphylococcus aureus №100 KC, Staphylococcus aureus №5 MRSA, Staphylococcus aureus №3797 MRSA, Staphylococcus epidermidis №533, Enterococcus faecalis №559, Enterococcus faecium №569 или Escherichia coli 4300.
Кроме того, соединения по изобретению обладают противовирусной активностью, в частности в отношении вирусов герпеса, таких как вирусы герпеса простого 1 и/или 2 типа. Предпочтительно, соединения по изобретению обладают активностью в отношении вирусов герпеса простого 1 типа, штамм EC, и/или 2 типа, штамм G (ATCC № VR-734).
Указанные выше соединения формулы (I) и/или их соли могут быть использованы в качестве активных ингредиентов в фармацевтических композициях (например, в твердой, полутвердой или жидкой формах) в смеси с органическим или неорганическим носителем или наполнителем.
Активный ингредиент может быть включен в композицию вместе с обычно используемыми нетоксичными, фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток, пилюль, капсул, суппозиториев, эмульсий, суспензий, спреев, ингаляторов, капель, мазей и любых других лекарственных форм. В качестве носителей могут быть использованы вода, глюкоза, лактоза, аравийская камедь, желатин, крахмал, триксилит магния, тальк, кукурузный крахмал, мочевина, полиэтиленгликоль и другие носители, пригодные для изготовления твердых, мягких или жидких препаратов. При этом в качестве добавок могут быть использованы стабилизаторы, загустители, красители и отдушки.
Соединение формулы I вводят в композицию в эффективном количестве, достаточном для получения антибактериального и/или противовирусного эффекта.
При изготовлении разовой лекарственной формы количество активного ингредиента, используемого в комбинации с носителем, может варьировать в зависимости от реципиента, подвергающегося лечению, от конкретного способа введения лекарственного средства.
Так, например, при использовании соединений настоящего изобретения в виде растворов для инъекций содержание действующего начала в них составляет 0,001-1 мас.%. В качестве разбавителя вещества могут быть использованы 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина для инъекций, раствор Рингера, раствор глюкозы. При использовании соединения общей формулы (I) в виде таблеток и суппозиториев количество вещества составляет 1,0-100,0 мг на единичную дозированную форму. Для таблеток и суппозиториев в качестве фармацевтического наполнителя используют любую фармацевтически пригодную основу.
Поскольку соединения общей формулы (I) являются как водорастворимыми, так и липофильными, то они могут применяться в виде водных растворов, спиртовых растворов, мазей, кремов и т.д.
Далее, изобретение относится к антибактериальному и противовирусному лекарственному средству на основе указанных выше соединений формулы (I), а также к способу лечения заболеваний, вызываемых указанными выше бактериями и/или вирусами, включающему введение нуждающемуся в этом пациенту указанного выше соединения формулы (I) или фармацевтической композиции на его основе.
Способ лечения предназначен для пациентов-млекопитающих, в том числе людей. Рекомендуемые дозы соединения формулы (I) составляют 0,01-10 мг/кг.
Поскольку соединения формулы (I) обладают антибактериальной и противовирусной активностью, они могут также использоваться в качестве или в составе антисептических и/или дезинфицирующих средств. Такие средства могут быть изготовлены, например, в виде растворов с использованием различных растворителей, таких как вода и низшие спирты (например, 1-пропанол или 2-пропанол).
Еще один аспект изобретения относится к способу получения описанных выше новых соединений формулы (I).
Соединения формулы (I) получают путем взаимодействия активированного по карбоксильным группам производного гемина с аминокомпонентом с применением стандартных методов пептидного синтеза.
В качестве аминокомпонентов используют пептиды, аминокислоты (в основном, α-аминокислоты) или их аналоги, в частности, ArgNH2, Arg(NO2)OMe, GlyNH2, SerNH2, SerOH, GlyOH, Glu(OH)OH, NH2CH2CH2OH, GlyOMe и SerOMe. Реакцию проводят в растворителе, предпочтительно в DMF.
Предпочтительно, аминогруппы аминокомпонентов (например, α-аминогруппы карбоксилзащищенных аминокислот) ацилируют бис-N-оксисукцинимидным эфиром гемина. Реакции проводят в DMF в течение 0,5-2 часов, при температуре от -15° до +30°С, с применением триэтиламина. Подобные реакции с незащищенными аминокислотами проводят в DMF в присутствии триэтиламина и до 10% воды. Кроме того, конъюгаты гемина с разветвленными пептидами получают с помощью прямого присоединения защищенных по СООН группе производных аминокислот и пептидов к конъюгату гемина с глутаминовой кислотой в присутствии конденсирующего агента TBTU.
Таким образом, предлагаются новые эффективные антибактериальные и противовирусные средства на основе производных гемина. Их преимуществами являются биосовместимость, биодеградируемость, повышенная активность в отношении резистентных штаммов бактерий, низкая токсичность и отсутствие побочных эффектов, что делает их перспективными для применения в качестве лекарственных средств.
Изобретение далее иллюстрируется с помощью примеров, которые не предназначены для ограничения его объема.
Список сокращений
ВПГ-1 - вирус простого герпеса 1 типа
ВПГ-2 - вирус простого герпеса 2 типа
ИК - инфракрасная спектроскопия
ИР - ингибирование роста
МБК - минимальная бактерицидная концентрация
МИК - минимальная ингибирующая концентрация
ПАВ - поверхностно-активные вещества
ТСХ - тонкослойная хроматография
ХЛФ - хлороформ
ЦПД - цитопатогенное действие
А - оптическая плотность
DMF - диметилформамид
DMSO - диметилсульфоксид
Et3N - триэтиламин
MeOH - метиловый спирт
MH - среда Mueller-Hilton
MRSA - метициллин-резистентный Staphylococcus aureus
OMe - метиловый эфир
PEG - полиэтиленгликоль
TBTU - 2-/1H-бензотриазол-1-ил/-1,1,3,3-тетраметилуронийтетрафторборат
TCID50 - тканевая цитопатогенная доза, вызывающая гибель 50% клеток монослоя.
Следующие примеры иллюстрируют предлагаемое изобретение.
В работе использовались аминокислоты и их производные L-ряда, за исключением глицина, фирмы «Bachem» (Германия), «Reanal» (Венгрия), Et3N (Fluka, Германия). Все растворители безводные, за исключением тех, которые использовались для экстракции из водных растворов. Индивидуальность полученных соединений проверяли методом ТСХ на пластинах Kieselgel 60 F254 (Merck, Германия) в системах: хлороформ: метанол: уксусная кислота: вода 5:4:0,5:0,5 (1), хлороформ: метанол: уксусная кислота: вода 5:4:0,2:0,2 (2), хлороформ - метанол 9:1 (3). Хроматограммы проявляли хлор-толидиновым реактивом, по свечению в УФ-свете.
Масс-спектры высокого разрешения получали на время-пролетном масс-спектрометре «Ultraflex» («Bruker», Германия) методом матриксной лазерно-десорбционной ионизации (TOF MALDI), в качестве матрицы использовалась 2,5-дигидроксибензойная кислота.
ИК-спектры регистрировали на Фурье-спектрометре: «Magna 750» («Nicolet», США).
Электронные спектры снимали на спектрофотометре «Jasco» модель UV/VS 7800 (Япония).
Общая методика получения соединений II-V
К суспензии 0,26 ммоль аминокомпонента в 1,5 мл DMF прибавляли 0,033 мл (0,266 ммоль) Et3N и перемешивали при комнатной температуре 3 мин. К полученному раствору прибавляли раствор 0,100 г (0,118 ммоль) 6,7-бис-N-оксисукцинимидного эфира протогемина IX в 5 мл DMF и перемешивали 30 мин при комнатной температуре. Контроль за протеканием реакции осуществляли методом ТСХ в системе (3). Реакционную массу концентрировали в вакууме до объема 1 мл. Для нерастворимых в воде соединений III, IV и V к сконцентрированной реакционной массе добавляли 10 мл водного 0,01 М раствора соляной кислоты, осадок отделяли и промывали водой до нейтральной реакции. Осадок сушили в эксикаторе при пониженном давлении над хлоридом кальция в течение суток. Для водорастворимого соединения II к сконцентрированной реакционной массе добавляли 2,55 М раствор соляной кислоты в метаноле до достижения нейтральной реакции, затем добавляли 0,01 М раствор соляной кислоты в насыщенном водном растворе NaCl. Осадок отделяли и сушили в эксикаторе при пониженном давлении над хлоридом кальция в течение суток, затем растворяли в 1 мл безводного метанола и отфильтровывали нерастворившийся NaCl, после чего очищали с помощью гель-фильтрации на колонке 20×2 см, заполненной Sephadex LH20, элюируя метанолом. Содержащие целевой продукт фракции объединяли, растворитель удаляли в вакууме. Целевой продукт сушили в эксикаторе при пониженном давлении над хлоридом кальция в течение суток.
Пример 1
6,7-бис-(Амид N α -аргинил)-протогемин (IX) (II)
Выход 0,1020г (70%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1656 (амид I), 1534 (амид II). Масс-спектр (MALDI), m/z: 926 [M-Cl-]+. Электронный спектр, DMSO, λmax, нм, (ε·10-3): 403,8 (92,60), 499,2 (6,3643), 623,6 (1,553).
Пример 2
6,7-бис-(Метиловый эфир-N α -(N G -нитро)аргинил)-протогемин (IX) (III)
Выход 0,083 г (65 %), Rf 0,26 (1), 0,71 (2). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1737 (СО сл.эф.), 1648 (амид I), 1539 (амид II). Масс-спектр, m/z: [M]+ 1001 [M-NO2-Cl-] 956 [M-2NO2-Cl-]. Электронный спектр, DMSO, λmax, нм, (ε·10-3): 404 (1,163), 500,2 (0,986), 623,4 (0,540).
Пример 3
6,7-бис-(Амид N α -глицил)-протогемин (IX) (IV)
Выход 0.092 г (68%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1654 (амид I), 1536 (амид II). Масс-спектр (MALDI), m/z: 728 [M-Cl-]+. Электронный спектр, DMSO, λmax, нм, (ε·10-3): 402,0 (101,2), 504,2 (7,417), 628,6 (4,201).
Пример 4
6,7-бис-(Амид N α -серил)-протогемин (IX) (V)
Выход 0,105 г (72%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1651 (амид I), 1530 (амид II). Масс-спектр (MALDI), m/z: 788 [M-Cl-]+. Электронный спектр, DMSO, λmax, нм, (ε·10-3): 404,8 (207,12), 499,2 (6.547), 623,4 (3,603).
Общая методика получения соединений VI-VIII
К раствору или суспензии аминокислоты (0,945 ммоль) в 0,5 мл воды добавляли 0,130 мл (для серина и глицина) или 0,260 мл (для глутаминовой кислоты и дигидрохлоридов аргинина и гистидина) триэтиламина. Полученный раствор добавляли к 6,7-бис-N-оксисукцинимидного эфира гемина (100 мг, 0,118 ммоль) в 6 мл диметилформамида и перемешивали 30 мин. Реакционную массу концентрировали в вакууме до объема 1 мл. Для нерастворимых в воде соединений VI-VIII к сконцентрированной реакционной массе добавляли 10 мл водного 0,01 М раствора соляной кислоты, осадок отделяли и промывали водой до нейтральной реакции. Осадок сушили в эксикаторе при пониженном давлении над хлоридом кальция в течение суток.
Пример 5
6,7-бис-(N α -серил)-протогемин (IX) (VI)
Выход 84,7 мг (87%). ИК-спектр (KBr, νmax/см-1): 1727 (COOH), 1656 (C=O амид I), 1530 (C=O амид II). Масс-спектр (MALDI), m/z: 790 [M-Cl-]+. Электронный спектр, DMSO, λmax, нм, (ε·10-3): 403(188), 497 (8,51), 622 (4,49).
Пример 6
6,7-бис-(N α -глицил)-протогемин (IX) (VII)
Выход 77,7 мг (86%). ИК-спектр (KBr, νmax/см-1): 3294 (NH), 1724 (COOH), 1656 (C=O амид I), 1543 (C=O амид II). Масс-спектр (MALDI), m/z: 730,1 [M-Cl-]+. Электронный спектр, DMSO, λmax, нм, (ε·10-3): 404 (126), 498 (8,02), 622 (4,48).
Пример 7
6,7-бис-(N α -глутамил)-протогемин (IX) (VIII)
Выход 88 мг (82%). ИК- спектр (KBr, νmax/см-1): 3286 (NH), 172 (COOH), 1644 (C=O амид I), 1544 (C=O амид II). Масс-спектр (MALDI), m/z: 874 [M-Cl-]+. Электронный спектр, DMSO, λmax, нм, (ε·10-3): 404 (76,7), 496 (8,79), 615 (6,02).
Общая методика получения соединений IX-XIV
К 0,070 г (0,077 ммоль) 6,7-бис-Nα-глутамил-протогемина (IX) в 5 мл ДМФА добавляли 0,148 г (0,462 ммоль) TBTU и 0,086 мл (0,462 ммоль) Et3N. Реакционную смесь перемешивали в течение 30 мин. К суспензии 0,462 ммоль гидрохлорида аминокомпонента в 1,5 мл DMF прибавляли 0,086 мл (0,462 ммоль) Et3N и перемешивали при комнатной температуре 3 мин, после чего полученный раствор добавляли к раствору преактивированного 6,7-бис-Nα-глутамил-протогемина (IX). Реакционную массу перемешивали в течение суток, после чего концентрировали в вакууме до объема 1 мл. Для нерастворимых в воде соединений (XI и XIV) к сконцентрированной реакционной массе добавляли 10 мл водного 0,1 М раствора соляной кислоты, осадок отделяли и промывали водой до нейтральной реакции. Осадок сушили в эксикаторе при пониженном давлении над хлоридом кальция в течение суток. Для водорастворимых соединений (IX, X и XIII) к сконцентрированной реакционной массе добавляли 0,01 М раствора соляной кислоты в насыщенном водном растворе NaCl. Осадок отделяли и сушили в эксикаторе при пониженном давлении над хлоридом кальция в течение суток, затем растворяли в 1 мл безводного метанола и отфильтровывали нерастворившийся NaCl, после чего очищали с помощью гель-фильтрации на колонке 20×2 см, заполненной Sephadex LH20, элюируя метанолом. Содержащие целевой продукт фракции объединяли, растворитель удаляли в вакууме. Целевой продукт сушили в эксикаторе при пониженном давлении над хлоридом кальция в течение суток.
Пример 8
6,7-бис-[(Ди-амид N α -L-аргинил)-L-глутамил]-протогемин IX (IX)
Выход 0,082 г (71%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1658 (амид I), 1541 (амид II). Масс-спектр (MALDI), m/z: 1495 [M-Cl-]+ Электронный спектр, DMSO, λmax, нм, (ε·10-3): 396,8 (137,83), 505,6 (13,404), 623,2 (6,419).
Пример 9
6,7-бис-[(Ди-метиловый эфир N α -L-серил)-L-глутамил]-протогемин IX (X)
Выход 0,068 г (67%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1747 (СО сл.эф.), 1646 (амид I), 1542 (амид II). Масс-спектр (MALDI), m/z: 1313 [M-Cl-]+ Электронный спектр, DMSO, λmax, нм, (ε·10-3): 404,6 (124,25), 500 (7,434), 622,2 (4,032)
Пример 10
6,7-бис-[(Ди-2-гидроксиэтиламид)-L-глутамил]-протогемин IX (XI)
Выход 0,054 г (64%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1654 (амид I), 1547 (амид II). Масс-спектр (MALDI), m/z: 1046 [M-Cl-]+ Электронный спектр, DMSO, λmax, нм, (ε·10-3): 403,2 (107,83), 502,3 (9,041), 635,2 (6,591).
Пример 11
6,7-бис-[(Ди-амид N α -L-серил)-L-глутамил]-протогемин IX (XII)
Выход 0,074 г (76%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1651 (амид I), 1537 (амид II). Масс-спектр (MALDI), m/z: 1218 [M-Cl-]+ Электронный спектр, DMSO, λmax, нм, (ε·10-3): 398,6 (89,41), 497,4 (4,162), 619,4 (2,124).
Пример 12
6,7-бис-[(Ди-амид N α -L-глицил)-L-глутамил]-протогемин IX (XIII)
Выход 0,077 г (87%). ИК-Фурье спектр, ν, см-1, таблетка KBr: 1652 (амид I), 1539 (амид II). Масс-спектр (MALDI), m/z: 1098 [M-Cl-]+ Электронный спектр, DMSO, λmax, нм, (ε·10-3): 404,4 (88,0), 497,8 (5,184), 621,8 (2,728).
Пример 13
6,7-бис-[(Ди-метиловый эфир N α -L-глицил)-L-глутамил]-протогемин IX (XIV)
Выход 0,072 г (78%).ИК-Фурье спектр, ν, см-1, таблетка KBr: 1738 (СО сл.эф.), 1652 (амид I), 1535 (амид II). Масс-спектр (MALDI), m/z: 1158 [M-Cl-]+ Электронный спектр, DMSO, λmax, нм, (ε·10-3): 404,4 (88,0), 497,8 (5,184), 621,8 (2,728).
Пример 14
Гидрофильность соединений общей формулы (I)
C помощью программы ACDLabs 8.0 были вычислены коэффициенты распределения октанол/вода (CLogP) заявляемых соединений общей формулы I: II, IV, V, IX, X, XII, XIII, XIV, а также ранее известных соединений общей формулы I, где R1 и R2 представляют собой ArgOMe (XV), Glu(ArgOMe)ArgOMe (XVI), GlyOMe (XVII), SerOMe (XVIII) [Патент RU 2415868 C1, опубликованный 10.04.2011].
Из фиг. 1 видно, что замещение группы -OMe на NH2-группу приводит к увеличению гидрофильности производных гемина. Таким образом, новые заявляемые соединения общей формулы I обладают большей гидрофильностью, чем ранее известные.
Пример 15
Антибактериальная активность соединений общей формулы I, в том числе в отношении резистентных штаммов бактерий
Пример 15 (1)
Для определения антибактериальной активности веществ были использованы штаммы грамположительных бактерий Staphylococcus aureus 209P, Enterococcus faecalis ВКМ В-871, Micrococcus luteus ВКМ Ac-2230, Bacillus subtilis BKM B-501 и грамотрицательных бактерий Pseudomonas aeruginosa PAO1 и Escherichia coli КМ МГУ С-600. Штаммы с маркировкой ВКМ были получены из Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов РАН. Штамм Staphylococcus aureus 209P был получен из коллекции кафедры микробиологии биологического факультета МГУ им. М.В.Ломоносова, а Pseudomonas aeruginosa PAO1 - из коллекции микроорганизмов Института биоорганической химии РАН.
Основные параметры, которые характеризуют антибактериальную активность, - это минимальная ингибирующая концентрация (МИК) и минимальная бактерицидная концентрация (МБК). МИК - это наименьшая концентрация исследуемого соединения, полностью ингибирующая размножение бактерий в жидкой среде. МБК - это наименьшая концентрация, вызывающая гибель всех клеток.
МИК оценивали методом ингибирования роста культуры в жидкой среде с серийными разведениями веществ по модифицированной методике [Amsterdam, D. 1996. Susceptibility testing of antimicrobials in liquid media, p.52-111. In Loman, V., ed. Antibiotics in laboratory medicine, 4th ed. Williams and Wilkins, Baltimore].
Бактерии культивировали и тестирование проводили в жидкой среде МН (среда Mueller-Hinton: сухой экстракт говяжьего бульона 4 г/л, крахмал 1,5 г/л, гидролизат казеина 17,5 г/л; Sigma-Fluka каталожный номер 70192) при 37°C, 100% влажности и перемешивании. Для тестирования использовали культуру (с 4 по 7 пересев от разморозки) в экспоненциальной фазе роста.
Все исследуемые соединения поглощают свет на длине волны 595 нм, используемой для оценки роста бактериальной культуры. Поэтому при оценке оптической плотности суспензии бактерий учитывали поправку на поглощение каждого соединения с учетом его концентрации в лунке. Ингибирование роста (ИР) бактерий рассчитывали в процентах через 20 часов инкубации клеток с веществами по оптической плотности (А), измеряемой в каждой лунке на длине волны 595 нм, используя формулу:
| ИРi=[(Aкt-Aк0)-(Ait-Ai0)]×100/(Aкt-Aк0) | (1), |
где индекс i обозначает номер лунки, к - контрольная лунка с бактериями, в которую исследуемое соединение не вносится, 0 - измерение проводится сразу же после внесения исследуемого вещества в лунку, t - измерение через 20 часов после внесения вещества.
Для определения антибактериальной активности исследуемых соединений использовали следующий экспериментальный протокол. Криопробирку с культурой тестируемого штамма в среде с 7% DMSO, хранившуюся в жидком азоте, быстро размораживали, 100 мкл суспензии клеток добавляли к 1,5 мл свежей среды MH. Клетки растили в течение суток при температуре 37°С и перемешивании на орбитальном шейкере со скоростью 150 об/мин. Морфологические признаки штамма и отсутствие контаминации посторонними бактериями проверяли (а) путем посева на агаризованную (15 г/л агара) среду МН по форме и цвету образующихся колоний, (б) под микроскопом (Микмед-2, ЛОМО, Россия) с 40× объективом по характерным морфологическим признакам клеток. Далее бактерии культивировали в 1 мл жидкой среды МН при температуре 37°С и перемешивании. Клетки пересевали каждые сутки. Начиная с 3-его и заканчивая 6-м пересевом, культуру клеток использовали для постановки тестов.
Для постановки теста 5 мкл бактериальной суспензии в стационарной фазе роста переносили в 1 мл стерильной среды MH и инкубировали до достижения экспоненциальной фазы роста (3-5 ч, 37°С при перемешивании со скоростью 150 об/мин). Чтобы оценить концентрацию микроорганизмов, измеряли оптическую плотность (А) полученной бактериальной культуры на длине волны 595 нм. Считали, что А=0,2, измеренная от 200 мкл суспензии клеток в 96-луночном планшете с учетом поглощения среды, соответствует 4×108 клеток/мл для обоих используемых штаммов. С учетом измерения концентрации клеток суспензию разбавляли средой МН до 5×104-1×105 клеток/мл и переносили стерильный 96-луночный планшет по 100 мкл на лунку. Затем к клеткам вносили исследуемые соединения и делали серийные двукратные разведения этих соединений в лунках планшета. Максимальная концентрация веществ в серии составляла 10-4 М, минимальная - 1,6×10-6 М. Исследование антибактериальной активности выполняли в 2 повторах для каждого соединения, а результат усредняли.
В качестве контролей использовали: 100 мкл бактериальной культуры без добавления каких-либо веществ (4 лунки); бактериальная культура в которую добавлен 1% ДМСО или вода в объеме, как в лунках с максимальной концентрацией тестируемых соединений (4 лунки); 100 мкл стерильной среды MH без бактерий и без исследуемых веществ для контроля случайной контаминации в планшете (4 лунки).
Сразу после внесения соединений с помощью планшетного фотометра “Униплан” (Пикон, Россия) в каждой лунке измеряли Ai0, а в контрольных лунках - Ак0, необходимые для расчета по формуле (1). Планшет инкубировали в течение 20 ч при температуре 37°С и перемешивании со скоростью 150 об/мин. Затем в каждой лунке измеряли Ait, а в контрольных лунках - Akt и рассчитывали ингибирование роста бактерий по формуле (1). МИК определяли как минимальную концентрацию исследуемого соединения, при которой ингибирование роста составляет 100%.
Для определения МБК среду из лунок, где концентрация исследуемого соединения равнялась МИК, МИК×2 и МИК×4, переносили на чашки Петри с агаризованной средой МН (15 г/л агара) и равномерно растирали по площади чашек стерильными шпателями. Чашки инкубировали 2 суток. МБК определяли как наименьшую концентрацию исследуемого соединения, при которой колонии на чашке Петри не вырастают.
В таблице 1 в качестве соединений сравнения приведены ранее известные соединения общей формулы (I), в которых R1=R2=ArgOMe (XV), Glu(ArgOMe)ArgOMe (XVI), GlyOMe (XVII), SerOMe (XVIII) [Патент RU 2415868 C1, опубликованный 10.04.2011]. Таким образом, соединения II, III, IV, V, IX, X, XIV по изобретению подавляют рост грамположительных бактерий S.aureus в микромолярном интервале концентраций (таблица 1). Эти соединения также проявляют бактерицидную активность в концентрациях до 25 мкМ.
Бактерии M.luteus высокочувствительны даже в субмикромолярных концентрациях к действию всех соединений (в отдельных случаях МИК<0,8 мкМ).
Энтерококки E.faecalis в среднем более устойчивы к действию данных соединений, чем микрококки M.luteus и стафилококки S.aureus. Наиболее эффективными соединениями в отношении E.faecalis оказались II и V: МИК<7 мкМ.
Практически все исследованные соединения проявляют активность в отношении грамположительных бактерий B.Subtilis.
Пример 15.2
Для определения специфической активности веществ были также использованы штаммы Staphylococcus aureus №25923 ATCC (American Type Culture Collection); Staphylococcus aureus №100 KC; Staphylococcus epidermidis №533; Enterococcus faecalis №559; Enterococcus faecium №569, Staphylococcus aureus №5 (MRSA), Staphylococcus aureus №3797 (MRSA). Для культивирования Staphylococcus aureus использовали готовую сухую среду - Триптиказосоевый агар (Trypticase Soy Agar, BBL). Для культивирования Enterococcus faecalis использовали готовую сухую среду - Колумбийский агар (Columbia Agar Base, BBL). Среды стерилизовали автоклавированием при 121°С в течение 15 минут. Бактериальный инокулюм был постоянный и составлял 5×105 КОЕ/мл (105 КОЕ/0,2 мл). Для водорастворимых соединений с 2 по 8 лунки вносили растворитель (вода) по 15 мкл, затем в 1 лунку вносили 30 мкл стокового раствора исследуемого соединения в воде с концентрацией 1×103М и последовательным двукратным разведением доводили его концентрацию до 0,007×103М. Из каждой лунки отбирали по 10 мкл и добавляли по 190 мкл бактериальной культуры (105 КОЕ). Для растворимых в DMSO соединений с 2 по 8 лунки вносили растворитель (DMSO) по 10 мкл, затем в 1 лунку вносили 20 мкл стокового раствора исследуемого соединения в воде с концентрацией 5×103 М и последовательным двукратным разведением доводили его концентрацию до 0,039×103 М. Из каждой лунки отбирали по 2 мкл и добавляли по 198 мкл бактериальной культуры (105 КОЕ).
В качестве контроля включали лунки, не содержащие тестируемых препаратов (контроль роста культуры). Кроме того, ставился контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 36°С в течение 24 часов.
Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест - соединений с ростом культуры без них. За МИК принимали последнее разведение испытуемых препаратов с подавлением роста бактериальной культуры.
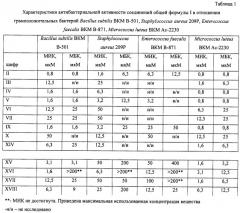
| Таблица 2Характеристики антибактериальной активности соединений общей формулы I в отношении грамположительных бактерий Staphylococcus aureus 25923, Staphylococcus aureus 100 KC, Staphylococcus epidermis 533, Enterococcus faecalis 559, ванкомицин-резистентного Enterococcus faecium 569 и грамотрицательных ванкомицин-резистентных бактерий Echerichia coli 4300 (МИК, мкМ) | ||||||
| S.aureus 25923 | S.aureus 100 KC | S.epidermis 533 | E.faecalis 559 | E.faecium 569 | E.coli 4300 | |
| II | 1,04 | 2,6 | 0,39 | 1,3 | 3,12 | 41,6 |
| IV | 0,39 | 0,39 | 1,56 | 0,39 | 50 | >50,0 |
| V | 0,78 | 0,52 | 1,56 | 25 | 25 | >50,0 |
| VI | 12,5 | 5,21 | 3,12 | >50,0 | >50,0 | >50,0 |
| VII | 2,6 | 12,5 | 6,25 | >50,0 | >50,0 | >50,0 |
| IX | 1,56 | 0,78 | 0,78 | 3,12 | 6,25 | 16,6 |
| XI | 0,39 | >50.0 | 6,25 | 33,3 | >50.0 | >50.0 |
| XIII | 12,5 | 12,5 | 12,5 | 12,5 | >50.0 | >50.0 |
| XIV | 0,39 | 2,6 | 1,04 | 3,12 | >50.0 | >50.0 |
| XV | 25 | 50 | 25 | 25 | >50 | >50 |
| XVII | 25 | >50 | 25 | 25 | >50 | >50 |
В таблице 2 в качестве соединений сравнения приведены ранее известные соединения общей формулы (I), в которых R1=R2=ArgOMe (XV) или GlyOMe (XVII) [Патент RU 2415868 C1, опубликованный 10.04.2011].
Новые соединения проявили активность в отношении грамположительных бактерий Staphylococcus aureus 25923, Staphylococcus aureus 100 KC и Staphylococcus epidermis 533, причем МИК не превышали 13 мкМ.
В отношении Enterococcus faecalis 559 соединения проявили несколько меньшую активность.
В отношении резистентных к ванкомицину бактерий Enterococcus faecium 569 оказались активными II (МИК=3,12 мкМ), IV (МИК=50 мкМ), V (МИК=25 мкМ), IX (МИК=6,25 мкМ).
В отношении грамотрицательных бактерий E.coli оказались активными II (МИК=41,6 мкМ) и IX (МИК=16,6 мкМ).
| Таблица 3Характеристики антибактериальной активности соединений общей формулы I в отношении метициллин-резистентных грамположительных бактерий Staphylococcus aureus №5, Staphylococcus aureus 3797 (МИК, мкМ) | ||
| St.aur №5 MRSA | St.aur №3797 MRSA | |
| II | 41 | 50 |
| III | 25 | 25 |
| IV | 3,12 | 3,12 |
| V | 1,56 | 1,56 |
| VI | 0,78 | 0,78 |
| VII | 6,25 | 6,25 |
| XI | 12,5 | 12,5 |
| XIII | 83 | 50 |
| XIV | 3,12 | 2,6 |
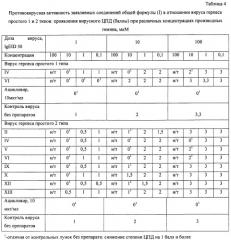
Как видно из таблицы 3, новые соединения проявили высокую антибактериальную активность в отношении MRSA-штаммов, при этом МПК лежали в интервале 0,78-13 мкМ.
Пример 16
Противовирусная активность производных гемина в отношении вирусов семейства Herpesviridae
Для исследований использовали вирус простого герпеса 1 типа (коллекция НИИ вирусологии, штамм EC), вирус простого герпеса 2 типа штамм G (ATCC #VR-734) и цитомегаловирус человека штамм AD169 (ATCC #VR-538). Вирусы простого герпеса 1 и 2 типов культивировали в клетках Vero. Клет