Штамм бактерий planomicrobium koreense 78k - продуцент сайт-специфической эндонуклеазы pkri
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и генной инженерии и касается штамма бактерий Planomicrobium koreense 78k. Предложенный штамм бактерий Planomicrobium koreense 78k выделен из почвы и обеспечивает получение сайт-специфической эндонуклеазы PkrI, узнающей и расщепляющей обе цепи нуклеотидной последовательности ДНК, которая содержит три или четыре С5-метилцитозиновых оснований в сайте узнавания 5′-GCNAGC-3′ с образованием однонуклеотидного 3′-выступающего конца. Штамм депонирован во Всероссийской Коллекции Промышленных микроорганизмов ФГУП ГосНИИгенетика под номером В-10627. Представленный штамм может быть использован для выделения новой сайт-специфической эндонуклеазы PkrI, которая может применяться при выявлении и расщеплении метилированных участков ДНК. 3 ил., 3 пр.
Реферат
Изобретение относится к биотехнологии и касается получения нового штамма, используемого для выделения новой сайт-специфической эндонуклеазы, узнающей и расщепляющей обе цепи метилированной нуклеотидной последовательности ДНК 5′-GCN↓GC-3′/3′-CG↓NCG-5′ при наличии в ней трех или четырех 5-метилцитозинов. Эндонуклеаза, обладающая данной специфичностью, может быть использована для сайт-специфического гидролиза ДНК, содержащей С5-метилцитозиновые основания.
К настоящему времени известны несколько сайт-специфических эндонуклеаз, узнающих и расщепляющих ДНК, только при наличии в сайте узнавания 5-метилцитозина.
Известен штамм Glacial ice bacterium I, продуцирующий эндонуклеазу GlaI, которая узнает и расщепляет метилированную нуклеотидную последовательность 5′-G(m5C)↓GC-3′, где m5C - С5-метилцитозин [1].
Известен штамм бактерии Bacillus simplex 23, продуцирующий сайт-специфическую эндонуклеазу BlsI, расщепляющую метилированную нуклеотидную последовательность 5′-GCNGC-3′ после центрального нуклеотида при наличии в этой последовательности двух 5-метилцитозинов нуклеотидную [2].
Недостатком данного штамма является то, что продуцируемая им сайт-специфическая эндонуклеаза расщепляет все последовательности 5′-GCNGC-3′ даже при наличии в ней хотя бы двух 5-метилцитозинов, что не позволяет ее использовать для сайт-специфического расщепления в ДНК только гиперметилированных узнаваемых последовательностей 5′-GCNGC-3′, в которых содержится только три или четыре 5-метилцитозина.
Известен штамм Bacillus subtilis T30 [3], продуцирующий сайт-специфическую эндонуклеазу BisI, которая узнает и расщепляет метилированную нуклеотидную последовательность 5′-GCNGC-3′, при наличии в сайте узнавания С5-метилцитозиновых оснований.
Недостатком известного штамма является то, что продуцируемая им эндонуклеаза рестрикции BisI не способна узнавать и расщеплять обе цепи метилированной нуклеотидной последовательности ДНК 5′-GC(m5C)GGC-3′/3′-CGG(m5C)CG-5′, где m5C - 5-метилцитозин.
Наиболее близким к заявляемому штамму - прототипом является штамм Glacial ice bacterium 24, продуцирующий эндонуклеазу рестрикции GluI, которая узнает последовательность нуклеотидов 5′-GCNGC-3′ и расщепляет ее перед центральным нуклеотидом (N) с образованием однонуклеотидного 5′-выступающего конца, если все цитозиновые основания узнаваемой последовательности метилированы в положении 5 (С5-метилцитозин) [4].
Недостатком известного штамма является то, что продуцируемая им сайт-специфическая эндонуклеаза Glul не может расщеплять узнаваемую последовательность 5′-GCNGC-3′ после центрального нуклеотида, а также не расщепляет эту последовательность при наличии в ней трех 5-метилцитозинов.
Технической задачей изобретения является получение бактериального штамма, продуцирующего сайт-специфическую эндонуклеазу, которая узнает и расщепляет обе цепи нуклеотидной последовательности ДНК 5′-GCNGC-3′ при наличии в ней трех или четырех 5-метилцитозинов с образованием однонуклеотидного 3′-выступающего конца.
Поставленная техническая задача достигается получением штамма Planomicrobium koreense 78k - продуцента сайт-специфической эндонуклеазы, узнающей и расщепляющей метилированную последовательность нуклеотидов:
5′-G(m5C) N↓G(m5C)-3′
3′-(m5C)G↓N(m5C)G-5′
где m5C - С5-метилцитозин. (Стрелками указаны позиции расщепления ДНК.)
Предлагаемый штамм выделен из природного материала (почвы) в результате целенаправленного систематического поиска.
Полученный штамм Planomicrobium koreense 78k депонирован во Всероссийской Коллекции Промышленных микроорганизмов ФГУП ГосНИИгенетика, а продуцируемая им сайт-специфическая эндонуклеаза названа PkrI.
Штамм Planomicrobium koreense 78k характеризуется следующими признаками.
Культурально-морфологические признаки. Клетки - грамположительные кокки, 1 мкм в диаметре, располагаются одиночно, в парах, тетрадах, неподвижные. При встряхивании в бульоне Лурия образуют гомогенную муть. На питательном агаре через 4 суток при 24°C образуют колонии около 1 мм, гладкие, блестящие, непрозрачные, розоватого оттенка.
Физиолого-биохимические признаки. Факультативные анаэробы. Каталазоположительные. Растут при температуре от 4 до 40°C.
Содержание Г+Ц в ДНК, равное 55%, определили по методу [5].
Штамм идентифицирован на основе анализа морфологических и биохимических свойств по определителю [6], продуцируемая заявляемым штаммом сайт-специфическая эндонуклеаза PkrI названа согласно номенклатуре [7].
Хранение штамма осуществляется в лиофильно высушенном состоянии или в растворе 30% глицерина при температуре -60°C.
Для культивирования штамма применяют среду следующего состава (г/л): пептон - 10, дрожжевой экстракт - 5, NaCl - 5. Культивирование проводят при 28°C с аэрацией до достижения стационарной стадии роста.
Выход целевого фермента составляет 100 ед/г сырой биомассы с концентрацией 4000 ед/мл.
Полученная сайт-специфическая эндонуклеаза PkrI характеризуется следующими свойствами:
1. Узнает и расщепляет метилированную последовательность нуклеотидов 5′-GCN↓GC-3′/3′-CG↓NCG-5′ при наличии в этой последовательности трех или четырех 5-метилцитозинов.
2. Не расщепляет вышеприведенную последовательность, не содержащую С5-метилцитозиновых оснований (неметилированную) или меньше трех 5-метилцитозинов.
3. Расщепляет связи после центрального нуклеотида в обеих цепях узнаваемой последовательности.
4. Оптимальная температура действия фермента 30-37°C.
5. Оптимальное значение рН для действия фермента 8,0-8,5.
6. Оптимальная концентрация соли при расщеплении ДНК 0-10 мМ NaCl.
7. Для проявления активности RotI требуются ионы Mg2+, оптимальная концентрация - 2-10 мМ.
Определяющим отличием предлагаемого штамма от штаммов-продуцентов сайт-специфических эндонуклеаз BlsI и GluI является то, что первый продуцирует сайт-специфическую эндонуклеазу, которая узнает и расщепляет обе цепи метилированной нуклеотидной последовательности ДНК 5′-GC∧NGC-3′ только при условии метилирования в узнаваемой последовательности больше трех цитозинов. Данное отличие от Blsl позволяет использовать эндонуклеазу PkrI для более крупноблочной фрагментации С5-метилированной ДНК, а отличие от Glul - для менее крупноблочной фрагментации С5-метилированной ДНК.
Таким образом, сайт-специфическая эндонуклеаза PkrI представляет собой новый, не имеющий аналогов фермент.
Поскольку предлагаемый штамм получен впервые и для выделения сайт-специфической эндонуклеазы, узнающей и расщепляющей вышеназванную последовательность нуклеотидов в указанной позиции никогда не использовался, можно сделать вывод о соответствии предлагаемого штамма критериям изобретения «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Выращивание штамма и выделение фермента.
Для получения биомассы клетки штамма-продуцента переносят на агаризованную среду ЛБ в чашку Петри и инкубируют в течение ночи при 28°C. Свежевыращенные колонии переносят стерильной бактериологической петлей в колбы, содержащие жидкую питательную среду ЛБ и культивируют на качалках при 28°C при перемешивании - 150 об/мин, до достижения стационарной фазы роста. Клетки осаждают центрифугированием при 5000 об/мин при 4°C. Выход биомассы составляет 5 г/л среды. Дезинтеграцию клеток, выделение и очистку фермента проводят по известной методике [8].
Пример 2. Сайт-специфический гидролиз С 5-метилированной плазмидной ДНК эндонуклеазой PkrI.
Расщепление ДНК проводят в оптимальных условиях (37°C, реакционный буфер - 10 мМ TrisHCl, рН 8.5, 10 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT) в течение 60 мин. Продукты расщепления плазмидной ДНК разделяют путем электрофореза в 1% агарозном геле.
В качестве субстратов для выявления специфичности расщепления используют различные метилированные и неметилировнные плазмидные и фаговые ДНК: фагов лямбда и Т7, pHspAI (содержит метилированные последовательности 5′-G(5mC)GC-3′/5′-G(5mC)GC-3′ [1]) и pFsp4HI2 (содержит метилированные последовательности 5′-G(5mC)NGC-3′/5′-G(5mC)NGC-3′ [4]), а также ДНК pUC19, предварительно модифицированную метилазой CviPI. Метилаза CviPI метилирует цитозины в положении С5 в последовательности 5′-GC-3′ [9].
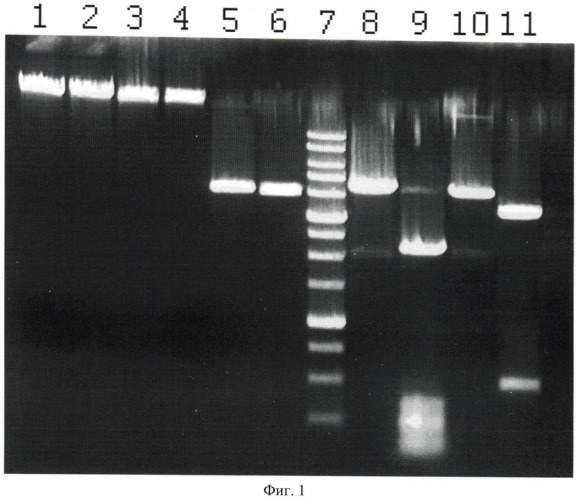
На фигуре 1 представлена электрофореграмма продуктов, образованных в результате обработки ДНК фагов лямбда и Т7, а также плазмид pHspAI и pFsp4HI2 эндонуклеазой PkrI.
Описание дорожек на электрофореграмме, изображенной на фиг.1:
1 - ДНК фага лямбда;
2 - ДНК фага лямбда, обработанная эндонуклеазой PkrI;
3 - ДНК фага Т7;
4 - ДНК фага Т7, обработанная эндонуклеазой PkrI;
5 - ДНК pHspAI,
6 - ДНК pHspAI, обработанная эндонуклеазой PkrI;
7 - маркер молекулярного веса ДНК 1 kb (производство НПО СибЭнзим);
8 - ДНК pFsp4HI2;
9 - ДНК pFsp4HI2, обработанная ВlsI;
10 - ДНК pFsp4HI2, обработанная GluI;
11 - ДНК pFsp4HI2, обработанная PkrI.
Как видно из фиг.1, эндонуклеаза PkrI не расщепляет неметилированные ДНК фагов лямбда и Т7, а также ДНК pHspAI, содержащую метилированные последовательности 5′-GCGC-3′. При этом PkrI расщепляет ДНК pFsp4HI2, давая хорошо видимый фрагмент в районе 450-500 п.н. (дорожка 11). Теоретические расчеты показывают, что в ДНК pFsp4HI2 имеются две последовательности 5′-GCNGCNGC-3′, расположенные друг от друга на расстоянии 484 п.н.. Последовательность 5′-GCNGCNGC-3′ содержит два сайта узнавания метилазы M.Fsp4HI, метилирующей первый цитозин в последоательности 5′-GCNGC-3′. Поэтому последовательность 5′-GCNGC-3′ в pFsp4HI2 должна содержать два 5-метилцитозина на обеих цепях сайта узнавания, a 5′-GCNGCNGC-3′ должна содержать три 5-метилцитозина: 5′-G(5mC)NG(5mC)NGC-3′/3′-CGN(5mC)GN(5mC)G-5′. Эта последовательность включает две последовательности 5′-GCNGC-3′ с тремя 5-метилцитозинами. Как показывают теоретические расчеты, в pFsp4HI2 имеются две последовательности с тремя 5-метилцитозинами (5′-G(5mC)NG(5mC)NGC-3′/3′-CGN(5mC)GN(5mC)G-5′), расположенные друг от друга на расстоянии 485 п.н., что соответствует электрофоретической подвижности фрагмента, образующегося при обработке pFsp4Ffl2 эндонуклеазой PkrI. Этот факт дает основание предположить, что эндонуклеаза PkrI узнает и расщепляет метилированную последовательность 5′-GCNGC-3′, содержащую три 5-метилцитозина. Как видно на фигуре 1, в отличие от PkrI эндонуклеаза BlsI эффективно расщепляет все метилированные последовательности 5′-GCNGC-3′, если в ней есть уже два 5-метилцитозина на обеих цепях (дорожка 6). В отличие от PkrI эндонуклеаза GluI не расщепляет последовательности 5′-GCNGC-3′ как с двумя, так и с тремя 5-метилцитозинами.
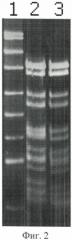
На фигуре 2 представлена электрофореграмма продуктов, образованных в результате обработки ДНК pUC19 эндонуклеазой рестрикции Fsp4HI, а также ДНК pUC19, предварительно метилированной метилазой CviPI и обработанной эндонуклеазой PkrI.
Описание дорожек на электрофореграмме, изображенной на фиг.2:
1 - ДНКрUС19, гидролизованная эндонуклеазой рестрикции MspI по сайту 5′-CCGG-3′, использованная в качестве маркера молекулярных весов;
2 - ДНКрUС19, гидролизованная эндонуклеазой рестрикции Fsp4HI по сайту 5′-GCNGC-3′;
3 - ДНК pUC19, предварительно метилированная метилазой CviPI и обработанная эндонуклеазой PkrI.
Как видно из фиг.2, электрофоретические подвижности фрагментов, образованных при гидролизе pUC19 по последовательности сайта узнавания рестриктазы Fsp4HI и при гидролизе эндонуклеазой PkrI плазмиды pUC19, предварительно метилированной по последовательности 5′-GC-3′, совпадают.
Этот факт означает, что при С5-метилировании ДНК по последовательности 5′-GC-3′ эндонуклеаза PkrI расщепляет метилированные последовательности 5′-G(5mC)NG(5mC)-3′/3′-(5mC)GN(5mC)G-5′, содержащие четыре 5-метилцитозина в узнаваемой последовательности.
Таким образом, сайт-специфическая эндонуклеаза PkrI узнает и расщепляет последовательность 5′-GCNGC-3′ только при наличии в ней трех или четырех 5-метилцитозинов.
Пример 3. Анализ сайт-специфичности и определение позиции гидролиза ДНК эндонуклеазой PkrI на олигонуклеотидных дуплексах.
Определение места гидролиза ДНК рестриктазой PkrI осуществляли путем сравнения длин фрагментов, образуемых при расщеплении эндонуклеазами рестрикции PkrI и BlsI олигонуклеотидного дуплекса D1/D2, образованного из олигонуклеотидов D1 и D2:
D1: 5′-GAGTTTAG(m5C)GG(m5C)TATCGATCC-3′
D2: 5′-GGATCGATAG(m5C)CG(m5)CTAAACTC-3′.
В качестве маркера длин фрагментов использовали продукты частичного расщепления этих же дуплексов экзонуклеазой ExoIII.
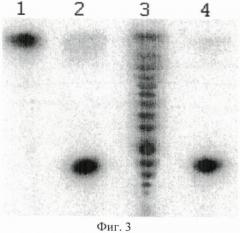
На фигуре 3 изображен радиоавтограф электрофореграммы продуктов расщепления дезоксирибоолигонуклеотидного радиоактивно меченного дуплекса D1/D2 в 20% полиакриламидном геле, содержащем 7-молярную мочевину.
Описание дорожек на электрофореграмме, изображенной на фиг.3:
1 - исходный дуплекс D1*/D2;
2 - дуплекс D1*/D2, обработанный эндонуклеазой PkrI;
3 - дуплекс D1*/D2, обработанный экзонуклеазой III из E.coli;
4 - дуплекс D1*/D2, обработанный эндонуклеазой BlsI.
Олигонуклеотиды, меченные радиоактивным фосфором 32Р по 5′-концу, обозначены знаком*.
Из фиг.3 видно, что продукты гидролиза ДНК дуплекса D1*/D2 на дорожках 2 и 4 имеют одинаковые длины. Это означает, что позиции гидролиза ферментами PkrI и BlsI совпадают.
На основе полученных результатов можно сделать вывод, что эндонуклеаза PkrI узнает и сайт-специфически расщепляет последовательность ДНК 5′-GCNGC-3′ после центрального нуклеотида при наличии в этой последовательности не менее трех 5-метилцитозинов.
Выход сайт-специфической эндонуклеазы PkrI определяют по электрофоретической картине расщепления ДНК pFsp4HI2. За единицу активности принимают минимальное количество фермента, необходимое для полного расщепления 1 мкг ДНК pFsp4HI2 за 1 час при температуре 37°C в объеме реакционной смеси 50 мкл. Выход фермента составляет 3000 ед/г сырой биомассы, концентрация 4000 ед/мл.
Фермент хранится при -20°C в буфере, содержащем 50% глицерин, 0,2 М NaCl, 10 мМ трисНС1 (рН 7,5), 7 мМ β-меркаптоэтанол, 0,1 мМ ЭДТА.
Таким образом, получен новый штамм, продуцирующий сайт-специфическую эндонуклеазу PkrI, узнающую и расщепляющую обе цепи нуклеотидной последовательности ДНК, которая содержит три или четыре С5-метилцитозиновых оснований в сайте узнавания 5'-GCNGC-3' с образованием однонуклеотидного 5'-выступающего конца.
Данная сайт-специфическая эндонуклеаза может быть использована в молекулярной биологии, биотехнологии и генной инженерии для сайт-специфического расщепления метилированной ДНК, в частности для выявления и анализа метилированной хромосомной ДНК млекопитающих и человека.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Чернухин В.А., Наякшина Т.Н., Абдурашитов М.А., Томилова Ю.Э., Мезенцева Н.В., Дедков B.C., Михненкова Н.А., Гончар Д.А., Дегтярев С.Х. // Новая эндонуклеаза рестрикции Glal узнает метилированную последовательность 5′-GCGC-3′. - Биотехнология. - 2006. - №4. - С.31-35.
2. Чернухин В.А., Томилова Ю.Э., Чмуж Е.В., Соколова О.О., Дедков B.C., Дегтярев С.Х. Сайт-специфическая эндонуклеаза BlsI узнает последовательности ДНК 5′-G(5mC)NGC-3′ и расщепляет ее с образованием 3′-выступающих концов // Вестник биотехнологии и физико-химической биологии имени Ю.А.Овчинникова. - 2007. - Т.3. - №1. - С.28-33.
3. Чмуж Е.В., Каширина Ю.Г., Томилова Ю.Э., Мезенцева Н.В., Дедков B.C., Гончар Д.А., Абдурашитов М.А., Дегтярев С.Х. Новая эндонуклеаза рестрикции BisI из Bacillus subtilis Т30 узнает метилированную последовательность ДНК 5′G(m5C)∧NGC-3′ // Биотехнология. - 2005. - №3. - С.22-26.
4. Чернухин В.А., Чмуж Е.В., Томилова Ю.Э., Наякшина Т.Н., Гончар Д.А., Дедков B.C., Дегтярев С.Х. Новая сайт-специфичесчкая эндонклеаза Glul узнает метилированную последовательность ДНК 5′-G(5mC)NG(5mC)-3′/3′-(5mC)GN(5mC)G-5′ // Вестник биотехнологии и физико-химической биологии имени Ю.А.Овчинникова. - 2007. - Т.3. - №2. - С.13-17.
5. Дедков B.C. Определение содержания G+C в ДНК бактерий при помощи эндонуклеаз рестрикции // Биотехнология. - 2004. - №4. - С.77-82.
6. Определитель бактерий Берджи. / Под ред. Дж. Хоулта и др. (9-е издание в 2 томах: Пер. с англ. под ред. акад. РАН Г.А.Заварзина). - М., 1997.
7. Smith H.O., Nathans D. A suggested nomenclature for bacterial host modification and restriction systems and their enzymes. // J. Mol. Biol. - 1973. - Vol.81. - P.419-423.
8. Bickle T.A., Pirrotta V. and Imber R. A simple, general procedure for purifying restriction endonucleases. // Nucleic Acids Res. - 1977. - V.4 - P.561-572.
9. Rebase official site http://rebase.neb.com/rebase/rebase.html
Штамм бактерий Planomicrobium koreense 78k, депонированный под №ВКПМ В-10627 во Всероссийской Коллекции Промышленных микроорганизмов ФГУП ГосНИИгенетика - продуцент сайт-специфической эндонуклеазы PkrI, узнающей и расщепляющей обе цепи нуклеотидной последовательности ДНК, которая содержит три или четыре С5-метилцитозиновых основания в сайте узнавания 5′-GCN∧GC-3′ с образованием однонуклеотидного 3′-выступающего конца.