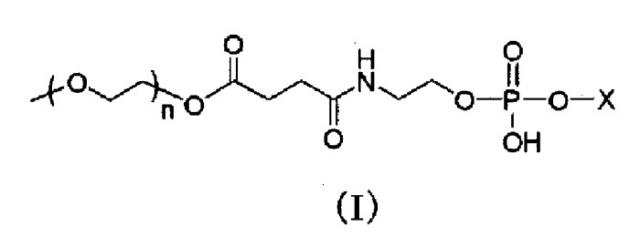
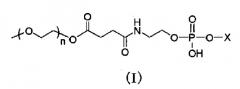
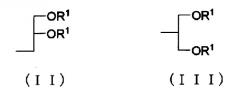Носитель лекарственного средства
Иллюстрации
Показать всеГруппа изобретений относится к фармакологии и касается циркулирующего носителя для лекарственного средства. Носитель содержит модифицированный полиэтиленгликолем фосфолипид, представленный общей формулой (I) или его фармацевтически приемлемой солью:
где Х представляет собой следующие (II) или (III); и n представляет собой целое число от 30 до 150,
где R1 представляет собой остаток насыщенной неразветвленной жирной кислоты, имеющей от 17 до 22 атомов углерода, и 2-O-(2-диэтиламиноэтил)карбамоил-1,3-O-диолеоилглицерин. При этом модифицированный полиэтиленгликолем фосфолипид содержится в количестве 30 - 50% мас. от общей массы липидов в носителе. Предложена также фармацевтическая композиция, содержащая вышеописанный носитель и лекарственное средство. Группа изобретений обеспечивает увеличение времени циркуляции и соответственно повышение эффективности лекарственного средства. 2 н. и 4 з.п. ф-лы, 19 ил., 5 табл., 49 пр.
Реферат
Область техники
Настоящее изобретение относится к новому длительно циркулирующему носителю лекарственного средства.
Предшествующий уровень техники
В последнее время внимание было сосредоточено на лекарственных средствах на основе нуклеиновых кислот, таких как синтетическая двухцепочечная РНК (такая как поли(I)-поли(C)), короткая интерферирующая РНК (миРНК), использующие РНК-интерференцию (РНКи), микроРНК (мкРНК), короткая шпилечная РНК (кшРНК), антисмысловая ДНК и антисмысловая РНК, которые интенсивно изучены. Такое лекарственное средство на основе нуклеиновой кислоты с трудом доставляется в ткань с участком повреждения, даже при системном введении лекарственного средства независимо в организм через, например, вену. Таким образом, для лекарственного средства на основе нуклеиновой кислоты требуется, например, введение после его включения в подходящий носитель или местное введение в ткань с участком поражения.
Примеры носителя лекарственного средства для доставки лекарственного средства на основе нуклеиновой кислоты в ткань с участком повреждения включают катионные липосомы, такие как ЛИПОФЕКТИН (зарегистрированный товарный знак), ЛИПОФЕКТАМИН 2000 (зарегистрированный товарный знак) и ОЛИГОФЕКТАМИН (зарегистрированный товарный знак), и катионная липосома (далее в настоящем документе обозначаемая как «липосома с соединением A»), содержащие в качестве обязательных компонентов 2-O-(2-диэтиламиноэтил)карбамоил-1,3-O-диолеоилглицерин (далее в настоящем документе обозначаемый как «соединение A») и фосфолипид (см., например, патентный документ 1). Так как подобные катионные липосомы имеют тенденцию легко накапливаться в печени и селезенке, при системном введении через, например, вену предполагается применение катионных липосом в качестве терапевтического средства для лечения злокачественной опухоли печени или гепатита посредством включения лекарственного средства на основе нуклеиновой кислоты в катионные липосомы. В настоящее время описывают, что комплекс «липосомы с соединением A» и синтетической двухцепочечной РНК, такой как поли (I)-поли (C), является эффективным в лечении злокачественной опухоли печени или гепатита (см., например, патентный документ 2, патентный документ 3, непатентный документ 1 и непатентный документ 2).
Для накапливания в печени или т.п. в качестве носителя лекарственного средства на основе нуклеиновой кислоты пригодны катионные липосомы. Однако они не являются достаточными в качестве носителя для применения в доставке лекарственного средства на основе нуклеиновой кислоты в ткань, отличную от печени или селезенки (такую как легкие, почки, поджелудочная железа или сердце), а также для обеспечения продолжительной циркуляции в крови.
Описывают, что посредством модифицирования липида, составляющего липосому, модифицированную полиэтиленгликолем, снижают поглощение в ретикулоэндотелиальной системе и, таким образом, увеличивают способность к циркулированию в крови (см., например, непатентный документ 3).
Однако модифицированный полиэтиленгликолем липид с увеличением содержания липида может снижать эффективность лекарственного средства, включенного в липосому. Таким образом, важно добавлять минимальное количество липида, позволяющее обеспечивать способность к длительному циркулированию (см., например, патентный документ 4).
Описывают, что модифицированный полиэтиленгликолем дистеароилфосфатидилэтаноламин, в качестве компонента липосомы, обеспечивает наиболее продолжительное время циркуляции в количестве приблизительно 4 мол.% в общем количестве липидов, составляющих липосому (см., например, непатентный документ 3).
Между тем также описано, что модифицированный полиэтиленгликолем липид, дозированный в количестве приблизительно 10 или 15 мол.%, обеспечивает продолжительное время циркуляции (см., например, патентные документы 5 до 9). По патентным документам от 5 до 9, в зависимости от различия в структуре модифицированного полиэтиленгликолем липида, или катионного липида, подлежащих использованию в качестве компонента липосомы, изменяется полученный эффект удлинения времени циркуляции или степень проявления эффективности лекарственного средства.
Патентный документ 1: WO 94/19314 A1
Патентный документ 2: WO 99/20283 A1
Патентный документ 3: WO 99/48531 A1
Патентный документ 4: WO 2005/051351 A2
Патентный документ 5: WO 2006/074546 A1
Патентный документ 6: WO 2006/007712 A1
Патентный документ 7: WO 2005/120152 A2
Патентный документ 8: CA 2271582 A1
Патентный документ 9: US 2004/0166150 A1
Непатентный документ 1: Kazuko Hirabayashi, et al., Cancer Research, 1999, Vol. 59, pp. 4325-4333
Непатентный документ 2: Kazuko Hirabayashi, et al., Oncology Research, 1999, Vol. 11, pp.497-504
Непатентный документ 3: Tatsuhiro Ishida, et al., Riposomu Oyo no Shintenkai, 2005, June, pp. 528-538
Описание изобретения
Задачи, подлежащие решению посредством изобретения
Основной целью настоящего изобретения является получение носителя лекарственного средства, который представляет собой длительно циркулирующий носитель лекарственного средства, в основном содержащий модифицированный полиэтиленгликолем фосфолипид и соединение A, где модифицированный полиэтиленгликолем фосфолипид содержится в концентрации в пределах определенного диапазона, и получение фармацевтической композиции, содержащей носитель лекарственного средства, включающей лекарственное средство.
Средства решения задач
После проведения авторами изобретения интенсивных исследований они обнаружили, что в носителе лекарственного средства, который в качестве существенных компонентов содержит модифицированный полиэтиленгликолем фосфолипид с определенной структурой и соединение A, модифицированный полиэтиленгликолем фосфолипид в высокой концентрации от 30 до 50% мас. от общей массы липидов в носителе лекарственного средства придает носителю лекарственного средства способность к длительному циркулированию, и также позволяет лекарственному средству, включенному в носитель лекарственного средства, проявлять эффективность in vivo. Таким образом, настоящее изобретение завершено.
Настоящее изобретение включает, например, следующие изобретения, описанные в патентных документах 1 и 2.
1. Долго циркулирующий носитель лекарственного средства, включающий модифицированный полиэтиленгликолем фосфолипид, представленный следующей общей формулой (I) (далее, для краткости, обозначаемый в настоящем документе как «модифицированный PEG фосфолипид») или его фармацевтически приемлемую соль:
где X представляет собой следующие (II) или (III); и n представляет собой целое число от 30 до 150,
где R1 представляет собой остаток насыщенной неразветвленной жирной кислоты, имеющий от 17 до 22 атомов углерода, и соединение A, где модифицированный PEG фосфолипид, представленный общей формулой выше (I), содержится в количестве в пределах от 30 до 50% мас. от общей массы липидов в носителе лекарственного средства (далее в настоящем документе обозначаемый как «носитель по настоящему изобретению»).
2. Фармацевтическую композицию, содержащую носитель по настоящему изобретению, который включает лекарственное средство (далее в настоящем документе обозначаемую как «композиция по настоящему изобретению»).
Примеры остатка насыщенной неразветвленной жирной кислоты, имеющего от 17 до 22 атомов углерода, представляющего собой R1, включают стеароил, арахидоил и бегеноил. Среди них предпочтительным является остаток насыщенной неразветвленной жирной кислоты, имеющий от 17 до 20 атомов углерода, и более предпочтительным является стеароил.
n представляет собой целое число в пределах от 30 до 150, предпочтительно целое число в пределах от 30 до 100, более предпочтительно целое число в пределах от 30 до 65.
Фосфолипид, модифицированный PEG, можно использовать в виде свободной кислоты, как таковой, однако ее можно перевести традиционным способом в форму фармацевтически приемлемой соли и использовать.
Фармацевтически приемлемая соль конкретно не ограничена, но ее примеры включают натриевую соль и калиевую соль. Среди них особенно предпочтительной является натриевая соль.
Предпочтительные примеры модифицированного PEG фосфолипида включают 1,3-дистеароилглицеро-2-фосфатидил-N-(метоксиполиэтиленгликоль-сукцинил)этаноламин и N-(метоксиполиэтиленгликоль-сукцинил)дистеароилфосфатидилэтаноламин.
Краткое описание чертежей
[Фиг.1] На фиг.1 показан массовый спектр модифицированного PEG фосфолипида, синтезированного в примере получения 3.
[Фиг.2] На фиг.2 показан массовый спектр модифицированного PEG фосфолипида, использованного в примерах получения от 12 до 15.
[Фиг.3] На фиг.3 показано зависящее от времени изменение в способности к циркулированию в плазме. На вертикальной оси представлен коэффициент распределения (% дозы), а на горизонтальной оси представлен период времени после введения (час).
[Фиг.4] На фиг.4 показана способность к циркулированию в плазме, определенная через 24 часа после введения. На вертикальной оси показан коэффициент распределения (% дозы), а на горизонтальной оси представлено содержание использованного модифицированного PEG фосфолипида (% мас.).
[Фиг.5] На фиг.5 показана способность к циркулированию в плазме, определенная через 24 часа после введения. На вертикальной оси показан коэффициент распределения (% дозы), а на горизонтальной оси представлено содержание использованного модифицированного PEG фосфолипида (% мас.).
[Фиг.6] На фиг.6 показана способность к циркулированию в плазме. На вертикальной оси представлен коэффициент распределения (% от дозы), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.7] На фиг.7 показана способность к циркулированию в плазме. На вертикальной оси представлен коэффициент распределения (% дозы), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.8] На фиг.8 показана способность к доставке в печень. На вертикальной оси представлен коэффициент распределения (% дозы), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.9] На фиг.9 показана способность к доставке в селезенку. На вертикальной оси представлен коэффициент распределения (% дозы), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.10] На фиг.10 показана способность к доставке в легкие. На вертикальной оси представлен коэффициент распределения (% дозы), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.11] На фиг.11 показана способность к доставке в почки. На вертикальной оси представлен коэффициент распределения (% дозы), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.12] На фиг.12 показана способность к доставке в периферические ткани злокачественной опухоли. На вертикальной оси представлена концентрация носителя лекарственного средства (мкг/г), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.13] На фиг.13 показана способность к доставке в злокачественные узлы. На вертикальной оси представлена концентрация носителя лекарственного средства (мкг/г), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.14] На фиг.14 показана способность к доставке в плазму. На вертикальной оси представлена концентрация носителя лекарственного средства (мкг/г), а на горизонтальной оси представлен период времени после введения фармацевтической композиции (час).
[Фиг.15] На фиг.15 показано противоопухолевое действие. На вертикальной оси представлен объем опухоли (мм3), а на горизонтальной оси представлен период времени после имплантации злокачественных клеток.
[Фиг.16] На фиг.16 показано противоопухолевое действие в случае постоянного введения композиции по настоящему изобретению. На вертикальной оси представлен уровень выживаемости (%), а на горизонтальной оси представлен период выживаемости после имплантации злокачественных клеток (сутки).
[Фиг.17] На фиг.17 показано противоопухолевое действие в случае периодического введения композиции по настоящему изобретению. На вертикальной оси представлен уровень выживаемости в (%), а на горизонтальной оси представлен период выживаемости после имплантации злокачественных клеток (сутки).
[Фиг.18] На фиг.18 показано противоопухолевое действие. На вертикальной оси представлен уровень выживаемости (%), а на горизонтальной оси представлен период выживаемости после имплантации злокачественных клеток (сутки).
[Фиг.19] На фиг.19 показано противоопухолевое действие. На вертикальной оси показана масса поджелудочной железы (г).
Лучший способ осуществления изобретения
I. Способ получения модифицированного PEG фосфолипида
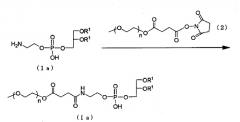
Модифицированный PEG фосфолипид (Ia), в котором X представлен формулой выше (II), можно получать, в присутствии подходящего основания, посредством взаимодействия аминового производного, представленного следующей общей формулой (1a), с производным PEG, представленным следующей общей формулой (2).
Растворитель, подлежащий использованию в реакции с производным PEG, представленным следующей общей формулой (2), конкретно не ограничивают при условии, что растворитель не участвует в реакции, и его примеры включают дихлорметан, диметоксиэтан и их жидкую смесь. Примеры основания включают триэтиламин, пиридин и водный раствор бикарбоната натрия. Температура реакции представлена, соответствующим образом, в пределах от 0°C до 50°C. Время реакции изменяется в зависимости от вида используемого исходного материала и температуры реакции. В основном, время реакции располагается, соответствующим образом, в пределах от 1 до 30 часов.
(В формуле n и R1 представляют собой то же, что определено выше).
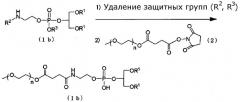
Модифицированный PEG фосфолипид (Ib), в котором X представлен формулой выше (III), можно получать, в присутствии подходящего основания, посредством удаления, общепринятым способом защитной группы (R2) для аминогруппы и защитной группы (R3) для фосфорной кислоты аминового производного, представленного следующей общей формулой (1b), и затем посредством взаимодействия аминового производного с производным PEG, представленным выше общей формулой (2).
Удаление защитных групп R2 и R3 можно выполнять одновременно или последовательно. Примеры реагента для удаления защитной группы R2 включают кислоты, такие как трифторуксусная кислота, уксусная кислота и соляная кислота. Примеры реагента для удаления защитной группы R3 включают жидкую смесь пиридина, триэтиламина и воды (3:1:1); раствор триэтиламина в ацетонитриле; 50% водно-диоксановый раствор пиридин-2-карбоксальдоксима и N1,N1,N3,N3-тетраметилгуанидина; и кислот, таких как трифторуксусная кислота, уксусная кислота и соляная кислота.
Растворитель, используемый в реакции с производным PEG, представленным общей формулой выше (2), конкретно не ограничен при условии, что он не участвует в реакции, и его примеры включают дихлорметан, диметоксиэтан и их жидкую смесь. Примеры основания включают триэтиламин, пиридин и жидкий раствор бикарбоната натрия. Температура реакции представлена, соответствующим образом, в пределах от 0°C до 50°C. Время реакции изменяется в зависимости от вида используемого исходного материала и температуры реакции. В основном, время реакции представлено, соответствующим образом, в пределах от 1 до 30 часов.
В формуле n и R1 представляют собой то же, что определено выше. R2 обозначает защитную группу для аминогруппы. Защитная группа конкретно не ограничена и ее примеры включают трет-бутилоксикарбонил и бензилоксикарбонил. R3 обозначает защитную группу для фосфорной кислоты. Защитная группа конкретно не ограничена и ее примеры включают метил, цианоэтил и трет-бутил.
Аминовое производное, представленное выше общей формулой (1a), можно получать по способу, описанному в документе (J. Am. Chem. Soc., 1993, 115, pp. 10487-10491), используя фосфатидилхолин, представленный следующей общей формулой (3), аминоэтанол, представленный следующей общей формулой (4), и фосфолипазу D.
(В формуле R1 представляет собой то же, что определено выше).
Аминовое производное, представленное выше общей формулой (1b), можно получать посредством взаимодействия соединения амидита, представленного общей формулой (5), с аминоэтанолом, представленным следующей общей формулой (6), в присутствии подходящего активатора, а затем окислением полученного продукта подходящим окислителем.
Примеры активатора включают тетразол и 5-фенил-1H-тетразол. Примеры окислителя включают йодный раствор (0,1 M йод / тетрагидрофуран:пиридин:вода = 7:1:2) и раствор трет-бутил гидропероксида. Температура реакции, соответствующим образом, представлена в пределах от 0°C до 50°C. Растворитель, подлежащий использованию, конкретно не ограничен, при условии, что растворитель не участвует в реакции, и его примеры включают ацетонитрил и дихлорметан. Время реакции изменяется в зависимости от вида исходного материала, подлежащего использованию, и температуры реакции. В основном, время реакции соответствующим образом представлено в пределах от 1 до 30 часов.
(В формуле R1, R2 и R3 представляют собой то же, что определено выше. R4 обозначает алкил. Алкил конкретно не ограничен, и его примеры включают метил, этил, н-пропил и изопропил).
Амидит, представленный выше общей формулой (5), можно получать преобразованием спирта, представленного следующей общей формулой (7), в амидит в присутствии подходящего активатора.
Примеры активатора включают диизопропиламмония тетразолид, тетразол, 5-фенил-1H-тетразол и диизопропилэтиламин. Примеры реагента, подлежащего использованию в преобразовании в амидит, включают бис(N,N-диизопропиламино)цианоэтилфосфит, 2-цианоэтил-N,N-диизопропилхлорфосфорамидит и трет-бутил тетраизопропилфосфорамидит. Растворитель, подлежащий использованию, конкретно не ограничен, при условии, что растворитель не участвует в реакции, и его примеры включают ацетонитрил и дихлорметан. Температура реакции, соответствующим образом, представлена в пределах от 0°C до 50°C. Время реакции изменяется в зависимости от вида исходного материала, подлежащего использованию, и температуры реакции. В основном, время реакции соответствующим образом представлено в пределах от 1 до 30 часов.
(В формуле R1, R2 и R3 представляют собой то же, что определено выше).
Спирт, представленный выше общей формулой (7), можно получать по способу, описанному в документе (например, The Journal of Organic Chemistry, 1970, vol. 35, pp. 2082-2083), используя димер дигидроксиацетона (8). Примеры конденсирующего средства включают N,N'-дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид и 1-гидроксибензотриазол. Примеры восстановителя включают натрия борогидрид.
(В формуле R1 представляет собой то же, что определено выше.)
II. Носитель по настоящему изобретению
Носитель по настоящему изобретению содержит модифицированный PEG фосфолипид и соединение A в качестве существенных компонентов. Конкретно, носитель по настоящему изобретению может приобретать форму липосомы, жировой эмульсии или им подобных. Примеры в форме липосомы включают многослойную и однослойную везикулу.
Соединение A можно синтезировать способом, описанным в WO 94/19314.
Количество в смеси модифицированного PEG фосфолипида в носителе по настоящему изобретению представлено, соответствующим образом, в пределах от 30% мас. до 50% мас., предпочтительно в пределах от 40% мас. до 50% мас. от общей массы липидов в носителе по настоящему изобретению.
Касаемо соотношения в смеси между модифицированным PEG фосфолипидом и соединением A в носителе по настоящему изобретению доля соединения A представлена, соответствующим образом, в пределах от 0,2 до 20 массовых частей на 1 массовую часть модифицированного PEG фосфолипида, предпочтительно в пределах от 0,5 до 10 массовых частей, более предпочтительно в пределах от 0,7 до 1,3 массовой части.
К носителю по настоящему изобретению, кроме модифицированного PEG фосфолипида и соединения A, которые являются существенными компонентами, дополнительно можно добавлять фосфолипид. Фосфолипид конкретно не ограничен, при условии, что он является фармацевтически приемлемым фосфолипидом, и его примеры включают фосфатидилхолин, фосфотидилэтаноламин, фосфатидилинозитол, фосфатидилсерин, сфингомиелин, лецитин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин и дипальмитоилфосфатидилглицерин. Их можно использовать отдельно или в комбинации из двух или более. Среди них особенно предпочтительными являются 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин, фосфатидилхолин и лецитин из бобов сои.
Что касается, в случае добавления такого фосфолипида, соотношения в смеси между модифицированным PEG фосфолипидом и фосфолипидом в носителе по настоящему изобретению, то фосфолипид соответствующим образом представлен в пределах от 0,03 до 100 массовых частей на 1 массовую часть модифицированного PEG фосфолипида, предпочтительно в пределах от 0,05 до 20 массовых частей, более предпочтительно в пределах от 0,2 до 1,1 массовой части.
К носителю по настоящему изобретению, кроме модифицированного PEG фосфолипида и соединения A, которые являются существенными компонентами, можно дополнительно добавлять холестерин. Что касается, в случае добавления холестерина, соотношения в смеси между модифицированным PEG фосфолипида и холестерином в носителе по настоящему изобретению, то холестерин соответствующим образом представлен в пределах от 0,01 до 200 массовых частей на 1 массовую часть модифицированного PEG фосфолипида, предпочтительно в пределах от 0,02 до 100 массовых частей.
Дисперсию носителя по настоящему изобретению можно получать смешиванием, например, модифицированного PEG фосфолипида и соединения A; модифицированного PEG фосфолипида, соединения A и фосфолипида; или модифицированного PEG фосфолипида, соединения A и холестерина и диспергированием компонентов в водном растворе по общепринятому способу. Процедуру диспергирования можно выполнять посредством подходящего прибора, такого как ультразвуковой диспергатор или диспергатор для эмульгирования.
III. Композиция по настоящему изобретению
Размер частицы носителя по настоящему изобретению, содержащей лекарственное средство, где носитель содержится в композиции по настоящему изобретению, конкретно не ограничен и соответствующим образом представлен в пределах от, например, 50 нм до 200 нм, предпочтительно в пределах от 60 нм до 150 нм.
Примеры “лекарственного средства”, которое можно использовать в композиции по настоящему изобретению, включают водорастворимые анионные соединения, противоопухолевые средства, противовирусные средства и антибиотики. Их конкретные примеры включают нуклеиновые кислоты, такие как одноцепочечные или двухцепочечные РНК, одноцепочечные или двухцепочечные ДНК и олигонуклеиновые кислоты, кислые сахара, такие как гепаран-сульфат и декстран сульфат, цитокины, вторичные мессенджеры, такие как циклические АМФ, АТФ и IP3, пенициллины и цефалоспорины, витамины, такие как витамин C и ретинолы, и другие, имеющиеся лекарственные средства с кислотной группой, такие как интерфероны (α, β, γ), интерлейкины (IL-1, IL-2), колониестимулирующие факторы (CSF), фактор некроза опухолей (TNF), левамизол, пестатин, ретиноевая кислота, 5-фторурацил (5-FU), цитозинарабинозид (Ara-C), аденинарабинозид (Ara-A), цисплатин (CDDP), циклофосфамид и азидотимидин (AZT).
Примеры синтетической двухцепочечной РНК включают те, которые описаны ниже.
1. Комплексы гомополимер-гомополимер
Полиинозиновая кислота-полицитидиловая кислота
Полиинозиновая кислота-поли(5-бромцитидиловая кислота)
Полиинозиновая кислота-поли(2-тиоцитидиловая кислота)
Поли(7-деазаинозиновая кислота)-полицитидиловая кислота
Поли(7-деазаинозиновая кислота)-поли(5-бромцитидиловая кислота)
Поли(2'-азидоинозиновая кислота)-полицитидиловая кислота
Полиинозиновая кислота-поли(цитидин-5'-тиофосфорная кислота)
2. Комплексы гомополимер-сополимер
Полиинозиновая кислота-поли(цитидиловая кислота, уридиловая кислота)
Полиинозиновая кислота-поли(цитидиловая кислота, 4-тиоуридиловая кислота)
3. Комплексы синтетическая нуклеиновая кислота и поликатион
Полиинозиновая кислота-полицитидиловая кислота-поли-L-лизин
4. Другие
Полиинозиновая кислота-поли(1-винилцитидиловая кислота)
Примеры олигонуклеиновой кислоты включают РНК, ДНК и их соединения, которые содержат от 10 до 3000 нуклеиновых оснований, предпочтительно от 15 до 2000 нуклеиновых оснований, более предпочтительно от 18 до 1000 нуклеиновых оснований на молекулу, например, миРНК, мкРНК, кшРНК, некодирующая РНК, антисмысловая ДНК, антисмысловая РНК, ДНК - ферменты, рибозимы и аптамеры.
Олигонуклеиновая кислота не ограничена встречающимися в природе видами, и по меньшей мере некоторую часть сахарного, фосфатного остова или т.п., которые образованы ее нуклеотидами, можно модифицировать для увеличения стабильности in vivo, такой как устойчивость к нуклеазам. Примеры такой модификации включают модификацию рибозы в 2'-положении, модификацию рибозы в других положениях и модификации фосфатного остова. Примеры модификации рибозы в 2'-позиции включают модификации посредством замещения гидроксильной группы в 2'-положении рибозы на H, OR5, R5, R6OR5, SH, SR5, NH2, NHR5, N(R5)2, N3, CN, F, Cl, Br и I. В настоящей работе R5 представлен алкилом или арилом, и R6 представлен алкиленом.
Алкил R5 конкретно не ограничен по образованию линейной или разветвленной цепи, и его примеры включают алкил, имеющий от 1 до 6 атомов углерода. Его конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, н-гексил и изогексил. Алкил можно замещать 1-3 заместителями, включая, например, галоген, алкил, алкокси, циано и нитро. Примеры галогена включают фтор, хлор, бром и йод. Примеры алкила включают те же группы, что и описанные выше для алкила. Алкокси конкретно не ограничен по образованию линейной или разветвленной цепи, и его примеры включают алкокси, имеющий от 1 до 6 атомов углерода. Его конкретные примеры включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентокси, изопентокси, н-гексилокси и изогексилокси. Среди них особенно предпочтительным является алкокси, имеющий 1-3 атома углерода.
Примеры арила в R5 включают арил, имеющий от 6 до 10 атомов углерода. Конкретные примеры арил включают фенил, α-нафтил и β-нафтил. Среди них особенно предпочтительным является фенил.
Алкилен в R6 конкретно не ограничен по образованию линейной или разветвленной цепей, и его примеры включают алкилен, имеющий от 1 до 6 атомов углерода. Конкретные примеры алкилена включают метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, 2-(этил)триметилен и 1-(метил)тетраметилен.
Примеры модификаций рибозы в остальных положениях включают 4'-тио-модификации. Примеры модификаций фосфатного остова включают фосфотиоатные, фосфодитиоатные, алкилфосфонатные и фосфорамидатные модификации.
Массовое отношение (носитель по настоящему изобретению / лекарственное средство) носителя по настоящему изобретению к лекарственному средству, включенному в композицию по настоящему изобретению, изменяется в зависимости от вида лекарственного средства, соотношения в смеси модифицированного PEG фосфолипида или соединения A в носителе по настоящему изобретению и т.д. Массовое отношение соответствующим образом представлено в пределах от 0,01 до 1000, предпочтительно в пределах от 10 до 300, более предпочтительно в пределах от 100 до 200. В случае, если лекарственное средство, включенное в композицию, представляет собой олигонуклеиновую кислоту, массовое отношение соответствующим образом представлено в пределах от 0,01 до 100, предпочтительно в пределах от 1 до 50, более предпочтительно в пределах от 5 до 30.
В композицию по настоящему изобретению, кроме указанного выше носителя по настоящему изобретению и лекарственного средства, можно, по мере необходимости, примешивать фармацевтически приемлемую добавку. Примеры добавки включают эмульгирующие вспомогательные средства (такие, как жирные кислоты, имеющие от 6 до 22 атомов углерода и их фармацевтически приемлемые соли, альбумин и декстран), стабилизаторы (такие, как холестерин и фосфатидная кислота), средства, регулирующие тоничность (такие, как хлорид натрия, глюкоза, мальтоза, лактоза, сахароза и трегалоза), и средства, регулирующие pH (такие, как соляная кислота, серная кислота, фосфорная кислота, уксусная кислота, гидроксид натрия, гидроксид калия и триэтаноламин). Их можно использовать индивидуально или в комбинации из двух или более.
Композицию по настоящему изобретению можно получать, добавляя лекарственное средство к дисперсии носителя по настоящему изобретению и посредством размешивания, соответствующим образом, полученной смеси. Композицию по настоящему изобретению также можно получать, добавляя лекарственное средство в процессе получения носителя настоящего изобретения. Указанную выше добавку можно добавлять в надлежащее время процесса или до, или после процедуры диспергирования.
Композицию по настоящему изобретению можно получать, например, в виде жидкого препарата или лиофилизированного препарата. В случае жидкого препарата концентрация носителя по настоящему изобретению, содержащегося в композиции по настоящему изобретению, соответствующим образом представлена в пределах от 0,001 мас./об.% до 50 мас./об.%, предпочтительно в пределах от 0,01 мас./об.% до 25 мас./об.%, более предпочтительно в пределах от 0,1 мас./об.% до 10 мас./об.%.
Лиофилизированный препарат можно получать, подвергая процедуре лиофилизации, посредством общепринятого способа, композицию по настоящему изобретению в форме жидкого препарата. Например, процедуру лиофилизации можно осуществлять так, как указано далее. После того как композицию по настоящему изобретению в форме жидкого препарата соответствующим образом стерилизуют, заданный объем переносят в пробирку с последующим предварительным замораживанием в условиях приблизительно от -40°C до -20°C в течение приблизительно 2 часов. Затем композицию подвергают первичному высушиванию при пониженном давлении при приблизительно от 0°C до 10°C и затем вторичному высушиванию при пониженном давлении при приблизительно от 15°C до 25°C. В основном, внутрь пробирки помещают газообразный азот, пробирку запечатывают, таким образом можно получать лиофилизированный препарат композиции по настоящему изобретению.
Лиофилизированный препарат композиции по настоящему изобретению, как правило, можно получать, добавляя подходящий раствор (раствор для повторного растворения) для повторного растворения препарата. Примеры раствора для повторного растворения включают воду для инъекций, физиологический раствор и другие общепринятые инфузионные растворы. Объем жидкости для раствора, для повторного растворения, изменяется в зависимости от его применения и т.д. и конкретно не ограничен, и соответствующим образом объем жидкости в растворе от 0,5 до 2 раз превышает объем жидкости в композиции по настоящему изобретению до лиофилизации или 500 мл или менее.
Заболевание, для которого можно применять композицию по настоящему изобретению, конкретно не ограничено и примеры заболевания включают злокачественную опухоль, вирусные, воспалительные, метаболические и неврологические заболевания.
Путь введения композиции по настоящему изобретению конкретно не ограничен, при условии, что он является фармацевтически приемлемым путем введения и может быть выбран в соответствии со способом лечения. Примеры пути введения включают внутривенное введение, внутриартериальное введение, пероральное введение, транспульмональное введение, введение внутрь ткани, трансдермальное введение, введение внутрь слизистой оболочки, ректальное введение, введение внутрь мочевого пузыря, интраперитонеальное введение, внутриглазное введение, внутрицеребральное введение и внутригрудное введение. Среди них внутривенное введение, трансдермальное введение и введение внутрь слизистой оболочки являются особенно предпочтительными. Лекарственная форма композиции по настоящему изобретению конкретно не ограничена, и примеры лекарственной формы включают различные формы для инъекций, оральные средства, формы для инфузий, ингаляций, глазные капли, мази, примочки и суппозитории.
Дозу композиции по настоящему изобретению в виде лекарственного средства устанавливают, предпочтительно, учитывая вид и лекарственную форму лекарственного средства, состояние пациента, такое как возраст и масса тела, путь введения и природу и тяжесть заболевания. Как правило, доза находится в пределах от 0,01 мг до 10 г/человека/сутки, предпочтительно в пределах от 0,1 мг до 5 г/человека/сутки в качестве дозы лекарственного средства для взрослого. В случае, если лекарственное средство, содержащееся в композиции по настоящему изобретению, представляет собой олигонуклеиновую кислоту, то доза олигонуклеиновой кислоты для взрослого находится, как правило, в пределах от 0,1 мг до 10 г/человека/сутки, предпочтительно в пределах от 1 мг до 5 г/человека/сутки. Численные значения иногда изменяются в зависимости от вида целевого заболевания, пути введения и целевой молекулы. Таким образом, в некоторых случаях, доза олигонуклеиновой кислоты может быть достаточной, когда она ниже диапазона, описанного выше. В некоторых случаях может требоваться доза выше диапазона, описанного выше. Дозу можно вводить один раз в сутки или несколько раз в сутки, или можно вводить в интервалах от одних до нескольких суток.
Примеры
Далее в настоящем документе настоящее изобретение будет более подробно проиллюстрировано со ссылкой на примеры получения, сравнительные примеры и примеры тестирования. Однако настоящее изобретение не ограничено объемом, описанным ниже.
Пример получения 1: Синтез олиго РНК
Используя автоматический синтезатор нуклеиновых кислот (Expedite 8909, произведено Applied BioSystems, Inc.), олиго РНК с нуклеотидной последовательностью, представленной SEQ ID NO: 1, олиго РНК с нуклеотидной последовательностью, представленной SEQ ID NO: 2, олиго РНК с нуклеотидной последовательностью, представленной SEQ ID NO: 3, и олиго РНК с нуклеотидной последовательностью, представленной SEQ ID NO: 4, синтезировали амидитным способом, описанным в документе (Nucleic Acid Research, 1984, Vol. 12, pp. 4539-4557).
Защитные группы основных молекул удалили отщеплением от CPG с использованием жидкости, смешанной из концентрированного гидроксида аммония и этанола (3/1) и, дополнительно, реакцией в том же растворе при 55°C в течение 18 часов. Затем, удалили защитную силильную группу в 2'-положении реакцией при комнатной температуре в течение 20 часов, используя 1 М раствор фторида тетрабутиламмония в тетрагидрофуране. Полученную, в результате, олиго РНК очистили обратно-фазовой хроматографией. Далее удалили защитную диметокситритильную группу в 5'-положении реакцией при комнатной температуре в течение 30 минут, используя 80% водный раствор уксусной кислоты, и затем полученную, в результате, олиго РНК снова очистили ионообменной хроматографией. Концентрации полученных олиго РНК с нуклеотидной последовательностью, представленной SEQ ID NO: 1, олиго РНК с нуклеотидной последовательностью, представленной SEQ ID NO: 2, олиго РНК с нуклеотидной последо