Пероральные составы, содержащие аналоги цитидина, и способы их использования
Иллюстрации
Показать всеГруппа изобретений относится к фармакологии и медицине. Группа изобретений включает фармацевтические композиции, содержащие 5-азацитидин, для перорального введения, где композиции высвобождают аналог цитидина по существу в желудке, способ лечения субъекта, имеющего заболевание, ассоциированное с аномальной клеточной пролиферацией, который включает пероральное введение субъекту фармацевтической композиции, применение 5-азацитидина для получения фармацевтической композиции для лечения заболевания, ассоциированного с аномальной клеточной пролиферацией. Группа изобретений обеспечивает повышение эффективности лечения. 4 н. и 32 з.п. ф-лы, 12 табл., 9 пр., 23 ил.
Реферат
I. ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по предварительным патентным заявкам США № 61/053609, поданной 15 мая 2008 года, 61/201145, поданной 5 декабря 2008 года, и 61/157875, поданной 5 марта 2009 года, содержание которых включено в настоящий документ в качестве ссылки в полном объеме.
II. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
В настоящем документе описаны фармацевтические составы, которые содержат аналоги цитидина или их соли, сольваты, гидраты, предшественники и/или их производные, для перорального введения субъектам. Также предоставлены способы получения таких составов и способы использования таких составов для лечения заболеваний и нарушений, которые включают, среди прочего, злокачественные опухоли, нарушения, связанные с аномальной клеточной пролиферацией, гематологические нарушения и иммунные нарушения.
III. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Злокачественные опухоли являются основной проблемой здравоохранения мирового масштаба; ожидали, что только в США в 2005 году будет зарегистрировано приблизительно 570000 смертей, связанных со злокачественными опухолями. См., например, Jemal et al., CA Cancer J. Clin. 55(l):10-30 (2005). В медицинской литературе описано много видов злокачественных опухолей. Примеры включают злокачественные опухоли крови, костей, легких (например, немелкоклеточный рак легких и мелкоклеточный рак легких), толстой кишки, молочной железы, простаты, яичника, мозга и кишечника. Заболеваемость злокачественными опухолями продолжает расти с увеличением возраста населения в целом и выявлением новых видов злокачественных опухолей. Сохраняется необходимость в эффективных лекарственных средствах для лечения субъектов со злокачественными опухолями.
Миелодиспластические синдромы (МДС) относятся к разнородной группе нарушений гемопоэтических стволовых клеток. Миелодиспластическими синдромами поражены приблизительно 40000-50000 человек в США и 75000-85000 человек в Европе. МДС могут отличаться нарушением морфологии и созревания кроветворных клеток костного мозга (дисмиелопоэз), цитопенией в периферической крови и неодинаковыми рисками развития острого лейкоза, которые возникают в результате неэффективного образования клеток крови. См., например, The Merck Manual 953 (17th ed. 1999); List et al., J. Clin. Oncol. 8:1424 (1990).
МДС объединены в одну группу по причине наличия диспластических изменений в одном или нескольких ростках кроветворения, включая диспластические изменения в миелоидном, эритроидном и мегакариоцитарном ростках. Эти изменения приводят к цитопениям в одном или нескольких из этих трех ростков. У пациентов, пораженных МДС, могут развиваться осложнения, связанные с анемией, нейтропенией (инфекции) и/или тромбоцитопенией (кровотечения). Приблизительно у 10-70% пациентов с МДС может развиться острый лейкоз. На ранних стадиях МДС основной причиной цитопении является учащение запрограммированной клеточной смерти (апоптоза). По мере развития заболевания и его перерождения в лейкоз пролиферирующие лейкозные клетки заполоняют здоровый костный мозг. Течение заболевания отличается в ряде случаев, когда заболевание ведет себя как медленно растущая опухоль или когда заболевание ведет себя агрессивно, обладает очень короткой длительностью течения заболевания и перерождается в острую форму лейкоза. В конечном счете у большинства людей с более высоким риском МДС наступает недостаточность костного мозга. До 50% пациентов с МДС умирают от осложнений, таких как инфекции или кровотечения, еще до развития острого миелоцитарного лейкоза.
При выявлении первичных и вторичных МДС учитывают анамнез пациента: предшествующее лечение химиотерапевтическими средствами, лучевая терапия или профессиональная подверженность действию токсических веществ являются теми факторами, которые отделяют вторичный МДС (вМДС) от первичного МДС. С точки зрения цитогенетики, эти две группы различаются сложностью аномальных кариотипов; для первичного МДС типичны аберрации одной хромосомы, тогда как множественные изменения более часто наблюдаются при вторичных нарушениях. Некоторые лекарственные средства, такие как гидроксимочевина при 17p и ингибиторы топоизомераз при 11q23 и 21q22, могут иметь конкретные мишени. Генетические изменения в злокачественных клетках МДС ведут в основном к потере генетического материала, содержащего вероятные гены-супрессоры опухолевого роста.
Международная группа гематологов, French-American-British (FAB) Cooperative Group, разделила МДС на пять подгрупп, дифференцировав их от острого миелолейкоза. См., например, The Merck Manual 954 (17th ed. 1999); Bennett J.M., et al., Ann. Intern. Med., 103(4): 620-5 (1985); и Besa E.C., Med. Clin. North Am. 76(3):599-617 (1992). Основные диспластические изменения в трех ростках клеток костного мозга пациентов найдены во всех подтипах. Доступна информация о патологических процессах при МДС, определенных системах классификации МДС и конкретных способах лечения и ведения МДС. См., например, патент США № 7189740 (выдан 13 марта 2007 года), который в полном объеме включен в настоящий документ в качестве ссылки.
Аналоги нуклеозидов использовались в клинике для лечения вирусных инфекций и злокачественных опухолей. Большинство аналогов нуклеозидов классифицируются как антиметаболиты. После проникновения в клетку аналоги нуклеозидов последовательно фосфорилируются до нуклеозид-5'-монофосфатов, -дифосфатов и -трифосфатов.
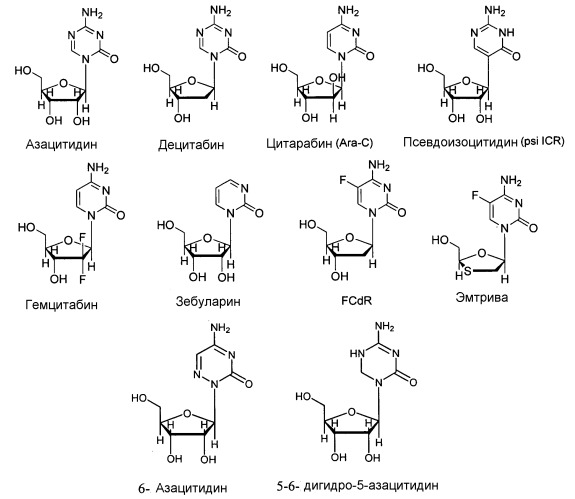
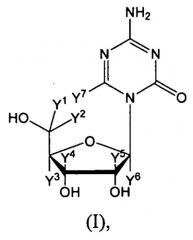
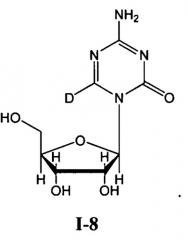
5-Азацитидин (обозначение согласно «National Service Center» NSC-102816; регистрационный номер CAS 320-67-2), также известный как азацитидин, АЗА или 4-амино-1-β-D-рибофуранозил-1,3,5-триазин-2(1H)-он, в настоящее время представлен на рынке в виде готовой лекарственной формы VIDAZA®. 5-Азацитидин является аналогом нуклеозида, более конкретно, аналогом цитидина. 5-Азацитидин является антагонистом своего родственного природного нуклеозида, цитидина. 5-Азацитидин и 5-аза-2'-дезоксицитидин (также известный как децитабин, аналог дезоксицитидина) также являются антагонистами дезоксицитидина. Структурное различие между этими аналогами цитидина и их родственным природным нуклеозидом заключается в присутствии атома азота вместо атома углерода в 5 положении в кольце цитозина. 5-Азацитидин можно определить посредством брутто-формулы C8H12N4O5, молекулярной массы 244,21 грамм/моль и следующей структурной формулы:
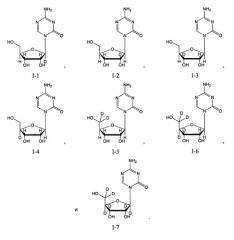
Другие члены класса аналогов цитидина включают, например: 1-β-D-арабинофуранозилцитозин (цитарабин или ара-C); 5-аза-2'-дезоксицитидин (децитабин или 5-аза-CdR); псевдоизоцитидин (psi ICR); 5-фтор-2'-дезоксицитидин (FCdR); 2'-дезокси-2',2'-дифторцитидин (гемцитабин); 5-аза-2'-дезокси-2',2'-дифторцитидин; 5-аза-2'-дезокси-2'-фторцитидин; 1-β-D-рибофуранозил-2(1H)-пиримидинон (зебуларин); 2',3'-дидезокси-5-фтор-3'-тиацитидин (эмтрива); 2'-циклоцитидин (анцитабин); 1-β-D-арабинофуранозил-5-азацитозин (фазарабин или ара-AC); 6-азацитидин (6-аза-CR); 5,6-дигидро-5-азацитидин (dH-аза-CR); N4-пентилоксикарбонил-5'-дезокси-5-фторцитидин (капецитабин); N4-октадецилцитарабин; и цитарабин элаидиновой кислоты.
После встраивания в реплицирующуюся ДНК 5-азацитидин или 5-аза-2'-дезоксицитидин образует ковалентный комплекс с ДНК-метилтрансферазами. ДНК-метилтрансферазы отвечают за метилирование ДНК de novo, а также за дублирование сложившихся паттернов метилирования реплицируемой ДНК в дочерних цепях ДНК. Ингибирование ДНК-метилтрансфераз 5-азацитидином или 5-аза-2'-дезоксицитидином ведет к снижению метилирования ДНК, вследствие чего восстанавливаются нормальное функционирование морфологически диспластических незрелых гемопоэтических клеток и злокачественных клеток путем восстановления экспрессии генов, участвующих в регуляции нормального клеточного цикла, дифференциации и гибели. Цитотоксические эффекты этих аналогов цитидина вызывают гибель быстро делящихся клеток, включая злокачественные клетки, которые больше не подчиняются нормальным механизмам контроля клеточного роста. 5-Азацитидин, в отличие от 5-аза-2'-дезоксицитидина, также встраивается в РНК. Цитотоксические эффекты азацитидина могут быть опосредованы многими механизмами, включая ингибирование синтеза ДНК, РНК и белка, встраивание в РНК и ДНК и активацию путей повреждения ДНК.
В клинических испытаниях тестирование 5-азацитидина и 5-аза-2'-дезоксицитидина выявило значительную противоопухолевую активность, например такую, как в лечении миелодиспластических синдромов (МДС), острого миелобластного лейкоза (ОМЛ), хронического миелобластного лейкоза (ХМЛ), острого лимфоцитарного лейкоза (ОЛЛ) и неходжкинской лимфомы (НХЛ). См., например, Aparicio et al., Curr. Opin. Invest. Drugs 3(4): 627-33 (2002). 5-Азацитидин проходил финансируемые Национальным институтом рака испытания по лечению МДС и одобрен для лечения всех подтипов МДС по классификации FAB. См., например, Kornblith et al., J. Clin. Oncol. 20(10): 2441-2452 (2002); Silverman et al., J. Clin. Oncol. 20(10): 2429-2440 (2002). Посредством цитотоксической активности и ингибирования ДНК-метилтрансферазы 5-азацитидин может изменять нормальное течение МДС, снижая вероятность перерождения в ОМЛ. В III фазе исследования при подкожном введении 5-азацитидин значительно продлевал выживаемость и время до перерождения в ОМЛ или смерти субъектов с МДС с высоким риском перерождения. См., например, P. Fenaux et al., Lancet Oncol., 2009, 10(3):223-32; Silverman et al., Blood 106(11): Abstract 2526 (2005).
5-Азацитидин и другие аналоги цитидина одобрены для подкожного (ПК) или внутривенного (ВВ) введения для лечения различных пролиферативных нарушений. Пероральное дозирование аналогов цитидина более желательно и удобно для пациентов и врачей, например, за счет избавления от реакций в местах инъекций, которые могут развиваться при подкожном введении, и/или за счет возможности усовершенствовать соблюдение пациентом схемы лечения. Однако доказано, что пероральная доставка аналогов цитидина осложнена сочетанием химической нестабильности, ферментативной нестабильности и/или плохой проницаемости. Например, считается, что аналоги цитидина подвержены действию кислоты и нестабильны в кислой среде желудка. Разработанные ранее пероральные лекарственные формы аналогов цитидина обязательно имеют такое энтеросолюбильное покрытие центральной части лекарственного средства, чтобы защитить активный фармацевтический компонент (АФК) от того, что понимают и признают как терапевтически неприемлемый гидролиз в желудке, чтобы лекарственное средство предпочтительно всасывалось в конкретных участках нижней части желудочно-кишечного тракта, такой как тощая кишка тонкого кишечника. См., например, Sands, et al., публикацию патента США № 2004/0162263 (заявка № 10/698983). Кроме того, в данной области существует общепринятое представление о том, что вода ведет к разрушительному гидролизу аналогов цитидина в процессе получения лекарственного средства, что впоследствии влияет на стабильность АФК в лекарственной форме. В результате этого покрытия, наносимые на центральную часть лекарственного средства для предполагаемой пероральной доставки аналогов цитидина, ранее были ограничены системами на основе органического растворителя, чтобы минимизировать воздействие воды на АФК.
Сохраняется значительная потребность в пероральных составах и лекарственных формах аналогов цитидина, таких как, например, 5-азацитидин, чтобы, среди прочего, потенциально обеспечить более благоприятные уровни доз или периоды дозирования; усовершенствование фармакокинетических профилей, фармакодинамических профилей или профилей безопасности; оценку преимуществ долгосрочной или поддерживающей терапии; разработку усовершенствованных схем лечения, которые максимально увеличивают биологическую активность; использование аналогов цитидина для лечения новых заболеваний или нарушений; и/или другие потенциальные благоприятные преимущества.
IV. КРАТКОЕ ИЗЛОЖЕНИЕ
В настоящем документе описаны фармацевтические композиции, содержащие аналоги цитидина, где композиции высвобождают АФК по существу в желудке после перорального введения. Кроме того, предоставлены способы получения таких композиций и способы использования таких композиций для лечения заболеваний и нарушений, включая, среди прочего, злокачественные опухоли, нарушения, связанные с аномальной клеточной пролиферацией, и гематологические нарушения.
В определенных вариантах осуществления аналогом цитидина является 5-азацитидин. В других вариантах осуществления аналогом цитидина является 5-аза-2'-дезоксицитидин (децитабин или 5-аза-CdR). В других вариантах осуществления аналогом цитидина является, например: 1-β-D-арабинофуранозилцитозин (цитарабин или ара-C); псевдоизоцитидин (psi ICR); 5-фтор-2'-дезоксицитидин (FCdR); 2'-дезокси-2',2'-дифторцитидин (гемцитабин); 5-аза-2'-дезокси-2',2'-дифторцитидин; 5-аза-2'-дезокси-2'-фторцитидин; 1-β-D-рибофуранозил-2(1H)-пиримидинон (зебуларин); 2',3'-дидезокси-5-фтор-3'-тиацитидин (эмтрива); 2'-циклоцитидин (анцитабин); 1-β-D-арабинофуранозил-5-азацитозин (фазарабин или ара-AC); 6-азацитидин (6-аза-CR); 5,6-дигидро-5-азацитидин (dH-аза-CR); N4-пентилоксикарбонил-5'-дезокси-5-фторцитидин (капецитабин); N4-октадецилцитарабин; цитарабин элаидиновой кислоты; или их производные или родственные аналоги.
Определенные варианты осуществления по настоящему документу относятся к композициям, которые представляют собой единичные стандартные лекарственные формы, содержащие аналог цитидина. Определенные варианты осуществления по настоящему документу относятся к композициям, которые не покрыты энтеросолюбильным покрытием. Определенные варианты осуществления по настоящему документу относятся к композициям, которые представляют собой таблетки, содержащие аналог цитидина. Определенные варианты осуществления по настоящему документу относятся к композициям, которые представляют собой капсулы, содержащие аналог цитидина. Капсулы могут представлять собой, например, твердые желатиновые капсулы или мягкие желатиновые капсулы; в конкретных вариантах осуществления предоставлены капсулы из гидроксипропилметилцеллюлозы (ГПМЦ). В определенных вариантах осуществления единичные стандартные лекарственные формы необязательно дополнительно содержат один или несколько эксципиентов. В определенных вариантах осуществления таблетки необязательно дополнительно содержат один или несколько эксципиентов. В других вариантах осуществления капсулы необязательно дополнительно содержат один или несколько эксципиентов. В определенных вариантах осуществления композиция представляет собой таблетку, которая осуществляет немедленное высвобождение АФК после перорального введения. В других вариантах осуществления композиция представляет собой таблетку, которая осуществляет контролируемое высвобождение АФК по существу в желудке. В определенных вариантах осуществления композиция представляет собой капсулу, которая осуществляет немедленное высвобождение АФК после перорального введения. В других вариантах осуществления композиция представляет собой капсулу, которая обеспечивает контролируемое высвобождение АФК по существу в желудке. В конкретных вариантах осуществления таблетка содержит центральную часть лекарственного средства, которая содержит аналог цитидина, и необязательно дополнительно содержит покрытие центральной части лекарственного средства, где покрытие нанесено на центральную часть лекарственного средства с использованием водного растворителя, например, такого как вода, или неводного растворителя, например, такого как этанол.
Определенные варианты осуществления по настоящему документу относятся к способам получения составов, содержащих аналоги цитидина, которые предназначены для пероральной доставки. Кроме того, предоставлены промышленные изделия, которые включают упаковочный материал, пероральный состав, содержащий аналог цитидина, и ярлык, на котором указано, что состав предназначен для лечения определенных заболеваний или нарушений, включая, например, злокачественные опухоли, нарушения, связанные с аномальной клеточной пролиферацией, гематологические нарушения или иммунные нарушения.
Определенные варианты осуществления по настоящему документу относятся к способам использования составов, предоставленных в настоящем документе, для лечения заболеваний или нарушений, включая среди прочего, например, злокачественные опухоли, нарушения, связанные с аномальной клеточной пролиферацией, гематологические нарушения или иммунные нарушения. В определенных вариантах осуществления составы, содержащие аналоги цитидина, перорально вводят субъектам, нуждающимся в этом, для лечения злокачественной опухоли или гематологического нарушения, например, такого как МДС, ОМЛ, ОЛЛ, ХМЛ, НХЛ, лейкоз или лимфома; или солидной опухоли, например, такой как саркома, меланома, карцинома, или злокачественных опухолей толстой кишки, молочной железы, яичника, желудочно-кишечного тракта, почки, легкого (например, немелкоклеточный рак легких и мелкоклеточный рак легких), яичка, простаты, поджелудочной железы или кости. В определенных вариантах осуществления составы, содержащие аналоги цитидина, перорально вводят субъектам, нуждающимся в этом, для лечения иммунного нарушения. В определенных вариантах осуществления пероральные составы, предоставленные в настоящем документе, совместно вводят с одним или несколькими терапевтическими средствами, чтобы обеспечить синергический терапевтический эффект у субъектов, нуждающихся в этом. В определенных вариантах осуществления пероральные составы, предоставленные в настоящем документе, совместно вводят с одним или несколькими терапевтическими средствами, чтобы обеспечить эффект повторной сенсибилизации у субъектов, нуждающихся в этом. Совместно вводимые средства могут представлять собой терапевтические средства против злокачественных опухолей, как описано в настоящем документе. В определенных вариантах осуществления совместно вводимое средство(а) можно дозировать, например, перорально или посредством инъекции.
Конкретные варианты осуществления по настоящему документу относятся к таблеткам, содержащим 5-азацитидин, и способам получения и использования таких таблеток для лечения злокачественных опухолей, нарушений, связанных с аномальной клеточной пролиферацией, или гематологических нарушений. В определенных вариантах осуществления таблетки необязательно дополнительно содержат один или несколько эксципиентов, например, таких как глиданты, разбавители, лубриканты, красители, дезинтегрирующие средства, гранулирующие средства, связующие средства, полимеры и/или покрывающие средства. Примеры компонентов, которые можно использовать при получении определенных составов, предоставленных в настоящем документе, описаны, например, в Etter et al., публикации патентной заявки США № 2008/0057086 (заявка № 11/849958), включенной в настоящий документ в качестве ссылки в полном объеме.
Среди прочего, конкретные варианты осуществления по настоящему документу относятся к фармацевтическим композициям, которые содержат терапевтически эффективное количество 5-азацитидина, где из композиции 5-азацитидин высвобождается по существу в желудке после перорального введения субъекту. Дополнительные варианты осуществления относятся к указанным выше композициям, которые представляют собой композиции с немедленным высвобождением; не имеют энтеросолюбильного покрытия (т.е. не покрыты энтеросолюбильным покрытием); представляют собой таблетки; представляют собой капсулы; дополнительно содержат эксципиент, выбранный из любых эксципиентов, описанных в настоящем документе; дополнительно содержат усиливающее проникновение средство; дополнительно содержат d-альфа-токоферил полиэтиленгликоль 1000 сукцинат; дополнительно содержат в составе усиливающее проникновение средство в количестве приблизительно 2% по массе по отношению к общей массе состава; по существу не содержат ингибитор цитидиндеаминазы; по существу не содержат тетрагидроуридин; содержат 5-азацитидин в количестве по меньшей мере приблизительно 40 мг; содержат 5-азацитидин в количестве по меньшей мере приблизительно 400 мг; содержат 5-азацитидин в количестве по меньшей мере приблизительно 1000 мг; достигают значения площади под кривой по меньшей мере приблизительно 200 нг×ч/мл после перорального введения субъекту; достигают значения площади под кривой по меньшей мере приблизительно 400 нг×ч/мл после перорального введения субъекту; достигают максимальной концентрации в плазме по меньшей мере приблизительно 100 нг/мл после перорального введения субъекту; достигают максимальной концентрации в плазме по меньшей мере приблизительно 200 нг/мл после перорального введения субъекту; достигают значения времени достижения максимальной концентрации в плазме приблизительно менее чем 90 минут после перорального введения субъекту; и/или достигают значения времени достижения максимальной концентрации в плазме приблизительно менее чем 60 минут после перорального введения субъекту.
Конкретные варианты осуществления по настоящему документу относятся к фармацевтической композиции для перорального введения, содержащей терапевтически эффективное количество 5-азацитидина, из которой 5-азацитидин высвобождается по существу в желудке и достигает значения площади под кривой по меньшей мере приблизительно 200 нг×ч/мл после перорального введения.
Конкретные варианты осуществления по настоящему документу относятся к фармацевтической композиции для перорального введения, содержащей терапевтически эффективное количество 5-азацитидина, из которой 5-азацитидин высвобождается по существу в желудке и достигает значения площади под кривой по меньшей мере приблизительно 400 нг×ч/мл после перорального введения.
Конкретные варианты осуществления по настоящему документу относятся к фармацевтической композиции для перорального введения, содержащей терапевтически эффективное количество 5-азацитидина, из которой 5-азацитидин высвобождается по существу в желудке и достигает максимальной концентрации в плазме по меньшей мере приблизительно 100 нг/мл после перорального введения.
Конкретные варианты осуществления по настоящему документу относятся к фармацевтической композиции для перорального введения, содержащей терапевтически эффективное количество 5-азацитидина, из которой 5-азацитидин высвобождается по существу в желудке и достигает максимальной концентрации в плазме по меньшей мере приблизительно 200 нг/мл после перорального введения.
Конкретные варианты осуществления по настоящему документу относятся к фармацевтической композиции для перорального введения, содержащей терапевтически эффективное количество 5-азацитидина, из которой 5-азацитидин высвобождается по существу в желудке и достигает значения времени достижения максимальной концентрации в плазме, например, приблизительно менее чем 6 ч, приблизительно менее чем 5 ч, приблизительно менее чем 4 ч, приблизительно менее чем 3 ч, приблизительно менее чем 2,5 ч, приблизительно менее чем 2 ч, приблизительно менее чем 1,5 ч, приблизительно менее чем 1 ч, приблизительно менее чем 45 мин или приблизительно менее чем 30 мин после перорального введения. В конкретных вариантах осуществления присутствие пищи может влиять на суммарное воздействие (например, увеличивать) и/или влиять на время достижения максимальной концентрации в плазме.
Конкретные варианты осуществления по настоящему документу относятся к фармацевтической композиции для перорального введения, содержащей терапевтически эффективное количество 5-азацитидина, из которой 5-азацитидин высвобождается по существу в желудке и достигает значения времени достижения максимальной концентрации в плазме приблизительно менее чем 60 минут после перорального введения.
Конкретные варианты осуществления по настоящему документу относятся к любым указанным выше композициям в виде единичных стандартных лекарственных форм, таблеток или капсул.
Среди прочего, конкретные варианты осуществления по настоящему документу относятся к способам лечения субъекта, имеющего заболевание, связанное с аномальной клеточной пролиферацией, которые включают пероральное введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество 5-азацитидина, где из композиции 5-азацитидин высвобождается по существу в желудке после перорального введения субъекту. Дополнительные варианты осуществления по настоящему документу относятся к указанным выше способам, в которых заболевание представляет собой миелодиспластический синдром; заболевание представляет собой острый миелобластный лейкоз; способ дополнительно включает совместное введение субъекту, нуждающемуся в этом, дополнительного терапевтического средства, выбранного из любых дополнительных терапевтических средств, описанных в настоящем документе; композиция представляет собой композицию с немедленным высвобождением; композиция не обладает энтеросолюбильным покрытием; композиция дополнительно содержит усиливающее проникновение средство; композиция дополнительно содержит усиливающее проникновение средство d-альфа-токоферил полиэтиленгликоль 1000 сукцинат; в состав композиции дополнительно входит d-альфа-токоферил полиэтиленгликоль 1000 сукцинат в количестве приблизительно 2% по массе по отношению к общей массе состава; дополнительно способ не включает совместное введение ингибитора цитидиндеаминазы и аналога цитидина; композиция представляет собой единичную стандартную лекарственную форму; композиция представляет собой таблетку; композиция представляет собой капсулу; композиция дополнительно содержит эксципиент, выбранный из любых эксципиентов, описанных в настоящем документе; количество 5-азацитидина составляет по меньшей мере приблизительно 40 мг; количество 5-азацитидина составляет по меньшей мере приблизительно 400 мг; количество 5-азацитидина составляет по меньшей мере приблизительно 1000 мг; способ позволяет достичь значения площади под кривой по меньшей мере приблизительно 200 нг×ч/мл после перорального введения субъекту; способ позволяет достичь значения площади под кривой по меньшей мере приблизительно 400 нг×ч/мл после перорального введения субъекту; способ позволяет достичь максимальной концентрации в плазме по меньшей мере приблизительно 100 нг/мл после перорального введения субъекту; способ позволяет достичь максимальной концентрации в плазме по меньшей мере приблизительно 200 нг/мл после перорального введения субъекту; способ позволяет достичь значения времени достижения максимальной концентрации в плазме приблизительно менее чем 90 минут после перорального введения субъекту; и/или способ позволяет достичь значения времени достижения максимальной концентрации в плазме приблизительно менее чем 60 минут после перорального введения субъекту.
Среди прочего, конкретные варианты осуществления по настоящему документу относятся к фармацевтическим композициям, содержащим терапевтически эффективное количество 5-азацитидина, где композиции предназначены для лечения заболевания или нарушения, ассоциированного с аномальной клеточной пролиферацией, где композиции получают для перорального введения и где композиции получают для высвобождения 5-азацитидина по существу в желудке. Дополнительные варианты осуществления по настоящему документу относятся к указанным выше композициям, которые содержат 5-азацитидин в количестве приблизительно 40 мг, приблизительно 400 мг или приблизительно 1000 мг; получают, чтобы достигать значения площади под кривой по меньшей мере приблизительно 200 нг×ч/мл или 400 нг×ч/мл после перорального введения; получают, чтобы достигать максимальной концентрации в плазме по меньшей мере приблизительно 100 нг/мл или 200 нг/мл после перорального введения; получают, чтобы достигать значения времени достижения максимальной концентрации в плазме приблизительно менее чем 60 минут или 90 минут после введения; получают в форме композиции с немедленным высвобождением; получают для перорального введения в сочетании с дополнительным терапевтическим средством, выбранным из любых дополнительных терапевтических средств, описанных в настоящем документе; предназначены для лечения миелодиспластического синдрома или острого миелобластного лейкоза; дополнительно содержат усиливающее проникновение средство; которые дополнительно содержат усиливающее проникновение средство d-альфа-токоферил полиэтиленгликоль 1000 сукцинат; представляют собой единичные стандартные лекарственные формы; представляют собой таблетки или капсулы; и/или дополнительно содержат эксципиент, выбранный из любых эксципиентов, описанных в настоящем документе.
Среди прочего, конкретные варианты осуществления по настоящему документу относятся к использованию 5-азацитидина для получения фармацевтической композиции для лечения заболевания, ассоциированного с аномальной клеточной пролиферацией, где композицию получают для перорального введения и где композицию получают для высвобождения 5-азацитидина по существу в желудке. Дополнительные варианты осуществления по настоящему документу относятся к указанному выше использованию, в котором заболевание представляет собой миелодиспластический синдром или острый миелобластный лейкоз; количество 5-азацитидина выбрано из любых количеств, описанных в настоящем документе; и/или композицию получают для немедленного высвобождения. Дополнительные варианты осуществления, среди прочего, относятся к способам лечения субъекта, имеющего заболевание или нарушение, предусмотренное в настоящем документе, введением фармацевтических композиций, предоставленных в настоящем документе, где лечение приводит к улучшению выживаемости субъекта.
V. КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг. 1 показаны процессы и стадии, которые можно использовать для получения конкретных таблеток, содержащих азацитидин, для перорального дозирования; в конкретных вариантах осуществления необязательно можно пропустить одну или несколько стадий.
На фиг. 2 показаны ФК профили человека после подкожного дозирования азацитидина 75 мг/м2 в 1 и 7 сутки в множественном исследовании с увеличением дозы (n=18). По оси X отложено время; по оси Y отложена концентрация азацитидина в плазме (среднее ± SD).
На фиг. 3 показаны ФК профили человека после ПК (75 мг/м2) и ПО (240 мг, 300 мг и 360 мг) дозирования азацитидина в множественном исследовании с увеличением дозы. Проводили сравнение ФК профилей концентрации азацитидина в плазме при различных дозах. По оси X отложено время; по оси Y отложена концентрация азацитидина в плазме (среднее ± SD).
На фиг. 4 приведены ФД данные отдельного пациента (субъект 02008, мужчина в возрасте 80 лет, РАИБ-1, RAEB-1), собранные в ходе множественного исследования с увеличением дозы. Пациенту дозировали состав с азацитидином №3, 240 мг. На график нанесены количество тромбоцитов (103/мкл), Hgb (г/дл), АЧН, (ANC) (103/мкл) и относительное количество бластных клеток в костном мозге (%) в зависимости от даты получения образцов в ходе исследования.
На фиг. 5 приведены ФД данные отдельного пациента (субъект 02007, мужчина в возрасте 76 лет, CMML), собранные в ходе множественного исследования с увеличением дозы. Пациенту дозировали состав с азацитидином №3, 240 мг. На график нанесены количество тромбоцитов (103/мкл), Hgb (г/дл), АЧН (103/мкл) и относительное количество бластных клеток в костном мозге (%) в зависимости от даты получения образцов в ходе исследования.
На фиг. 6 приведены ФД данные отдельного пациента (субъект 02004, мужчина в возрасте 61 года, МДС, MDACC), собранные в ходе множественного исследования с увеличением дозы. Пациенту дозировали состав с азацитидином №1, 120 мг. На график нанесены количество тромбоцитов (103/мкл), Hgb (г/дл), АЧН (103/мкл) и относительное количество бластных клеток в костном мозге (%) в зависимости от даты получения образцов в ходе исследования.
На фиг. 7 приведена схема исследования для исследования Rapid Aza Clinical Evaluation (RACE) CL008. Показаны дозы, которые давали в различные сутки в рамках цикла лечения. Время введения дозы может составлять ±1 сутки, при условии, что интервал между дозами составляет по меньшей мере 48 часов.
На фиг. 8 показаны азацитидиновые ФК профили человека, полученные от отдельного пациента (субъект 106003, N=1) после ПК (124 мг, 75 мг/м2) и ПО (180 мг, 360 мг, 1200 мг, состав №4) дозирования азацитидина в клиническом исследовании RACE. Показаны значения AUC(0-t) для ПК и ПО доз.
На фиг. 9 показаны азацитидиновые ФК профили человека, полученные от отдельного пациента (субъект 106004, N=1) после ПК (120 мг, 75 мг/м2) и ПО (180 мг, 360 мг, 1200 мг, состав №6) дозирования азацитидина в клиническом исследовании RACE. Показаны значения AUC(0-∞) для ПК и ПО доз.
На фиг. 10 показаны ФК профили человека (линейная шкала) после подкожного и перорального введения азацитидина в клинических исследованиях.
На фиг. 11 показаны ФК профили человека (полулогарифмическая шкала) после подкожного и перорального введения азацитидина в клинических исследованиях.
На фиг. 12 показаны значения AUC человека после ПК дозирования азацитидина и перорального дозирования азацитидина в составах №3, №4 и №6 при различных уровнях доз в клинических исследованиях (CL005 и CL008).
На фиг. 13 показаны значения Cmax человека у пациентов после ПК дозирования азацитидина и перорального дозирования азацитидина в составах №3, №4 и №6 при различных уровнях доз в клинических исследованиях.
На фиг. 14 показана относительная биодоступность при пероральном введении людям после перорального дозирования азацитидина в составах №3, №4 и №6 при различных уровнях доз.
На фиг. 15 показан процент воздействия у людей по отношению к ПК введению после перорального дозирования азацитидина в составах №3, №4 и №6 при различных уровнях доз.
На фиг. 16 показаны профили концентрации в плазме человека в зависимости от времени (линейная шкала) после перорального дозирования азацитидина в составах №3 и №6 и 180 мг (n=6).
На фиг. 17 показаны профили концентрации в плазме человека (нг/мл) (линейная шкала) в зависимости от времени (ч) после перорального дозирования азацитидина в составах №3 и №6 и 360 мг (n=6).
На фиг. 18 показан график зависимости отдельных («отд.») и средних значений AUC (0-∞) (нг×ч/мл) азацитидина от дозы азацитидина (мг) и рассчитанные прямые линейной регрессии для составов №3 и №6.
На фиг. 19 показано сравнение относительной биодоступности азацитидина при пероральном введении (%) (среднее ± SD) в зависимости от дозы азацитидина (мг) после дозирования в составах №3 или №6.
На фиг. 20 показано сравнение воздействия азацитидина по сравнению с ПК дозой (среднее ± SD) в зависимости от дозы азацитидина (мг) после перорального введения состава №3 или №6.
VI. ПОДРОБНОЕ ОПИСАНИЕ
Если не определено иное, все технические и научные термины, использованные в настоящем документе, имеют такое значение, в котором их обычно понимает специалист в данной области. Все публикации и патенты, указанные в настоящем документе, включены в настоящий документ по ссылке в полном объеме.
A. Определения
В описании и прилагающейся формуле изобретения использование единственной формы включает множественную форму, а также отдельные обозначаемые объекты, если контекст явно не диктует иное.
Термин «приблизительно» или «примерно» обозначает допустимую погрешность для конкретного значения, установленную специалистами в данной области, которая частично зависит от того, как это значение измеряют или устанавливают. В определенных вариантах осуществления термин «приблизительно» или «примерно» обозначает погрешность в пределах 1, 2, 3 или 4 стандартных отклонений. В определенных вариантах осуществления термин «приблизительно» или «примерно» обозначает погрешность в приделах 30%, 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1% или 0,05% от заданного значения или диапазона.
Как применяют в настоящем документе и если не указано иное, термины «лечить» и «лечение» относятся к устранению или уменьшению интенсивности заболевания или нарушения или одного или нескольких симптомов, ассоциированных с заболеванием или нарушением. В определенных вариантах осуществления термины относятся к минимизации распространения или увеличения тяжести заболевания или нарушения в результате введения одного или нескольких профилактических и