Липосомальная композиция
Иллюстрации
Показать всеНастоящее изобретение относится к области фармацевтики и касается липосомальной композиции, содержащей эрибулин или его фармакологически приемлемую соль, а также способа ее получения. Изобретение обеспечивает высокую стабильность липосомальной композиции. 2 н. и 37 з.п. ф-лы, 3 ил., 7 табл., 10 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новой липосомальной композиции, содержащей эрибулин или его фармакологически приемлемую соль. Настоящее изобретение также относится к способу производства липосомальной композиции.
Уровень техники изобретения
Липосомы представляют собой микроскопические замкнутые везикулы, имеющие внутреннюю фазу, окруженную одним или несколькими липидными бислоями, и способные удерживать водорастворимый материал во внутренней фазе, а липофильный материал - в липидном бислое. При заключении активного соединения в липосому и доставке его в ткани-мишени важными задачами являются захват активного соединения в липосому с высокой эффективностью и обеспечение устойчивого удержания активного соединения липосомой.
При заключении липофильных соединений в липосому высокий коэффициент захвата может быть достигнут относительно легко, за исключением случаев с соединениями, имеющими очень высокое сродство к мембранам, такими как амфотерицин B (главное действующее вещество в липосомальном лекарственном средстве AmBisome), стабильность удержания в сыворотке крови обычно низкая, и трудно добиться достаточного улучшения фармакокинетики. Что касается методов заключения водорастворимых соединений в липосомы, существуют различные методы, такие как метод липидной пленки (метод вихрей), метод обращенно-фазового выпаривания, метод удаления поверхностно-активных веществ, метод замораживания-оттаивания и методы дистанционной загрузки (метод градиента рН, метод ионного градиента). Однако только дистанционные методы загрузки обеспечивают близкий к 100% коэффициент захвата; коэффициент захвата в случае других методов составляет лишь порядка 5-30%.
В качестве методов дистанционной загрузки известны методы с использованием градиента pH и градиента ионов сульфата аммония. Метод градиента pH, который представляет собой метод дистанционной загрузки с использованием градиента pH, является методом заключения соединений в липосомы при помощи изменения равновесия молекулярной/ионной диссоциации из-за рН целевого соединения.
В качестве одного из примеров соединения, заключенного в липосоме методом градиента рН, можно привести, например, доксорубицин (DOX, pKa: 8,2). После получения липосомального раствора с буферным раствором, имеющим pH 4, внешнюю фазу липосом заменяют на буферный раствор с pH 7. В случае когда DOX добавляют к этому раствору липосом, то поскольку молекулярный DOX в растворе с pH 7 является липофильным, он мигрирует в мембраны липосом, а не в водную фазу. В случае когда DOX, который мигрировал в мембраны липосом, далее контактирует с внутренней фазой липосом с pH 4, он становится ионным и включается во внутреннюю фазу липосом. Таким образом, DOX переносится из внешней фазы во внутреннюю фазу липосом за счет изменения равновесия диссоциации (см. непатентный литературный источник 1, непатентный литературный источник 2 и патентный литературный источник 1).
Сообщалось о множестве способов усовершенствования этого типа методов удаленной загрузки. В непатентном литературном источнике 3 описан способ улучшения коэффициента захвата активных соединений путем добавления этанола вместе с активным соединением во внешнюю фазу липосом, когда метод градиента рН осуществляют в липосомах специального состава, называемых бесхолестериновыми липосомами.
В патентном литературном источнике 2, в дополнение к градиенту pH описан способ улучшения коэффициента захвата активных соединений за счет наличия во внутренней фазе липосом ионов меди.
Вместо градиента pH в методе с градиентом pH метод с сульфатом аммония, представляющий собой метод удаленной загрузки с использованием градиента ионов сульфата аммония, является методом заключения активных соединений во внутренней фазе липосом с помощью градиента ионов, таких как двухвалентный сульфат аммония (см. непатентный литературный источник 1 и патентный литературный источник 3).
В дополнение к методу градиента ионов, основанному на сульфате аммония, в патентном литературном источнике 4 описан метод заключения активных соединений в липосомы путем добавления бороновой кислоты вместе с активным соединением во внешнюю фазу липосом.
Вместо ионного градиента на основе сульфата аммония в патентном литературном источнике 5 описан метод, в котором по сравнению с ситуацией когда используют сульфат аммония скорость высвобождения активного соединения улучшается благодаря заключению активного соединения в липосомы с помощью ионного градиента анионов глюкуроновой кислоты.
Таким образом, с точки зрения коэффициента захвата методы удаленной загрузки являются прекрасными методами захвата. Однако в случае когда используют методы удаленной загрузки, за исключением особых случаев, например с Доксилем (липосомальный препарат DOX), в котором активное соединение, заключенное во внутренней фазе липосом, кристаллизованно, существует проблема, состоящая в том, что активное соединение имеет тенденцию к утечке из липосом в сыворотку крови и стабильность удержания активного соединения низка.
Как описано выше, при использовании обычных технических методов ситуация в настоящее время такова, что трудно достичь одновременно высокого коэффициента захвата активного соединения в липосомы и стабильности удержания активного соединения в липосомах.
Литературные источники предшествующего уровня техники
Патентные литературные источники
Патентный литературный источник 1: Патент Соединенных Штатов Америки №5192549, спецификация.
Патентный литературный источник 2: PCT Международная публикация WO 2006/037230, брошюра.
Патентный литературный источник 3: Патент Соединенных Штатов Америки №5316771, спецификация.
Патентный литературный источник 4: Патент Соединенных Штатов Америки №6051251, спецификация.
Патентный литературный источник 5: PCT Международная публикация WO 2005/046643, брошюра.
Непатентные литературные источники
Непатентный литературный источник 1: Yasuyuki Sazuka, «Liposome Preparation Method», «New Developments in Liposome Application: Toward the Development of Artificial Cells» (Kazunari Akiyoshi, Shigeru Tsujii, редакционная статья)» NTS, (2005), pp.33-37.
Непатентный литературный источник 2: Mayer LD et al., Biochimica et Biophysica Acta, (1986), 857: pp.123-126.
Непатентный литературный источник 3: N. Dos Santos et al., Biochimica et Biophysica Acta, (2004), 1661(1): pp.47-60.
Раскрытие изобретения
Проблема, решаемая с помощью изобретения
Задачей настоящего изобретения является создание липосомальной композиции с высоким коэффициентом захвата и стабильностью удержания активного соединения.
Способы решения проблемы
В результате всестороннего исследования, направленного на решение вышеуказанных проблем, авторы настоящего изобретения установили в отношении липосомальной композиции, активным соединением которой является эрибулин или его фармакологически приемлемая соль, что коэффициент захвата и стабильность удержания активного соединения в липосомальной композиции чрезвычайно высоки, что привело к завершению настоящего изобретения.
В частности, настоящее изобретение представляет собой следующее.
(1)
Липосомальная композиция, содержащая липосомы и содержащая активное соединение во внутренней фазе липосом, где активное соединение представляет собой эрибулин или его фармакологически приемлемую соль.
(2)
Липосомальная композиция по 1, находящаяся в твердой или жидкой форме.
(3)
Липосомальная композиция по 1 или 2, в которой внутренняя фаза липосом дополнительно содержит соль аммония.
(4)
Липосомальная композиция по 3, в которой концентрация вышеуказанной соли аммония составляет 10 мМ или выше.
(5)
Липосомальная композиция по любому из 1-4, в которой внутренняя фаза липосом дополнительно содержит соль, кислоту, основание и/или аминокислоту.
(6)
Липосомальная композиция по 5, в которой концентрация вышеуказанной соли составляет 1-300 мМ.
(7)
Липосомальная композиция по 5 или 6, в которой концентрация вышеуказанной кислоты составляет 1-300 мМ.
(8)
Липосомальная композиция по любому из 5-7, в которой концентрация вышеуказанной аминокислоты составляет 1-300 мМ.
(9)
Липосомальная композиция по любому из 5-8, в которой концентрация вышеуказанного основания составляет 1-300 мМ.
(10)
Липосомальная композиция по любому из 1-9, в которой концентрация вышеуказанного активного соединения составляет 0,01-300 мг/мл.
(11)
Липосомальная композиция по любому из 1-10, в которой вышеуказанное активное соединение представляет собой эрибулин мезилат.
(12)
Липосомальная композиция по любому из 1-11, в которой внутренняя фаза липосом дополнительно содержит сульфат аммония, лимонную кислоту и активное соединение.
(13)
Липосомальная композиция по любому из 1-12, в которой внешняя фаза липосом содержит сахар, электролит и/или аминокислоту.
(14)
Липосомальная композиция по любому из 1-13, в которой внешняя фаза липосом содержит сахар или электролит и аминокислоту.
(15)
Липосомальная композиция по 13 или 14, в которой концентрация вышеуказанного сахара составляет 2-20%.
(16)
Липосомальная композиция по любому из 13-15, в которой концентрация вышеуказанной аминокислоты составляет 1-300 мМ.
(17)
Липосомальная композиция по любому из 1-16, в которой внешняя фаза липосом содержит сахарозу или хлорид натрия и гистидин.
(18)
Липосомальная композиция по любому из 1-17, в которой вышеуказанная внутренняя фаза липосом по существу не содержит циклодекстрин.
(19)
Липосомальная композиция по любому из 1-18, в которой липосомы содержат гидрогенизированный фосфатидилхолин.
(20)
Липосомальная композиция по любому из 1-19, в которой липосомы содержат холестерин.
(21)
Липосомальная композиция по любому из 1-20, в которой липосомы содержат конденсат метоксиполиэтиленгликоля.
(22)
Липосомальная композиция по 21, в которой вышеуказанный конденсат метоксиполиэтиленгликоля представляет собой конденсат дистеароилфосфатидилэтаноламин-полиэтиленгликоля.
(23)
Липосомальная композиция по любому из 1-22, в которой липосомы содержат гидрогенизированный фосфатидилхолин, холестерин и конденсат дистеароилфосфатидилэтаноламин-полиэтиленгликоля.
(24)
Липосомальная композиция по 23, которая содержит от 10 до 80% вышеуказанного гидрогенизированного фосфатидилхолина, от 1 до 60% вышеуказанного холестерина и от 0 до 50% вышеуказанного конденсата дистеароилфосфатидилэтаноламин-полиэтиленгликоля.
(25)
Липосомальная композиция по любому из 1-24, в которой липосомы содержат гидрогенизированный соевый фосфатидилхолин, холестерин и полиэтиленгликоль 2000-фосфатидилэтаноламин.
(26)
Способ производства липосомальной композиции по любому из 1-25, включающий:
этап, на котором получают липосомальную дисперсионную жидкость, содержащую липосомы;
этап, на котором вышеуказанную липосомальную дисперсионную жидкость смешивают с вышеуказанным активным соединением; и
этап, на котором вышеуказанное активное соединение вводится во внутреннюю фазу липосом вышеуказанной липосомальной дисперсионной жидкости.
(27)
Способ по 26, в котором вышеуказанная липосомальная дисперсионная жидкость по существу не содержит соль аммония во внешней фазе липосом.
(28)
Способ по 26 или 27, в котором pH внешней фазы липосом вышеуказанной липосомальной дисперсионной жидкости равен 3-10.
(29)
Способ по любому из 26-28, в котором pH внешней фазы липосом вышеуказанной липосомальной дисперсионной жидкости равен 7-10.
(30)
Способ по 28 или 29, в котором вышеуказанный pH представляет собой pH внешней фазы липосом вышеуказанной липосомальной дисперсионной жидкости на этапе, на котором вышеуказанную липосомальную дисперсионную жидкость и вышеуказанное активное соединение смешивают.
(31)
Способ по любому из 26-30, в котором этап, на котором получают вышеуказанную липосомальную дисперсионную жидкость, включает этап, на котором получают предварительный липосомальный раствор, содержащий липосомы и содержащий соль аммония во внутренней фазе липосом и внешней фазе липосом; и этап, на котором внешнюю фазу липосом вышеуказанного предварительного липосомального раствора заменяют или разбавляют.
(32)
Способ по 31, в котором этап, на котором вышеуказанную внешнюю фазу липосом заменяют или разбавляют, является этапом, на котором pH внешней фазы липосом делают выше, чем рН внутренней фазы липосом.
(33)
Способ по 31 или 32, в котором этап, на котором вышеуказанную внешнюю фазу липосом заменяют или разбавляют, является этапом, на котором разница между pH внутренней фазы липосом и pH внешней фазы липосом составляет 1-5.
(34)
Способ по любому из 26-33, в котором pH вышеуказанной внутренней фазы липосом равен 3-9.
(35)
Способ по любому из 26-34, в котором pH вышеуказанной внутренней фазы липосом равен 4-9.
(36)
Способ по любому из 26-35, в котором pH вышеуказанной внутренней фазы липосом равен 5-8.
(37)
Способ по любому из 26-36, в котором внешняя фаза липосом представляет собой раствор, содержащий электролит на этапе, в котором вводят вышеуказанное активное соединение.
(38)
Способ по любому из 26-37, в котором вышеуказанная липосомальная дисперсионная жидкость по существу не содержит циклодекстрин во внутренней фазе липосом.
(39)
Способ по любому из 26-38, дополнительно включающий этап, на котором pH внешней фазы липосом делают нейтральным.
Эффект изобретения
По настоящему изобретению предложена новая липосомальная композиция. Липосомальная композиция по настоящему изобретению захватывает активное соединение во внутреннюю фазу липосом с высокой степенью эффективности и имеет высокую стабильность удержания активного соединения.
Краткое описание чертежей
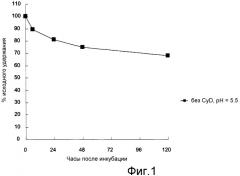
На фигуре 1 представлены изменения концентрации эрибулин мезилата в липосомальной композиции в сыворотке крови крыс (37°C) in vitro.
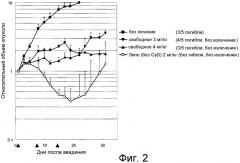
На фигуре 2 представлена противоопухолевая активность in vivo эрибулин мезилата из липосом у «голых» мышей с раковой опухолью FaDu.
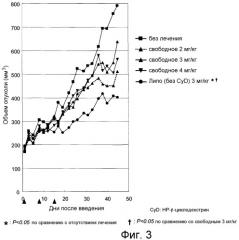
На фигуре 3 представлена противоопухолевая активность in vivo эрибулин мезилата из липосом у «голых» мышей с раковой опухолью ACHN.
Лучший способ осуществления изобретения
Настоящее изобретение конкретно описано с помощью вариантов осуществления изобретения, однако настоящее изобретение не ограничивается следующими вариантами осуществления изобретения и может осуществляться с различными модификациями.
Содержание литературных источников, приведенных в виде ссылок в настоящем изобретении, включено в настоящее изобретение посредством ссылок.
Определения
«Липосомы» означают микроскопические замкнутые везикулы, имеющие внутреннюю фазу, окруженную липидным бислоем. В настоящем изобретении липосомы включают небольшие одномембранные липосомы (SUV: небольшие однослойные везикулы), большие одномембранные липосомы (LUV: большие однослойные везикулы), одномембранные липосомы еще большего размера (GUV: гигантские однослойные везикулы), многослойные липосомы, имеющие несколько концентрических мембран (MLV: многослойные везикулы), липосомы, имеющие несколько мембран, не концентрических, а имеющих неправильную форму (MVV: мультивезикулярные везикулы), и так далее.
«Внутренняя фаза липосом» означает водный слой, заключенный в липидный бислой липосом, и используется в том же значении, что и «внутренняя водная фаза» и «внутренняя водная фаза липосом». «Внешняя фаза липосом» означает пространство, не заключенное в липидный бислой липосом (то есть пространство за пределами внутренней фазы и липидного бислоя), в случае когда липосомы диспергированы в жидкости.
«Липосомальная композиция» означает композицию, содержащую липосомы и дополнительно содержащую эрибулин мезилат во внутренней фазе липосом. В настоящем изобретении липосомальная композиция включает как твердые, так и жидкие формы.
«Липосомальная дисперсионная жидкость» означает композицию, содержащую липосомы, и представляет собой композицию до введения активного соединения во внутреннюю фазу липосом.
«Предварительный липосомальный раствор» означает композицию, содержащую липосомы, и представляет собой композицию до корректировки внешней фазы липосом с целью захвата эрибулин мезилата во внутреннюю фазу липосом.
«Липосомальный реагент» означает липосомальную дисперсионную жидкость в случае когда он находится в жидком виде. В случае когда он находится в твердом виде, это означает реагент, из которого липосомальную дисперсионную жидкость можно получать путем растворения или суспендирования в установленном растворителе. Растворитель описан ниже. Как описано ниже, твердый липосомальный реагент можно получать, например, путем высушивания липосомальной дисперсионной жидкости.
В настоящем описании «смешивание твердого и жидкого» включает растворение и суспендирование твердого вещества в жидкости, и смешивание, растворение и суспендирование используют взаимозаменяемым образом. Аналогично, растворитель и дисперсионную среду также используют взаимозаменяемым образом.
Кроме того, липосомальная композиция, липосомальная дисперсионная жидкость, предварительный липосомальный раствор и липосомальный реагент по настоящему изобретению по существу не содержат циклодекстрин. «По существу не содержать циклодекстрин» означает, что циклодекстрин не добавляют. Достаточно, если циклодекстрин не содержится в количестве, при котором улучшение растворимости (номинальной растворимости) активного соединения из-за циклодекстрина наблюдается в значительной степени, и даже в случае когда его добавляют в количестве, при котором улучшение растворимости активного соединения не наблюдается в значительной степени, это не должно быть исключением из вариантов осуществления настоящего изобретения.
Кроме того, в качестве предпочтительного способа осуществления настоящего изобретения «липосомальная дисперсионная жидкость, по существу не содержащая соль аммония во внешней фазе липосом», означает, что соль аммония не добавляют во внешнюю фазу липосомальной дисперсионной жидкости. Добавление соли аммония в количестве, находящемся в пределах диапазона, который позволяет достичь цели настоящего изобретения, не должно быть исключением из вариантов осуществления настоящего изобретения. В случае когда соль аммония содержится во внешней фазе липосом предварительного липосомального раствора, возможно получать липосомальную дисперсионную жидкость, которая по существу не содержит соль аммония, путем замены или разбавления внешней фазы липосом предварительного липосомального раствора, используя раствор, который по существу не содержит соль аммония.
Активное соединение
Активным соединением по настоящему изобретению является эрибулин или его фармакологически приемлемая соль (далее в данном документе иногда называемый «эрибулин и так далее»). Не существует конкретных ограничений в отношении фармакологически приемлемой соли при условии, что образуются эрибулин и соль, будь то соль неорганической кислоты или соль органической кислоты. Например, можно упомянуть соль соляной кислоты, соль серной кислоты, цитрат, соль бромистоводородной кислоты, соль йодистоводородной кислоты, соль азотной кислоты, бисульфат, соль фосфорной кислоты, соль суперфосфорной кислоты, соль изоникотиновой кислоты, соль уксусной кислоты, соль молочной кислоты, соль салициловой кислоты, соль винной кислоты, соль пантотеновой кислоты, соль аскорбиновой кислоты, соль янтарной кислоты, соль малеиновой кислоты, соль фумаровой кислоты, соль глюконовой кислоты, соль сахариновой кислоты, соль муравьиной кислоты, соль бензойной кислоты, соль глютаминовой кислоты, соль метансульфоновой кислоты, соль этансульфоновой кислоты, соль бензолсульфоновой кислоты, соль п-толуолсульфоновой кислоты, соль памовой кислоты (памоат) и так далее. Предпочтительными среди них являются соль соляной кислоты, соль серной кислоты, соль уксусной кислоты, соль фосфорной кислоты, цитрат и соль мезиловой кислоты, и наиболее предпочтительной из всех является соль мезиловой кислоты. То есть предпочтительным активным соединением по настоящему изобретению является эрибулин мезилат.Более того, в качестве фармакологически приемлемой соли эрибулина допустимо использовать эрибулин и соли алюминия, кальция, лития, магния, кальция [sic], натрия, цинка и диэтаноламина. Эрибулин или его фармакологически приемлемая соль представляет собой соединение или его соль, указанные в брошюре РСТ международной публикации WO 99/65894 или патенте Соединенных Штатов Америки 6214865 (содержание этих патентов включено в данный документ посредством ссылок) и обладающие фармакологическим действием, включая противоопухолевое действие и антимитотическое действие. Эрибулин или его фармакологически приемлемая соль оказывает противоопухолевое действие в отношении меланомы, фибросаркомы, моноцитарного лейкоза, рака толстой кишки, рака яичников, рака молочной железы, рака костей, рака простаты, рака легких и ras-трансформированных фибробластов.
Однако в качестве активных соединений, которые можно комбинировать с эрибулином, и так далее можно выбирать среди соединений, используемых в области медицины (в том числе диагностических препаратов), косметической продукции, пищевых продуктов и так далее. Что касается активных соединений, допустимо объединять одно или несколько соединений, отличных от эрибулина, и так далее.
В качестве активных соединений можно упомянуть низкомолекулярные соединения и так далее. Среди них подходящими являются соединения, используемые в качестве противоопухолевых средств, антибактериальных средств, противовоспалительных средств, средств против инфаркта миокарда и контрастных веществ.
Что касается молекулярного веса активного соединения, более предпочтительным является диапазон от 100 до 2000, диапазон от 200 до 1500, и еще более предпочтительным является диапазон от 300 до 1000. В пределах этих диапазонов проницаемость липосомальной мембраны для активного соединения в целом удовлетворительная, и настоящее изобретение может быть соответствующим образом применено.
Активные соединения включают водорастворимые соединения и липофильные соединения, и настоящее изобретение может быть применено при условии, что они более или менее растворимы в воде или водных растворителях.
В настоящем изобретении не существует конкретных ограничений в отношении противоопухолевых средств и можно упомянуть, например, производные камптотецина, такие как иринотекан гидрохлорид, ногитекан гидрохлорид, экзатекан, RFS-2000, луртотекан, BNP-1350, Bay-383441, PNU-166148, IDEC-132, BN-80915, DB-38, DB-81, DB-90, DB-91, CKD-620, T-0128, ST-1480, ST-1481, DRF-1042, DE-310; производные таксана, такие как доцетаксел гидрид, доцетаксел, паклитаксел, IND-5109, BMS-184476, BMS-188797, T-3782, TAX-1011, SB-RA-31012, SBT-1514 и DJ-927; ифосфамид, нимустин гидрохлорид, карвокон, циклофосфамид, дакарбазин, тиотепа, бусульфан, мелфалан, ранимустин, эстрамустин натрия фосфат, 6-меркаптопурин-рибозид, эноцитабин, гемцитабин гидрохлорид, кармфур, цитарабин, цитарабин окфосфат, тегафур, доксифлуридин, гидроксикарбамид, фторурацил, метотрексат, меркаптопурин, флударабин фосфат, актиномицин D, акларубицин гидрохлорид, идарубицин гидрохлорид, пирарубицин гидрохлорид, эпирубицин гидрохлорид, даунорубицин гидрохлорид, доксорубицин гидрохлорид, эпирубицин, пирарубицин, даунорубицин, доксорубицин, пирарубицин гидрохлорид, блеомицин гидрохлорид, зиностатин стималамер, неокарциностатин, митомицин С, блеомицин сульфат, пепломицин сульфат, этопозид, винорельбин тартрат, винкристин сульфат, виндезин сульфат, винбластин сульфат, амрубицин гидрохлорид, гефитиниб, экземестан, капецитабин, TNP-470, TAK-165, KW-2401, KW-2170, KW-2871, KT-5555, KT-8391, TZT-1027, S-3304, CS-682, YM-511, YM-598, TAT-59, TAS-101, TAS-102, TA-106, FK-228, FK-317, E7070, (8E, 12E, 14E)-7-[(4-циклогептипиперазин-1-ил)карбонил]окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (E7107), KRN-700, KRN-5500, J-107088, HMN-214, SM-11355, ZD-0473 и так далее. Что касается соединений, записанных в виде солей, среди вышеупомянутых противоопухолевых средств любая соль является приемлемой и свободные основные вещества также являются приемлемыми. Что касается соединений, записанных в виде свободных основных веществ, любая их соль является приемлемой.
Не существует конкретных ограничений в отношении антибактериальных средств и можно упомянуть, например, амфотерицин B, цефотиам гексил, цефалоспорин, хлорамфеникол, диклофенак и так далее. Что касается соединений вышеупомянутых антибактериальных средств, любая их соль является приемлемой.
Не существует конкретных ограничений в отношении противовоспалительных средств и можно упомянуть, например, простагландины (PGE1, PGE2), дексаметазон, гидрокортизон, пироксикам, индометацин, преднизолон и так далее. Что касается соединений вышеупомянутых противовоспалительных средств, любая их соль является приемлемой.
Не существует конкретных ограничений в отношении средств против инфаркта миокарда и можно упомянуть, например, аденозин, атенолол, пилсикаинид и так далее, а в качестве контрастных веществ можно упомянуть, например, йопамидол, йоксагловую кислоту, йогексол, йомепрол и так далее. Что касается соединений вышеупомянутых средств против инфаркта миокарда и контрастных веществ, любая их соль является приемлемой.
Липиды
Предпочтительно, чтобы мембранные составляющие липосом по настоящему изобретению включали фосфолипиды и/или производные фосфолипидов. В качестве фосфолипидов и производных фосфолипидов можно упомянуть, например, фосфатидилэтаноламин, фосфатидилхолин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, кардиолипин, сфингомиелин, церамид фосфорилэтаноламин, церамид фосфорилглицерин, церамид фосфорилглицеринфосфат, 1,2-димиристоил-1,2-дезоксифосфатидилхолин, плазмалоген, фосфатидную кислоту и так далее. Можно комбинировать один или несколько этих фосфолипидов и производных фосфолипидов.
Не существует конкретных ограничений в отношении остатков жирных кислот в фосфолипидах и производных фосфолипидов и можно упомянуть, например, остатки насыщенных или ненасыщенных жирных кислот с числом атомов углерода от 12 до 20. Конкретно можно упомянуть ацильные группы из жирных кислот, таких как лауриновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота и линолевая кислота. Можно также использовать фосфолипиды, полученные из природных веществ, такие как лецитин яичного желтка и соевый лецитин, частично гидрогенизированный лецитин яичного желтка, в котором остаток ненасыщенной жирной кислоты частично или полностью гидрогенизирован, (полностью) гидрогенизированный лецитин яичного желтка, частично гидрогенизированный соевый лецитин, (полностью) гидрогенизированный соевый лецитин и так далее.
Не существует конкретных ограничений в отношении смешиваемого количества (мольной доли) фосфолипидов и/или производных фосфолипидов, которые используют при получении липосом, однако предпочтительно использовать от 10 до 80% по отношению ко всему составу мембран липосом, и более предпочтительно - от 30 до 60%.
Что касается компонентов мембран, помимо фосфолипидов и/или производных фосфолипидов липосомы по настоящему изобретению могут также включать стерины, такие как холестерин и холестенол, в качестве стабилизаторов мембран - жирные кислоты, содержащие насыщенные или ненасыщенные ацильные группы с числом атомов углерода от 8 до 22, и антиоксиданты, такие как α-токоферол.
Не существует конкретных ограничений в отношении смешиваемого количества (мольной доли) этих стеринов, используемых при получении липосом, однако предпочтительно использовать от 1 до 60% по отношению ко всему составу мембран липосом, более предпочтительно - от 10 до 50% и еще более предпочтительно - от 30 до 50%.
Кроме того, не существует конкретных ограничений в отношении смешиваемого количества (мольной доли) жирных кислот, однако предпочтительно использовать от 0 до 30% по отношению ко всему составу мембран липосом, более предпочтительно - от 0 до 20% и еще более предпочтительно - от 0 до 10%. Что касается смешиваемого количества (мольной доли) антиоксидантов, достаточно если добавляют количество, способное обеспечить антиоксидантный эффект, однако предпочтительно использовать от 0 до 15% по отношению ко всему составу мембран липосом, более предпочтительно - от 0 до 10% и еще более предпочтительно - от 0 до 5%.
Липосомы по настоящему изобретению могут также содержать функциональные липиды и модифицированные липиды в качестве мембранных компонентов.
В качестве функциональных липидов можно упомянуть производные липидов, сохраняющиеся в крови, термочувствительные производные липидов, рН-чувствительные производные липидов и так далее. В качестве модифицированных липидов можно упомянуть ПЭГ-липиды, сахарные липиды, антитело-модифицированные липиды, пептид-модифицированные липиды и так далее.
В качестве производных липидов, сохраняющихся в крови, можно упомянуть, например, гликофорин, ганглиозид GM1, ганглиозид GM3, производные глюкуроновой кислоты, производные глютаминовой кислоты, производные полиглицеринфосфолипидов, производные полиэтиленгликоля (конденсаты метоксиполиэтиленгликоль и так далее), такие как N-[карбонил-метоксиполиэтиленгликоль-2000]-1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин, N-[карбонил-метоксиполиэтиленгликоль-5000]-1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин, N-[карбонил-метоксиполиэтиленгликоль-750]-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин, N-[карбонил-метоксиполиэтиленгликоль-2000]-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин, (MPEG 2000-дистеароилфосфатидилэтаноламин) и N-[карбонил-метоксиполиэтиленгликоль-5000]-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин, которые представляют собой конденсаты фосфоэтаноламина и метоксиполиэтиленгликоля. При наличии липосом, содержащих производные липидов со способностью сохраняться в крови, становится возможным улучшать способность сохраняться в крови липосом, поскольку захват липосом как посторонних примесей, в печени и так далее становится затруднительным.
В качестве термочувствительных производных липидов можно упомянуть, например, дипальмитоилфосфатидилхолин и так далее. При наличии липосом, содержащих термочувствительные производные липидов, становится возможным вызывать разрушение липосом при определенных температурах и вызывать изменения в поверхностных свойствах липосом. Более того, при сочетании этого с повышением температуры в целевой зоне опухоли и так далее становится возможным разрушать липосомы в целевой зоне и высвобождать активное соединение в целевой зоне.
В качестве pH-чувствительных производных липидов можно упомянуть, например, диолеоилфосфатидилэтаноламин и так далее. При наличии липосом, содержащих pH-чувствительные производные липидов, становится возможным стимулировать мембранное слияние липосом и эндосом, когда липосомы попадают в клетку за счет эндоцитоза, и улучшать перенос активного соединения в клеточную ткань.
В качестве сахарных липидов антитело-модифицированных липидов и пептид-модифицированных липидов можно упомянуть липиды, связанные с сахарами, антителами или пептидами, которые совместимы с клетками-мишенями или тканями-мишенями. Благодаря использованию модифицированных липидов липосомы могут активно переноситься к клеткам-мишеням или тканям-мишеням.
Не существует конкретных ограничений в отношении смешиваемого количества (мольной доли) используемых производных липидов со способностью сохраняться в крови при получении липосом, однако предпочтительно использовать от 0 до 50% относительно всего количества липидов, составляющих мембраны липосом, более предпочтительно - от 0 до 30% и еще более предпочтительно - от 0 до 20%.
Липосомы
Как упоминалось выше, липосомы представляют собой микроскопические замкнутые везикулы, имеющие внутреннюю фазу, окруженную липидным бислоем.
В идеале, что касается липосом, предпочтительно, чтобы для эрибулина и так далее существовала барьерная функция, препятствующая его утечке во внешнюю фазу липосом после того как эрибулин и так далее был заключен во внутреннюю фазу липосом. В случае когда их используют в качестве лекарственного средства, желательно, чтобы липосомы обладали стабильностью in vivo и чтобы для эрибулина и так далее существовала барьерная функция, препятствующая его утечке во внешнюю фазу липосом в крови, когда липосомы вводят in vivo.
Состав мембранных компонентов для липосом, обладающих такой мембранной проницаемостью на уровне, допускающем практическое применение, могут должным образом выбирать специалисты в данной области в зависимости от активного соединения, ткани-мишени и тому подобного, сверяясь при необходимости с вариантами осуществления, описанными ниже (Hiroshi Kikuchi, et. al., «Liposome I-Preparation Method and Assay Method-», Cell Technology (1983), 2(9): pp.1136-1149, и с литературными источниками, приведенными в указанной публикации).
При использовании в качестве лекарственного средства желательно, чтобы эрибулин и так далее высвобождался из липосом после того как липосомы достигнут ткани-мишени, клеток или внутриклеточных органелл. Что касается липосом, сами мембранные компоненты, как правило, являются биодеградируемыми и в конечном счете разлагаются в ткани-мишени и тому подобном. Считается, что захваченный эрибулин и так далее высвобождается таким образом. Более того, также приемлемо, если липосомы сами включаются в клетки.
Липосомальная композиция не только может быть нацелена на ткань-мишень, такую как солидный рак, но ее также можно использовать для переноса активных соединений для гематологического рака и так далее. Ее также можно использовать в крови в качестве препарата с замедленным высвобождением, препарата с контролируемым высвобождением и так далее.
Размер частиц липосом можно устанавливать в зависимости от задач. Например, если необходимо доставить липосомы к раковой ткани или воспаленной ткани при помощи эффекта EPR (повышенная проницаемость и удержание) в виде инъекционного продукта или тому подобного, предпочтительно, чтобы размер частиц липосом составлял от 30 до 400 нм, и более предпочтительно, чтобы размер частиц составлял от 50 до 200 нм. В случае когда нужно доставить липосомы к макрофагам, предпочтительно, чтобы размер частиц липосом составлял от 30 до 1000 нм, и более предпочтительно, чтобы размер частиц составлял от 100 до 400 нм. В случае когда липосомальную композицию предстоит использовать в качестве перорального препарата или трансдермального препарата, размер частиц липосом можно устанавливать в несколько микрон. Следует отметить, что (1) в нормальной ткани стенки сосудов служат барьером (потому что стенки сосудов состоят из плотно прилегающих сосудистых эндотелиальных клеток) и микрочастицы, такие как супермолекулы и липосомы заданного размера, не могут распространяться в ткани. Однако в пораженной ткани стенки сосудов рыхлые (потому что между клетками эндотелия сосудов существуют промежутки), что увеличивает проницаемость сосудов, и супермолекулы и микрочастицы могут распространяться в ткани за пределами сосудов (повышенная проницаемость). Кроме того, (2) в нормальной ткани лимфатическая система хорошо развита, однако известно, что в пораженной ткани лимфатическая система не развита и что супермолекулы или микрочастицы после их включения не перерабатываются в рамках общей системы, а сохраняются в пораженной ткани (повышенное удержание) - это называется эффект EPR (Matsumura, Maeda, Cancer Research, (1986), 46: pp.6387-6392). Следовательно, можно контролировать фармакокинетику путем регулирования размеров частиц липосом.
В настоящем изобретении размер частиц липосом означает средневзвешенный размер частиц, определенный методом динамического рассеяния света (метод квазиупругого рассеяния света). В данном документе приведен размер частиц, измеренный на приборах для динамического рассеяния света (например, модель Zetasizer Nano ZS производства Malvern Instruments Ltd. и ELS-8000 производства Otsuka Electronics Co., Ltd.). Приборы измеряют броуновское движение частиц, и размер частиц определяют на основе устоявшейся методологической теории динамического рассеяния света.
Не существует конкретных ограничений в отн