Препарат антитела
Иллюстрации
Показать всеГруппа изобретений относится к медицине, в частности к составам, содержащим человеческое анти-СD20 моноклональное антитело, поверхностно-активное вещество: полисорбат или полоксамер, трегалозу, гистидиновый буфер, к способам его изготовления и применения. Группа изобретний обеспечивает составы для парэнтерального введения с хорошей стабильностью при хранении при температуре 2-8° и 25°С с достаточной устойчивостью в отношении физических факторов, таких как агрегация, и химических, таких как фрагментация. 3 н. и 2 з.п. ф-лы, 2 табл., 2 пр.
Реферат
Данное изобретение относится к составу с анти-CD20 моноклональным антителом, к способу изготовления указанного состава и применениям данного состава.
Уровень техники
Молекула CD20 (также называемая человеческим В-лимфоцитарным антигеном дифференцировки или Вр35) представляет собой гидрофобный трансмембранный белок с молекулярной массой приблизительно 35 кДа, находящийся на пре-В и зрелых В-лимфоцитах (Valentine et al. (1989) J. Biol. Chem. 264(19):11282-11287; и Einfield et al. (1988) EMBO J. 7(3):711-717). CD20 находится на поверхности более 90% В-клеток периферической крови или лимфоидных органов, экспрессируется в раннем пре-В-клеточном развитии и сохраняется до этапа дифференциации плазматических клеток. CD20 присутствует и на нормальных В-клетках, и на злокачественных В-клетках. В частности, CD20 экспрессируется на более чем 90% В-клеток неходжкинских лимфом (non-Hodgkin's lymphomas, NHL) (Anderson et al. (1984) Blood 63(6): 1424-1433)), но он не найден на гемопоэтических стволовых клетках, про-В-клетках, нормальных плазматических клетках или других нормальных тканях (Tedder et al. (1985) J, Immunol. 135(2):973-979).
85-аминокислотный участок карбоксильного конца белка CD20 находится в цитоплазме. Длина этого участка отличается от длины других специфических В-клеточных поверхностных структур, таких как IgM, IgD и тяжелые цепи IgG или антигены гистосовместимости класса I1 α- или β-цепей, которые имеют сравнительно короткие внутрицитоплазматические участки из 3, 3, 28, 15 и 16 аминокислот соответственно (Komaromy et al. (1983) NAR 11:6775-6785). Из последних 61 аминокислот карбоксильного конца 21 является кислотным остатком, тогда как только 2 являются основными, указывая, что этот участок имеет сильный отрицательный заряд. Номер в ГенБанке (GenBank Accession No) NP-690605. Считается, что CD20 могут участвовать в регулировании первого этапа(ов) процессов активации и дифференцировки В-клеток (Tedder et al. (1986) Eur. J. Immunol. 25 16:881-887) и могут функционировать в качестве каналов для ионов кальция (Tedder et al. (1990) J. Cell. Biochem. 14D: 195).
Существует два различных типа анти-CD20-антител, значительно различающихся в характере их связывания CD20 и биологических активностей (Cragg, M.S., et al, Blood, 103 (2004) 2738-2743; и Cragg, M.S., et al, Blood, 101 (2003) 1045-1051). Антитела I типа, такие как ритуксимаб, являются мощными в отношении опосредованной комплементом цитотоксичности, в то время как антитела II типа, такие как тозитумомаб (Bexxar®, В1), 11В8 и АТ80, эффективно инициируют смерть клетки-мишени путем каспаза-независимого апоптоза с сопутствующим высвобождением фосфатидилсерина.
Общие особенности анти-CD20 антител I и II типа приведены в таблице 1.
| Таблица 1 | |
| Свойства анти-CD20 антител I и II типа | |
| анти-CD20 антитела I типа | анти-CD20 антитела II типа |
| эпитоп CD20 I типа | эпитоп CD20 II типа |
| Локализация CD20 на липидных рафтах | Нет локализации CD20 на липидных рафтах |
| Увеличена CDC (при изотипе IgG1) | Уменьшена CDC (при изотипе IgG1) |
| Антителозависимая клеточная | Антителозависимая клеточная |
| цитотоксичность (при изотипе IgG1) | цитотоксичность (при изотипе IgG1) |
| Полная связывающая способность | Уменьшенная связывающая способность |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Апоптоз при перекрестном сшивании | Сильная индукция клеточной гибели без перекрестного сшивания |
Сущность изобретения
В одном аспекте изобретение относится к фармацевтическому составу, содержащему:
от 1 до 150 мг/мл анти-CD20 антитела;
от 1 до 100 мМ буфера;
возможно от 0,001 до 1% поверхностно-активного вещества; а также
возможно от 1 до 800 мМ тонического агента;
при рН в диапазоне от 4,5 до 7,0.
Предпочтительно указанное анти-CD20 антитело является антителом II типа. Более предпочтительно указанное анти-CD20 антитело является гуманизированным B-Ly1 антителом.
Подробное описание изобретения
Термин "антитело" включает в себя различные формы антител, в том числе, без ограничения, целые антитела, человеческие антитела, гуманизированные антитела и антитела, полученные путем генной инженерии, такие как моноклональные антитела, химерные антитела или рекомбинантные антитела, а также фрагменты таких антител до тех пор, пока сохраняются их характерные свойства в соответствии с изобретением.
"Фрагменты антитела" включают часть антитела полной длины, как правило, по меньшей мере связывающую часть антигена или его вариабельную область. Примеры фрагментов антител включают двойные антитела, одноцепочечные молекулы антител, иммунотоксины и полиспецифические антитела, сформированные из фрагментов антител. Кроме того, фрагменты антитела включают одноцепочечные полипептиды, имеющие характеристики цепи VH, а именно возможность объединяться с цепью VL, или характеристики цепи VL, связывающей антиген CD20, а именно возможность объединяться с цепью VH для формирования функционального антиген-связывающего кармана.
"Фрагменты антител" также включают такие фрагменты, которые сами по себе не способны обеспечивать эффекторные функции (ADCC/CDC), но обеспечивают эти функции в соответствии с изобретением после комбинирования с константным доменом(ами) соответствующего антитела.
Используемые в данном документе термины "моноклональное антитело" или "композиция с моноклональным антителом" относятся к изготовлению молекул антитела единого аминокислотного состава. Таким образом, термин "человеческое моноклональное антитело" относится к антителам, демонстрирующим одинаковую специфичность связывания, которые имеют вариабельные и константные области, полученные из человеческих зародышевых последовательностей иммуноглобулина. В одном воплощении человеческие моноклональные антитела производят с помощью гибридомы, которая включает В-клетки, полученные из трансгенного отличного от человека животного, например из трансгенной мыши, с геномом, содержащим трансген человеческой тяжелой цепи и трансген человеческой легкой цепи, слитым с иммортализованной клеткой.
Термин "химерное антитело" относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, из одного источника или вида и по меньшей мере часть константной области, полученной из различных источников и видов, как правило полученных с помощью методик рекомбинантной ДНК. Особенно предпочтительными являются химерные антитела, содержащие мышиный вариабельный участок и человеческий константный участок. Такие мышиные/человеческие химерные антитела являются продуктом экспрессированных генов иммуноглобулинов, содержащих сегменты ДНК, кодирующие вариабельные участки мышиного иммуноглобулина, и сегменты ДНК, кодирующие константные участки человеческого иммуноглобулина. Другими формами "химерных антител", охватываемыми данным изобретением, являются те, в которых класс или подкласс был модифицирован или изменен по сравнению с исходным антителом. Такие "химерные" антитела также называют "антителами с переключением класса". Способы получения химерных антител включают обычные методики рекомбинантной ДНК и генной трансфекции, в настоящее время хорошо известные в данной области. См., например, Morrison, S.L, et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; патенты США 5202238 и 5204244.
Термин "гуманизированное антитело" относится к антителам, в которых были изменены каркасные участки или "участки, определяющие комплементарность" (CDR) так, чтобы они содержали CDR иммуноглобулина другой специфичности, отличной от родительского иммуноглобулина. В предпочтительном воплощении мышиный CDR прививают каркасному участку человеческого антитела для получения "гуманизированного антитела". См., например, Riechmann, L., et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Особенно предпочтительные CDR соответствуют тем из представленных последовательностей, которые распознают отмеченные выше антигены для химерных и бифункциональных антител.
Термин "человеческое антитело", используемый в данном документе, включает антитела с вариабельными и константными участками, полученными из человеческих зародышевых последовательностей иммуноглобулина. Человеческие антитела хорошо известны в данной области (van Dijk, M.A., and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374). На основе такой технологии можно получить человеческие антитела против самых разнообразных мишеней. Примерами человеческих антител являются, например, описанные в Kellermann, S. A., et al., Curr Opin Biotechnol. 13 (2002) 593-597.
Термин "рекомбинантное человеческое антитело", используемый в данном документе, охватывает все человеческие антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, таких как антитела, выделенные из принимающей клетки (клетки-хозяина), такой как клетка NS0 или СНО, или животного (например, мыши), которые являются трансгенными для человеческих генов иммуноглобулинов или антител, экспрессируемых с помощью рекомбинантного вектора экспрессии, трансфицированного в принимающую клетку (клетку-хозяина). Такие рекомбинантные человеческие антитела имеют вариабельный и константный участки, полученные из зародышевых последовательностей человеческого иммуноглобулина, в перегруппированной форме. Рекомбинантные человеческие антитела в соответствии с изобретением подвергали соматическому гипермутированию in vivo. Таким образом, аминокислотные последовательности участков VH и VL рекомбинантных антител являются последовательностями, которые, будучи полученными из и связанными с человеческими зародышевыми последовательностями VH и VL, не могут естественным образом существовать в наборе человеческих зародышевых антител in vivo.
Используемые в данном документе термины "специфически связывающийся" или "связывается специфически с" относятся к антителу, специфически связывающемуся с антигеном CD20. Предпочтительно аффинность связывания имеет значение KD 10-9 моль/л или ниже (например, 10-10 моль/л), предпочтительно значение KD 10-10 моль/л или ниже (например, 10-12 моль/л). Аффинность связывания определяют с помощью стандартного анализа связывания, такого как методика поверхностного плазменного резонанса (Biacore®).
Термин "нуклеиновокислотная молекула", используемый в данном документе, включает молекулы ДНК и РНК. Нуклеиновокислотная молекула может быть одноцепочечной или двуцепочечной, но предпочтительной является двуцепочечная ДНК.
"Константные домены" не участвуют непосредственно в связывании антитела с антигеном, но участвуют в эффекторных функциях (ADCC, реакция связывания комплемента и CDC).
Термин "вариабельный участок" (вариабельный участок легкой цепи (VL), вариабельный участок тяжелой цепи (VH)), используемый в данном документе, означает пару из легкой и тяжелой цепей, которая непосредственно участвует в связывании антитела с антигеном. Домены вариабельной человеческой легкой и тяжелой цепей имеют одинаковые общие структуры, и каждый домен содержит четыре каркасных участка (framework region, FR), последовательности которых в значительной степени консервативны, соединенные тремя "гипервариабельными участками" (или участками, определяющими комплементарность, CDR). Каркасные участки принимают конформацию b-листа, и CDR могут образовывать петли, связывающие структуру b-листа. CDR в каждой цепи удерживаются в их трехмерной структуре с помощью каркасных участков и образуют вместе с CDR из другой цепи антиген-связывающий участок. CDR3-участки тяжелой и легкой цепи антитела играют особенно важную роль в специфичности связывания/аффинности антител в соответствии с изобретением и, следовательно, обеспечивают дальнейший предмет изобретения.
Термины "гипервариабельный участок" или "антигенсвязывающая часть антитела", используемые в данном документе, относятся к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельный участок содержит аминокислотные остатки из "участков, определяющих комплементарность", или "CDR". "Каркасными участками", или "FR", являются те участки вариабельного домена, которые отличаются от остатков гипервариабельных участков, определенных здесь. Таким образом, легкие и тяжелые цепи антитела содержат от N-конца к С-концу домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. В частности, CDR3 тяжелой цепи является участком, который вносит наибольший вклад в связывание антигена. Области CDR и FR определены в соответствии со стандартной системой определения Кабата, Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) и/или этими остатками из "гипервариабельной петли".
Термины "CD20" и "CD20-антиген" используются в данном документе как взаимозаменяемые и включают в себя любые варианты, изоформы и виды гомологов человеческого CD20, которые естественным образом экспрессируются клетками или экспрессируются на клетках, трансфецированных геном CD20. Связывание антитела изобретения с антигеном CD20 опосредует уничтожение клеток, экспрессирующих CD20 (например, опухолевой клетки) путем инактивации CD20. Уничтожение клеток, экспрессирующих CD20, может осуществляться по одному или более из следующих механизмов.
Синонимы CD20, принятые в данной области, включают В-лимфоцитарный антиген CD20, В-лимфоцитарный поверхностный антиген В1, Leu-16, Bp35, BM5 и LF5.
Термин "анти-CD20 антитело" в соответствии с изобретением обозначает антитело, которое специфично связывает CD20-антиген. В зависимости от связывающих свойств и биологической активности анти-CD20 антител с CD20-антигеном можно различать два типа aнти-CD20 антител (тип I и тип II анти-CD20 антител) в соответствии с Cragg, M.S., et al, Blood 103 (2004) 2738-2743; и Cragg, M.S., et al Blood 101 (2003) 1045-1051, см. таблицу 2.
| Таблица 2 | |
| Свойства анти-CD20 антител I и II типа | |
| анти-CD20 антитела I типа | анти-CD20 антитела II типа |
| эпитоп CD20 I типа | эпитоп CD20 II типа |
| Локализация CD20 на липидных рафтах | Нет локализации CD20 на липидных рафтах |
| Увеличена CDC (при изотипе IgG1) | Уменьшена CDC (при изотипе IgG1) |
| Антителозависимая клеточная цитотоксичность (при изотипе lgG1) | Антителозависимая клеточная цитотоксичность (при изотипе IgG1) |
| Полная связывающая способность | Уменьшенная связывающая способность |
| Гомотипическая агрегация | Более сильная гомотипическая агрегация |
| Апоптоз при перекрестном сшивании | Сильная индукция клеточной гибели без перекрестного сшивания |
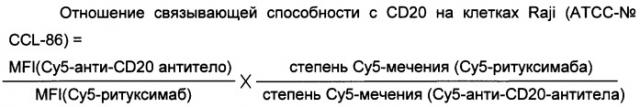
Одним из важнейших свойств анти-CD20 антител I и II типа является их способ связывания. Таким образом, анти-CD20 антитела I и II типа можно классифицировать по связывающей способности указанного анти-CD20 антитела с CD20 на клетках Raji (АТСС-№ CCL-86) по сравнению с ритуксимабом.
Используемый в данном документе термин "анти-CD20 антитело" может использоваться для антитела I или II типа. Предпочтительно это антитело II типа.
Aнти-CD20 антитела I типа имеют отношение связывающей способности указанного анти-CD20 антитела с CD20 на клетках Raji (АТСС-№ CCL-86) к связывающей способности с ритуксимабом от 0,8 до 1,2, предпочтительно от 0,9 до 1,1. Примеры таких анти-CD20 антител I типа включают ритуксимаб (WO 94/11026), 1F5 IgG2a (ЕСАСС, гибридома; Press et al., Blood 69/2:584-591 (1987)), HI47 IgG3 (ЕСАСС, гибридома), 2С6 IgG1 (раскрыто в WO 2005/103081), 2F2 IgG1 (раскрыто в WO 2004/035607 и WO 2005/103081) и 2Н7 IgG1 (раскрыто в WO 2004/056312). Предпочтительно указанное анти-CD20 антитело I типа представляет собой моноклональное антитело, которое связывается с таким же эпитопом, как ритуксимаб. AHTH-CD20 антитела II типа имеют отношение связывающей способности указанного анти-CD20 антитела с CD20 на клетках Raji (АТСС-№ CCL-86) к связывающей способности с ритуксимабом от 0,3 до 0,6, предпочтительно от 0,35 до 0,55, более предпочтительно от 0,4 до 0,5. Примеры таких анти-CD20 антител II типа включают тозитумомаб (В1 IgG2a), гуманизированное B-Ly1 антитело IgG1 (химерное гуманизированное антитело IgG1, раскрыто в WO 2005/044859), 11 В8 IgG1 (раскрыто в WO 2004/035607) и АТ80 IgG1. Предпочтительно указанное анти-CD20 антитело II типа представляет собой моноклональное антитело, которое связывается с таким же эпитопом, как гуманизированное B-Ly1 антитело (раскрыто в WO 2005/044859).
"Отношение связывающей способности анти-CD20 антител с CD20 на клетках Raji (АТСС-№CCL-86) к связывающей способности с ритуксимабом" определяют путем прямого иммунофлуоресцентного анализа (измеряют среднюю интенсивность флуоресценции (MFI, mean fluorescence intensity)) с использованием указанного анти-CD20 антитела, конъюгированного с Су5, и ритуксимаба, конъюгированного с Су5, в FACS-анализе (Becton Dickinson) с клетками Raji (ATCC-№ CCL-86), как описано в примере №2, и рассчитывают следующим образом.
MFI представляет собой среднюю интенсивность флуоресценции. Используемый здесь термин "степень Су5-мечения" означает число молекул Су5-метки на молекулу антитела.
Обычно указанное анти-CD20 антитело I типа имеет отношение связывающей способности указанного анти-CD20 антитела I типа с CD20 на клетках Raji (АТСС-№ CCL-86) к связывающей способности с ритуксимабом от 0,8 до 1,2, предпочтительно от 0,9 до 1,1.
Обычно указанное анти-CD20 антитело II типа имеет отношение связывающей способности указанного анти-CD20 антитела I типа с CD20 на клетках Raji (АТСС-№ CCL-86) к связывающей способности с ритуксимабом от 0,3 до 0,6, предпочтительно от 0,35 до 0,55, более предпочтительно от 0,4 до 0,5.
В предпочтительном воплощении указанное анти-CD20 антитело II типа, предпочтительно гуманизированное B-Ly1 антитело, имеет повышенную антителозависимую клеточную цитотоксичность (ADCC).
Под используемым в данном документе термином "антитело, имеющее повышенную антителозависимую клеточную цитотоксичность (ADCC)" понимается антитело с повышенной ADCC, что определяется любым подходящим способом, известным специалистам в данной области. Одним из принятых анализов ADCC in vitro является следующий:
1) анализ использует клетки-мишени, о которых известно, что они экспрессируют целевой антиген, распознаваемый антиген-связывающим участком антитела;
2) в качестве эффекторных клеток анализ использует мононуклеарные клетки периферической крови человека (МНПК, РВМС), выделенные из крови случайно выбранных здоровых доноров;
3) анализ проводится в соответствии со следующим протоколом:
I) МНПК выделяют с использованием стандартных процедур центрифугирования по плотности и суспендируют в количестве 5×106 клеток/мл в культуральной клеточной среде RPMI;
II) клетки-мишени выращивают с использованием стандартных способов культивирования тканей, собирают в экспоненциальной фазе роста с жизнеспособностью более 90%, промывают в культуральной клеточной среде RPMI, метят 100 мкКюри "CI-, дважды промывают в культуральной клеточной среде и ресуспендируют в клеточной культуральной среде с плотностью 1 0' клеток/мл;
III) 100 мкл конечной клеточной суспензии переносят в каждую лунку 96-луночной микропланшеты;
IV) антитела серийно разводят от 4000 нг/мл до 0,04 нг/мл в клеточной культуральной среде, и 50 мкл полученных растворов антитела добавляют к клеткам-мишеням в 96-луночной микропланшете, тестируя в трех экземплярах различные концентрации антитела, охватывающие весь спектр концентраций;
V) для контроля максимального высвобождения (maximum release, MR) в три дополнительные лунки в планшете с мечеными клетками-мишенями вносят по 50 мкл 2% (VN) водного раствора неионогенного поверхностно-активного вещества (Nonidet, Sigma, St. Louis) вместо раствора антитела (п. IV выше);
VI) для контроля спонтанного высвобождения (spontaneous release, SR) в три дополнительные лунки в планшете с мечеными клетками-мишенями вносят по 50 мкл клеточной культуральной среды RPMI вместо раствора антитела (п. IV выше);
VII) затем 96-луночную планшету центрифугируют при 50g в течение 1 минуты и инкубируют в течение 1 часа при 4°С;
VIII) 50 мкл суспензии РВМС (п. V выше) добавляют в каждую лунку для получения отношения эффекторные клетки: клетки-мишени, равного 25: 1, и помещают планшеты в инкубатор в атмосферу с 5% CO2 при 37°С на 4 часа;
IX) из каждой лунки собирают бесклеточный супернатант и с помощью гамма-счетчика оценивают экспериментальный выброс радиоактивных веществ (experimentally released radioactivity, ER);
X) процент специфического лизиса рассчитывают для каждой концентрации антитела в соответствии с формулой (ER-MR)/(MR-SR)×100, где ER представляет собой среднюю радиоактивность, подсчитанную (см. п. IX выше) для данной концентрации антитела, MR представляет собой среднюю радиоактивность, подсчитанную (см. п. IX выше) для контроля MR (см. п. V выше), a SR представляет собой среднюю радиоактивность, подсчитанную (см. п. IX выше) для контроля SR (см. п. VI выше);
4) "повышенная ADCC" определяется или как увеличение максимального процента специфического лизиса, наблюдаемого в пределах концентрации антитела, описанной выше, и/или как снижение концентрации антитела, необходимой для достижения половины максимального процента специфического лизиса, наблюдаемого в пределах концентрации антитела, описанной выше. Повышение ADCC соотносится с ADCC, измеренной в описанном выше анализе при посредничестве того же антитела, которое было получено с помощью того же типа принимающих клеток (клеток-хозяев) с использованием тех же стандартных способов получения, очистки, составления и хранения, которые хорошо известны специалистам в данной области, но которое не было получено с помощью принимающих клеток, созданных для сверхэкспрессии GnTIII.
Указанная "повышенная ADCC" может быть получена с применением гликотехнологии к указанным антителам, это означает повышение указанных естественных клеточно-опосредованных эффекторных функций моноклональных антител путем разработки их олигосахаридного компонента, как описано в Umana, Р. et al., Nature Biotechnol. 17:176-180 (1999) и патенте США №6602684.
Термин "комплемент-зависимая цитотоксичность (CDC)" относится к лизису человеческих опухолевых клеток-мишеней с помощью антитела в соответствии с изобретением в присутствии комплемента. CDC измеряют предпочтительно путем обработки препарата клеток, экспрессирующих CD20, антителом анти-CD20 в соответствии с изобретением в присутствии комплемента. CDC считается найденной, если антитело в концентрации 100 нМ в течение 4 часов индуцирует лизис (клеточную гибель) 20% или более опухолевых клеток. Анализ проводят предпочтительно с опухолевыми клетками, мечеными 51Cr или Eu, и измеряют высвобождение 51Cr или Eu. Для контроля проводят инкубацию опухолевых целевых клеток с комплементом, но без антитела.
Обычно анти-CD20 антитела I и II типа изотипа IgG1 демонстрируют характерные свойства CDC. Анти-CD20 антитела I типа имеют повышенную CDC (изотип IgG1), а анти-CD20 антитела II типа имеют сниженную CDC (изотип IgG1) по сравнению друг с другом. Предпочтительно анти-CD20 антитела и I, и II типа являются антителами изотипа IgG1.
Антитело "ритуксимаб" является генно-инженерным химерным моноклональным антителом, содержащим человеческий гамма 1 и мышиный константный домен, направленным против человеческого антигена CD20. Это химерное антитело содержит человеческие гамма-1 константные домены и называется "С2В8" в W094/11026 (Anderson et al.). Ритуксимаб одобрен для лечения пациентов с рецидивирующей или рефракторной, низкой степени злокачественности или фолликулярной, CD20-положительной В-клеточной неходжкинской лимфомой. Исследования механизма действия in vitro показали, что ритуксимаб демонстрирует человеческую комплемент-зависимую цитотоксичность (CDC) (Reff et. al, Blood 83(2): 435-445 (1994)). Кроме того, он проявляет значительную активность в анализах, которые измеряют антитело-зависимую клеточную цитотоксичность (ADCC).
Термин "гуманизированное B-Ly1 антитело" относится к гуманизированному B-Ly1 антителу, раскрытому в WO 2005/044859, которое было получено из мышиного моноклонального анти-CD20 антитела B-Ly1 (вариабельный участок мышиной тяжелой цепи (VH): SEQ ID №1; вариабельный участок мышиной легкой цепи (VL): SEQ ID №2 - см. Poppema, S. and Visser, L, Biotest Bulletin 3: 131-139 (1987)) путем химеризации с человеческим константным доменом из IgG1 и последующей гуманизации (см. WO 2005/044859). Эти "гуманизированные B-Ly1 антитела" раскрыты подробно в WO 2005/044859.
Предпочтительно "гуманизированное B-Ly1 антитело" имеет вариабельный участок тяжелой цепи (VH), выбранный из группы с SEQ ID №3 по SEQ ID №20 (с В-НН2 по В-НН9 и с B-HL8 по B-HL17 из WO 2005/044859). Особенно предпочтительными являются SEQ ID №№3, 4, 7, 9, 11, 13 и 15 (В-НН2, ВНН-3, В-НН6, В-НН8, B-HL8, B-HL11 и B-HL13 из WO 2005/044859). Наиболее предпочтительным из указанных VH является ВНН6. Предпочтительно "гуманизированное B-Ly1 антитело" имеет вариабельный участок легкой цепи (VL) из SEQ ID №20 (B-KV1) из WO 2005/044859. Кроме того, гуманизированное B-Ly1 антитело является предпочтительно IgG1-антителом. Предпочтительно такие гуманизированные B-Ly1 антитела получены путем модификации углевода, ассоциированного с молекулой белка (glycoengineered, GE) в Fc-области в соответствии с процедурами, описанными в WO 2005/044859, WO 2004/065540, Umana, P. et al., Nature Biotechnol. 17:176-180 (1999) и WO 99/154342. Большинство подвергшихся гликомодификации гуманизированных B-Ly1 антител имеют измененную структуру гликозилирования в Fc-области, предпочтительно имея сниженный уровень фукозных остатков. Предпочтительно по меньшей мере 40% или более (в одном воплощении между 40% и 60%, в другом воплощении по меньшей мере 50%, а в еще одном воплощении по меньшей мере 70% или более) олигосахаридов Fc-области являются нефукозилированными. Кроме того, олигосахариды Fc-области предпочтительно имеют симметричное разветвление. Наиболее предпочтительно "гуманизированное B-Ly1 антитело" содержит VH В-НН6 и VL B-KV1 из WO 2005/044859. В данном документе указанное антитело также называют "HuMab <CD20>". В другом наиболее предпочтительном воплощении указанное антитело имеет сниженный уровень фукозных остатков, как это определено выше, и/или олигосахариды Fc-области наиболее предпочтительно имеют симметричное разветвление. В еще одном наиболее предпочтительном воплощении указанное антитело демонстрирует увеличенную ADCC, как она определена в данном документе.
Олигосахаридный компонент может существенно влиять на свойства, имеющие отношение к эффективности терапевтического гликопротеина, включая физическую стабильность, устойчивость к разрушению протеазой, взаимодействия с иммунной системой, фармакокинетику и специфическую биологическую активность. Такие свойства могут зависеть не только от наличия или отсутствия олигосахаридов, но также от их специфических структур. Можно сделать некоторые обобщения между олигосахаридной структурой и функцией гликопротеина. Например, некоторые олигосахаридные структуры опосредуют быстрое выведение гликопротеина из кровотока через взаимодействие со специфическими углеводосвязывающими белками, тогда как другие могут связываться с антителами и вызывать нежелательные иммунные реакции (Jenkins et al., Nature Biotechnol. 14:975-81 (1996)).
Клетки млекопитающих являются предпочтительными хозяевами для продукции терапевтических гликопротеинов из-за их способности гликозилировать белки в более подходящей для применения у человека форме (Cumming et al., Glycobiology 1:115-30 (1991); Jenkins et al., Nature Biotechnol. 14:975-81 (1996)). Бактерии очень редко гликозилируют белки, и как другие типы общепринятых хозяев, таких как дрожжи, мицелиальные грибы, клетки насекомых и растений, вырабатывают структуры гликозилирования, связанные с быстрым выведением из кровотока, нежелательными иммунными взаимодействиями, а также в некоторых конкретных случаях сокращением биологической активности. Среди клеток млекопитающих в течение последних двух десятилетий наиболее часто используются клетки яичника китайского хомячка (Chinese hamster ovary, CHO). В дополнение к данной подходящей структуре гликозилирования эти клетки позволяют получить постоянное потомство генетически стабильных высокопроизводительных клональных клеточных линий. Они могут культивироваться с высокой плотностью в простых биореакторах с использованием бессывороточных сред и позволяют разработать безопасные и воспроизводимые биологические процессы. Другие часто используемые клетки животных включают клетки почек детенышей хомяка (baby hamster kidney, BHK), мышиные миеломные клетки NSO и SP2/0. Совсем недавно также была испытана продукция с помощью трансгенных животных (Jenkins et al., Nature Biotechnol. 14: 975-981 (1996)).
Все антитела содержат углеводные структуры в консервативных позициях в константных участках тяжелых цепей, с каждым изотипом, обладающим различной сетью N-связанных углеводных структур, которые с различной силой влияют на белковую конструкцию, секрецию или функциональную активность (Wright, A., and Morrison, S.L, Trends Biotech. 15: 26-32 (1997)). Структура присоединенных N-связанных углеводов значительно варьирует в зависимости от степени процессинга, а также может включать высокоманнозные сложные олигосахариды, широко разветвленные и с двумя ветвями (Wright, A., and Morrison, S.L., Trends Biotech. 15: 26-32 (1997)). Как правило, существует гетерогенный процессинг основных олигосахаридных структур, присоединенных к конкретному сайту гликозилирования, так что даже моноклональные антитела существуют в нескольких гликоформах. Кроме того, было показано, что между клеточными линиями происходят значительные различия в гликозилировании антител, и даже при культивировании данной линии клеток в различных условиях наблюдаются незначительные различия (Lifely, M.R. et al., Glycobiology 5(8):813-22 (1995)).
Один из способов достижения значительного увеличения активности, сохраняя при этом простой процесс продукции и, возможно, избегая значительных нежелательных побочных эффектов, заключается в усилении природных клеточно-опосредованных эффекторных функций моноклональных антител путем проектирования их олигосахаридного компонента, как описано в Umana, P. et al., Nature Biotechnol. 17:176-180 (1999) и патенте США №6602684. Антитела типа IgG1, наиболее часто используемые в иммунотерапии рака, являются гликопротеинами, которые имеют консервативный N-связанный сайт гликозилирования Asn297 в каждом СН2-домене. Два сложных олигосахарида с двумя ветвями, присоединенные к Asn297, скрыты между CH2-доменами, образуя обширные контакты с полипептидным остовом, и их присутствие имеет важное значение для опосредования эффекторных функций антитела, таких как антитело-зависимая клеточная цитотоксичность (ADCC) (Lifely, M. R., et al., Glycobiology 5: 813-822 (1995); Jefferis, R., et al., Immunol. Rev. 163: 59-76 (1998); Wright, A. and Morrison, S.L., Trends Biotechnol. 15: 26-32 (1997)).
Ранее было показано, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы I11 ("GnTII17y), гликозилтрансферазы, катализирующей образование олигосахаридов с двумя ветвями, значительно увеличивает in vitro ADCC-активность антинейробластомного химерного моноклонального антитела (chCE7), полученного путем проектирования клеток СНО (см. Umana, P. et al., Nature Biotechnol. 17: 176-180 (1999); и WO 99/154342, содержание которого полностью включено данной ссылкой). Антитело chCE7 относится к широкому классу неконъюгированных моноклональных антител, которые имеют высокую опухолевую аффинность и специфичность, но слишком низкую активность, чтобы быть клинически полезными, когда производятся в стандартных промышленных клеточных линиях, в которых отсутствует фермент GnTIII (см. Umana, P. et al., Nature Biotechnol. 17: 176-180 (1999)). Это исследование впервые показало, что значительное увеличение ADCC-активности может быть достигнуто путем создания клеток, продуцирующих антитела, чтобы они экспрессировали GnTIII, что также ведет к увеличению доли константного участка (Fc)-ассоциированных олигосахаридов с двумя ветвями, включая нефукозилированные олигосахариды с двумя ветвями, выше уровней, обнаруженных в природных антителах.
Термин "экспрессия CD20-антигена" призван подчеркнуть значительный уровень экспрессии антигена CD20 в клетке, предпочтительно на клеточной поверхности Т- и В-клетки, более предпочтительно В-клетки, от опухоли или рака соответственно, предпочтительно несолидной опухоли. Пациентов с "CD20-экспрессирующим раком" можно выявить с помощью стандартных анализов, известных в данной области. "Экспрессия CD20-антигена" также предпочтительно используется для указания значительного уровня экспрессии антигена CD20 в клетке, предпочтительно на клеточной поверхности Т- и В-клетки, более предпочтительно В-клетки, при аутоиммунных заболеваниях. Например, экспрессию антигена CD20 измеряют с помощью иммуногистохимического исследования (IHC, immunohistochemical detection), FACS-анализа (проточного цитометрического анализа) или путем основанного на ПЦР выявления соответствующей мРНК.
Термин "CD20-экспрессирующий рак", используемый в данном документе, относится предпочтительно к лимфомам (предпочтительно В-клеточным неходжкинским лимфомам (НХЛ)) и лимфоцитарным лейкемиям. Такие лимфомы и лимфоцитарные лейкемии включают, например, а) фолликулярные лимфомы, b) лимфомы из мелких клеток с нерасщепленными ядрами/лимфому Беркитта (включая эндемическую лимфому Беркитта, спорадическую лимфому Беркитта и неходжкинскую лимфому Беркитта) с) лимфомы маргинальной зоны (включая экстранодальную В-клеточную лимфому маргинальной зоны (лимфомы, связанные с лимфатической тканью слизистой оболочкой, MALT), узловую В-клеточную лимфому маргинальной зоны и лимфому маргинальной зоны селезенки), d) лимфому из клеток зоны мантии (MCL), е) крупноклеточную лимфому (включая диффузную В-крупноклеточную лимфому (DLCL), диффузную лимфому смешанного клеточного типа, иммунобластную лимфому, первичную В-клеточную лимфому средостения, ангиоцентричную лимфому/легочную В-клеточную лимфому), f) волосатоклеточную лейкемию, g) лимфоцитарную лимфому, макроглобулинемию Вальденстрема, h) острый лимфолейкоз (ALL), хронический лимфолейкоз (CLL)/лимфому из малых лимфоцитов (SLL), В-клеточный пролимфоцитарный лейкоз, i) новообразования из плазматических клеток, миелому из плазматических клеток, множественную миелому, плазмоцитому, j) болезнь Ходжкина.
Предпочтительно CD20-экспрессирующий рак является В-клеточной неходжкинской лимфомой (NHL). Особенно CD20-экспрессирующим раком является лимфома клеток мантии (MCL), острый лимфолейкоз (ALL), хронический лимфолейкоз (CLL), В-клеточная диффузная крупноклеточная лимфома (DLCL), лимфома Беркитта, волосатоклеточная лейкемия, фолликулярная лимфома, множественная миелома, лимфома маргинальной зоны, посттрансплантационное лимфопролиферативное расстройство (PTLD), ВИЧ-ассоциированная лимфома, макроглобулинемия Вальденстрема или первичная лимфома ЦНС.
Используемый в данном документе термин "аутоиммунное заболевание" относится к болезни или расстройству, связанному с и направленному против собственных тканей организма. Примеры аутоиммунных заболеваний или расстройств включают артрит (ревматоидный артрит, ювенильный ревматоидный артрит, остеоартроз, псориатический артрит), псориаз, дерматит, полимиозит/дерматомиозит, токсический эпидермальный некролиз, системную склеродермию и склероз, ответы, связанные с 1 5 воспалительными заболеваниями кишечника, болезнь Крона, язвенный колит, респираторный дистресс-синдром, респираторный дистресс-синдром взрослых (ARDS), менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические состояния, экзему, астму, состояния, сопровождающиеся инфильтрацией Т-клеток и хроническими воспалительными реакциями, атеросклероз, аутоиммунный миокардит, дефицит лейкоцитарной адгезии, системную красную волчанку (СКВ), ювенильный диабет, рассеянный склероз, аллергический энцефаломиелит, иммунные реакции, связанные с гиперчувствительностью немедленного и замедленного типа, опосредованные цитокинами и Т-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включая гранулематоз Вегенера, агранулоцитоз, васкулит (включая АNСА-ассоциированный), апластическую анемию, анемию Даймонда-Блэкфана, иммунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), злокачественную анемию, парциальную красноклеточную аплазию (PRCA), дефицит фактора VIII, гемофилию А, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, сопровождающиеся лейкоцитарным диапедезом, воспалительные заболевания центральной нервной системы (ЦНС), синдром множественных органных поражений, миастению гравис, заболевания, опосредованные комплексом антиген-антитело, болезнь аутоантител к базальным мембранам, антифосфолипидный синдром, аллергический неврит, болезнь Бехчета, синдром Кастлемена, синдром Гудпасчера, миастенический синдром Ламберта-Итона, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, буллезный пемфигоид, пузырчатку, аутоиммунные полиэндокринопатии, нефропатию, IgM-полинейропатии или IgM-опосредованную нейропатию, идиопатическую тромбоцитопеническую пурпуру (ITP), тромботическую тромбоцитопеническую пурпуру (ТТР), аутоиммунную тромбоц