Средство, обладающее антиаритмическим, антифибрилляторным, противоишемическим действием, и фармацевтическая композиция на его основе
Иллюстрации
Показать всеГруппа изобретений относится к области медицины. В качестве средства, обладающего антиаритмическим, антифибрилляторным и противоишемическим действием, применяют дигидрохлорид 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]бензимидазол формулы I:
Композиция, обладающая антиаритмическим, антифибрилляторным и противоишемическим действием, содержит в качестве действующего активного компонента соединение формулы I, взятое в эффективном количестве. Заявленная группа изобретений обладает высоким антиаритмическим, антифибрилляторным и противоишемическим действием. 2 н.п. ф-лы, 3 ил., 12 табл., 1 пр.
Реферат
Изобретение относится к фармакологии, а именно к биологически активным веществам и композициям на их основе, обладающим антиаритмическим, антифибрилляторным, противоишемическим действием, которые могут быть использованы при создании лекарственных препаратов для лечения нарушений ритма сердца различного генеза, нарушения коронарного кровообращения, повышения устойчивости миокарда к фибрилляциям.
Нарушения ритма сердца в настоящее время остаются основной причиной кардиальных смертей. Несмотря на прогресс, достигнутый в области катетерной абляции аритмий и имплантации кардиовертеров-дефибрилляторов, признается тот факт, что в настоящее время применение этих эффективных инвазивных методов при лечении нарушений ритма сердца у большинства пациентов невозможно даже без учета их высокой стоимости и определенного хирургического риска. Эффективность же лекарственной терапии, оцениваемая по восстановлению стабильного синусового ритма, не превышает 50-70%.
Основной стратегией поиска и создания новых антиаритмических препаратов был и остается принцип блокады трансмембранных ионных токов при лечении аритмий, заложенный в основу классификации, предложенной V.Williams и модифицированной D.Harrison. Согласно этой классификации выделяются 4 класса: I - блокаторы натриевых каналов, II - блокаторы β-адренергических рецепторов, III - блокаторы калиевых каналов, IV - блокаторы кальциевых каналов.
Исследования по программам CAST, CASCADE и ESVEM показали, что несмотря на выраженное снижение частоты желудочковых экстрасистол лечение препаратами 1 класса не только не уменьшает, но даже увеличивает смертность, обусловленную аритмиями, что согласуется с данными мета-анализа [The Cardiac Arrhythmia Suppression Trial (CAST) investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia supression after miocardial infarction // N. Engl. J. Med. - 1989. - Vol.321. - P.406-412; The Cardiac Arrhythmia Suppression Trial II Investigators. Effect of theantiarrhythmic agent moricizine on survival after myocardial infarction. N Engl J Med 1992; 327:227-233; The CASCADE investigators. Randomized antiarrhythmic drug therapy in survivors of cardiac arrest (the CASCADE study) // Am. J. Cardiol. - 1993. - Vol.72. - P.280-287]. В группе пациентов, получавших антиаритмики 1 класса, смертность возросла в целом на 11%, а селективными препаратами 1C подкласса на 42% по сравнению с контрольной группой [Мазур Н.А. Сравнительная оценка эффективности лечения антиаритмическими препаратами // Тер. архив. - 1994. - Т.66, №12. - С.3-6].
Попытки создания антиаритмических препаратов III класса новой генерации - так называемых «чистых» (высокоселективных) блокаторов выходящих калиевых токов (таких, как d-соталол, сематилид, дофетилид, алмокалант, ибутилид, ризотилид, нибентан, терикалант, тедисамил, амбасилид и др.) не дали позитивных результатов.
В исследованиях SWORD и SCD-HeFT было показано, что и антиаритмические препараты III класса (d-соталол) несмотря на подавление желудочковой эктопической активности ухудшали прогноз больных, перенесших острый инфаркт миокарда или имеющих выраженную хроническую сердечную недостаточность III-IV функционального класса [Беленков Ю.Н., Мареев В.Ю. Лечение сердечной недостаточности в XXI веке: достижения, вопросы и уроки доказательной медицины / Кардиология. - 2008. - №2. - С.6-16; Bardy G.H. et al. Amiodarone or an implantable cardioverter defibrillator for congestive heart failure. N Engl J Med 2005; 352:3:225-237].
В международных рекомендациях по лечению аритмий Американской ассоциации сердца и Европейской ассоциации кардиологов наиболее эффективным антиаритмиком для профилактики внезапной сердечной смерти, при лечении фибрилляции предсердий и желудочковых аритмий признан кордарон [Канорский С.Г. Новые международные рекомендации по лечению фибрилляции предсердий и желудочковых аритмий: подтверждение роли амиодарона // Клиническая фармакология и терапия. - 2007. - Т.16, №4. - С.46-49; ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation. Eur Heart J 2006; 27:1979-2030]. В качестве препарата выбора его используют 24,1% в США, 34,5% - в Европе [Шубик Ю.В. Кордарон в международных рекомендациях по лечению аритмий // Русский медицинский журнал. - 2008. - Т.16, №21. - С.1385-1390].
Являясь классическим эталоном антиаритмиков III класса, кордарон не принадлежит к чистым блокаторам калиевых каналов. Он обладает множеством фармакологических эффектов: влияет на различные трансмембранные ионные токи - Na+, K+, Са+; обладает адреноблокирующим действием, является структурным аналогом тиреоидных гормонов. Известно, что эффективность кордарона при различных нарушениях ритма составляет 60-90% [Гиляров М., Сулимов В. Кордарон: прошлое, настоящее и будущее // Клиническая фармакология и терапия. - 2006. - Т.15, №4. - С.60-65]. Однако по данным разных авторов побочные эффекты, потребовавшие отмены кордарона, составили: аритмогенный - 0-7%, другие кардиогенные и некардиогенные - 11,5-27% [Фисенко В. О побочных эффектах кордарона // Врач. - 2003. - №11. - С.50-51]. Так, согласно данным мета-анализа, посвященного оценке побочных эффектов низких доз кордарона, число случаев вынужденного прекращения приема препарата было приблизительно в 1,5 раза выше, чем в группе плацебо [Моисеев С.В. Профилактика внезапной сердечной смерти: мета-анализ рандомизированных контролируемых исследований // Клиническая фармакология и терапия. - 2009. - Т.18, №4. - С.52-56]. Особенности фармакокинетических свойств (медленное насыщение, способность к кумуляции, длительная элиминация, отсутствие корреляции: сывороточная концентрация/вероятность побочных эффектов) кордарона также ограничивает его применение. Кроме того, кордарон изменяет фармакокинетику препаратов, метаболизирующихся с помощью цитохрома Р-450. Можно констатировать, что, хотя кордарон остается эффективным антиаритмиком при лечении предсердных и желудочковых аритмий, особенности фармакокинетики и фармакодинамики, а также большое количество побочных эффектов серьезно ограничивают применение этого препарата.
Одним из новых подходов к профилактике рецидивов пароксизмальных форм фибрилляций и трепетаний предсердий является лечение комбинациями антиаритмических препаратов. Теоретически применение комбинации антиаритмиков в дозах, уменьшенных по сравнению с терапевтической, вполне обосновано, так как, имея разные механизмы действия и точки приложения, они дополняют друг друга и спектр их воздействия на электрофизиологические механизмы развития аритмий расширяется. При этом уменьшенные дозы препаратов, составляющих комбинацию, предположительно должны легче переноситься больными. Рекомендуются комбинации половинных доз этацизин и пропранолола, этацизина и верапамила, кордарона и верапамила [Бунин Ю.А., Федякина Л.Ф. Комбинированная профилактическая антиаритмическая терапия фибрилляций и трепетания предсердий // Российский кардиологический журнал. - 2006. - №6 (62). - С.35-45], применение нибентана на фоне кордарона.
В России для фармакологической кардиоверсии фибрилляций предсердий кроме кордарона используются препараты с доказанной эффективностью, такие как пропафенон и этацизин, а также недостаточно изученные дизопирамид, новокаинамид, соталол [Гуревич М.А. Современные аспекты фармакотерапии фибрилляций предсердий // Российский кардиологический журнал. - 2009. - №5 (79). - С.95-101]. Для терапии наджелудочковых тахикардии используют бета-блокаторы, верапамил, дилтиазем, кордарон, соталол, пропафенон, новокаинамид [Бунин Ю.А. Фармакотерапия наджелудочковых тахикардии // Российский кардиологический журнал. - 2009. - №3 (77). - С.80-88]. В соответствии с Рекомендациями МИНЗДРАВСОЦРАЗВИТИЯ России для врачей, оказывающих первичную медико-санитарную помощь, [2007], в условиях сердечно-легочной реанимации для купирования фибрилляций желудочков может использоваться лидокаин.
Лечение ишемии миокарда направлено на улучшение прогноза и предупреждение возникновения инфаркта миокарда или внезапной смерти, а также на уменьшение частоты и интенсивности приступов. К этой группе препаратов относятся бета-блокаторы, антагонисты кальция, органические нитраты, антитромбоцитарные, гипохолестеринемические средства и др. [Диагностика и лечение стабильной стенокардии. Рекомендации Комитета экспертов Всероссийского научного общества кардиологов, 2009]. Среди них определенное место занимает кордарон. Он обладает умеренными противоишемическими свойствами, уменьшая адренергические влияния, улучшая коронарный кровоток, нормализуя сократимость миокарда и доставку кислорода к миокарду, а также оказывает профилактическое и лечебное действие при аритмиях, вызванных ишемией [Национальные Рекомендации ВНОК и ОССН по диагностике и лечению ХСН (II пересмотр), 2010]. Однако не менее чем в 40% случаев его прием осложняется опасными побочными эффектами, описанными ранее. Кроме того, препарат действует продолжительно, и последующее применение других кардиотропных препаратов, в том числе антиаритмиков, у больных, принимавших амиодарон, может быть опасным [Федеральное руководство по использованию лекарственных средств (формулярная система). Выпуск X. 2009].
Техническим результатом изобретения является повышение антиаритмического, антифибрилляторного и противоишемического действия лекарственных средств.
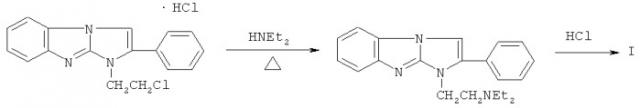
Технический результат достигается применением дигидрохлорида 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]бензимидазола формулы I:
в качестве средства, обладающего антиаритмическим, антифибрилляторным и противоишемическим действием.
Технический результат достигается также композицией, содержащей в качестве действующего начала дигидрохлорид 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-a]бензимидазола формулы I, взятый в эффективном количестве.
Дигидрохлорид 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-a]-бензимидазола формулы I известен как биологически активное соединение, обладающее местноанестезирующим действием при инфильтрационной, проводниковой и эпидуральной анестезиях (патент РФ №2314312, C07D 487/04, А61К 31/4188, 2008 г.).
В ряду солей 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]-бензимидазола не известны соединения, обладающие антиаритмическим, антифибрилляторным и противоишемическим действием.
Способ получения дигидрохлорида 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]бензимидазола I описан в вышеуказанном патенте и заключается во взаимодействии гидрохлорида 2-фенил-1-(2-хлорэтил)имидазо[1,2-a]бензимидазола (В.А.Анисимова, А.А.Спасов, М.В.Левченко, Е.А.Александрова. Хим.-фарм. ж., 1995, т.29 №10, с.18) с диэтиламином и последующем переводе полученного 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]бензимидазола в водорастворимый дигидрохлорид I:
Получение композиции заключается в смешении соединения I в действующей дозе (0,01-0,1 г) с нейтральными носителями и вспомогательными веществами, разрешенными к медицинскому применению.
В качестве вспомогательных веществ могут быть использованы:
стеариновая кислота и/или ее соли - в качестве антифрикционного компонента;
крахмал, поливинилпирролидон, кальция фосфат двузамещенный, лактоза, и/или лудипресс, и/или производные целлюлозы - в качестве наполнителя и связывающего компонента при изготовлении таблетированной формы;
лактоза, и/или микрокристаллическая целлюлоза, и/или лудипресс, или крахмал в качестве разрыхлителя для улучшения биодоступности.
Ниже приведена методика синтеза предлагаемого соединения.
Пример. Дигидрохлорид 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-a]-бензимидазола (I). Смесь 3,32 г (10 ммоль) гидрохлорида 2-фенил-1-(2-хлорэтил)имидазо[1,2-a]бензимидазола (Анисимова В.А, Спасов А.А., Левченко М.В., Александрова Е.А. Хим.-фарм. ж., 1995, №10, с.18) и 10 мл диэтиламина нагревают 5-6 ч в запаянной ампуле при 145-150°С. После вскрытия ампулы содержимое ее выливают в 100 мл воды и экстрагируют хлороформом (3×20 мл). Экстракт промывают водой от избытка диэтил-амина (3×25 мл), сушат безводным Na2SO4, упаривают до небольшого объема и пропускают через слой окиси алюминия, элюируя 1-(2-диэтил-аминоэтил)-2-фенилимидазо[1,2-а]бензимидазола хлороформом. Элюат подкисляют насыщенным раствором HCl в сухом изопропиловом спирте, выпавший белоснежный осадок I через час отфильтровывают, промывают сухим ацетоном, высушивают в вакуум-эксикаторе. Выход 75-80%. Соль перекристаллизовывают из изопропилового спирта (1 г/15-16 мл) и высушивают при 120°С до постоянного веса. Белоснежные гигроскопичные иголочки, очень легко растворимые в воде и этаноле с т.разл. 226-227°С (запаянный капилляр, вещество вначале подплавляется при ~190°С).
Найдено, %: С 55,2; Н 6,7; Cl 15,5; N 12,0.
C21H24N4·2HCl·3H2O.
Вычислено, %: С 54.9; Н 7,0; Cl 15,4; N 12,2.
ИК-спектр (вазелин, масло), см-1: 1665 (C=N+<), 2250-2720, 3300-3600 (N+H).
Спектр 1Н ЯМР основания (CDCl3), δ, м.д.: 0,70 (6Н, т, 2СН3), 2,35 (4Н, кв, N(CH2)2), 2,73 (2Н, т, CH2N), 4,10 (2Н, т, NCH2), 7,12-7,45 (10Н, м, ароматические протоны).
Ниже приведен пример получения композиции в форме таблетки.
Состав композиции, мас.%:
| Соединение I | 30,0-70,0 |
| Стеариновая кислота и/или ее соли | 1,0-1,3 |
| лактоза и/или микрокристаллическая | |
| целлюлоза и/или лудипресс | остальное |
Получена композиция, содержащая в мас.%: соединение I - 30,0, стеариновая кислота - 1,0, лактоза - 69,0.
Получены также композиции, содержащие в мас.%:
соединение I - 50,0, стеариновая кислота - 1,2, лактоза - 48,8.
соединение I - 70,0, стеариновая кислота - 1,3, лактоза - 28,7.
соединение I - 30,0, натриевая соль стеариновой кислоты - 1,0, лудипресс - 69,0.
соединение I - 50,0, натриевая соль стеариновой кислоты - 1,2, лудипресс - 38,8.
соединение I - 70,0, натриевая соль стеариновой кислоты - 1,3, лудипресс - 28,7.
соединение I - 30,0, натриевая соль стеариновой кислоты - 1,0, микрокристаллическая целлюлоза - 69,0.
соединение I - 50,0, натриевая соль стеариновой кислоты - 1,2, микрокристаллическая целлюлоза - 38,8.
соединение I - 70,0, натриевая соль стеариновой кислоты - 1,3, микрокристаллическая целлюлоза - 28,7.
Просеивают сухие компоненты фармацевтической композиции, смешивают, опудривают просеянной сухой стеариновой кислотой и/или ее солями и проводят таблетирование на ротационном прессе с определенным диаметром пуансонов.
Ниже приведены материалы, методы и результаты исследований соединения I.
Были изучены антиаритмические, антифибрилляторные и противоишемические свойства дигидрохлорида 1-(2-диэтиламиноэтил)-2-фенилимидазо[1,2-а]бензимидазола (I). В качестве препарата сравнения использовали кордарон 5% раствор для инъекций (KRKA, Словения), лидокаин использовали в виде 2% раствора для инъекций ("Мосхимфармпрепараты", Россия).
Все эксперименты были выполнены согласно методическим руководствам и нормативным документам (ГОСТ З 51000.3-96 и 51000.4-96; правила и Международные рекомендации Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997); правила лабораторной практики (GLP) в Российской Федерации, утвержденные приказом Минздрава РФ от 19 июня 2003 г. №267). Забой животных проводился согласно требованиям, изложенным в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1997).
1. Противоаритмические свойства
Влияние на рефракторный период миокарда изолированных предсердий крыс изучали по методу Я.И.Зайдлера (1967) [Зайдлер Я.И. Моделирование, методы изучения и экспериментальная терапия патологических состояний. - М., 1967. - Ч.3. - 46 с.]. Противоаритмическое действие оценивали по усвоению изолированным предсердием навязанного ритма (условного частотного порога). Опыты проводили на изолированных предсердиях белых беспородных крысах обоего пола массой 180-230 г, определяли минимальную концентрацию (МЭК) соединения (М/л), препятствующую усвоению навязанного ритма в течение 15 сек.
Соединение I удлиняет эффективный рефракторный период в опытах на изолированных предсердиях крыс. МЭК составляет 1,6·105 М/л (табл.1). Соединение превосходит кордарон по величине МЭК в 10 раза, по терапевтическому индексу - в 2,2 раза.
| Таблица 1 | |||||
| Влияние соединения I и кордарона на продолжительность эффективного рефракторного периода изолированных предсердий крыс | |||||
| № | Препарат | МЭК, М/л | МЭК, мг/кг | ЛД50, мг/кг | Терапевтический индекс (ЛД50/МЭК) |
| 1 | Соединение I | 1,6·10-5 | 6,5 | 17.0 | 2,6 |
| 2 | Кордарон | 1,7·10-4 | 115,9 | 135.5* | 1,2 |
| * - по данным Beckers (1987) |
Изучение действия соединения I на трансмембранные ионные токи проводили на изолированных трабекулах предсердий лягушки Rana Ridibunda (диаметром 150 мкм, длина 5-6 мм) при температуре 20-22°С. Препараты помещали в систему с двойным сахарозным мостиком [Поротиков В.И. Исследование механизма действия лекарственных веществ на полную проницаемость миокардиальных мембран: Автореф. Дис. …докт. биол. наук. - Купавна, 1982. - 28 с.], которая позволила делать измерения с фиксацией тока и напряжения. Для изучения выраженности мембранотропного действия соединения I было исследовано его влияние на трансмембранные ионные токи кардиомиоцита в диапазоне концентраций: 1·10-6, 5·10-6, 1·10-5, 5·10-5 М. Стимуляцию препарата по заданным программам, регистрацию потенциала действия и ионных токов, а также вычисление параметров потенциала действия, порога возбуждения, вольт-амперных характеристик и других параметров ионных каналов, вывод данных проводили в автоматизированном режиме с помощью ЭВМ СМ-3, сопряженной с экспериментальной установкой через модули КАМАК [Поротиков В.И., Андреева Л.А. Отчет об испытаниях новых ситетических производных имидазо[1,2-а]бензимидазола на трансмембранные ионные токи. - Купавна, 1982. - 4 с.].
В результате исследования влияния соединения I на трансмембранные ионные токи трабекул предсердий лягушки было установлено, что вещество оказывает сложное мембранотропное действие (табл.2). Выявлено выраженное дозозависимое блокирующее влияние на выходящие токи калия. Так при введении соединения I в дозе 1·10-6 М/л калиевый ток уменьшился на 39%, а в дозе 5·10-5 М/л был заблокирован на 60%.
В отношении быстрого Na+ и медленного Са2+ ионных токов дозозависимого блокирующего эффекта не наблюдалось. Так, в дозе 5·10-6 соединение угнетает токи натрия и кальция на 30% и 33% соответственно. При дальнейшем увеличении доз эффект на данные трансмембранные токи практически не меняется.
Таким образом, выявлено выраженное дозозависимое блокирующее влияние на токи калия и незначительный угнетающий эффект в больших дозах на токи натрия и кальция (Поротиков В.И., 1982).
| Таблица 2 | |||
| Влияние соединения I на трансмембранные токи трабекул предсердия лягушек методом фиксации потенциала | |||
| Концентрация соединения, (М/л) | Ионные токи (в %) | ||
| К+ | Na+ | Са2+ | |
| 1·10-6 | -39 | +15 | -30 |
| 5·10-6 | -45 | -30 | -33 |
| 1·10-5 | -51 | -30 | -35 |
| 5·10-5 | -60 | -34 | -34 |
Влияние соединения I на проводящую систему сердца изучали по электрокардиограмме, регистрируемой во втором стандартном отведении с помощью медицинского осциллоскопа ОС2-01 на самописце Н-338-8. Опыты выполнены на 20 наркотизированных кошках (нембутал, 50 мг/кг, внутрибрюшинно). Соединение I вводили внутривенно со скоростью 0,15 и 0,6 мг/кг/мин. Препарат сравнения кордарон вводили в эквивалентных дозах внутривенно со скоростью 5,0 и 20,0 мг/кг/мин. Анализ действия соединения I и препарата сравнения на электрофизиологические показатели работы сердца проводили по интервалам RR, QT, QTc, PQ.
В результате установлено наличие зависимости эффекта от дозы и скорости введения. При постоянной внутривенной инфузии со скоростью 0,15 мг/кг в минуту соединение I в течение 6 минут (суммарная доза 0,75 мг/кг) статистически достоверно не изменяло интервалы RR, QT, QTc. С 3-й минуты от начала введения исследуемое вещество замедляло атриовентрикулярную проводимость, которое определяли по интервалу PQ. На 6-й минуте (в суммарной дозе 0,9 мг/кг) увеличение интервала PQ составило 50% по отношению к исходным данным (р<0,05).
При увеличении скорости внутривенной инфузии до 0,6 мг/кг в минуту соединение I увеличивало интервал RR начиная со 2-й минуты введения на 20,6% (суммарная доза 1,2 мг/кг), а на 4-й минуте (суммарная доза 2,4 мг/кг) - на 102,9% (р<0.05), что свидетельствует об угнетающем влиянии на активность синусового узла (табл.3). Возникновение брадикардии вероятно, обусловлено нарастанием максимального диастолического потенциала вследствие увеличения продолжительности потенциала действия синусового узла. Изучаемое соединение увеличивало рефрактерность миокарда, статистически достоверно изменяя интервал QT с 3-й минуты от начала введения, максимально - на 4-й минуте (+17,4%). При увеличении скорости введения вещество I еще в большей степени увеличивало время проведения по предсердиям и атриовентрикулярному узлу. Со 2-й минуты от начала введения (в суммарной дозе 1,2 мг/кг) удлинение интервала PQ составило 25%, на 3-й минуте - 50% по отношению к исходным данным (р<0,05).
| Таблица 3 | ||||||
| Влияние соединения I (при постоянной внутривенной инфузии со скоростью 0,6 мг/кг/мин) на некоторые показатели электрокардиограммы (II - стандартное отведение) наркотизированных кошек (М±n) | ||||||
| № | Показатель | исходные данные | Время введения препарата (минуты) и суммарная доза (мг/кг) | |||
| 1 (0.6) | 2 (1.2) | 3 (1.8) | 4 (2.4) | |||
| 1 | RR, сек | 0.34±0.06 | 0.37±0.05 | 0.41±0.02* | 0.49±0.04* | 0.69±0.06* |
| 2 | QT, сек | 0.24±0.04 | 0.26±0.05 | 0.29±0.08 | 0.34±0.04* | 0.40±0.05* |
| 3 | QTc, сек | 0.41±0.02 | 0.43±0.02 | 0.45±0.04 | 0.49±0.03 | 0.48±0.04 |
| 4 | PQ, сек | 0.08±0.002 | 0.08±0.002 | 0.1±0.008* | 0.12±0.008* | 0.12±0.008* |
| * - различия статистически значимы по отношению к исходным данным (р<0,05) |
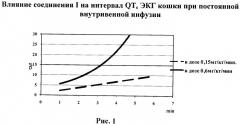
В отношении интервала QTc при исследуемых скоростях введения 0,15 и 0,6 мг/кг в минуту наблюдается статистически достоверное увеличение, которое составило на последних минутах 10,5% (6-я минута, суммарная доза 0,9 мг/кг) и 19,5% (4-я минута, суммарная доза 2,4 мг/кг) соответственно (табл.4, рис.1). Динамика изменения интервала QTc представлена в таблице 4 и на рисунке 1. На рис.1 показано влияние соединения I на интервал QTc ЭКГ кошки при постоянной внутривенной инфузии, где кривая 1 отражает увеличение интервала при введении соединения в дозе 0,6 мг/кг/мин, а кривая 2-в дозе 0,15 мг/кг/мин.
Для определения терапевтического индекса была рассчитана величина ЕД10 - доза, в которой увеличение QTc составляло 10%. Для соединения I и кордарона она составила 0,85 и 18,3 мг/кг соответственно. Изучаемое вещество превосходит кордарон по величине ЕД10 в 21 раз, по терапевтическому индексу - в 2,7 раза.
| Таблица 4 | ||||||||
| Влияние соединения I и кордарона (при постоянной внутривенной инфузии) на изменение интервала QTc электрокардиограммы во II стандартном отведении наркотизированных кошек (в дельта % по отношению к исходным данным) (М±m) | ||||||||
| № | Вещество | Скорость введения, мг/кг/мин | Время введения вещества, минуты | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| 1 | Вода для инъекций | 6.25±2.5 | 6.25±2.5 | 3.13±3.13 | 3.13±3.13 | 3.13±3.13 | 9.38±4.62 | |
| 2 | Кордарон | 5,0 | 7.89±6.23 | 10.52±4.87 | 7.89±2.85 | 5.23±1.74 | 13.16±1.47* | 23.68±2.56* |
| 3 | Кордарон | 20,0 | 5.4±3.47 | 13,5±2.62* | 13,5±2.62* | - | - | - |
| 4 | I | 0,15 | 0.0±0.0 | 5.26±1.64 | 7.89±2.56 | 7.89±2.56 | 5.26±1.64 | 10.53±1.24* |
| 5 | I | 0,6 | 4.8±2.62* | 9.7±1.25 | 19.5±2.35* | 17.1±1.8* | - | - |
| * - различия статистически значимы по отношению к исходным данным (р<0,05) |
Таким образом, показано наличие тенденции к угнетению функции синоатриального узла (удлинение интервала RR), увеличению рефрактерности миокарда (удлинение интервала QTc), замедлению атриовентрикулярной проводимости (удлинение интервала PQ), что свидетельствует о кордароноподобном эффекте. Изменения, возникающие при введении изучаемого вещества, зависели от дозы и скорости введения.
Замедление скорости проведения по синусовому (удлинение интервала RR) и атриовентрикулярному (удлинение интервала PQ) узлам, вероятно, обусловлено нарастанием максимального диастолического потенциала вследствие увеличения продолжительности потенциала действия пейсмейкерных клеток этих узлов, а также блокирующим влиянием препарата в больших концентрациях на натриевые и кальциевые токи.
Соединение I обладает выраженной антиаритмической активностью и превосходит препарат сравнения на моделях суправентрикулярных нарушений ритма.
Предсердные нарушения ритма проявлялись исчезновением зубца Р на электрокардиограмме и появлением вместо него многочисленных волн, на предсердной электрограмме исчезали нормальные сокращения и появлялись беспорядочные сокращения отдельных участков предсердий. Кроме того, происходило снижение артериального давления в среднем на 20-40 мм рт.ст. Продолжительность нарушений ритма составила в среднем 58 минут.
Влияние соединения I на электрические фибрилляции предсердий [Самвелян В.М., Василян С.С. Противоаритмические свойства некоторых холинолитических средств // Кровообращение. - 1981. - Т.14, №6. - С.13-18] изучали на 15 кошках, наркотизированных этаминалом натрия (50 мг/кг, внутрибрюшинно) массой 2,0-4,5 кг, в условиях искусственной вентиляции легких, торакотомии и перекардотомии. Регистрировали следующие показатели: электрокардиограмма во 2-м стандартом отведении с помощью медицинского осциллоскопа ОС2-01 на самописце Н-338-8, предсердная электрограмма на кардиоэнцефалоскопе КЭС-02, артериальное давление с помощью электроманометра на самописце Н-338-8.
Нарушения ритма контролировали по зубцу Р электрокардиограммы, изменению предсердной электрограммы, снижению артериального давления.
Соединение I вводили внутривенно (в яремную вену) со скоростью 0.5 мг/кг в минуту до восстановления синусового ритма, предсердной электрограммы и нормализации артериального давления. Препарат сравнения вводили в эквивалентном объеме.
Начало введения изучаемых препаратов при моделировании "электрических фибрилляции предсердий" - через 30 минут после возникновения аритмии. За минимальную эффективную дозу (МЭД) принимали антиаритмический эффект - восстановление синусового ритма длительностью не менее 2-х минут.
В результате исследования был получен выраженный антиаритмический эффект. Соединение I при постоянной внутривенной инфузии в суммарной дозе 0.91 мг/кг в 100% случаев восстанавливало синусовый ритм, нормализовало предсердную электрограмму. Повышение давления происходило до исходного уровня. Результаты сравнительного анализа противоаритмической активности на данной модели аритмий представлены в табл.5. Соединение I превосходило кордарон как по показателям минимальной эффективной дозы (в 8,5 раза), так и величине терапевтического индекса.
| Таблица 5 | |||||
| Минимальная эффективная доза (МЭД) соединения I и кордарона при аритмиях, вызванных электрической стимуляцией предсердий у кошек | |||||
| № | Вещество | Количество животных | МЭД, мг/кг | ЛД50, (мг/кг, в/в) | Терапевтический индекс, ЛД50/МЭД |
| 1 | Соединение I | 8 | 0.91±0,16 | 17.0 | 18,68 |
| 2 | Кордарон | 5 | 7.7±0,66 | 135.5* | 17,59 |
| * - по данным Beckers (1987) |
Соединение I обладает выраженной антиаритмической активностью на моделях желудочковых нарушений ритма.
Изучение влияния соединения I на желудочковые нарушения ритма, вызванные аконитином [Генденштейн Э.И., Ходжай Я.И. К фармакологии нового противоаритмического средства - аймалина // Фармакол. и токсикология. - 1961. - Т.24, №1. - С.49-57], проводили на 28 наркотизированных крысах (нембутал, 40 мг/кг, внутрибрюшинно) обоего пола массой 160-240 г. Нитрат аконитина вводили внутрибрюшинно в дозе 50 мкг/кг. Нарушения ритма сердца определяли по электрокардиограммам (2-е стандартное отведение) при непрерывном визуальном наблюдении на экране электрокардиоскопа в течение 60 мин. Вещества вводили за 5 минут до введения аконитина внутривенно в дозах 0,1; 0,2; 0,5; 1,0 мг/кг. Рассчитывали ЕД50 - эффективная доза, в 50% случаев предотвращающая возникновение нарушений ритма сердца.
На экспериментальной модели аритмии, вызванной внутривенным введением аконитина, в контрольных опытах аконитин в дозе 50 мкг/кг в 100% случаев вызывал фибрилляции желудочков и гибель животных. Нарушения ритма возникали в первые две минуты, гибель животных наступала через 20-60 минут. ЕД50 - соединения I в данной серии опытов оказалась равной 0,3 мг/кг (табл.6). Вещество I оказалось активнее кордарона как по величине ЕД50 в 33,3 раза, так и по терапевтическому индексу в 4,2 раза.
| Таблица 6 | |||||
| Антиаритмическая активность соединения I и кордарона при желудочковых нарушения ритма, вызванных внутривенным введением аконитина у крыс | |||||
| № | Вещество | Количество животных | ЕД50 (мг/кг, в/в) | ЛД50, (мг/кг, в/в) | Терапевтический индекс, ЛД50/ЕД50 |
| 1 | Соединение I | 8 | 0,3 | 17.0* | 56,7 |
| 2 | Кордарон | 5 | 10,0 | 135.5 | 13,5 |
| * - по данным Beckers (1987) |
2. Антифибрилляторные свойства
Влияние соединения I на максимально вопроизводимую частоту и порог фибрилляций желудочков, вызванных электрической стимуляцией, изучали на кошках, наркотизированных этаминалом натрия (50 мг/кг, внутрибрюшинно) массой 2,0-4,5 кг, в условиях искусственной вентиляции легких. "Эктопический очаг" возбуждения создавали электрической стимуляцией с помощью подшитых к левому желудочку игольчатых электродов (электростимулятор ЭС-50-01) в условиях торакотомии и перекардотомии.
Порог фибрилляций определяли повторным сканированием уязвимого периода из 90 прямоугольных импульсов постоянного тока длительностью 4 мс и увеличивающейся интенсивности (частота 50 Гц) до тех пор, пока не возникала фибрилляция желудочков. Дефибрилляцию производили с помощью дефибриллирующего разряда заданной активности, создаваемого непосредственно на миокард от дефибриллятора ДИ-03.
Величину порога оценивали как минимальную интенсивность тока в миллиамперах, при которой возникала фибрилляция предсердий или желудочков.
В этой же серии экспериментов определяли порог навязанного тока. На 1 миокард через игольчатые электроды подавались прямоугольные импульсы постоянного тока длительностью 4 мс пороговой силы тока (порог навязанного ритма) и увеличивающейся частотой.
За пороговую величину принимали ту частоту, при которой происходил срыв навязанного ритма и желудочки начинали сокращаться в своем ритме. Усвоение сердцем навязанного ритма определяли по ЭКГ, записываемой во втором стандартном отведении, изменению артериального давления.
Соединение I вводили в дозах 1.0, 1.7, 3.0 мг/кг. Препаратом сравнения выбран лидокаин в дозе 5 мг/кг как один из рекомендованных для купирования фибрилляций желудочков [Рекомендации МИНЗДРАВСОЦРАЗВИТИЯ России для врачей, оказывающих первичную медико-санитарную помощь, 2007]. Все параметры определяли до и через 15, 30, 60, 90 минут после внутривенного (в яремную вену) введения вещества.
При стимуляции раздражения в эктопическом очаге, превышающего исходную частоту возбуждения синусового узла, на электрокардиограмме последовательно возникают единичные, групповые экстрасистолы и, наконец, фибрилляций желудочков.
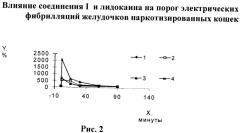
При изучении влияния соединения I на максимально воспроизводимую частоту и порог фибрилляций желудочков, вызванных электрической стимуляцией, были получены результаты, приведенные в табл.7 и на рис.2. Для возникновения фибрилляций желудочков после введения исследуемого соединения требовалась значительно большая интенсивность электрического раздражения, чем до введения. Соединение I в диапазоне доз (1 (1/17 ЛД50); 1.7 (1/10 ЛД50) и 3 (1/6 ЛД50) мг/кг) статистически достоверно повышало порог электрических фибрилляций желудочков в 6.5; 5.4 и 20.7 раз соответственно. Повышение порога фибрилляций отмечалось в течение 15-60 минут (в зависимости от вводимой дозы). Препарат сравнения - лидокаин - в дозе 5 мг/кг (1/5 ЛД50) увеличивал порог электрических фибрилляций желудочков в 6.9 раза в течение 15 минут.
| Таблица 7 | ||||||||
| Влияние соединения I и лидокаина на порог электрических фибрилляций желудочков наркотизированных кошек | ||||||||
| № | Вещество | Доза, мг/кг, в/в | Исходные данные, mA | Время (минуты) и порог фибрилляций (mA) | ||||
| 1 мин | 15 мин | 30 мин | 60 мин | 90 мин | ||||
| 1 | Соединение I | 1,0 | 2.10±0.14 | 13.05±0.94* | 5.46±0.42* | 2.31±0.41 | 2.10±0.23 | 2.10±0.23 |
| 2 | 1,7 | 4.80±2.50 | 26.47±1.85* | 22.68±2.37* | 8.42±1.12* | 7.24±0.87 | 6.00±1.25 | |
| 3 | 3,0 | 1.90±0.16 | 39.33±4.95* | 12.54±2.47* | 7.98±1.5* | 2.85±0.23* | 2.47±0.21 | |
| 4 | Лидокаин | 5 | 1.90±0.21 | 13.11±1.72* | 4.94±0.96* | 2.28±0.10 | 2.34±0.28 | 1.9±0.28 |
| * - различия статистически значимы по отношению к исходным данным (р<0.05) |
На рис.2 показано влияние соединения I и лидокаина на порог электрических фибрилляций желудочков наркотизированных кошек где кривые 1-4 отражают это влияние в зависимости от вводимых доз соединения (1 - в дозе 1 мг/кг; 2 - в дозе 1,7 мг/кг; 3-3 мг/кг) и лидокаина (4-5 мг/кг).
Проведен сравнительный анализ эффективности соединения I и лидокаина относительно ЛД50 при внутривенном введении. ЛД50 лидокаина взяли из литературных данных (LD50 Rat iv 25 mg/kg [Lewis, R.J. Sax's Dangerous Properties of Industrial Materials. 9th ed. Volumes 1-3. New York, NY: Van Nostrand Reinhold, 1996, p.1148]). При сравнительном анализе эффективности установлено, что соединение I в дозе 1 мг/кг (1/17 ЛД50) оказывает на порог электрических фибрилляций эффект, подобный лидокаину в дозе 5 мг/кг (1/5 ЛД50). В дозах, эквивалентных 1/5-1/6 ЛД50, исследуемое соединение превосходило препарат сравнения как по абсолютной величине повышения порога электрических фибрилляций в 3 раза, так и по длительности антифибрилляторного эффекта в 3-4 раза.
Соединение I во всех дозах статистически достоверно снижало максимально воспроизводимую частоту сердцебиений (табл.8, рис.3) - то есть подавляло эктопический водитель ритма - в течение 30 минут. Максимальное влияние соединения отмечалось на первой минуте в дозе 3 мг/кг, когда произошло снижение максимально воспроизводимой частоты сокращений на 40%. В табл.8 показано влияние соединения I и лидокаина на максимально воспроизводимую частоту сердечных сокращений наркотизированных кошек (в Δ% по отношению к контролю).
| Таблица 8 | |||||||
| Влияние соединения I и лидокаина на максимально воспроизводимую частоту сердечных сокращений наркотизированных кошек (в Δ% по отношению к контролю) | |||||||
| № | Вещество | Доза, мг/кг, в/в | Время (минуты) | ||||
| 1 мин | 15 мин | 30 мин | 60 мин | 90 мин | |||
| 1 | Соединение I | 1,0 | -23.34±3.36* | -21.32±9.43* | -12.00±2.00* | -5.33±5.33 | 0.00±0.00 |
| 2 | 1,7 | -28.37±2.28* | -21.94±2.23* | -13.25±3.26* | -2.23±1.33 | 0.00±0.00 | |
| 3 | 3,0 | -40.00±9.82* | -23.00±9.84* | -13.96±5.12* | -1.33±1.33 | 0.00±0.00 | |
| 4 | Лидокаин | 5 | -36.00±7.45* | -20.82±6.21* | -8.00±4.62 | 0.00±0.00 | 0.00±0.00 |
| * - различия статистически значимы по отношению к исходным данным (р<0.05) |
На рис.3 показано влияние соединения I и лидокаина на максимально воспроизводимую частоту сердечных сокращений наркотизированных кошек (в Δ% по отношению к контролю), где кривые 1-4 отражают изменение максимально воспроизводимой частоты сердечных сокращений при различных дозах внутривенного введения соединения (1 - в дозе 1 мг/кг; 2 - в дозе 1,7 мг/кг; 3-3 мг/кг) и лидокаина (4-5 мг/кг).
Эффект лидокаина продлился 15 минут, максимально снижение изучаемого показателя было на первой минуте и составило 36%. Несмотря на примерно одинаковую силу действия лидокаина и соединения I эффект второго был более длительным (в 2 раза).
Таким образом, соединение I проявляет выраж