Твердые формы, содержащие (-)-о-десметилвенлафаксин, и их применения
Иллюстрации
Показать всеИзобретение относится к новой кристаллической форме десметилвенлафаксина формулы (I) в виде гидрохлоридной соли стереомерно чистого соединения, пригодной для лечения, предотвращения или менеджмента заболевания, выбранного из депрессии, боли, тревожности, недержании или вазомоторных симптомах, вызванных менопаузой.
Кристаллическая форма содержит воду, причем вода присутствует в количестве от примерно 4% до примерно 8% от общей массы образца, и молярное отношение воды к гидрохлоридной соли составляет примерно один к одному, и кристаллическая форма имеет пики порошковой рентгенограммы в положениях примерно 12.7, 14.5, 19.1, 21.4, 23.0, 25.5 и 27.3°2θ и характеризуется следующими соответствующими параметрами элементарной ячейки, измеренной примерно при 150 К: а=6,78 Å; b=9,29 Å; с=27,65 Å; α=90°; β=90°; γ=90°. Кристаллическая форма характеризуется потерей массы при термическом гравиметрическом анализе от примерно 4% до примерно 8%, преимущественно примерно 5.6%, от общей массы образца при нагревании от примерно 25°С до примерно 110°С и эндотермическим эффектом при дифференциальной сканирующей калориметрии с температурой начала эффекта от примерно 50 до примерно 125°С, преимущественно температура начала эффекта составляет примерно 93°С. При этом кристаллическая форма является негигроскопической при относительной влажности от примерно 5% до примерно 85% и чистой формой. 3 н. и 17 з.п. ф-лы, 58 ил. 7 табл., 18 пр.
Реферат
Настоящая заявка заявляет приоритет на основании предварительной заявки на выдачу патента США 60/902950, зарегистрированной 21 февраля 2007 года, содержание которой включено в настоящее описание в виде ссылки в полном объеме.
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к твердым формам, содержащим стереомерно чистый (-)-O-десметилвенлафаксин, включая его соли, к композициям, содержащим твердые формы, способам получения твердых форм и способам их применения для лечения различных заболеваний и/или расстройств.
2. УРОВЕНЬ ТЕХНИКИ
Каждое фармацевтическое соединение имеет оптимальную терапевтическую концентрацию в крови и летальную концентрацию. Биодоступность соединения определяет дозовую концентрацию в лекарственном средстве, необходимую для получения идеального уровня в крови. Если лекарственное средство может кристаллизоваться в виде двух или более кристаллических форм, отличающихся по биодоступности, то оптимальная доза будет зависеть от кристаллической формы, присутствующей в препарате. В случае таких лекарственных средств наблюдается большое различие между терапевтическими и летальными концентрациями. Хлорамфеникол-3-пальмитат (CAPP), например, является антибиотиком широкого спектра действия, который, как известно, кристаллизуется, по меньшей мере, в трех полиморфных кристаллических формах и одной аморфной форме. На рынке продается наиболее стабильная форма A. Биоактивность указанного полиморфа и другой формы, В, отличаются в восемь раз, таким образом создавая возможность смертельных передозировок соединения в том случае, если случайно вводят соединение в форме B вследствие изменений, произошедших во время обработки и/или хранения. Поэтому контролирующие органы, такие как Администрация по контролю за продуктами питания и лекарствами США, начали устанавливать жесткий контроль за содержанием полиморфных форм активного компонента в твердых лекарственных формах. В общем, для лекарственных средств, которые существуют в полиморфных формах, в том случае, когда необходимо продавать препарат, отличный от чистого термодинамически предпочтительного полиморфа, контролирующий орган может потребовать проведения контрольных проверок каждой партии. Таким образом, становится важным как по медицинским, так и по коммерческим причинам получать и продавать чистое лекарственное средство в его наиболее термодинамически стабильной полиморфной форме, по существу не содержащей других кинетически предпочтительных полиморфов.
Новые твердые формы фармацевтического средства могут способствовать разработке препаратов для лечения заболеваний. Например, в фармацевтической области известно, что твердые формы солей соединения влияют, например, на растворимость, скорость растворения, биодоступность, химическую и физическую стабильность, текучесть, хрупкость и способность подвергаться прессованию соединения, а также безопасность и эффективность лекарственных продуктов на основе такого соединения (см., например, Byrn, S.R., Pfeiffer, R.R., and Stowell, J.G. (1999) Solid-State Chemistry of Drugs, 2nd ed., SSCI, Inc.: West Lafayette, IN).
Соответственно, идентификация твердой формы, содержащей соль или свободное основание соединения с оптимальными физическими и химическими свойствами, будет способствовать прогрессу в разработке соединения в виде фармацевтического средства. Полезными физическими и химическими свойствами являются воспроизводимое получение, отсутствие гигроскопичности, растворимость в воде, стабильность при действии видимого и ультрафиолетового излучения, низкая скорость распада в условиях повышенной температуры и влажности, низкая скорость изомеризации между изомерными формами и безопасность в случае длительного введения человеку. Часто требуется кристалличность, хотя в некоторых случаях профили ускоренной диссоциации могут быть достигнуты в результате получения аморфной формы.
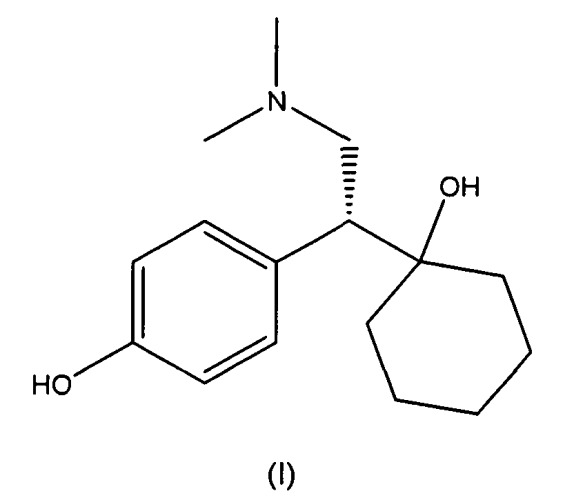
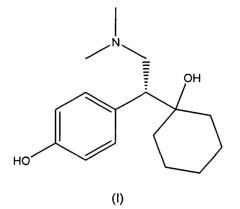
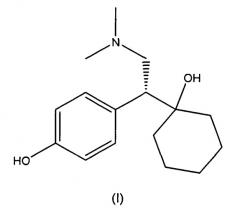
O-десметилвенлафаксин, имеющий химическое название 1-[2-(диметиламино)-1-(4-гидроксифенил)этил]циклогексанол, является метаболитом соединения венлафаксина, гидрохлоридная соль которого в настоящее время коммерчески доступна под торговой маркой Effexor®. Effexor®, который представляет собой рацемическую смесь (+) и (-)-энантиомеров венлафаксина, показан для лечения депрессии. Рацемический O-десметилвенлафаксин в качестве примера приведен в виде фумаратной соли в патенте США № 4535186, и сукцинатная и формиатные соли описаны в патентах США № 6673838 и 7001920, соответственно. Стереохимически чистый (-)-O-десметилвенлафаксин и его фармацевтически приемлемые соли описаны в патентах США № 6342533 B1, 6441048 B1 и 6911479 B2.
Авторы обнаружили, что не все твердые формы, содержащие (-)-O-десметилвенлафаксин, включая его соли, в равной мере применимы, если их оценивать по приведенному выше списку свойств. Таким образом, настоящее изобретение направлено на удовлетворение потребности в улучшенных твердых формах, содержащих (-)-O-десметилвенлафаксин, например, для производства и приготовления препаратов.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым твердым формам, включая аморфные формы и кристаллические формы, содержащим (-)-O-десметилвенлафаксин и его соли, имеющим практическое применение для лечения, предотвращения или оказания помощи при состояниях и расстройствах, включая, без ограничения, аффективные расстройства, такие как депрессия, биполярные и маниакальные расстройства, синдром дефицита внимания, синдром дефицита внимания с гиперактивностью, тревожные расстройства, расстройство панического типа, социальное тревожное расстройство, посттравматическое стрессовое расстройство, предменструальное дисфорическое расстройство, пограничное расстройство личности, фибромиалгию, агорафобию, обсессивно-компульсивное расстройство, анорексию и нейрогенную булимию, ожирение, увеличение массы, синдром Жиля де ла Туретта, синдром Шая-Дрейджера, болезнь Альцгеймера, болезнь Паркинсона, эпилепсию, нарколепсию, прекращение курения, пристрастие к наркотикам, опосредованную нервной системой половую дисфункцию, боль, включая хроническую и нейропатическую боль, расстройства функции мозга, старческое слабоумие, потерю памяти, амнезию/амнестический синдром; расстройство сознания, кому, расстройства речи, синдром Леннокса, аутизм, гиперкинетический синдром, шизофрению, мигрень, недержание, синдром хронической усталости, апноэ во сне, менопаузные вазомоторные симптомы, такие как приливы, расстройства, ослабляемые ингибированием захвата моноаминов нейронами, родственные расстройства и психические болезни, описанные в American Psychiatric Association's Diagnostic and Statistical Manual of Mental Disorders, 4th edition (DSM-IV).
В некоторых вариантах твердые формы являются кристаллическими формами, включая полиморфы, солей согласно изобретению. Изобретение также охватывает водные и безводные кристаллические формы, содержащие (-)-O-десметилвенлафаксин и его соли. Не имея намерения ограничиться какой-либо теорией, предполагают, что такие свойства, как стабильность при хранении, способность подвергаться прессованию, объемная плотность или растворимость твердых форм, являются полезными для производства, приготовления препаратов и биодоступности (-)-O-десметилвенлафаксина и его солей. В некоторых вариантах изобретение относится к фармацевтическим композициям, содержащим твердые формы, и способам их применения для лечения, предотвращения и/или оказания помощи при состояниях и расстройствах, включая, без ограничения, аффективные расстройства, такие как депрессия, биполярные и маниакальные расстройства, синдром дефицита внимания, синдром дефицита внимания с гиперактивностью, тревожные расстройства, расстройство панического типа, социальное тревожное расстройство, посттравматическое стрессовое расстройство, предменструальное дисфорическое расстройство, пограничное расстройство личности, фибромиалгия, агорафобия, обсессивно-компульсивное расстройство, анорексию и нейрогенную булимию, ожирение, увеличение массы, синдром Жиля де ла Туретта, синдром Шая-Дрейджера, болезнь Альцгеймера, болезнь Паркинсона, эпилепсию, нарколепсию, прекращение курения, пристрастие к наркотикам, опосредованную нервной системой половую дисфункцию, боль, включая хроническую и нейропатическую боль, расстройства функции мозга, старческое слабоумие, потерю памяти, амнезию/амнестический синдром; расстройство сознания, кому, расстройства речи, синдром Леннокса, аутизм, гиперкинетический синдром, шизофрению, мигрень, недержание, синдром хронической усталости, апноэ во сне, менопаузные вазомоторные симптомы, такие как приливы, расстройства, ослабляемые ингибированием захвата моноаминов нейронами, родственные расстройства и психические болезни, описанные в American Psychiatric Association's Diagnostic and Statistical Manual of Mental Disorders, 4th edition (DSM-IV).
В некоторых вариантах соединения и композиции согласно изобретению применяют для лечения, профилактики и/или оказания помощи при описанных выше состояниях и расстройствах, при этом уменьшая или устраняя неблагоприятные эффекты, включая, без ограничения, стойкую гипертензию, головную боль, астению, потоотделение, тошноту, запор, сонливость, сухость во рту, головокружение, бессонницу, нервозность, тревогу, расфокусированное или расплывчатое зрение и аномальную эякуляцию/оргазм или импотенцию у мужчин.
Твердые формы получают из (-)-O-десметилвенлафаксина, который описан в патентах США № 6342533 B1, 6441048 B1 и 6911479 B2, которые включены в настоящее описание в виде ссылки в полном объеме. (-)-O-десметилвенлафаксин имеет следующую структуру (I):
В некоторых вариантах настоящее изобретение относится к кристаллическим солям (-)-O-десметилвенлафаксина. В других вариантах настоящее изобретение относится к кристаллическим гидрохлоридным солям (-)-O-десметилвенлафаксина. В некоторых вариантах кристаллические гидрохлоридные соли (-)-O-десметилвенлафаксина обладают неожиданными превосходными свойствами, подробно описанными ниже. В некоторых вариантах настоящее изобретение относится к полиморфам солей хлористоводородной кислоты и (-)-O-десметилвенлафаксина. В некоторых вариантах настоящее изобретение относится к сольватам гидрохлоридных солей (-)-O-десметилвенлафаксина. В некоторых вариантах настоящее изобретение относится к полиморфам сольватов гидрохлоридных солей (-)-O-десметилвенлафаксина. В некоторых вариантах настоящее изобретение относится к гидратам гидрохлоридных солей (-)-O-десметилвенлафаксина. В некоторых вариантах настоящее изобретение относится к полиморфам гидратов гидрохлоридных солей (-)-O-десметилвенлафаксина. В некоторых вариантах настоящее изобретение относится к аморфным солям (-)-O-десметилвенлафаксина. В некоторых вариантах настоящее изобретение относится к аморфным гидрохлоридным солям (-)-O-десметилвенлафаксина.
В некоторых вариантах настоящее изобретение относится к фармацевтическим композициям, содержащим кристаллическую форму, кристаллическую солевую форму, полиморф солевой формы, сольват солевой формы, гидрат солевой формы или аморфную солевую форму согласно изобретению и/или фармацевтически приемлемый разбавитель, эксципиент или носитель. В некоторых вариантах настоящее изобретение, кроме того, относится к способам лечения, предотвращения и/или оказания помощи в случае одного или более из следующих состояний или расстройств: аффективных расстройств, таких как депрессия, биполярных и маниакальных расстройств, синдрома дефицита внимания, синдрома дефицита внимания с гиперактивностью, тревожных расстройств, расстройства панического типа, социального тревожного расстройства, посттравматического стрессового расстройства, предменструального дисфорического расстройства, пограничного расстройства личности, фибромиалгии, агорафобии, обсессивно-компульсивного расстройства, анорексии и нейрогенной булимии, ожирения, увеличения массы, синдрома Жиля де ла Туретта, синдрома Шая-Дрейджера, болезни Альцгеймера, болезни Паркинсона, эпилепсии, нарколепсии, прекращения курения, пристрастия к наркотикам, опосредованной нервной системой половой дисфункции, боли, включая хроническую и нейропатическую боль, расстройств функции мозга, старческого слабоумия, потери памяти, амнезии/амнестического синдрома; расстройства сознания, комы, расстройств речи, синдрома Леннокса, аутизма, гиперкинетического синдрома, шизофрении, мигрени, ожирения и увеличения массы, недержания, синдрома хронической усталости, апноэ во сне, менопаузных вазомоторных симптомов, таких как приливы, расстройств, ослабляемых ингибированием захвата моноаминов нейронами, родственных расстройств и психических болезней, описанных в American Psychiatric Association's Diagnostic and Statistical Manual of Mental Disorders, 4th edition (DSM-IV), при этом такие способы включают введение субъекту, например, человеку, нуждающемуся в таком лечении, профилактике и/или помощи, терапевтически и/или профилактически эффективного количества твердой формы согласно изобретению. Настоящее изобретение также относится к способам лечения, предотвращения или оказания помощи в случае состояний и расстройств, включая, без ограничения, аффективные расстройства, такие как депрессия, биполярные и маниакальные расстройства, синдром дефицита внимания, синдром дефицита внимания с гиперактивностью, тревожные расстройства, расстройство панического типа, социальное тревожное расстройство, посттравматическое стрессовое расстройство, предменструальное дисфорическое расстройство, пограничное расстройство личности, фибромиалгию, агорафобию, обсессивно-компульсивное расстройство, анорексию и нейрогенную булимию, ожирение, увеличение массы, синдром Жиля де ла Туретта, синдром Шая-Дрейджера, болезнь Альцгеймера, болезнь Паркинсона, эпилепсию, нарколепсию, прекращение курения, пристрастие к наркотикам, опосредованную нервной системой половую дисфункцию, боль, включая хроническую и нейропатическую боль, расстройства функции мозга, старческое слабоумие, потерю памяти, амнезию/амнестический синдром; расстройство сознания, кому, расстройства речи, синдром Леннокса, аутизм, гиперкинетический синдром, шизофрению, мигрень, недержание, синдром хронической усталости, апноэ во сне, менопаузные вазомоторные симптомы, такие как приливы, расстройства, ослабляемые ингибированием захвата моноаминов нейронами, родственные расстройства и психические болезни, описанные в American Psychiatric Association's Diagnostic and Statistical Manual of Mental Disorders, 4th edition (DSM-IV), включающим введение субъекту, например человеку, нуждающемуся в таком лечении, предотвращении или помощи терапевтически или профилактически эффективного количества твердой формы согласно изобретению.
В некоторых вариантах настоящее изобретение относится к способам получения, выделения и/или характеристики твердых форм согласно изобретению.
В некоторых вариантах новые твердые формы согласно изобретению применимы в качестве активных фармацевтических ингредиентов для приготовления препаратов, применяемых для животных или человека. В некоторых вариантах настоящее изобретение охватывает применение таких твердых форм в качестве конечных лекарственных продуктов. В некоторых вариантах твердые формы, включая кристаллические формы, аморфные формы и конечные лекарственные продукты согласно изобретению, применимы, например, для лечения, предотвращения или оказания помощи в случае состояний и расстройств, перечисленных выше.
4. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлена термограмма термического гравиметрического анализа образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.2 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.3 представлена порошковая рентгенограмма образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.4 представлен спектр инфракрасного излучения для образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.5 представлен спектр комбинационного рассеяния света для образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.6 представлена изотерма сорбции влаги для образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.7 представлена асимметричная единица кристаллической структуры формы A, полученная посредством дифракции рентгеновских лучей в монокристалле образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.8 представлена порошковая рентгенограмма, смоделированная на основании данных дифракции рентгеновских лучей в монокристалле, полученных для образца, содержащего форму A гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.9 представлена термограмма термического гравиметрического анализа образца, содержащего форму B гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.10 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму B гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.11 представлена порошковая рентгенограмма образца, содержащего форму B гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.12 представлен спектр инфракрасного излучения для образца, содержащего форму B гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.13 представлен спектр комбинационного рассеяния света для образца, содержащего форму B гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.14 представлена изотерма сорбции влаги для образца, содержащего форму B гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.15 представлена термограмма термического гравиметрического анализа образца, содержащего форму C гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.16 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму C гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.17 представлена порошковая рентгенограмма образца, содержащего форму C гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.18 представлен спектр инфракрасного излучения для образца, содержащего форму C гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.19 представлен спектр комбинационного рассеяния света для образца, содержащего форму C гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.20 представлена изотерма сорбции влаги для образца, содержащего форму C гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.21 представлена термограмма термического гравиметрического анализа образца, содержащего форму D гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.22 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму D гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.23 представлена порошковая рентгенограмма образца, содержащего форму D гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.24 представлена термограмма термического гравиметрического анализа образца, содержащего форму E гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.25 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму E гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.26 представлена порошковая рентгенограмма образца, содержащего форму E гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.27 представлен спектр инфракрасного излучения для образца, содержащего форму E гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.28 представлен спектр комбинационного рассеяния света для образца, содержащего форму E гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.29 представлена изотерма сорбции влаги для образца, содержащего форму E гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.30 представлена термограмма термического гравиметрического анализа образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.31 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.32 представлена порошковая рентгенограмма образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.33 представлена порошковая рентгенограмма, смоделированная на основании данных дифракции рентгеновских лучей в монокристалле, полученных для образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.34 представлен спектр инфракрасного излучения для образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.35 представлен спектр комбинационного рассеяния света для образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.36 представлена изотерма сорбции влаги для образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.37 представлена асимметричная единица кристаллической структуры формы F, полученная посредством дифракции рентгеновских лучей в монокристалле образца, содержащего форму F гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.38 представлена термограмма термического гравиметрического анализа образца, содержащего форму G гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.39 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму G гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.40 представлена порошковая рентгенограмма образца, содержащего форму G гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.41 представлена изотерма сорбции влаги для образца, содержащего форму G гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.42 представлена термограмма термического гравиметрического анализа образца, содержащего форму H гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.43 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму H гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.44 представлена порошковая рентгенограмма образца, содержащего форму H гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.45 представлена термограмма термического гравиметрического анализа образца, содержащего форму I гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.46 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму I гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.47 представлена порошковая рентгенограмма образца, содержащего форму I гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.48 представлена порошковая рентгенограмма образца, содержащего форму J гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.49 представлена порошковая рентгенограмма образца, содержащего форму K гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.50 представлена порошковая рентгенограмма, смоделированная на основании данных дифракции рентгеновских лучей в монокристалле, полученных для образца, содержащего форму K гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.51 представлена термограмма термического гравиметрического анализа образца, содержащего форму L гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.52 представлена термограмма дифференциальной сканирующей калориметрии образца, содержащего форму L гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.53 представлена порошковая рентгенограмма образца, содержащего форму L гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.54 представлена порошковая рентгенограмма образца, содержащего десольватированный сольват, относящийся к изоструктурному семейству 1 гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.55 представлена термограмма термического гравиметрического анализа образца, содержащего аморфную форму гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.56 представлена термограмма модулированной дифференциальной сканирующей калориметрии образца, содержащего аморфную форму гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.57 представлена порошковая рентгенограмма образца, содержащего аморфную форму гидрохлоридной соли (-)-O-десметилвенлафаксина.
На фиг.58 представлена изотерма сорбции влаги для образца, содержащего аморфную форму гидрохлоридной соли (-)-O-десметилвенлафаксина.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
5.1 ОПРЕДЕЛЕНИЯ
В используемом в настоящем описании смысле термин «(-)-O-десметилвенлафаксин» означает соединение, которое имеет химическое название (-)-1-[2-(диметиламино)-1-(4-гидроксифенил)этил]циклогексанол.
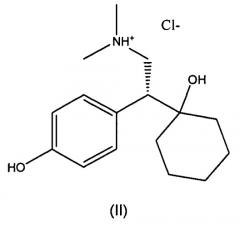
В используемом в настоящем описании смысле термин «фармацевтически приемлемые соли» относится к солям, полученным из фармацевтически приемлемых, относительно нетоксичных кислот, включая неорганические кислоты и органические кислоты. Подходящие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, угольную, лимонную, дигидрофосфорную, этенсульфоновую, фумаровую, галактуроновую, глюконовую, глюкуроновую, глутаминовую, бромистоводородную, хлористоводородную, йодистоводородную, изомасляную, изэтиновую, молочную, малеиновую, яблочную, малоновую, миндальную, метансульфоновую, моногидроугольную, моногидрофосфорную, моногидросерную, муциновую, азотную, памовую, пантотеновую, фосфорную, фталевую, пропионовую, субериновую, янтарную, серную, винную, толуолсульфоновую, включая п-толуолсульфоновую, м-толуолсульфоновую и o-толуолсульфоновую кислоты, и тому подобные (см., например, Berge et al., J. Pharm. Sci., 66: 1-19 (1977); Stahl and Wermuth, Handbook of Pharmaceutical Salts, Wiley VCH, (2002)). Также включены соли других относительно нетоксичных соединений, которые обладают свойствами кислоты, включая аминокислоты, такие как аргинин и тому подобные, и другие соединения, такие как аспирин, ибупрофен, сахарин и тому подобные. Особенно предпочтительными являются хлористоводородная, бромистоводородная, метансульфоновая и серная кислоты, и наиболее предпочтительной является гидрохлоридная соль. Кислотно-аддитивные соли могут быть получены в результате контакта нейтральной формы таких соединений с достаточным количеством требуемой кислоты, либо неразбавленной, либо в подходящем инертном растворителе. В виде твердых веществ соли могут существовать в кристаллических и/или аморфных модификациях.
Конкретные соли, описанные ниже, включают «гидрохлоридные соли», «соли хлористоводородной кислоты» и «HCl-соли» (-)-O-десметилвенлафаксина согласно изобретению. Гидрохлоридная соль, соль хлористоводородной кислоты или HCl-соль представляет собой кислотно-аддитивную соль, образованную с использованием хлористоводородной кислоты.
Термин «твердые формы» и родственные термины, используемые в настоящем описании, если не оговорено особо, относятся к кристаллическим формам и аморфным формам, содержащим (-)-O-десметилвенлафаксин, и, в частности, включает кристаллические формы и аморфные формы, содержащие соли (-)-O-десметилвенлафаксина.
Термин «кристаллический» и родственные термины, используемые в настоящем описании при использовании для описания вещества, компонента или продукта, означают, что вещество, компонент или продукт является кристаллическим, что определяют на основании дифракции рентгеновских лучей. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA, 173 (1990); The United States Pharmacopeia, 23rd ed., 1843-1844 (1995).
Термин «кристаллические формы» и родственные термины в настоящем описании относятся к различным кристаллическим модификациям данного вещества, включая, без ограничения, полиморфы, сольваты, гидраты, сокристаллы и другие молекулярные комплексы, а также соли, сольваты солей, гидраты солей, другие молекулярные комплексы солей и их полиморфы. Кристаллические формы вещества могут быть получены несколькими способами, которые известны в данной области. Такие способы включают, без ограничения, перекристаллизацию из расплава, охлаждение расплава, перекристаллизацию из растворителя, перекристаллизацию в замкнутом объеме, например в нанопорах или капиллярах, перекристаллизацию на поверхностях или матрицах, таких как, например, полимеры, перекристаллизацию в присутствии добавок, таких как, например, противомолекулы сокристалла, десольватацию, дегидратацию, быстрое упаривание, быстрое охлаждение, медленное охлаждение, диффузию из паровой фазы, возгонку, измельчение и измельчение с добавлением по каплям растворителя.
Термины «полиморфы», «полиморфные формы» и родственные термины в настоящем описании относятся к двум или более кристаллическим формам, которые состоят из одной и той же молекулы, молекул или ионов. Разные полиморфы могут обладать разными физическими свойствами, такие как, например, температуры плавления, теплота плавления, растворимости, скорости растворения и/или колебательные спектры, в результате расположения или конформации молекул или ионов в кристаллической решетке (см., например Byrn, S.R., Pfeiffer, R.R., and Stowell, J.G. (1999) Solid-State Chemistry of Drugs, 2nd ed., SSCI, Inc.: West Lafayette, IN). Различия в физических свойствах, проявляемых полиморфами, влияют на фармацевтические параметры, такие как стабильность при хранении, способность подвергаться прессованию и плотность (важные для приготовления композиций и производства продукта), и скорость растворения (важный фактор с точки зрения биодоступности). Различия в стабильности могут быть результатом изменений химической активности (например, разное окисление, так что лекарственная форма обесцвечивается быстрее в том случае, когда содержит один полиморф, по сравнению с формой, содержащей другой полиморф) или механических изменений (например, таблетки крошатся при хранении, так как кинетически предпочтительный полиморф превращается в термодинамически более стабильный полиморф) или одновременно изменений химической активности и механических изменений (например, таблетки одного полиморфа более чувствительны к разрушению при высокой влажности). В результате различий в растворимости/растворении в предельной ситуации некоторые полиморфные переходы могут приводить к утрате эффективности или в другом предельной случае - к токсичности. Кроме того, физические свойства кристалла могут быть важны для обработки, например, один полиморф может с большей вероятностью образовывать сольваты или может с трудом поддаваться фильтрованию и отмыванию от примесей (т.е., форма и распределение частиц по размеру могут быть разными у разных полиморфов).
Термин «сольват» и «сольватированный» в используемом в настоящем описании смысле относится к кристаллической форме вещества, которая содержит растворитель. Термин «гидрат» и «гидратированный» относится к сольвату, в котором растворителем является вода. Термин «полиморфы сольватов» относится к существованию более чем одной кристаллической формы для конкретной сольватной композиции. Подобным образом «полиморфы гидратов» относится к существованию более чем одной кристаллической формы для конкретной гидратной композиции.
Термин «десольватированный сольват» в используемом в настоящем описании смысле относится к кристаллической форме вещества, которая может быть получена удалением растворителя из сольвата.
Термин «изоструктурное семейство» в используемом в настоящем описании смысле относится к серии из двух или более кристаллических форм вещества, которые имеют структурное сходство, включая приблизительно сходные межплоскостные расстояния в кристаллической решетке. (Более подробный расчет кристаллических решеток можно найти в главах 2 и 3 в работе Stout and Jensen, X-Ray Structure Determination: A Practical Guide, MacMillan Co., New York (1968)). Благодаря структурному сходству представители изоструктурного семейства кристаллических форм обычно имеют сходные, но необязательно идентичные порошковой рентгенограммы. В основе изоструктурного семейства может быть вещество, которое представлено нейтральной молекулой, солью или молекулярным комплексом. Серия может состоять из сольватов, включая гидраты, и кристаллических форм вещества в виде десольватированных сольватов. Сольватированные представители изоструктурного семейства кристаллических форм обычно содержат один или более растворителей, включая воду, в кристаллической решетке. Растворителем или растворителями в кристаллической решетке могут быть растворитель или растворители для кристаллизации, используемые при получении кристаллической формы. Обычные растворители, используемые для кристаллизации, включают воду и все классы органических и других типов лабораторных растворителей, включая, без ограничения, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, втор-бутанол, трет-бутанол, гидроксифенил, глицерин и тому подобные; карбонилсодержащие растворители, такие как ацетон, метилэтилкетон, муравьиная кислота, уксусная кислота, этилацетат, бутилацетат, N,N-диметилформамид и тому подобные; углеводороды, такие как пентан, гексан, циклогексан, бензол, толуол, ксилены и тому подобные; галогенированные растворители, такие как дихлорметан, хлороформ, четыреххлористый углерод и тому подобные; и лабораторные растворители, содержащие другие гетероатомы и/или функциональные группы, такие как ацетонитрил, тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, сероуглерод, диметилсульфоксид, 1,4-диоксан, нитробензол, нитрометан, пиридин и тому подобные.
Термин «аморфный», «аморфная форма» и родственные термины, используемые в настоящем описании, означают, что рассматриваемый материал, вещество, компонент или продукт не является кристаллическим, что определяют на основании рентгенограммы. Аморфные формы вещества могут быть получены несколькими способами, которые известны в данной области. Такие способы включают, без ограничения, нагревание, охлаждение расплава, быстрое охлаждение расплава, выпаривание растворителя, быстрое выпаривание растворителя, десольватацию, возгонку, измельчение, криоизмельчение и сушку вымораживанием.
Способы характеристики кристаллических форм и аморфных форм включают, без ограничения, термический гравиметрический анализ (ТГА), дифференциальную сканирующую калориметрию (ДСК), порошковую рентгеновскую дифрактометрию (XRPD), рентгеновскую дифрактометрию монокристаллов, колебательную спектроскопию, например, инфракрасную (ИК) спектроскопию и спектроскопию комбинационного рассеяния, ЯМР твердого тела, оптическую микроскопию, высокотемпературную оптическую микроскопию, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ площади поверхности, исследования растворимости и исследования растворения.
В используемом в настоящем описании смысле и если не оговорено особо, термины «около» и «примерно» при использовании в связи с дозами, количеством или массовым процентом ингредиентов композиции или лекарственной формы, означают дозу, количество или массовый процент, которые, как понятно специалистам в данной области, обеспечивают фармакологическое действие, эквивалентное действию, получаемому при использовании конкретной дозы, количества или массового процента. В частности, термины «около» и «примерно» при использовании в данном контексте означают дозу, количество или массовый процент в пределах 15%, в пределах 10%, в пределах 5%, в пределах 4%, в пределах 3%, в пределах 2%, в пределах 1% или в пределах 0,5% от конкретной дозы, количества или массового процента.
В используемом в настоящем описании смысле и если не оговорено особо, термины «около» и «примерно» при использовании в связи с числовым значением или диапазоном значений, которые указаны при описании конкретной твердой формы, например, конкретной температуры или диапазона температур, таких как, например, температуры, которые описывают плавление, дегидратацию, десольватацию или стеклование; изменения массы, такого как, например, изменение массы как функции температуры и влажности; содержания растворителя или воды, например, в виде указания массы или процента; или положения пиков, таких как, например, в случае анализа ИК-спектроскопией или спектроскопией комбинационного рассеяния или XRPD; указывают, что зна