Применение низкой температуры и/или низкого pн в культуре клеток
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению белка, представляющего собой растворимый рецептор, в культуре клеток млекопитающего, и может быть использовано в медицине для получения фармацевтических композиций растворимого рецептора. Способ предусматривает: (а) выращивание клеток млекопитающего в культуре при пониженной температуре в диапазоне от 27,0°С до менее чем 30,0°С; и (b) выращивание клеток в культуре при пониженном рН в диапазоне от 6,8 до менее чем 7,0. Вариант способа предусматривает: (а) выращивание указанной культуры клеток в диапазоне температур от 27,0°С до менее чем 30,0°С; причем уровень гликозилирования получаемого белка увеличивается при увеличении температуры или уменьшается при уменьшении температуры до определенного заранее уровня; и (b) выращивание указанной культуры клеток в диапазоне рН от 6,8 до менее чем 7,0; причем уровень гликозилирования получаемого белка увеличивается при увеличении рН или уменьшается при уменьшении рН до определенного заранее уровня. Изобретение позволяет получить белковый продукт - растворимый рецептор со сниженным количеством неправильно свернутых и/или агрегированных молекул. 4 н. и 19 з.п. ф-лы, 45 ил., 1 табл., 2 пр.
Реферат
[0001] Настоящая заявка испрашивает приоритет согласно Предварительной Заявке США сер. №60/913,382, поданной 23 апреля, 2007, включенной в текст настоящей заявки в полном объеме посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Область техники
[0002] Настоящее изобретение относится к способам улучшения продуцирования белков культивируемыми клетками, в частности клетками млекопитающих. В частности, данное изобретение относится к способам получения белкового(ых) продукта(ов), например, гликопротеинового(ых) продукта(ов), в которых характеристики белкового продукта контролируют путем манипуляций с условиями, в которых находится культура клеток. Изобретение также относится к способам повышения терапевтической эффективности и/или иммуногенности белкового(ых) продукта(ов), например, гликопротеинового продукта(ов), продуцируемых клетками млекопитающих, например, путем управления гликозилированием белков и снижения агрегации и неправильного сворачивания белка за счет снижения температуры и/или рН клеточной культуры.
Уровень техники
[0003] Большую часть продуктов биотехнологии как коммерчески доступных, так и находящихся на стадии разработки, составляют белковые терапевтические средства. Существует значительная и продолжающая расти потребность в получении белка в культуре клеток животных, а также в улучшенных способах такого получения. Такие улучшенные способы нужны, поскольку клеточный аппарат клетки животного, как правило, должен вырабатывать много форм белковых лекарственных средств, таких как белки, подвергшиеся посттрансляционной модификации, в частности гликозилированные белки.
[0004] Обычной проблемой, возникающей при применении способов крупномасштабного получения терапевтических белков, является то, что значительную часть белкового продукта получают в неправильно свернутой или агрегированной форме, т.е. в форме агрегатов высокой молекулярной массой («HMWA»). Например, повышенная рекомбинантная экспрессия полипептидов в клетках может вызвать перегрузку аппарата эндоплазматического ретикулума (ЭР), что приводит к тому, что повышенное количество неправильно свернутых и/или агрегированных белков ускользает от механизма разрушения и выходит из ЭР. Таким образом, современные способы получения белка могут давать большую долю продукта, являющегося агрегированным, нефункциональным и, следовательно, бесполезного. Присутствие неправильно свернутого и/или агрегированного белка нежелательно, поскольку это может привести к неблагоприятным явлениям после введения, включая, но не ограничиваясь, возможную иммуногенность при введении (например, активацию комплемента или анафилаксию). Таким образом, избыточное неправильное сворачивание и/или агрегация терапевтического белка может привести к неудаче, например, в клинических испытаниях. В связи с этим, в данной области существует необходимость в новых способах ограничения или снижения неправильного сворачивания и/или агрегации белка.
[0005] Гликозилирование белков является обычным процессом посттрансляционной модификации, в ходе которого к поверхности белка в ЭР под действием ряда специализированных ферментов, гликотрансфераз и гликозидаз, присоединяются фрагменты сложных сахаров. Этот процесс может регулировать правильную укладку новосинтезированных полипептидов таким образом, чтобы только правильно свернутые белки могли покинуть ЭР, а неправильно свернутые подвергались расщеплению (разрушению). Характер гликозилирования белков влияет на нацеливание белков на их мишени, структуру, термодинамическую стабильность и ферментативную активность (см., напр., Solá et al. (2007) Cell. Mol. Life Sci. 64:2133-52; Solá and Griebenow (2006) FEBS Lett. 580:1685-90). Например, сиалирование N-гликанов связано с увеличением периода полужизни гликопротеинов, поскольку такие гликопротеины не распознаются рецепторами асиалогликопротеинов, которые направленно расщепляют несиалированные белки (см., напр., Bork et al. (2007) FEBS Letters 581:4195-98). Таким образом, изменения гликозилирования белков могут влиять на качество и эффективность продукта.
[0006] Более того, нарушенное гликозилирование белков может стать причиной иммуногенности конечного терапевтического белкового продукта. К белкам, продуцируемым в неприродных, субоптимальных условиях, могут присоединяться сахара и комбинации сахаров, не встречающиеся в природе на поверхности белков человека, что может привести к возникновению у пациента иммунной реакции (Jefferis (2006) Biotechnol. Prog. 21:11-16). Такое неприродное гликозилирование особенно часто встречается в таких белковых терапевтических средствах, как терапевтические средства на основе антител, например, терапевтические средства, содержащие белки слияния, содержащие Fc, например, терапевтические средства, содержащие белки слияния, содержащие растворимый Fc-рецептор.
[0007] По этим причинам Федеральное Управление по Лекарственным Средствам (FDA) требует, чтобы профили гликоформ терапевтических белков поддерживались в строгих рамках. Таким образом, в фармацевтической промышленности существует необходимость в способе получения терапевтических белков в культуре клеток, который позволял бы контролировать уровень гликозилирования белков.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Таким образом, настоящее изобретение представляет собой способ получения белка в культуре клеток, включающий не менее одного из: (а) выращивание клеток в культуре клеток при пониженной температуре; и (b) выращивание клеток в культуре клеток при пониженном рН; что обеспечивает снижение образования неправильно свернутых и/или агрегированных белков. Как вариант, клетки выращивают в культуре клеток при пониженной температуре и при пониженных значениях рН.
[0009] В предпочтительных вариантах реализации настоящее изобретение относится к изменению параметров рН и температуры, обеспечивающему снижение образования неправильно свернутых и/или агрегированных белков в культуре клеток млекопитающего, и в частности, в культуре клеток яичника китайского хомячка («СНО»). В предпочтительных вариантах реализации культура клеток продуцирует белок («получаемый белок», «продуцируемый белок»), представляющий собой растворимый рецептор, например, помимо прочих, белки TNFR-Fc или sIL-13R. В этих предпочтительных вариантах реализации пониженная температуре может лежать в диапазоне от 27.0°С до менее 30.0°С. В других предпочтительных вариантах реализации пониженный рН лежит в диапазоне от 6.80 до менее 7. Также можно использовать комбинацию рН и температуры в указанных выше диапазонах.
[0010] Согласно другому аспекту, изобретение представляет собой способ получения белка в культуре клеток, причем уровень гликозилирования получаемого белка регулируют путем изменения температуры и/или рН культуры клеток. Таким образом, уровень гликозилирования, например, без ограничения, сиалирование N-гликанов, можно повысить путем повышения температуры и/или рН или снизить путем понижения температуры и/или рН.
[0011] Согласно следующему аспекту, настоящее изобретение представляет собой способ получения терапевтического белка при контроле параметров, указанных выше. Согласно еще одному аспекту, настоящее изобретение представляет собой фармацевтическую композицию, содержащую терапевтический белок, полученный описанным выше способом, и фармацевтически приемлемый носитель.
КРАТКОЕ ОПИСАНИЕ ФИГУР
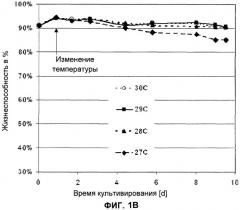
[0012] На ФИГ.1А представлены общие значения числа жизнеспособных клеток (ось Y; IVC [нормированные е9 клеток *день/л]), нормированные по средним значениям IVC в день сбора клеток, клеток СНО, трансфецированных TNFR-Fc, выращенных при 27.0°С [♦], 28.0°С [▲], 29.0°С [■] или при 30.0°С [○], в зависимости от времени (ось X; время культивирования в днях [d]); ФИГ.1В представляет жизнеспособность клеток (ось Y) для тех же клеток в зависимости от времени (ось X; время культивирования [d]).
[0013] На ФИГ.2А представлен профиль остаточной глюкозы (ось Y; глюкоза [г/л]) в культуре клеток СНО, трансфецированных TNFR-Fc, выращенных при 27.0°С [♦], 28.0°С [▲], 29.0°С [■] или при 30.0°С [○], в зависимости от времени (ось X; время культивирования [d]); ФИГ.2В представляет профиль глютамина (ось Y; глютамин [мМ]) для тех же клеток в зависимости от времени (ось X; время культивирования [d]).
[0014] На ФИГ.3А представлена концентрация лактата в средах (ось Y; лактат [г/л]) в культуре клеток СНО, трансфецированных TNFR-Fc, выращенных при 27.0°С [♦], 28.0°С [▲], 29.0°С [■] или при 30.0°С [○], в зависимости от времени (ось X; время культивирования [d]); ФИГ.3В представляет профиль аммония (ось Y; NH4 + [мМ]) для тех же клеток в зависимости от времени (ось X; время культивирования [d]).
[0015] На ФИГ.4А изображены значения удельной продуктивности клеток, представленные как интегральное среднее Qр (ось X; Инт. Ср. Qp [нормированное мг/е9 клеток/день]), приведенные к интегральным средним Qp среднего дневного урожая клеток, для культуры клеток СНО, трансфецированных TNFR-Fc, выращенных при 27.0°С [♦], 28.0°С [▲], 29.0°С [■] или при 30.0°С [○], в зависимости от времени (ось X; время культивирования в днях [d]); ФИГ.4В представляет титр TNFR-Fc (ось X; титр продукта [нормированные мг/л]), нормированный по средним значениям титра в день сбора, для тех же клеток в зависимости от времени (ось X; время культивирования [d]).
[0016] Влияние изменения температуры при получении (ось X; [°С]) в культуре клеток СНО, трансфецированных TNFR-Fc, на продуцирование неправильно свернутого и/или агрегированного TNFR-Fc (ось Y; % неправильно свернутого/агрегированного продукта) представлено на ФИГ.5А; а влияние температуры на продукцию HMWA (ось Y; % продукта высокой молекулярной массы) представлено на ФИГ.5В.
[0017] Влияние изменения температуры получения (ось X; температура [°С]) в культуре клеток СНО, трансфецированных TNFR-Fc, на процентную долю общего сиалирования (сиалирование N- и O-связанных гликанов) TNFR-Fc (ось Y; процентная доля общего сиалирования контрольного материала) показано на ФИГ.6А. В качестве контрольного материала использовали определенные аликвоты TNFR-Fc с известным и предпочтительным характером (паттерном) гликозилирования, с которым можно сравнить результаты теста. На ФИГ.6В показано влияние изменения температуры получения (ось X; температура [°С]) в культуре тех же клеток на общую процентную долю сиалированных (□) или процентную долю несиалированных (●) N-связанных гликанов (ось Y; Процент Общего Числа N-связанных Гликанов).
[0018] На ФИГ.7 показано влияние выращивания клеток при разной температуре (27.0°С [♦], 28.0°С [▲], 29.0°С [■] или 30.0°С [○]) на рН культуры клеток СНО (ось Y) в зависимости от времени (ось X; время культивирования [d]).
[0019] На ФИГ.8А представлены интегрированные значения числа жизнеспособных клеток (ось Y; IVC [нормированные е9 клеток *день/л]), нормированные по средним значениям IVC в день сбора клеток, для клеток СНО, трансфецированных TNFR-Fc, выращенных при заданных значениях рН, равных 7.20 [◊], 7.10 [■], 7.00 [♦], 6.90 [●] или 6.80 [▲] в зависимости от времени (ось X; время культивирования [d]); а на ФИГ.8В показана жизнеспособность тех же клеток (ось Y) в зависимости от времени (ось X; время культивирования [d]).
[0020] На ФИГ.9А представлен профиль глюкозы (ось Y; глюкоза [г/л]) культуры клеток СНО, трансфецированных TNFR-Fc, выращенных при заданных значениях рН, равных 7.20 [◊], 7.10 [■], 7.00 [♦], 6.90 [●] или 6.80 [▲], в зависимости от времени (ось X; время культивирования [d]); а на ФИГ.9В представлен профиль глютамина (ось Y; глютамин [мМ]) для одних и тех же клеток в зависимости от времени (ось X; время культивирования [d]).
[0021] На ФИГ.10А представлена концентрация лактата в средах (ось Y, лактат [г/л]) культуры клеток СНО, трансфецированных TNFR-Fc, выращенных при заданных значениях рН, равных 7.20 [◊], 7.10 [■], 7.00 [♦], 6.90 [●] или 6.80 [▲], в зависимости от времени (ось X, время культивирования [d]); на ФИГ.10В представлен профиль аммония (ось Y; NH4 + [мМ]) тех же клеток в зависимости от времени (ось X, время культивирования [d]).
[0022] На ФИГ.11А представлено отклонение рН клеточной культуры от заданных значений рН (ось X, рН культуры) для клеток СНО, трансфецированных TNFR-Fc, выращиваемых при заданных значениях рН, равных 7.20 [◊], 7.10 [■], 7.00 [♦], 6.90 [●] или 6.80 [▲], в зависимости от времени (ось X, время культивирования [d]). На ФИГ.11В представлена осмоляльность (ось X; осмоляльность [мОсм/кг]) для одних тех же клеток, выращенных при заданных значениях рН, равных 7.20 [◊], 7.10 [■], 7.00 [♦], 6.90 [●] или 6.80 [▲], в зависимости от времени (ось X, время культивирования [d]).
[0023] На ФИГ.12А изображена удельная продуктивность клеток, представленная интегральным средним Qp (ось X; Инт. Ср. Qp [нормированное значение в мг/е9 клеток/день]), интегральное среднее Qp, нормированное по среднему значению в день сбора клеток для клеток СНО, трансфецированных TNFR-Fc, выращенных при заданных значениях рН 7.20 [◊], 7.10 [■], 7.00 [♦], 6.90 [●] или 6.80 [▲] в зависимости от времени (ось X, время культивирования [d]); а на ФИГ.12В представлен титр TNFR-Fc (ось X; титр продукта [нормированное значение в мг/л]), нормированный по среднему титру в день сбора для тех же клеток в зависимость от времени (ось X, время культивирования [d]).
[0024] На ФИГ.13А показано влияние изменения заданных значений рН культуры (ось X, рН) клеток СНО, трансфецированных TNFR- Fc, на продуцирование неправильно свернутого/агрегированного TNFR-Fc (ось Y; % неправильно свернутого/агрегированного продукта).На ФИГ.13В изображено влияние изменения заданных значений рН культуры (ось X, рН) на продуцирование HMWA (ось Y; % продукта высокой молекулярной массы).
[0025] Влияние изменения заданных значений рН (ось X; рН) в культуре клеток СНО, трансфецированных TNFR-Fc, на процентную долю общего сиалирования TNFR-FC (ось Y; процентная доля общего сиалирования контрольного материала) показано на ФИГ.14А. ФИГ.14В представляет влияние изменения заданных значений рН клеточной культуры (ось X, рН) в культуре одних и тех же клеток, на общий процент сиалированных (□) или несиалированных (●) N-связанных гликанов (ось Y; процент общего количества N-связанных гликанов).
[0026] На ФИГ.15 изображен типичный профиль флюоресценции (ось Y; флюоресценция, измеренная в мВ) в зависимости от времени удерживания (ось X; минуты), описывающий сиалирование N-гликанов, которое определяли путем исследования освобожденных от меченых гидрозина 2-аминобензамидом-(2АВ) гликоформ белка с помощью Нормальной Фазовой Хроматографии.
[0027] На ФИГ.16 показаны профили флюоресценции (ось Y; мВ) в зависимости от времени удержания (ось X; минуты), описывающие сиалирование N-связанных гликанов, что наблюдалось благодаря исследованию освобожденных от гидразина 2-аминобензамид-(2АВ)-меченых гликоформ белка с помощью Нормальной Фазовой Хроматографии культуры клеток СНО, трансфецированных TNFR-Fc, при различных заданных значениях рН культуры.
[0028] На ФИГ.17 представлены: (А) плотность жизнеспособных клеток (ось Y; клеток/мл), (В) общая плотность клеток, включающая как жизнеспособные, так и не жизнеспособные клетки (ось Y; клеток/мл), (С) жизнеспособность клеток (ось Y) и (D) интегрированные значения числа жизнеспособных клеток (IVC) (ось Y; [е9 клеток *день/л]) для культуры клеток с повышенной экспрессией sIL-13R, выращенных при 37.0°С [♦], 33.0°С [■], 32.0°С [●], 31.0°С [◊], 29.0°С [∆] или КТ [□] в течение определенного времени (ось X; время культивирования [d]).
[0029] На ФИГ.18 представлен титр sIL-13R как в форме димеров, так и в HMWA форме (ось Y; sIL-13R [мг/л]) для клеточных культур с повышенной экспрессией sIL-13R, выращиваемых при 37.0°С [♦], 33.0°С [■], 32.0°С [●], 31.0°С [◊], 29.0°С [∆] или КТ (комнатной температуре) [□], в зависимости от времени (ось X; время культивирования [d]).
[0030] На ФИГ.19А представлена скорость продукции sIL-13R (ось Y; Qp [мг/е9 клеток/d]) в течение разных временных интервалов (ось X) для культур клеток с повышенной экспрессией sIL-13R, выращиваемых при 37.0°С, 33.0°С, 32.0°С, 31.0°С, 29.0°С или RT. На ФИГ.19В представлены интегральные средние удельной продуктивности клеток (ось Y; Инт. Ср. Qp [мг/е9 клеток/день]) в зависимости от времени (ось X; время культивирования [d]) для культур клеток с повышенной экспрессией sIL-13R, выращиваемых при 37.0°С, 33.0°С, 32.0°С, 31.0°С, 29.0°С или КТ.
[0031] На ФИГ.20 представлен дневной удельный уровень потребления глюкозы (ось Y; Qglc [г/е9 клеток/ d]) для различных интервалов времени (ось X) для культур клеток с повышенной экспрессией sIL-13R, выращенных при 37.0°С, 33.0°С, 32.0°С, 31.0°С, 29.0°С или КТ.
[0032] На ФИГ.21 представлен дневной удельный уровень потребления глютамина (ось Y; Qgln [ммоль/е9 клеток/ d]) для различных интервалов времени (ось X) для культур клеток с повышенной экспрессией sIL-13R, выращенных при 37.0°С, 33.0°С, 32.0°С, 31.0°С, 29.0°С или КТ.
[0033] На ФИГ.22 представлена концентрация лактата (ось Y; лактат[г/л]) в культуральных средах культуры клеток с повышенной экспрессией sIL-13R, выращенных при 37.0°С [♦], 33.0°С [■], 32.0°С [●], 31.0°С [◊], 29.0°С [∆] или КТ [□] в зависимости от времени (ось X; время культивирования [d]).
[0034] На ФИГ.23 представлена концентрация аммония (ось Y; аммоний [мМ]) в культуральных средах культуры клеток с повышенной экспрессией sIL-13R, выращенных при 37.0°С [♦], 33.0°С [■], 32.0°С [●], 31.0°С [◊], 29.0°С [∆] или КТ [□] в зависимости от времени (ось X; время культивирования [d]).
[0035] На ФИГ.24 представлено влияние температуры культуры клеток (ось X; температура продукции [°С]) на продуцирование HMWA (ось Y; % Продукта высокой молекулярной массы) на 9 день культивирования клеток, сверхэкспрессирующих sIL-13R.
[0036] На ФИГ.25 представлено влияние температуры культуры клеток (ось X; температура продуцирования [°С]) на продуцирование HMWA (ось Y; % Высокомолекулярные Продукты) в день 18 культивирования клеток с повышенной экспрессией sIL-13R.
[0037] На ФИГ.26А представлена процентная доля димера sIL-13R (ось Y; % димера sIL-13R), выделенного из общего белка sIL-13R, полученного в кондиционированной среде клетками с повышенной экспрессией sIL-13R, выращенными при 37.0°С [♦], 33.0°С [■], 32.0°С [●], 31.0°С [◊], 29.0°С [∆] или КТ [□], в зависимости от времени (ось X; время культивирования [d]). На ФИГ.26В представлена процентная доля HMWA (ось Y; % Продукта высокой молекулярной массы) относительно общего sIL-13R в кондиционированной среде клеток с повышенной экспрессией sIL-13R в зависимости от времени (ось X; время культивирования [d]).
[0038] На ФИГ.27 представлен титр димера sIL-13R (ось Y; только sIL-13R [мг/л в кондиционированной среде клеток, выращенных при 37.0°С [♦], 33.0°С [■], 32.0°С [●], 31.0°С [◊], 29.0°С [∆] или КТ [□], в зависимости от времени (ось X; время культивирования [d]).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0039] Превалирующей точкой зрения в получении лекарственных белков в культуре клеток млекопитающего является то, что температура в ходе фазы продуцирования должна быть, по крайней мере, 30.0°С, и значение рН должно составлять по меньшей мере 7. Однако выращивание клеток в культуре клеток при температуре фазы продуцирования продукта около 30.0°С и значениях рН около 7 может вести к повышенной агрегации белков (также упоминаемой здесь как агрегаты высокой молекулярной массы HMWA), и неправильному сворачиванию белков, и, таким образом, к выработке меньшего количества функционального и пригодного к использованию белка.
[0040] Согласно настоящему изобретению предложен новый способ получения белка в культуре клеток, который обеспечивает снижение неправильного сворачивания белка и снижение агрегации белков. Согласно другому аспекту изобретения предложены способы контроля уровня гликозилирования белка.
Белки, полученные способами согласно настоящему изобретению
[0041] Фразы «полипептид» или «полипептидный продукт» в настоящем описании являются синонимами терминов «белок» или «белковый продукт» соответственно и, в соответствии со значением, принятым в данной области, обозначают по меньшей мере одну цепь аминокислот, соединенных последовательными пептидными связями. В некоторых вариантах осуществления, «целевой (целевой) белок» или «целевой полипептид» и подобные соединения представляют собой белок, кодируемый молекулой экзогенной нуклеиновой кислоты, введенной путем трансфекции или трансформации в клетку-хозяина, напр., временно или постоянно трансфецированный или трансформированный в клетку-хозяина. В некоторых вариантах осуществления, в которых экзогенная ДНК, которой трансфецируют или трансформируют клетку-хозяина, кодирует "целевой белок", при этом последовательность нуклеиновой кислоты экзогенной ДНК определяет последовательность аминокислот. Такая последовательность может представлять собой последовательность, встречающуюся в природе, или, как вариант, последовательность, созданную человеком. В некоторых вариантах реализации, «целевой белок» представляет собой белок, кодируемый молекулой нуклеиновой кислоты, являющейся эндогенной для клетки-хозяина. Экспрессия такого эндогенного целевого белка может быть изменена путем трансфецирования клетки-хозяина экзогенной молекулой нуклеиновой кислоты, которая может, например, содержать одну или более регуляторных последовательностей и/или кодировать белок, усиливающий экспрессию целевого белка. В вариантах осуществления настоящего изобретения целевой полипептид получают в культуре клеток, например, для последующей очистки.
[0042] Термин «гликопротеин», «гликозилированный белок» и им подобные относятся в белкам, содержащим остатки сахаров, например, олигосахаридные фрагменты, присоединенные к боковым цепям аспарагина (N-гликозилирование), либо к боковым цепям серина и/или треонина (O-гликозилирование). Например, одним из обычных типов N-гликозилирования белков является сиалирование белков (также известное как сиалирование N-гликанов). Гликозилирование большинства секреторных и мембранных белков (в том числе мембранных рецепторов) происходит в ЭР и/или аппарате Гольджи. Известно, что гликозилирование контролирует сворачивание и выход белков из ЭР. Кроме того, многие стадии процесса гликозилирования/дегликозилирования осуществляются в аппарате Гольджи. Современные представления о процессах гликозилирования как в ЭР, так и в аппарате Гольджи рассмотрены в Helenius et al. (2001) Science 291:2364-69; Parodi (2000) Biochem. J. 348:1-13; и Parodi (2000) Annu. Rev. Biochem. 69:69-93. Таким образом, в некоторых вариантах осуществления настоящего изобретения, целевой полипептид представляет собой целевой гликопротеин, а целевой гликопротеин получают в культуре клеток, например, для последующей очистки. В одном из вариантов осуществления настоящего изобретения целевой гликопротеин представляет собой рецептор и в т.ч. может представлять собой растворимый рецептор.
[0043] Способы и композиции согласно настоящему изобретению можно использовать для получения любого целевого белка, включая, но не ограничиваясь белками, обладающими фармацевтическими, диагностическими, сельскохозяйственными и/или любыми другими свойствами, полезными для коммерческого, экспериментального и другого использования. Кроме того, целевой белок может представлять собой белковое терапевтические средство. Конкретно, белковое терапевтическое средство (или терапевтический белок) представляет собой белок, оказывающий биологическое воздействие на участок тела, на который он непосредственно воздействует, или на участок тела, на который он воздействует удаленно через интермедиаты. В некоторых вариантах осуществления, белки, получаемые с использованием способов и/или композиций согласно настоящему изобретению, могут быть переработаны или модифицированы перед введением их пациенту в качестве терапевтических белков.
[0044] Настоящее изобретение может быть использовано для культивирования клеток для улучшенного получения любых терапевтических белков, таких как фармацевтические или коммерчески значимые ферменты, рецепторы, гибридные рецепторы, растворимые рецепторы, растворимые гибридные рецепторы, антитела (например, моноклональные и/или поликлональные антитела), антигенсвязывающие фрагменты антител, белки слияния, содержащие Fc, SMIP (низкомолекулярные блочные иммунотерапевтические средства), цитокины, гормоны, регулирующие факторы, факторы роста, факторы коагуляции/факторы свертывания крови, или антигенсвязывающие агенты. Приведенный выше перечень белков приведен лишь в качестве примера и не является исчерпывающим перечислением. Среднему специалисту будут известны и другие белки, которые могут быть получены в соответствии с настоящим изобретением, и он будет иметь возможность использовать способы, раскрытые в настоящем описании, для получения таких белков.
[0045] Термин "антитело" включает в себя белки, включающие по меньшей мере одну, а как правило две области VH (вариабельная область тяжелой цепи) или их части, и/или по меньшей мере одну, а как правило две области VL (вариабельная область легкой цепи) или их части. В других вариантах реализации, антитело представляет собой тетрамер, состоящий из двух тяжелых цепей иммуноглобулина и двух легких цепей иммуноглобулина, где тяжелые и легкие цепи иммуноглобулинов связаны друг с другом, например, дисульфидными связями. Антитела или их части могут быть получены из любого источника, включая, но не ограничиваясь, антитела грызунов, приматов (человека и других приматов), животных семейства верблюжьих, акул, а также рекомбинантным путем, например, химерные, гуманизированные и/или созданные in vitro, например, при помощи способов, хорошо известных специалистам.
[0046] Настоящее изобретение также охватывает "антигенсвязывающие фрагменты антител", включая (I) фрагмент Fab, моновалентный фрагмент, состоящий из областей VL, VH, CL и CH1; (II) F (ab')2-фрагмент, бивалентный фрагмент, включающий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (III) фрагмент Fd, состоящий из областей VH и CH1; (IV) фрагмент Fv, состоящий из областей VL и VH одного плеча антитела, (V) фрагмента dAb, который состоит из области VH; (VI) вариабельная область животного смейства верблюдовых или камелизированная вариабельная область, например, область VHH; (VII) одноцепочечный Fv (ScFv); (VIII) биспецифичное антитело; и (IX) один или более антигенсвязывающих фрагментов иммуноглобулина, связанных с участком Fc. Кроме того, хотя две области Fv-фрагмента, VL и VH, кодируются различными генами, они могут быть соединены рекомбинантными методами, при помощи синтетического линкера, позволяющего объединить их в одну белковую цепь, в которой области VL и VH объединяются СС образованием моновалентных молекул (известных как одноцепочечный Fv (scFv), см., например, Bird et al. (1988) Science 242:423-26; Huston et al. (1988) Proc. Natl. Acad. Sci. U.S.A. 85:5879-83). Такие одноцепочечные антитела также подпадают под определения термина "антигенсвязывающий фрагмент" антитела. Эти фрагменты антител получают при использовании обычных методов, известных специалистам в данной области, и эти фрагменты оценены за функционирование по тому же принципу, что и интактные антитела.
[0047] Настоящее изобретение также включает однодоменные антитела. Однодоменные антитела могут включать антитела, гипервариабельные участки которых являются частью однодоменного полипептида. Примеры включают, но не ограничиваются, следующими: тяжелые цепи антител, природные антитела, лишенные легких цепей, однодоменные антитела, полученные из обычных четырехцепочечных антител, искусственно созданные антитела и однодоменные скаффолды, отличные от полученных из антител. Однодоменные антитела могут быть любыми из уже известных антител или антител, которые станут известны в будущем. Однодоменные антитела могут быть получены из любого вида, включая, но не ограничиваясь, перечисленными: мышь, человек, верблюд, лама, коза, кролик, корова и акула. Согласно одному аспекту изобретения, однодоменные антитела согласно настоящему изобретению представляют собой природные однодоменные антитела, известные как тяжелоцепочечные антитела, лишенные легких цепей. Такие однодоменные антитела описаны, например, в WO 9404678. Для ясности, эта вариабельная область, полученная из тяжелоцепочечного антитела, естественным образом лишенного легких цепей, называется в настоящем описании VHH или нанотелом, чтобы отличить его от обычной VH четырехцепочечных иммуноглобулинов. Такая молекула VHH может быть получена из антител, вырабатываемых животными семейства Верблюдовых, например, верблюд, лама, дромадер, альпака и гуанако. Другие виды, помимо Верблюдовых, могут вырабатывать тяжелоцепочечные антитела, естественным образом лишенные легких цепей; такие VHH входят в объем изобретения. Однодоменные антитела также включают IgNAR акулы, см., например, Dooley et al., Proc. Natl. Acad. Sci. U.S.A., 103:1846-1851 (2006).
[0048] Антитела, отличные от "биспецифичных" или "бифункциональных" антител, представляют собой антитела, все сайты связывания которых идентичны. "Биспецифичное " или "бифункциональное антитело" представляет собой искусственно созданное гибридное антитело, содержащее две различные пары тяжелых/легких цепей и два различных сайта связывания. Биспецифичные антитела могут быть получены с помощью различных методов, включая слияние гибридом или соединение Fab-фрагментов. См., например, Songsivilai & Lachmann, Clin. Exp. Immunol. 79:315-321 (1990); Kostelny et al., J. Immunol. 148, 1547-1553 (1992).
[0049] В тех вариантах осуществления изобретения, в которых белок представляет собой антитело или фрагмент антитела, белок может содержать по меньшей мере одну или две полноразмерные тяжелые цепи и по меньшей мере одну одну или две легкие цепи. В альтернативном варианте, антитела или фрагменты антител могут содержать только антигенсвязывающий фрагмент (например, Fab, F(ab')2, Fv или одноцепочечный фрамент Fv). Антитела или фрагменты антител могут представлять собой моноклональные или моноспецифичные антитела. Антитела или фрагменты антител могут представлять собой антитела человека, химерные антитела, антитела с привитыми CDR (гипервариабельными участками) или созданные in vitro антитела. Кроме того, существуют варианты осуществления, в которых антитело содержит константную область тяжелой цепи, выбранную из, например, IgG1, IgG2, IgG3 или IgG4. В еще одном варианте реализации, антитело содержит легкую цепь, выбранную из, например, легких цепей каппа и лямбда. В одном из вариантов осуществления изобретения, константная область изменена, например, путем мутации, что обеспечивает изменение свойств антитела (например, увеличить или снизить одно или более из следующих свойств: связывание Fc-рецептора, гликозилирование антител, число остатков цистеина, функционирование эффекторной клетки или как компонентов системы комплемента). Обычно, антитела или фрагменты антител специфичным образом связываются с заранее определенным антигеном, например, с антигеном, связанным с каким-либо нарушением в организме (нейродегенеративным, метаболическим, воспалительным, аутоиммунным и/или злокачественным заболеванием).
[0050] Описанные в настоящей заявке белки дополнительно возможно включают фрагмент, усиливающий одно или более из следующих свойств: стабильность, функцию эффекторной клетки или связывание комплемента. Например, антитело или антигенсвязывающий возможно дополнительно содержит пегилированный фрагмент, альбумин или константную область тяжелой и/или легкой цепи.
[0051] Обычно антитела получают при помощи традиционных гибридомных технологий (Kohler et al., Nature 256:495 499 (1975)), методов рекомбинантной ДНК (патент США №4,816,567) или методик фагового дисплея с использованием библиотек антигенов (Clackson et al., Nature 352:624 628 (1991); Marks et al., J. Mol. Biol. 222:581 597 (1991)). Информацию о других разнообразных технологиях получения антител см. Antibodies: A Laboratory Manual, eds. Harlow et al.. Cold Spring Harbor Laboratory, 1988.
[0052] Кроме того, антитела можно снабдить детектируемой или функциональной меткой. Такие метки включают радиоактивные метки (например, 131I или 99Тс), ферментные метки (например, пероксидаза хрена или щелочная фосфатаза) и другие химические вещества (например, биотин).
[0053] «Низкомолекулярные блочные иммунотерапевтические средства» (SMIP™) (Trubion Pharmaceuticals, Seattle, WA) представляют собой одноцепочечные полипептиды, состоящие из связывающего домена для распознавания структуры антигена, лиганда (контррецептора) или подобной структуры, шарнирного участка полипептида, или включающего один остаток цистеина, или не содержащего остатков цистеина, и областей СН2 и СН3 иммуноглобулина (см. также www.trubion.com). SMIP и области их применения описаны, например, в опубликованных заявках на патенты США №2007/002159, 2003/0118592, 2003/0133939, 2004/0058445, 2005/0136049, 2005/0175614, 2005/0180970, 2005/0186216, 2005/0202012, 2005/0202023, 2005/0202028, 2005/0202534, и 2005/0238646, и аналогах указанных выше патентов, каждый из которых включен сюда посредством ссылки и в полном объеме.
[0054] В еще одном варианте осуществления, целевой белок представляет собой растворимый рецептор, например, белок слияния, включающий растворимый рецептор. Мембранные белки, в т.ч. рецепторы, обычно представляют собой гликозилированые белки. Соответственно, способы согласно настоящему изобретению являются чрезвычайно полезными в получении неагрегированных, правильно свернутых и гликозилированных белков, относящихся к растворимым рецепторам слияния.
[0055] Растворимые белки, например растворимые рецепторы, можно получать в соответствии с хорошо известными способами. В еще одном варианте реализации настоящего изобретения, растворимый рецептор содержит внеклеточный участок рецептора или его фрагмент. В другом варианте осуществления, растворимый рецептор содержит два полипептида. Первый полипептид включает полноразмерный рецептор; как вариант, первый полипептид включает в себя полноразмерный рецептор, а, например, внеклеточный участок рецептора. В одном из вариантов осуществления, первый полипептид представляет собой полноразмерный цитокиновый рецептор; в альтернативном варианте первый полипептид короче, чем полноразмерный цитокиновый рецептор и представляет собой, например, внеклеточный участок цитокинового рецептора. Такой растворимый рецептор также может содержать дополнительный полипептид, например, последовательность полипептида GST, Lex-A, МВР или цепь, включая, например, иммуноглобулина, Fc-фрагмент, константную область тяжелой цепи различных изотипов, включая: IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE.
[0056] В одном из вариантов осуществления, второй полипептид предпочтительно является растворимым. В некоторых вариантах осуществления, второй полипептид увеличивает время полужизни (в сыворотке или, например, время полужизни в циркулирующей крови) связанного с ним полипептида. В предпочтительных вариантах осуществления второй полипептид включает по меньшей мере участок полипептида иммуноглобулина. Полипептиды слияния, включающие иммуноглобулин, известны в данной области и описаны, например, в патентах США №5,516,964; 5,225,538; 5,428,130; 5,514,582; 5,714,147; и 5,455,165. Известно, что растворимые белки слияния подвержены агрегации в процессе продуцирования и поэтому способы согласно настоящему изобретению дают особенное преимущество при работе с культурами клеток, вырабатывающих белки данного типа.
[0057] В некоторых вариантах осуществления, второй полипептид содержит полноразмерный полипептид иммуноглобулина. В альтернативном варианте, второй полипептид содержит участок, меньший, чем полноразмерный полипептид иммуноглобулина, например, тяжелую цепь, легкую цепь, Fab, Fab2, Fv или Fc. Второй полипептид содержать тяжелую цепь полипептида иммуноглобулина. Также второй полипептид содержать Fc-фрагмент полипептида иммуноглобулина.
[0058] В одном из вариантов осуществления изобретения, растворимый рецепторный белок слияния содержит ингибитор фактора некроза опухолей. В некоторых вариантах осуществления, ингибиторы фактора некроза опухолей представляют собой фактор некроза опухолей альфа или бета (TNFR-1; ЕР 417,563, опубликованная 20 мap. 1991; и TNFR-2, ЕР 417,014, опубликованная 20 мap. 1991, каждая из которых включена в настоящее описание посредством ссылки и в полном объеме) экспрессируются согласно системам и способам настоящего изобретения (для обзора, см. Naismith and Sprang, J. Inflamm. 47(1-2): 1-7, 1995-96, помещено сюда посредством ссылки и в полном объеме). Согласно некоторым вариантам осуществления, ингибитор фактора некроза опухолей содержит растворимый рецептор TNF (фактора некроза опухолей). В некоторых вариантах осуществления, ингибиторы TNF согласно настоящему изобретению представляют собой растворимые формы TNFRI и TNFRII. В некоторых вариантах осуществления, ингибиторы TNF согласно настоящему изобретению представляют собой растворимые TNF-связывающие белки. В некоторых вариантах осуществления ингибиторы TNF согласно настоящему изобретению представляют собой белки слияния, содержащие TNFR, например, TNFR-Ig или TNFR-Fc. В настоящем описании термин «этанерцепт»