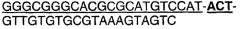Экспрессия множества генов, включая sorf-конструкции, и способы экспрессирования иммуноглобулина
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к экспрессионным конструкциям, и может быть использовано для экспрессии иммуноглобулина. Экспрессионный вектор содержит одну открытую рамку считывания (sORF)-вставку, которая включает первую последовательность нуклеиновой кислоты, кодирующую первый полипептид; первую промежуточную последовательность нуклеиновой кислоты, кодирующую первый сайт расщепления белка, включающий элемент аутопроцессинга с сегментом интеина, обеспечивающий протеолитическое расщепление полипептида sORF между первым полипептидом и сегментом интеина и вторым полипептидом, но не лигирование указанного первого полипептида с указанным вторым полипептидом; и вторую последовательность нуклеиновой кислоты, кодирующую второй полипептид. Экспрессионный вектор способен экспрессировать в клетке-хозяине полипептид млекопитающего, кодируемый sORF и расщепляемый в указанном первом сайте расщепления белка, состоящий из первого полипептида - тяжелой цепи иммуноглобулина и второго полипептида - легкой цепи иммуноглобулина, которые обладают способностью к сборке в мультимер. Изобретение обеспечивает продуцирование функционального антитела с "правильной" укладкой и сборкой. 4 н. и 36 з.п. ф-лы, 9 ил., 57 табл., 4 пр.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет по предварительной заявке на патент США No 60/701855, поданной 21 июля 2005, которая во всей своей полноте включена в настоящее описание посредством ссылки.
Предшествующий уровень техники
Настоящее изобретение относится к области молекулярной биологии, в частности к области экспрессии рекомбинантных белков, а также к экспрессии и процессингу, включая, в частности, посттрансляционный процессинг рекомбинантных полипротеинов или белков-предшественников.
В последние годы антитела, используемые в качестве диагностических и терапевтических средств, находят все большее применение. Моноклональное антитело ОКТ3 (Johnson and Johnson), на применение которого было получено разрешение Управления по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA), впервые было использовано для лечения пациентов с отторжением почечного трансплантата. Герцептин (торговый знак Genentech Inc., South San Francisco, CA), то есть гуманизованное моноклональное антитело, используемое для лечения пациентов с метастазами рака молочной железы, был разрешен к применению в 1998. Множество методов лечения, разработанных на основе антител, дали многообещающие результаты на различных стадиях клинических испытаний. Одним из ограничений для широкого клинического применения технологии с использованием антител является то, что для достижения терапевтической эффективности обычно требуются большие количества антител, но продуцирование антител в достаточном количестве связано со значительными затратами. В качестве клеточных линий млекопитающих для промышленного продуцирования гликозилированных человеческих белков, таких как антитела и другие биотерапевтические средства, чаще всего используются клетки яичника китайского хомячка (CHO) и клетки миеломы NSO (Humphreys and Glover 2001. Curr. Opin. Drug Discov. Devel. 4:172-85). В процессе культивирования в течение 5-7 дней в ферментере периодического действия клеточные линии млекопитающих обычно продуцируются в количестве от 50 до 250 мг/л, а в процессе культивирования в течение 7-12 дней в ферментере периодического действия с подпиткой эти клетки продуцируются в количестве 300-600 мг/л. Негликозилированные белки иммуноглобулина могут быть успешно продуцированы в дрожжах или в E.coli (см., например, Humphreys DP, et al., 2000, Protein Expr Purif. 20(2):252-64), однако наилучшее продуцирование в бактериальных системах экспрессии достигалось с использованием фрагментов антител. (Humphreys, D.P. 2003. Curr. Opin. Drug Discov. Devel. 2003 6:188-96).
Важным этапом в области экспрессии множества генных сегментов было открытие интеинов (см., например, Hirata, R et al., 1990, J. Biol. Chem. 265:6726-6733; Kane, PM et al., 1990, Science 250:, 651 -657; Xu, M-Q and Perler, FB, 1996, EMBO Journal 15(19):5146-5153). Интеины представляют собой белковые эквиваленты интронов генных последовательностей и облегчают сплайсинг белка. Как указывается в патенте США 7026526, Snell K., сплайсинг белка представляет собой процесс, в котором внутренняя область белка-предшественника (интеина) вырезается, а фланкирующие области белка (экстеины) лигируются с образованием зрелого белка. Этот процесс наблюдается в различных белках прокариотов и эукариотов (Perler, F. B., Xu, M. Q., Paulus, H. Current Opinion in Chemical Biology 1997, 1, 292-299; Perler, F. B. Nucleic Acids Research 1999, 27, 346-347). Интеин содержит компоненты, необходимые для катализа сплайсинга белка, и часто имеет эндонуклеазный домен, который участвует в транспорте интеина (Perler, F. B., et al., Nucleic Acids Research 1994, 22, 1127-1127).
Главным назначением систем на основе интеина является разработка технологий очистки и получение новых гибридных белков в результате экспрессии генных сегментов, так, например, в патенте США 7026526 были описаны конструкции ДНК с модифицированными интеинами, используемые для экспрессии множества генных продуктов в виде отдельных белков, сообщающих множество различных признаков растениям. Однако в этом патенте не приводится каких-либо указаний на то, что эти системы могут быть с успехом использованы для экспрессии отдельных белков, которые подвергаются сборке с образованием функциональных мультимерных белков; белков, подвергаемых внеклеточной секреции; белков млекопитающих или белков, продуцируемых в эукариотических клетках-хозяевах. Примечательно, что иммуноглобулины подпадают под все эти категории.
Трудности применения метода на основе модифицированных интеинов, описанного в патенте США 7026526, к другим генам или в других целях осложняется тем, что в данном случае необходимо определить степень потенциальной важности влияния нужных экстеиновых сегментов генной последовательности на присутствующую интеиновую систему. В раболе Паулюса (Paulus) сообщается: “Действительно, на сплайсинг белка, даже если он полностью катализируется интеином, могут заметно влиять последовательности экстеинов. Такое влияние подтверждается тем фактом, что экспрессия систем сплайсинга химерного белка, в которые между чужеродными кодирующими последовательностями в той же рамке считывания были встроены последовательности интеина, часто приводит к серьезным побочным реакциям, таким как расщепление, происходящее выше или ниже границ сплайсинга (Xu M-Q, et al., 1993, Cell 75:1371-77; и Shingledecker K, et al., 1998, Gene 207:187-95). Это позволяет предположить, что способность интеинов принимать конфигурацию, оптимальную для сплайсинга белка, не вызывая при этом побочных реакций, зависит от конкретных экстеинов”. См., Paulus H, 2000, Protein splicing and related forms of protein autoproces-sing, Annu. Rev. Biochem. 69:447-96. Другой автор утверждает, что “Хотя сообщение белкам нужных свойств и активностей может быть осуществлено с применением рациональных методов конструирования, однако небольшие изменения, необходимые для эффективного и практического продуцирования сконструированного продукта, часто лежат за пределами наших возможностей (Shao, Z. and Arnold, F.H. 1996. Curr. Opin. Struct. Biol. 6, 513-518).... Тем не менее, было обнаружено, что области, непосредственно фланкирующие интеины, влияют на эффективность сплайсинга (Chong, S. et al., 1998, Nucleic Acids Res. 26, 5109-5115; Southworth, M.W. et al., 199, Biotechniques 27, 110-114) и некоторые белки-хозяева могут быть не совместимы с активностью интеинов. И хотя высокий уровень экспрессии и чистота продукта являются важными факторам, однако они не имеют существенного значения, если конечный продукт является неактивным.” См. Amitai G. and Pietrokovski, 1999, Nature Biotechnology 17:854-855.
Поэтому в модифицированной интеиновой системе, где предпочтительным результатом является расщепление без последующего лигирования, присутствие чужеродного экстеина по отношению к данной последовательности интеина может фактически влиять на эффективную комбинацию таких признаков, как точное расщепление, отсутствие повторного лигирования и отсутствие побочных реакций. Очевидно, что адаптация метода модифицированных интеинов для рекомбинантного продуцирования некоторых белков, конечные продукты которых, например иммуноглобулины и другие биотерапевтические средства, обладают функциональной активностью, представляет значительные трудности для осуществления каких-либо нововведений.
В настоящем изобретении такая проблема рассматривалась не только в связи с применением интеиновых систем, но также и с точки зрения возможности применения доменов hedgehog. Белки семейства hedgehog представляют собой межклеточные сигнальные молекулы, имеющие важное значение для формирования структур в эмбрионах млекопитающих. См., например, Mann, R. K. and Beachy, P.A. (2000) Biochim. Biophys. Acta. 1529, 188-202; Beachy, PA, (1997) Cold Spring Harb Symp Quant Biol 62: 191-204. Нативные белки-предшественники hedgehog расшепляются с образованием C-концевых (Hh-C) и N-концевых фрагментов (Hh-N) посредством реакции аутопроцессинга, которая аналогична сплайсингу белков. Система hedgehog предоставляет пока еще не исследованные возможности для творческой разработки систем, включающих модифицированные варианты, подходящие для экспрессии множества отдельных фрагментов белка.
Предпринимавшиеся ранее попытки экспрессии полноразмерной молекулы антитела/иммуглобулина методами рекомбинантных ДНК с использованием одного вектора были недостаточно успешными и обычно давали в значительной степени отличающиеся уровни экспрессии тяжелой и легкой цепей молекулы антитела/иммуноглобулина, а конкретнее, более низкий уровень экспрессии второго гена. Для других целей могут потребоваться относительно более высокие уровни экспрессии одной цепи, чем это необходимо для оптимального продуцирования мультимерных антител или их функциональных фрагментов с соответствующей укладкой. В связи с этим может возникнуть проблема, связанная с субоптимальной стехиометрией экспрессии тяжелой и легкой цепей в данной клетке, которая приводит к общему низкому выходу подвергнутого сборке мультимерного антитела. Фанг (Fang) и др. показали, что для экспрессии высоких уровней полноразмерного биологически функционального антитела из одного вектора требуется эквимолярная экспрессия тяжелой и легкой цепей (см. Fang et al., 2005, Nature Biotechnology 23:584-590; публикация заявки на патент США 2004/0265955A1). Кроме того, стандартные системы экспрессии на основе векторов, которые независимо экспрессируют множество полипептидов, в значительной степени зависят от таких факторов, как взаимодействие промоторов (например, интерференция промоторов). Такие взаимодействия могут негативно влиять на эффективность экспрессии генов и/или на сборку экспрессированных цепей, или для их осуществления может потребоваться использование более чем одного вектора (см., например, патент США 6331415, Cabilly et al.). Такая потребность в использовании нескольких векторов является серьезным недостатком, поскольку она может быть связана с некоторыми осложнениями, такими как потеря одного или нескольких отдельных векторов, а обычно - с необходимостью проведения дополнительных манипуляций.
Другим фактором, ограничивающим возможность экспрессировать две или несколько кодирующих последовательностей в одном векторе, является упаковывающая способность самого вектора. Так, например, при рассмотрении соответствующей последовательности вектора/кодирующей последовательности такими факторами являются упаковывающая способность вектора (например, приблизительно 4500 п.н. для адено-ассоциировнного вируса, AAV); продолжительность in vitro/in vivo экспрессии рекомбинантного белка в трансфицированной вектором клетке или органе (например, непродолжительное время экспрессии в аденовирусных векторах); тип клеток, способных к эффективному поддерживанию инфекции, индуцированной вектором, если используется вирусный вектор; и нужный уровень экспрессии генного(ых) продукта(ов). Требование регулируемой экспрессии двух или более генных продуктов в сочетании с ограниченной упаковывающей способностью вирусных векторов, таких как аденовирус и AAV, ограничивает выбор векторной конструкции и систем для экспрессии определенных генов, таких как гены иммуноглобулина или его фрагментов.
В других методах экспрессии двух или более последовательностей белков или полипептидных последовательностей в одном векторе для экспрессии отдельных кодирующих последовательностей используют два или более промотора или один промотор и внутренний сайт связывания с рибосомой (IRES), расположенный между двумя представляющими интерес кодирующими последовательностями. Использование двух промоторов в одном векторе может приводить к снижению уровня экспрессии белка, вызываемому интерференцией промоторов. Если две кодирующие последовательности разделены последовательностью IRES, то уровень трансляции второй кодирующей последовательности часто бывает значительно ниже уровня трансляции первой последовательности (Furler et al. 2001. Gene Therapy 8:864-873). В публикации заявки на патент США 2004/0241821 описаны флавивирусные векторы, в которых гетерологичная кодирующая последовательность расположена за последовательностью, кодирующей вирусный полипротеин, и эти последовательности отделены друг от друга последовательностью IRES. Стратегия заякоривания вектора в ядре, применяемая в целях экспрессии рекомбинантного гена, включая гибридные белки, в которых сегменты разделены сайтами узнавания протеазой, описана в публикации заявки на патент США 2005/0026137.
Связывание белков в форме полипротеинов в одной открытой рамке считывания (sORF) представляет собой механизм, наблюдаемый при репликации многих природных вирусов, включая пикорнавирусы. После трансляции кодируемые вирусом протеиназы опосредуют быстрое внутримолекулярное (цис)расщепление полипротеина с образованием дискретных продуктов зрелого белка. Вирусы ящура (FMDV) принадлежат к группе пикорнавирусов и экспрессируют одну длинную открытую рамку считывания, кодирующую полипротеин размером приблизительно 225 кД. Полноразмерный продукт трансляции подвергается быстрому внутримолекулярному (цис)расщеплению у С-конца области 2A, которое происходит между предшественником капсидного белка (Р1-2А) и репликативными доменами полипротеина 2BC и P3, и это расщепление опосредуется самой областью 2A по механизму прерывания действия рибосомы (Ryan et al. 1991. J. Gen. Virol. 72:2727-2732); Vakharia et al. 1987. J. Virol. 61:3199-3207). Были идентифицированы остатки незаменимых аминокислот, участвующих в экспрессии протеазной активности области 2A вируса FMDV. Были также охарактеризованы область 2A и аналогичные домены афтовирусов и кардиовирусов, принадлежащих семейству пикорнавирусов (Donnelly et al. 1997. J. Gen. Virol. 78:13-21).
Другие попытки применения методов протеолитического процессинга были описаны ранее для продуцирования рекомбинантного инсулина, например, в EP055945 (Genentech); и EP037723 (“Регенты Университета Калифорнии”). Однако применение этих методов для осуществления рекомбинантной экспрессии гораздо более крупных и более сложных функциональных белков, таких как иммуноглобулины, потребует резкого изменения технологии их получения. Примерами функциональных молекул антител могут служить гетеромультимеры, необходимые для сборки четырех или более цепей (например, две тяжелые цепи и две легкие цепи иммуноглобулина).
В связи с этим возникает необходимость получения альтернативных и/или улучшенных систем для генерирования рекомбинантных белков. Особенно острой проблемой является, в частности, разработка методов эффективной и/или “правильной” экспрессии полноразмерных иммуноглобулинов и их антигенсвязывающих фрагментов, которые имели бы преимущества по сравнению с используемыми современными технологиями. Настоящее изобретение направлено на решение этой проблемы путем получения одной векторной конструкции с применением ряда стратегий, таких как использование интеинов, hedgehog-сегментов аутопроцессинга, автокаталитических вирусных протеаз и их вариантов соответственно. Независимо от этого проблема, связанная с необходимостью разработки метода эффективной сборки мультимерных продуктов (например, иммуноглобулина), может быть решена путем регуляции стехиометрического соотношения субъединиц (например, тяжелой и легкой цепей или их фрагментов). В некоторых вариантах конструкции в одной ORF (sORF) кодируют пептидный компонент аутопроцессинга, который может быть использован для широкомасштабной экспрессии полипептида или для экспрессии биологически функционального полипептида, такого как фермент, иммуноглобулин, цитокин, хемокин, рецептор, гормон, компоненты двухгибридной системы или других представляющих интерес мультисубъединичных белков.
Краткое описание сущности изобретения
Настоящее изобретение относится к экспрессионным кластерам, векторам, рекомбинантным клеткам-хозяевам и к способам рекомбинантной экспрессии и процессинга, включая посттрансляционный процессинг рекомбинантных полипротеинов и белков-предшественников.
В одном из вариантов настоящее изобретение относится к экспрессирующему вектору для генерирования одного или нескольких рекомбинантных белковых продуктов, содержащему sORF-вставку, где указанная sORF-вставка включает в себя первую последовательность нуклеиновой кислоты, кодирующую первый полипептид; промежуточную последовательность нуклеиновой кислоты, кодирующую первый сайт расщепления белка; и вторую последовательность нуклеиновой кислоты, кодирующую второй полипептид, где указанная промежуточная последовательность нуклеиновой кислоты, кодирующая указанный первый сайт расщепления белка, соответствующим образом расположена между указанной первой последовательностью нуклеиновой кислоты и указанной второй последовательностью нуклеиновой кислоты и где указанный экспрессирующий вектор способен экспрессировать полипептид, кодируемый sORF и расщепляемый в указанном первом сайте расщепления белка. В одном из вариантов изобретения указанный первый сайт расщепления белка включает в себя сайт расщепления посредством аутопроцессинга. В одном своем варианте изобретения указанный сайт аутопроцессинга включает в себя сегмент интеина или модифицированный сегмент интеина, где указанный модифицированный (или немодифицированный) сегмент интеина обеспечивает расщепление полипептидов без полного лигирования экспрессированных первых полипептидов с экспрессированными вторыми полипептидами. В одном из вариантов изобретения указанный сайт аутопроцессинга включает в себя сегмент hedgehog или модифицированный сегмент hedgehog, где указанный модифицированный (или немодифицированный) сегмент hedgehog позволяет расщеплять экспрессированные первые полипептиды и экспрессированные вторые полипептиды. В одном из вариантов изобретения экспрессируется множество отдельных белков (например, первые полипептиды, вторые полипептиды, третьи полипептиды и т.п.). В одном из вариантов изобретения указанные первый полипептид и второй полипептид обладают способностью к мультимерной сборке. В одном из вариантов изобретения по меньшей мере один из указанных первых и вторых полипептидов обладает способностью к внеклеточной секреции. В одном из вариантов изобретения по меньшей мере один из указанных первых и вторых полипептидов происходит от млекопитающего. В одном из своих вариантов настоящее изобретение относится к векторам и способам генерирования антител, подвергнутых сборке.
В некоторых вариантах настоящее изобретение относится к конструкциям и к способам рекомбинантной экспрессии множества отдельных белков. В конкретных вариантах изобретения указанные белки обладают способностью к внеклеточной секреции. В конкретных вариантах изобретения указанные белки происходят от млекопитающего. В конкретных вариантах изобретения указанные белки обладают способностью к мультимерной сборке. В конкретных вариантах изобретения указанными белками являются иммуноглобулины.
В одном из вариантов изобретения рассматривается введение сайта узнавания протеазой отщепляемого сигнального пептида или последовательность аутопроцессинга полипептида (включая интеин, С-концевой hedgehog-домен аутопроцессинга, происходящий от дрозофилы, мыши, человека и животных других видов (Dassa et al, Trends in Genetics, Vol. 20 No. 11 Nov, 2004, 538-542; Ibrahim et al, Biochimica et Biophysics Acta 1760 (2006) 347-355). Авторы настоящего изобретения отмечают, что в некоторых случаях последовательность аутопроцессинга полипептида, если она упоминается в связи с протеолитическим процессингом, может называться протеолитическим сайтом. Обычно используются C-концевые домены аутопроцессинга генов warthog, groundhog и других hog-содержащих генов, происходящих от нематод, таких как Caenorhabditis elegans (Snell EA et al, Proc. R. Soc. B (2006) 273, 401-407; Aspock et al, Genome Research, 1999, 9:909-923); и домен аутопроцессинга Hoglet-C, происходящий от колониальных жгутиковых (Сhoanoflagellatа) (Aspock et al., Genome Research, 1999, 9:909-923). Бактериальные интеин-подобные (BIL) домены A-типа, такие как домены, происходящие от бактерий, таких как Clostridium thermocellum, и домены BIL B-типа, происходящие от бактерий, таких как Rhodobacter sphaeroides (Dassa et al., Journal of Biological Chemistry, Vol. 279, No. 31, July 30, 32001-32007) (дикого типа, в усеченной форме или в других модифицированных формах), и введенные в последовательность рекомбинантного белка-предшественника обеспечивают эффективную экспрессию и расщепление про-белка, в результате этого высвобождаются биологически активная часть или нужные белки, экспрессированные в полипротеине. Осуществление такого процесса позволяет избежать необходимости ко-экспрессии природных протеолитических ферментов, осуществляющих процессинг про-белков. Альтернативно, протеаза, которая является когнатной для конкретного сайта узнавания, может экстенсивно экспрессироваться вместе с последовательностью про-белка, при этом сайт узнавания протеазой находится между ними, в результате чего указанная протеаза высвобождается посредством протеолиза, а затем высвобождается отщепляемая часть белка-предшественника посредством последующего протеолитического расщепления, что приводит к высвобождению активной части белка-предшественника. В другом варианте изобретения пептидная последовательность аутопротеолитического процессинга 2А может быть встроена в белок-предшественник между частью зрелого (биоактивного) белка и отщепляющейся частью белка-предшественника, так чтобы после экспрессии сконструированного рекомбинантного белка осуществлялся его аутопроцессинг.
В другом своем варианте настоящее изобретение относится к способу эффективной экспрессии рекомбинантных молекул иммуноглобулина, включающему рекомбинантную экспрессию полипротеина, содержащего по меньшей мере одну область тяжелой цепи и по меньшей мере одну область легкой цепи, где указанные области отделены друг от друга одним или несколькими сайтами узнавания протеазой, сигнальными пептидами, последовательностями интеина, которые опосредуют расщепление, но не присоединение полипептидов; последовательностью hedgehog, другими интеин-подобными или hedgehog-подобными последовательностями аутопроцессинга или их вариантами или такими последовательностями, как пептид 2A, который разделяет фланкирующие пептиды в процессе трансляции. В другом варианте изобретения протеаза может экспрессироваться как часть полипротеина, отделенная от остального полипротеина сайтами узнавания протеазой, где каждый сайт узнавания протеазой является когнатным для ко-экспрессируемой протеазы. Затем действие протеолитической или сигнальной пептидазы приводит к высвобождению протеазы и других отдельных белков из первичного продукта трансляции. Вышеописанные способы разделения белковых субъединиц в полипротеине могут также применяться в комбинации друг с другом в целях достижения нужного протеолиза и получения продуктов экспрессии белка.
В варианте изобретения, относящемся к экспрессии иммуноглобулина, дупликация области, кодирующей легкую цепь, позволяет повышать эффективность сборки и/или экспрессии полноразмерной молекулы иммуноглобулина в том случае, если области, кодирующие легкую цепь, присутствуют в экспрессионном кластере и/или в экспрессирующем векторе вместе с областью, кодирующей тяжелую цепь, в отношении 1:1. В контексте настоящего изобретения белки тяжелой и легкой цепей могут представлять собой функциональные фрагменты природных тяжелых и легких цепей (функциональный фрагмент сохраняет способность связываться с цепью антитела-аналога, а также способность связываться с когнатным антигеном, как хорошо известно специалистам). Так, например, настоящее изобретение относится к конструкциям и к способам, в которых отношение области, кодирующей компонент легкой цепи, к области, кодирующей компонент тяжелой цепи, составляет 1:1 или более. Так, например, в одном из вариантов изобретения отношение L:H составляет 2:1 или более, а в других вариантах изобретения это отношение составляет 3:1, 3:2, 4:1 или более.
В предпочтительном аспекте изобретения последовательность, кодирующая легкую цепь иммуноглобулина или ее фрагмент, дуплицируется в последовательности, кодирующей полипротеин, а последовательности, кодирующие тяжелую и легкую цепи иммуноглобулина, присутствуют в молярном отношении “легкая цепь: тяжелая цепь”, составляющем примерно 2:1, и экспрессируются в отношении “легкая цепь: тяжелая цепь”, составляющем более чем 1:1. Последовательности легкой и тяжелой цепей в указанном полипротеине присоединены посредством сайтов расщепления протеазой, сигнальных (или лидерных) пептидов, интеинов или сайтов аутопроцессинга.
Протеазами (эндопротеазами), сигнальными пептидазами и аминокислотными последовательностями их сайтов узнавания, которые могут быть использованы для разделения компонентов биологически активного белка в продукте трансляции полипротеина, и их последовательностями узнавания протеазами являются, но не ограничиваются ими, сайты узнавания: фурином, RXR/K-R (SEQ ID NO:1); VP4 IPNV, S/TXA-S/AG (SEQ ID NO:2); протеазой вируса гравировки табака (TEV), EXXYXQ-G(SEQ ID NO:3); протеазой 3C риновируса, LEVLFQ-GP (SEQ ID NO:4); протеазой PC5/6; протеазой PACE, протеазой LPC/PC7; энтерокиназой, DDDDK-X (SEQ ID NO:5); фактором Xa, IE/DGR-X (SEQ ID NO:6); тромбином, LVPR-GS (SEQ ID NO:7); гененазой I, PGAAH-Y(SEQ ID NO:8); протеазой MMP; ядерным белком включения a(N1a) потивируса мозаики турнепса; NS2B/NS3 флавивирусов денге типа 4 (DEN4), протеазой NS3 вируса желтой лихорадки (YFV); ORF V вируса мозаики цветной капусты; и протеазой KEX2, MYKR-EAD (SEQ ID). Другим вариантом внутреннего сайта расщепления является CB2. Положение в последовательности узнавания протеазами, в которой происходит расщепление, показано дефисом.
В одном из вариантов изобретения используемыми сигнальными последовательностями являются последовательности дикого типа, мутированные последовательности или неспецифически мутированные последовательности, и эти последовательности были выбраны посредством скрининга с применением методов, известных специалистам.
В объем настоящего изобретения, описанный выше, также входят экспрессионный кластер, в котором конкретная последовательность, кодирующая полипротеин или белок-предшественник (про-белок, полипротеин), функционально присоединена к последовательностям регуляции транскрипции; экспрессирующие векторы; и рекомбинантные клетки-хозяева, содержащие указанный экспрессирующий вектор или экспрессионный кластер.
Настоящее изобретение относится к системе экспрессии полноразмерного иммуноглобулина или его фрагмента, основанной на экспрессии последовательностей, кодирующих тяжелую и легкую цепь под транскрипционным контролем одного промотора, где разделение тяжелой и легкой цепей опосредуется интеинами или модифицированными интеинами (которые обеспечивают расщепление, но не лигирование высвобождаемых молекул белков, либо такое лигированием белков может быть предотвращено антителами или другими фланкирующими последовательностями белков, которые могут быть соответствующим образом модифицированы), либо С-концевым hedgehog-доменом ацтопроцессинга, происходящим от дрозофилы, мыши, человека и животных других видов, либо C-концевыми доменами аутопроцессинга генов warthog, groundhog и других hog-содержащих генов, происходящих от нематод, таких как Caenorhabditis elegans, либо доменом аутопроцессинга Hoglet-C, происходящим от колониальных жгутиковых (Сhoanoflagellatа), либо бактериальными интеин-подобными (BIL) доменами A-типа, такими как домены, происходящие от бактерий, таких как Clostridium thermocellum, либо доменами BIL B-типа, происходящими от бактерий, таких как Rhodobacter sphaeroides. Интеинами, которые могут быть использованы в настоящем изобретении, являются, но не ограничиваются ими, интеины VMA Saccharomyces cerevisiae, Pyrococcus, Synechocystis и другие интеины, известные специалистам. Разделение тяжелой и легкой цепей может также опосредоваться сайтом аутопроцессинга, например, последовательностью 2А или 2А-подобной последовательностью.
В одном из своих аспектов настоящее изобретение относится к вектору для экспрессии рекомбинантного иммуноглобулина, который включает в себя промотор, функционально присоединенный к последовательности, кодирующей первую цепь молекулы иммуноглобулина или ее фрагмент; к последовательности, кодирующей сайт аутопроцессинга; и к последовательности, кодирующей вторую цепь молекулы иммуноглобулина или ее фрагмент, где указанная последовательность, кодирующая сайт аутопроцессинга, встроена между последовательностью, кодирующей первую цепь молекулы иммуноглобулина, и последовательностью, кодирующей вторую цепь молекулы иммуноглобулина. Первой или второй цепью молекулы иммуноглобулина может быть тяжелая цепь или легкая цепь, а последовательностью, кодирующей рекомбинантный иммуноглобулин, может быть полноразмерная кодирующая последовательность или ее фрагмент. Вторая область, соответствующая легкой цепи, отделена от смежной области сайтом узнавания протеазой, сигнальным пептидом или сайтом аутопроцессинга, таким как сайт 2А. При этом могут присутствовать две копии последовательности L-цепи и одна копия последовательности Н-цепи (или множество копий каждой цепи), при условии что каждый компонент цепи антитела имеет соответствующий сайт процессинга или последовательность, ассоциированную с этим сайтом, которые могли бы обеспечивать продуцирование “правильно” процессированных цепей антител.
Вектором может быть любой рекомбинантный вектор, способный экспрессировать полноразмерный полипептид, например молекулу иммуноглобулина или ее фрагмент, и таким вектором является, например, плазмидный вектор, в частности вектор, подходящий для экспрессии генов в клетках млекопитающих; бакуловирусный вектор для экспрессии в клетках насекомых; вектор на основе аденоассоциированного вируса (AAV); лентивирусный вектор; ретровирусный вектор; компетентный по репликации аденовирусный вектор; дефектный по репликации аденовирусный вектор; аттенюированный аденовирусный вектор; вектор на основе герпесвируса или невирусный (плазмидный) вектор и т.п.
Сайты аутопроцессинга включают в себя пептидную последовательность 2A, например последовательность 2А, происходящую от вируса ящура (FMDV). В другом предпочтительном аспекте изобретения такой вектор содержит последовательность, кодирующую дополнительный сайт протеолитического расщепления, расположенный между последовательностью, кодирующей первую цепь молекулы иммуноглобулина или ее фрагмент, и последовательностью, кодирующей вторую цепь молекулы иммуноглобулина или ее фрагмент (то есть последовательность, смежную с последовательностью сайта аутопроцессинга, такого как сайт 2А), а также последовательностью, смежной со второй последовательностью легкой цепи. В одном из репрезентативных подходов дополнительным сайтом протеолитического расщепления является сайт расщепления фурином с консенсусной последовательностью RXK/R-R (SEQ ID NO:1). Вектор для экспрессии рекомбинантного иммуноглобулина, содержащий пептид аутопроцессинга, может включать любой из ряда промоторов, где указанный промотор является конститутивным, регуляторным или индуцибельным, а также клеткоспецифическим, тканеспецифическим или видоспецифическим. Такой вектор может также включать последовательность, кодирующую сигнальную последовательность для одной или нескольких последовательностей, кодирующих цепи иммуноглобулина, белки-предшественники или т.п.
Настоящее изобретение также относится к клеткам-хозяевам или к стабильным клонам клеток-хозяев, инфицированных вектором, который содержит последовательность, кодирующую тяжелую и легкую цепи иммуноглобулина (то есть антитела); последовательность, кодирующую сайт аутопроцессинга; и может также содержать дополнительную последовательность, кодирующую дополнительный сайт протеолитического расщепления; и, необязательно, область, кодирующую протеазу, которая аналогичным образом отделена от остальной(ых) кодирующей(их) последовательности(ей) сайтом аутопроцессинга или сайтом узнавания протеазой. Использование таких клеток или клонов для генерирования полноразмерных рекомбинантных иммуноглобулинов или их фрагментов также входит в объем настоящего изобретения. Подходящими клетками-хозяевами являются, но не ограничиваются ими, культивированные клетки насекомых, таких как Spodoptera frugiperda, клетки микробов, включая бактерии; клетки дрожжей, таких как Saccharomyces cerevisiae или Pichia pastoris; клетки грибов, таких как Trichoderma reesei, Aspergillus, Aureobasidum и Penicillium species, а также клетки млекопитающих, такие как клетки яичника китайского хомячка (например, CHO-K1, ATCC CCL 61; CHO DG44, Chasin et al. 1986, Som. Cell. Molec. Genet. 12:555), клетки почек детеныша хомячка (BHK-21, BHK- 570, ATCC CRL 8544, ATCC CRL 10314), клетки COS, клетки мышиных эмбрионов (NIH-3T3, ATCC CRL 1658), клетки Verо (клетки почек африканской зеленой мартышки, депонированные в ATCC CRL 1587), клетки почек собак (например, MDCK, ATCC CCL 34), клетки крысиного гипофиза (GH1, ATCC CCL 34), клетки некоторых человеческих клеточных линий, включая клетки почек человеческого эмбриона (например, HEK293, ATCC CRL 1573), а также могут быть использованы различные системы трансгенных животных, включая, но не ограничиваясь ими, свиней, мышей, крыс, овец, коз и коров. Известно, что для экспрессии в яичном белке используются куры, а для экспрессии в молоке используются трансгенные овцы, козы и коровы, и т.п. В качестве клеток-хозяев могут быть также использованы клетки растений.
В своем родственном аспекте настоящее изобретение относится к рекомбинантной молекуле иммуноглобулина или ее фрагменту, продуцируемым такими клетками или клонами, где указанный иммуноглобулин включает в себя аминокислоты, кодируемые генами сайта аутопроцессинга, сигнального пептида и интеина, hog-содержащими генами С-концевого домена аутопроцессинга, генами бактериальных интеин-подобных доменов (BIL) или генами сайтов узнавания протеазой; а также к способам их продуцирования. В случае использования интеина предпочтительным является модифицированный интеин, при этом указанный интеин должен быть таким, чтобы две цепи антитела не подвергались совместному сплайсингу с образованием одной полипептидной цепи, либо концы полипептидов антител должны быть такими, чтобы они не могли подвергаться совместному сплайсингу, опосредуемому этим интеином. Интеин вводят между N-экстеином и С-экстеином с сохранением рамки считывания, например, между тяжелой цепью и легкой цепью иммуноглобулина, при условии что этот интеин и/или ближайшая к области стыка аминокислотная последовательность первичного продукта трансляции полипротеина будут обеспечивать расщепление с высвобождением экстеинов, но при этом не будет происходить лигирования этих экстеиновых белков.
Настоящее изобретение также относится к стратегии посттрансляционного процессинга белка с использованием hedgehog- домена процессинга белка, расположенного между первой частью экспрессированного белка и второй частью белка. Hedgehog-домен процессинга белка (Hh-C) может быть, но необязательно, усечен в целях делеции холестерин-переносящей части для того, чтобы происходило только расщепление белка. В случае если не происходит полного вырезания Hh-C, то включение домена сигнального пептида у N-конца второй части белка может приводить к протеолитическому отщеплению зрелого второго белка от Hh-C/части первого белка. Кроме того, в объем данного аспекта изобретения входят неприродные рекомбинантные молекулы ДНК, содержащие последовательность, кодирующую полипротеин, который включает в себя hedgehog-домен процессинга белка, расположенный между последовательностью, кодирующей первую часть экспрессированного белка, и последовательностью, кодирующей вторую часть экспрессированного белка, так что трансляция полипротеина происходит из одного транскрипта.
В другом своем аспекте настоящее изобретение относится к модифицированному фурину, отличающемуся тем, что он имеет дополнительную пептидную область, которая нацеливает новосинтезированный белок фурин в просвет эндоплазматического ретикулума. Настоящее изобретение также включает в себя описанную здесь стратегию получения интеина или модифицированного интеина.
В другом своем аспекте настоящее изобретение относится к применению стратегии расщепления полипротеина/аутопроцессинга, процессинга интеина, отщепления сигнального пептида или протеолитического расщепления в технологии получения двухгибридной и трехгибридной системы (и их вариантов). Первый и второй белки или первый, второй и третий белки экспрессируются в виде полипротеина из одного транскрипта в подходящей клетке-хозяине, а последовательности, кодирующие эти белки, разделены с