Композиция 4-амино-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой оральную лекарственную форму в форме капсулы, содержащую: 1) помалидомид в количестве от 0,1 до 3 мас.% от общей массы композиции; 2) связующее или наполнитель в количестве от 90 до 99 мас.% от общей массы композиции, где связующее или наполнитель представляют собой крахмал, маннит или их смесь. Изобретение обеспечивает стабильность заявленной лекарственной формы. 8 н. и 14 з.п. ф-лы, 7 пр., 6 табл.
Реферат
1. Область техники, к которой относится изобретение
Раскрываются композиции и лекарственные формы помолидомида, т.е. 4-амино-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона или СС-4047. Также раскрываются способы применения композиций и лекарственных форм.
2. Предшествующий уровень техники
Фармацевтические субстанции для лекарственных препаратов обычно вводят в виде компонента композиции в комбинации с одним или более другими веществами, выполняющими различные и специализированные функции. Лекарственные формы различных типов можно приготовить при избирательном использовании фармацевтических наполнителей. Фармацевтические наполнители обладают различными функциями и вносят свой вклад в фармацевтические композиции многими различными путями, например, приводя к солюбилизации, разведению, загущению, стабилизации, консервации, окрашиванию, приданию вкуса и запаха и т.д. Свойства, которые обычно принимают во внимание при формуляции активного вещества, включают биодоступность, простоту производства, простоту введения и стабильность лекарственной формы. С учетом различных свойств активного вещества, подлежащего формуляции, как правило, для лекарственных форм выбирают фармацевтические наполнители, которые уникальным образом подгоняются к активному веществу для достижения улучшенных физических и фармацевтических свойств.
Помолидомид, также известный как СС-4047, в химическом отношении представляет собой 4-амино-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион. Помолидомид является иммуномодулятором, который ингибирует, например, продукцию моноцитами TNFα, IL-1β, IL-12, IL-6, MIP-1, MCP-1, GM-CSF, G-CSF и COX-2, индуцированную LPS. Также известно, что соединение костимулирует активацию Т-клеток. Помолидомид и способ синтеза соединения описаны, например, в патенте США №5635517, который в полном объеме включен в данный документ для сведения.
По причине многообразия фармакологических свойств помолидомид является пригодным для лечения, профилактики и/или контроля различных заболеваний или расстройств. Таким образом, существует потребность в лекарственных формах помолидомида, обладающих преимущественными физическими и фармацевтическими свойствами.
3. Сущность изобретения
Раскрываются фармацевтические лекарственные формы помолидомида или его фармацевтически приемлемого стереоизомера, пролекарства, соли, сольвата, гидрата или клатрата. Также раскрываются способы лечения, менеджмента или предупреждения заболеваний или состояний, таких как, не ограничиваясь этим, рак, боль, макулярная дегенерация, кожное заболевание, заболевание легких, заболевание, вызванное воздействием асбеста, паразитарное заболевание, иммунодефицит, расстройство ЦНС, повреждение ЦНС, атеросклероз, расстройство сна, гемоглобинопатия, анемия, аутоиммунное заболевание, вирусное заболевание, наследственное заболевание, аллергическое заболевание, бактериальное заболевание, неоваскуляризация глаза, хороидальная неоваскуляризация, неоваскуляризация сетчатки и рубеоз, с использованием помолидомида или его фармацевтически приемлемого стереоизомера, пролекарства, соли, сольвата, гидрата или клатрата, в лекарственных формах, описанных в данном документе.
3.1. Определения
В том смысле, в котором в данном документе используется, и если не указано иначе, термин композиция, которая «по существу не содержит» соединения, означает, что композиция содержит менее чем примерно 20 мас.%, более предпочтительно менее чем примерно 10 мас.%, еще более предпочтительно менее чем примерно 5 мас.% и наиболее предпочтительно менее чем примерно 3 мас.% соединения.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «стереоизомерно чистая», он означает композицию, которая содержит один стереоизомер соединения и по существу не содержит других стереоизомеров соединения. Например, стереоизомерно чистая композиция соединения, содержащего один хиральный центр, по существу не будет содержать противоположный энантиомер соединения. Стереоизомерно чистая композиция соединения, содержащего два хиральных центра, по существу не будет содержать другие диастереоизомеры соединения. Типичное стереизомерно чистое соединение содержит более чем при 80 мас.% одного стереоизомера соединения и менее чем примерно 20 мас.% других стереоизомеров соединения, более предпочтительно более чем примерно 90 мас.% одного стереоизомера соединения и менее чем примерно 10 мас.% других стереоизомеров соединения, еще более предпочтительно более чем примерно 95 мас.% одного стереоизомера соединения и менее чем примерно 5 мас.% других стереоизомеров соединения, и наиболее предпочтительно более чем примерно 97 мас.% одного стереоизомера соединения и менее чем примерно 3 мас.% других стереоизомеров соединения.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «энантиомерно чистая», он означает стереоизомерно чистую композицию соединения, содержащего один хиральный центр.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «фармацевтически приемлемая соль(и)», он включает, не ограничиваясь этим, соли кислых и основных групп талидомида. Основные группы способны к образованию широкого ряда солей с различными неорганическими и органическими кислотами. Кислоты, которые можно использовать для получения фармацевтически приемлемых аддитивных солей кислоты таких основных соединений, представляют кислоты, образующие нетоксичные аддитивные соли кислоты, т.е. соли, содержащие фармакологически приемлемые анионы. Подходящие органические кислоты включают, не ограничиваясь этим, малеиновую, фумаровую, бензойную, аскорбиновую, янтарную, уксусную, муравьиную, щавелевую, пропионовую, винную, салициловую, лимонную, глюконовую, молочную, миндальную, циннамовую, олеиновую, дубильную, аспарагиновую, стеариновую, пальмитиновую, гликолевую, глутаминовую, глюконовую, глюкуроновую, сахарную, изоникотиновую, метансульфоновую, этансульфоновую, п-толуолсульфоновую, бензолсульфоновую или памоевую (т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат) кислоты. Подходящие неорганические кислоты включают, не ограничиваясь этим, хлористоводородную, бромистоводородную, иодистоводородную, серную, фосфорную или азотную кислоты. Соединения, которые содержат аминогруппу, способны к образованию фармацевтически приемлемых солей с различными аминокислотами, в дополнение к кислотам, указанным выше. Химические группы, которые являются кислыми по своей природе, способны к образованию основных солей с различными фармакологически приемлемыми катионами. Примерами таких солей являются соли щелочных металлов или щелочноземельных металлов, и, в частности, кальция, магния, натрия, лития, цинка, калия или железа.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «сольват», он означает соединение, описанное в данном документе, или его соль, которое дополнительно содержит стехиометрическое или нестехиометрическое количество растворителя, связанного нековалентными межмолекулярными связями. В том случае, когда растворителем является вода, то сольват представляет гидрат.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «пролекарство», он означает производное соединение, которое может подвергаться гидролизу, окислению или взаимодействовать иным образом в биологических условиях (in vitro или in vivo) с образованием исходного соединения. Примеры пролекарств включают, не ограничиваясь этим, производные талидомида, содержащие биогидролизуемые группы, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфаты. Другие примеры пролекарств включают производные талидомида, содержащие группы -NO, -NO2, -ONO или -ONO2.
В том смысле, в котором в данном документе используются, и если не указано иначе, термины «биогидролизуемый карбамат», «биогидролизуемый карбонат», «биогидролизуемый уреид» и «биогидролизуемый фосфат», они означают соответственно карбамат, карбонат, уреид или фосфат соединения, которые: 1) не оказывают отрицательного влияния на биологическую активность соединения, но могут придавать соединению улучшенные свойства в условиях in vivo, такие как поглощение, продолжительность действия или начало действия или 2) являются биологически неактивными, но превращаются в условиях in vivo в биологически активное соединение. Примеры «биогидролизуемых карбаматов» включают, не ограничиваясь этим, низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические или гетероароматические амины и полиэфирамины.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «биогидролизуемый сложный эфир», он означает сложный эфир соединения, который: 1) не оказывает отрицательного влияния на биологическую активность соединения, но может придавать соединению улучшенные свойства в условиях in vivo, такие как поглощение, продолжительность действия или начало действия или 2) является биологически неактивным, но превращается в условиях in vivo в биологически активное соединение. Примеры «биогидролизуемых сложных эфиров» включают, не ограничиваясь этим, низшие алкиловые сложные эфиры, алкоксиацилоксиэфиры, алкилациламиноалкиловые сложные эфиры и сложные холиновые эфиры.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «биогидролизуемый амид», он означает амид соединения, который: 1) не оказывает отрицательного влияния на биологическую активность соединения, но может придавать соединению улучшенные свойства в условиях in vivo, такие как поглощение, продолжительность действия или начало действия или 2) является биологически неактивным, но превращается в условиях in vivo в биологически активное соединение. Примеры «биогидролизуемых амидов» включают, не ограничиваясь этим, низшие алкиламиды, амиды α-аминокислот, алкоксиациламиды и алкиламиноалкилкарбониламиды.
В том смысле, в котором в данном документе используются, и если не указано иначе, термины «лечить», «процесс лечения» и «лечение», они предполагают действие, которое имеет место, когда пациент страдает определенным заболеванием или расстройством, которое приводит к снижению тяжести заболевания или расстройства, или подавляет, или замедляет прогрессирование заболевания или расстройства.
В том смысле, в котором в данном документе используются, и если не указано иначе, термины «профилактировать», «процесс профилактики» и «профилактика», они относятся к предупреждению начала, рецидива или прогрессирования заболевания или расстройства, или одного, или более его симптомов. Термины «профилактировать», «процесс профилактики» и «профилактика» предполагают действие, которое имеет место, прежде чем пациент начинает страдать конкретным заболеванием или расстройством, которое приводит к подавлению или снижению тяжести заболевания или расстройства.
В том смысле, в котором в данном документе используются, и если не указано иначе, термины «контролировать», «процесс контроля» и «контроль», они включают предупреждение рецидива определенного заболевания или расстройства у пациента, который уже страдает заболеванием или расстройством, и/или удлинение периода времени, в течение которого пациент, страдающий заболеванием или расстройством, остается в состоянии ремиссии. Термин включает модуляцию порога, прогрессирования и/или продолжительности течения заболевания или расстройства, или изменение характера реакций, какими пациент отвечает на причину заболевания или расстройства.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «примерно», когда он используется по отношению к дозам, количествам или массовым процентам ингредиентов в композиции или лекарственной форме, он означает дозу, количество или массовый процент, известный специалистам в данной области, для обеспечения фармакологического эффекта, эквивалентного полученному от конкретной дозы, количества или массового процента. В частности, термин «примерно» предусматривает дозу, количество или массовый процент в пределах 30%, 25%, 20%, 15%, 10% или 5% от конкретной дозы, количества или массового процента.
В том смысле, в котором в данном документе используется, и если не указано иначе, термин «стабильная по отношению к композиции или лекарственной форме, он означает, что активный ингредиент в композиции или лекарственной форме остается в солюбилизированном состоянии в течение определенного периода времени и существенно не деградирует или агрегирует, или становится модифицированным иным образом (например, по данным ВЭЖХ). В некоторых вариантах осуществления примерно 70% или выше, примерно 80% или выше, или примерно 90% или выше соединения остается солюбилизированным после определенного периода времени.
4. Подробное описание изобретения
Раскрываются фармацевтические лекарственные формы помолидомида или его фармацевтически приемлемого стереоизомера, пролекарства, соли, сольвата, гидрата или клатрата. В некоторых вариантах осуществления лекарственные формы подходят для перорального введения пациенту. В других вариантах осуществления лекарственные формы, раскрытые в данном документе, проявляют улучшенные физические и/или фармакологические свойства. Такие свойства включают, не ограничиваясь этим, простоту анализа, однородность состава, сыпучесть для производства, растворение и биодоступность, и стабильность. В некоторых вариантах осуществления лекарственные формы, раскрытые в данном документе, имеют период полураспада, составляющий, по меньшей мере, примерно 12 месяцев, по меньшей мере, примерно 24 месяца или, по меньшей мере, примерно 36 месяцев при хранении без охлаждения.
Также раскрываются наборы, содержащие фармацевтические композиции и лекарственные формы, описанные в данном документе. Также раскрываются способы лечения, контроля и/или профилактики заболевания или состояния, которые включают введение пациенту, нуждающемуся в этом, фармацевтической композиции или лекарственной формы, описанной в данном документе.
4.1. Композиции и лекарственные формы
В одном варианте осуществления в данном документе раскрывается отдельная разовая лекарственная форма, подходящая для перорального введения человеку, содержащая количество активного ингредиента, равное или выше чем примерно 1; 5; 10; 15; 20; 25; 30; 50; 75; 100; 150 или 200 мг; и фармацевтически приемлемый наполнитель; в которой активный ингредиент представляет помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат. В некоторых вариантах осуществления количество активного ингредиента находится в пределах примерно от 0,1 до примерно 100 мг, примерно от 0,5 до примерно 50 мг, примерно от 0,5 до примерно 25 мг, примерно от 1 до примерно 10 мг, примерно от 0,5 до примерно 5 мг или примерно от 1 до примерно 5 мг. В одном варианте осуществления количество активного ингредиента составляет примерно 0,5 мг. В еще одном варианте осуществления количество активного ингредиента составляет примерно 1 мг. В еще одном варианте осуществления количество активного ингредиента составляет примерно 2 мг. В еще одном варианте осуществления количество активного ингредиента составляет примерно 5 мг.
Фармацевтические композиции и препаративные формы, описанные в данном документе, могут находиться в виде отдельных лекарственных форм, таких как капсулы (например, гелькапсулы), таблетки в виде капсул, таблетки, пастилки, сосательные таблетки, дисперсии и суппозитории, где каждая форма содержит заранее определенное количество активного ингредиента в виде порошка или гранул, раствора или суспензии в водной или неводной жидкости, эмульсии масло-в-воде или эмульсии вода-в-масле. За счет простоты введения таблетки, таблетки в виде капсул и капсулы являются предпочтительными разовыми лекарственными формами.
Как правило, таблетки, таблетки в виде капсул и капсулы содержат примерно от 50 мг до примерно 500 мг фармацевтической композиции (т.е. активного ингредиента и наполнителя(й)). Капсулы могут быть любого размера. Примеры стандартных размеров включают №000, №00, №0, №1, №2, №3, №4 и №5. См., например, Remington's Pharmaceutical Sciences, page 1658-1659 (Alfonso Gennaro ed., Mack Publishing Company, Easton Pennsylvania, 18th ed., 1990), этот источник включен в данный документ для сведения. В некоторых вариантах осуществления капсулы, раскрытые в данном документе, имеют размер №1 или более, №2 или более, или №4 или более.
Также в данном документе раскрываются безводные фармацевтические композиции и лекарственные формы, содержащие активный ингредиент, поскольку вода может способствовать деградации некоторых соединений. Например, добавление воды (например, 5%) широко применяется в фармации как способ моделирования периода полураспада, т.е. длительного периода хранения, для определения таких характеристик, как период полураспада или стабильность композиций с течением времени. См., например, Jens T. Cartensen, Drug Stability: Principles&Practice, 2d Ed., Marcel Dekker, NY, NY, 1995, pp. 379-380. Фактически вода и нагревание ускоряют разложение. Таким образом, воздействие воды на композицию может иметь очень большое значение, поскольку влага и/или влажность являются обычными факторами во время производства, обращения, упаковки, хранения, транспортировки и применения композиций.
Безводные фармацевтические композиции следует готовить и хранить таким образом, чтобы сохранялось их безводное состояние. Следовательно, в некоторых вариантах осуществления безводные композиции упаковывают с использованием материалов, о которых известно, что они предупреждают воздействие воды, так, что их можно включить в подходящие формулированные наборы. Примеры подходящих упаковок включают, не ограничиваясь этим, герметично закрытая фольга, пластик или тому подобное, контейнеры для разовых лекарственных форм, блистерные упаковки и стрип-упаковки.
В этом отношении также в данном документе раскрывается способ получения твердой фармацевтической композиции, содержащей активный ингредиент посредством смешивания активного ингредиента и наполнителя в безводных условиях и/или условиях с низким содержанием влаги/влажности, в которой ингредиенты по существу не содержат воды. Способ может дополнительно включать упаковку безводной или негигроскопичной твердой композиции в условиях с низкой влажностью. При использовании таких условий риск контактирования с водой снижается, и разложение активного ингредиента можно предупредить и существенно снизить.
Также в данном документе раскрываются фармацевтические композиции и лекарственные формы, не содержащие лактозу. Композиции и лекарственные формы, содержащие активный ингредиент, который представляет первичный или вторичный амин, предпочтительно не содержат лактозу. В том смысле, в котором в данном документе используется термин «не содержащие лактозу», он означает, что количество присутствующей лактозы, если она вообще находится в композиции, является недостаточным для существенного увеличения скорости разложения активного ингредиента, представляющего собой первичный или вторичный амин. Не содержащие лактозу композиции, раскрытые в данном документе, могут содержать наполнители, хорошо известные в данной области и перечисленные в Фармакопее США (USP (XXI)/NF (XVI)), этот источник включен в данный документ для сведения.
В одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно от 0,1 до примерно 10 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно от 0,1 до примерно 5 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно от 0,1 до примерно 3 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно от 0,5 до примерно 3 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно от 0,5 до примерно 2 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно 1 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно 0,8 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно 2 мас.% к общей массе композиции. В еще одном варианте осуществления помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат составляет примерно 1,7 мас.% к общей массе композиции.
В одном варианте осуществления активный ингредиент и носитель, разбавитель, связующее вещество или заполнитель смешиваются непосредственно, как описано в данном документе. В еще одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель включают маннит и/или крахмал. В еще одном варианте осуществления маннит представляет собой высушенный распылением маннит. В еще одном варианте осуществления крахмал представляет собой предварительно желатинированный крахмал.
В одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель составляют примерно от 70 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель составляют примерно от 80 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель составляют примерно от 85 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель составляют примерно от 90 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель составляют примерно от 95 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель составляют примерно 98 мас.% к общей массе композиции. В еще одном варианте осуществления носитель, разбавитель, связующее вещество или заполнитель составляют примерно 99 мас.% к общей массе композиции.
В одном варианте осуществления лекарственные формы, описанные в данном документе, содержат одновременно маннит и крахмал. В одном варианте осуществления маннит и крахмал составляют примерно от 70 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления маннит и крахмал составляют примерно от 80 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления маннит и крахмал составляют примерно от 85 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления маннит и крахмал составляют примерно от 90 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления маннит и крахмал составляют примерно от 95 до примерно 99 мас.% к общей массе композиции. В еще одном варианте осуществления маннит и крахмал составляют примерно 98 мас.% к общей массе композиции. В еще одном варианте осуществления маннит и крахмал составляют примерно 99 мас.% к общей массе композиции.
В одном варианте осуществления соотношение маннит:крахмал в лекарственной форме находится в пределах примерно от 1:1 до примерно 1:1,5. В одном варианте осуществления соотношение маннит:крахмал в лекарственной форме составляет примерно 1:1,3.
В еще одном варианте осуществления лекарственная форма содержит смазывающее вещество. В одном варианте осуществления лекарственная форма содержит примерно 0,2; 0,3; 0,5; 0,6 или 0,8 мг смазывающего вещества. В еще одном варианте осуществления лекарственная форма содержит примерно 0,16; 0,32; 0,64 или 0,75 мг смазывающего вещества. В еще одном варианте осуществления смазывающее вещество представляет стеарилфумарат натрия (PRUV).
В одном варианте осуществления смазывающее вещество, например PRUV, составляет примерно от 0,01 до примерно 5 мас.% к общей массе композиции. В еще одном варианте осуществления смазывающее вещество, например PRUV, составляет примерно от 0,01 до примерно 1 мас.% к общей массе композиции. В еще одном варианте осуществления смазывающее вещество, например PRUV, составляет примерно от 0,1 до примерно 1 мас.% к общей массе композиции. В еще одном варианте осуществления смазывающее вещество, например PRUV, составляет примерно от 0,1 до примерно 0,5 мас.% к общей массе композиции. В еще одном варианте осуществления смазывающее вещество, например PRUV, составляет примерно от 0,2 до примерно 0,3 мас.% к общей массе композиции. В еще одном варианте осуществления смазывающее вещество, например PRUV, составляет примерно 0,25 мас.% к общей массе композиции.
С учетом того, что обычно помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат получают с чистотой ниже 100%, то в некоторых вариантах осуществления композиции и лекарственные формы, описанные в данном документе, можно определить, как композиции, препаративные формы или лекарственные формы, содержащие помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, в количестве, которое обеспечивает содержание определенного количества 100% чистого помолидомида.
Например, в одном варианте осуществления раскрывается отдельная разовая лекарственная форма, содержащая соответственно: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 0,5; 1; 2; 3; 4 или 5 мг и 2) примерно 60; 120; 250; 180; 240 и 300 мг носителя, разбавителя, связующего вещества или заполнителя. В одном варианте осуществления количество носителя, разбавителя, связующего вещества или заполнителя составляет соответственно 62; 124; 248; 177; 236 или 295 мг.
В одном варианте осуществления раскрывается лекарственная форма, содержащая соответственно: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 0,5 мг и 2) фармацевтически приемлемый наполнитель. В одном варианте осуществления общая масса лекарственной формы составляет примерно 62,5 мг. В одном варианте осуществления лекарственная форма подходит для введения в капсуле размера №4 или более крупной капсуле. В одном варианте осуществления наполнитель включает носитель, разбавитель, связующее вещество и заполнитель. В одном варианте осуществления наполнители включают носитель, разбавитель, связующее вещество или заполнитель, и смазывающее вещество.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 62,5 мг, носитель, разбавитель, связующее вещество или заполнитель включают маннит и/или крахмал. В одном варианте осуществления наполнитель включает одновременно маннит и крахмал. В одном варианте осуществления, когда в лекарственной форме присутствуют одновременно маннит и крахмал, то лекарственная форма содержит примерно 35 мг крахмала, и остальная масса заполнена крахмалом. В одном варианте осуществления маннит представляет высушенный распылением маннит. В еще одном варианте осуществления крахмал представляет предварительно желатинированный крахмал.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 62,5 мг и где присутствует смазывающее вещество, то смазывающее вещество представляет стеарилфумарат натрия. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,2 мг. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,16 мг.
В одном варианте осуществления раскрывается лекарственная форма, содержащая: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 0,5 мг; 2) примерно 35 мг предварительно желатинированного крахмала; 3) примерно 0,16 мг стеарилфумарата натрия и 4) высушенный распылением маннит в количестве, которое доводит общую массу лекарственной формы до 62,5 мг. В одном варианте осуществления лекарственная форма подходит для введения в капсуле размера №4 или более крупной капсуле.
В одном варианте осуществления раскрывается лекарственная форма, содержащая: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 1 мг и 2) фармацевтически приемлемый наполнитель. В одном варианте осуществления общая масса лекарственной формы составляет примерно 125 мг. В одном варианте осуществления лекарственная форма подходит для введения в капсуле размера №4 или более крупной капсуле. В одном варианте осуществления наполнитель включает носитель, разбавитель, связующее вещество и заполнитель. В одном варианте осуществления наполнители включают носитель, разбавитель, связующее вещество или заполнитель, и смазывающее вещество.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 125 мг, носитель, разбавитель, связующее вещество или заполнитель включают маннит и/или крахмал. В одном варианте осуществления наполнитель включает одновременно маннит и крахмал. В одном варианте осуществления, когда в лекарственной форме присутствуют одновременно маннит и крахмал, то лекарственная форма содержит примерно 70 мг крахмала, и остальная масса заполнена крахмалом. В одном варианте осуществления маннит представляет высушенный распылением маннит. В еще одном варианте осуществления крахмал представляет предварительно желатинированный крахмал.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 125 мг и где присутствует смазывающее вещество, то смазывающее вещество представляет стеарилфумарат натрия. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,3 мг. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,32 мг.
В одном варианте осуществления раскрывается лекарственная форма, содержащая: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 1 мг; 2) примерно 70 мг предварительно желатинированного крахмала; 3) примерно 0,32 мг стеарилфумарата натрия и 4) высушенный распылением маннит в количестве, которое доводит общую массу лекарственной формы до 125 мг. В одном варианте осуществления лекарственная форма подходит для введения в капсуле размера №4 или более крупной капсуле.
В одном варианте осуществления раскрывается лекарственная форма, содержащая: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 2 мг и 2) фармацевтически приемлемый наполнитель. В одном варианте осуществления общая масса лекарственной формы составляет примерно 250 мг. В одном варианте осуществления лекарственная форма подходит для введения в капсуле размера №2 или более крупной капсуле. В одном варианте осуществления наполнитель включает носитель, разбавитель, связующее вещество и заполнитель. В одном варианте осуществления наполнители включают носитель, разбавитель, связующее вещество или заполнитель, и смазывающее вещество.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 250 мг, носитель, разбавитель, связующее вещество или заполнитель включают маннит и/или крахмал. В одном варианте осуществления наполнитель включает одновременно маннит и крахмал. В одном варианте осуществления, когда в лекарственной форме присутствуют одновременно маннит и крахмал, то лекарственная форма содержит примерно 140 мг крахмала, и остальная масса заполнена крахмалом. В одном варианте осуществления маннит представляет высушенный распылением маннит. В еще одном варианте осуществления крахмал представляет предварительно желатинированный крахмал.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 250 мг и где присутствует смазывающее вещество, то смазывающее вещество представляет стеарилфумарат натрия. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,6 мг. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,64 мг.
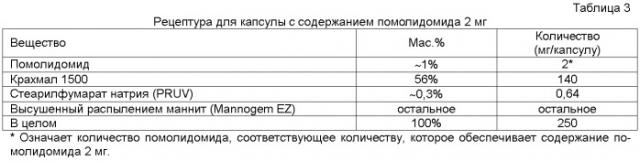
В одном варианте осуществления раскрывается лекарственная форма, содержащая: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 2 мг; 2) примерно 140 мг предварительно желатинированного крахмала; 3) примерно 0,64 мг стеарилфумарата натрия и 4) высушенный распылением маннит в количестве, которое доводит общую массу лекарственной формы до 250 мг. В одном варианте осуществления лекарственная форма подходит для введения в капсуле размера №2 или более крупной капсуле.
В одном варианте осуществления раскрывается лекарственная форма, содержащая: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспечивающем содержание помолидомида примерно 3 мг и 2) фармацевтически приемлемый наполнитель. В одном варианте осуществления общая масса лекарственной формы составляет примерно 180 мг. В одном варианте осуществления лекарственная форма подходит для введения в капсуле размера №2 или более крупной капсуле. В одном варианте осуществления наполнитель включает носитель, разбавитель, связующее вещество и заполнитель. В одном варианте осуществления наполнители включают носитель, разбавитель, связующее вещество или заполнитель, и смазывающее вещество.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 180 мг, носитель, разбавитель, связующее вещество или заполнитель включают маннит и/или крахмал. В одном варианте осуществления наполнитель включает одновременно маннит и крахмал. В одном варианте осуществления, когда в лекарственной форме присутствуют одновременно маннит и крахмал, то лекарственная форма содержит примерно 100 мг крахмала, и остальная масса заполнена крахмалом. В одном варианте осуществления маннит представляет высушенный распылением маннит. В еще одном варианте осуществления крахмал представляет предварительно желатинированный крахмал.
В одном варианте осуществления, где общая масса лекарственной формы составляет примерно 180 мг и где присутствует смазывающее вещество, то смазывающее вещество представляет стеарилфумарат натрия. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,5 мг. В одном варианте осуществления стеарилфумарат натрия находится в количестве примерно 0,45 мг.
В одном варианте осуществления раскрывается лекарственная форма, содержащая: 1) помолидомид или его фармацевтически приемлемый стереоизомер, пролекарство, соль, сольват, гидрат или клатрат, находящийся в количестве, обеспеч