Улучшенные способы лечения опухолей
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается синергической противораковой комбинации (ингибирующей клеточную пролиферацию) аплидина с другим лекарственным средством, выбранным из группы, состоящей из паклитаксела, цисплатина, триоксида мышьяка, 5-фторурацила, карбоплатина, 7-этил-10-гидроксикамптотецина, этопозида, мелфалана, дексаметазона, бортезомиба, леналидомида, и ритуксимаба, где рак выбран из рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, меланомы, множественной миеломы и лимфомы. Группа изобретений касается также применения указанной комбинации для ингибирования раковой клеточной пролиферации; способа лечения рака, включающего введение пациенту указанной комбинации. Группа изобретений обеспечивает синергическое действие в отношении рака. 3 н. и 65 з.п. ф-лы, 10 пр., 85 ил., 21 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к сочетаниям аплидина (Aplidine) или аналогов аплидина с другими противоопухолевыми средствами и применению этих сочетаний для лечения злокачественных опухолей, в частности для лечения рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Аплидин (дегидродидемнин B) представляет собой циклический депсипептид, который выделен из средиземноморских морских туникат, Aplidium albicans, и представляет собой предмет WO 91/04985. Он родственен соединениям, известным как дидемнины, и имеет следующую структуру:
Дополнительную информацию об аплидине, аналогах аплидина, его применениях, препаратах и синтезе можно найти в патентных заявках WO 99/42125, WO 01/35974, WO 01/76616, WO 02/30441, WO 02/02596, WO 03/33013 и WO 2004/080477. Авторы данного изобретения включили содержание каждого из этих текстов PCT в качестве отдельной ссылки.
В преклинических исследованиях на животных и в исследованиях у людей в клинической фазе I показано, что аплидин обладает цитотоксическим потенциалом в отношении широкого спектра типов опухолей, включая лейкоз и лимфомы. См., например:
Faircloth, G. et al.: "Dehydrodidemnin В (DDB) a new marine derived anticancer agent with activity against experimental tumour models", 9th NCI-EORTC Symp. New Drugs Cancer Ther. (March 12-15, Amsterdam) 1996, Abst 111;
Faircloth, G. et al.: "Preclinical characterization of aplidine, a new marine anticancer depsipeptide", Proc. Amer. Assoc. Cancer Res. 1997, 38: Abst 692;
Depenbrock H, Peter R, Faircloth GT, Manzanares I, Jimeno J, Hanauske AR.: "In vitro activity of Aplidine, a new marine-derived anti-cancer compound, on freshly explanted clonogenic human tumour cells and haematopoietic precursor cells" Br. J. Cancer, 1998; 78: 739-744; Faircloth G, Grant W, Nam S, Jimeno J, Manzanares I, Rinehart K.: "Schedule-dependency of Aplidine, a marine depsipeptide with antitumor activity", Proc. Am. Assoc. Cancer Res. 1999; 40: 394;
Broggini M, Marchini S, D'Incalci M, Taraboletti G, Giavazzi R, Faircloth G, Jimeno J.: "Aplidine blocks VEGF secretion and VEGF/VEGF-R1 autocrine loop in a human leukemic cell line", Clin. Cancer Res. 2000; 6 (suppl): 4509;
Erba E, Bassano L, Di Liberti G, Muradore I, Chiorino G, Ubezio P, Vignati S, Codegoni A, Desiderio MA, Faircloth G, Jimeno J and D'Incalci M.: "Cell cycle phase perturbations and apoptosis in tumour cells induced by aplidine", Br. J. Cancer 2002; 86: 1510-1517;
Paz-Ares L, Anthony A, Pronk L, Twelves C, Alonso S, Cortes-Funes H, Celli N, Gomez C, Lopez-Lazaro L, Guzman C, Jimeno J, Kaye S.: "Phase I clinical and pharmacokinetic study of aplidine, a new marine didemnin, administered as 24-hour infusion weekly" Clin. Cancer Res. 2000; 6 (suppl): 4509;
Raymond E, Ady-Vago N, Baudin E, Ribrag V, Faivre S, Lecot F, Wright T, Lopez Lazaro L, Guzman C, Jimeno J, Ducreux M, Le Chevalier T, Armand JP.: "A phase I and pharmacokinetic study of aplidine given as a 24-hour continuous infusion every other week in patients with solid tumor and lymphoma", Clin. Cancer Res. 2000; 6 (suppl): 4510; Maroun J, Belanger K, Seymour L, Soulieres D, Charpentier D, Goel R, Stewart D, Tomiak E, Jimeno J, Matthews S. :"Phase I study of aplidine in a 5 day bolus q 3 weeks in patients with solid tumors and lymphomas", Clin. Cancer Res. 2000; 6 (suppl): 4509;
Izquierdo MA, Bowman A, Martinez M, Cicchella B, Jimeno J, Guzman C, Germa J, Smyth J.: "Phase I trial of Aplidine given as a 1 hour intravenous weekly infusion in patients with advanced solid tumors and lymphoma", Clin. Cancer Res. 2000; 6 (suppl): 4509.
Исследование механизма показывает, что аплидин может блокировать секрецию VEGF в клетках ALL-MOLT4, а в образцах AML и ALL от пациентов-детей с ALL и AML de novo или с рецидивами ALL и AML наблюдали цитотоксическую активность in vitro при низких концентрациях (5 нМ). По-видимому, аплидин in vitro в обработанных лекарственным средством лейкозных клетках индуцирует арест в G1 и в G2. Кроме подавления рецептора VEGF, дополнительно о способе(ах) действия аплидина известно немного.
В фазе I клинических испытаний аплидина, для предотвращения миелотоксичности, назначали L-карнитин в виде предварительного введения за 24 часа или совместного введения, например, см. WO 02/30441. Доказано, что совместное введение L-карнитина способно улучшить восстановление от индуцированной лекарственным средством мышечной токсичности, и оно позволило увеличить дозу аплидина.
Ранее проведенные с аплидином в сочетании с другими противораковыми средствами анализы in vitro и in vivo показали, что сочетания с анализируемым лекарственным средством пригодны для комбинированного лечения лейкоза и лимфомы. В WO 2004/080421 аплидин для лечения лейкоза и лимфомы, в частности, оценивали в сочетании с метотрексатом, цитозинарабинозидом, митоксантроном, винбластином, метилпреднизолоном и доксорубицином.
Так как злокачественная опухоль является лидирующей причиной смертности животных и людей, прикладывались и все еще прикладываются значительные усилия для получения эффективного и безопасного для введения пациентам, страдающим от злокачественной опухоли, противоопухолевого лекарственного средства. Проблемой для разрешения посредством настоящего изобретения является предоставление противоопухолевых лекарственных средств, пригодных для лечения злокачественной опухоли.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения установили, что аплидин и аналоги аплидина усиливают действие других противораковых средств и, таким образом, их можно успешно использовать в комбинированной терапии для лечения злокачественной опухоли. Изобретение относится к фармацевтическим композициям, фармацевтическим лекарственным формам, наборам, способам лечения злокачественных опухолей с использованием этих способов комбинированной терапии и к применению аплидина и аналогов аплидина для получения лекарственного средства для комбинированной терапии.
По одному из аспектов данного изобретения авторы изобретения предоставляют эффективные способы комбинированной терапии на основе аплидина и аналогов аплидина с применением других лекарственных средств, эффективных при лечении злокачественной опухоли. Предпочтительно другое лекарственное средство или другие лекарственные средства эффективны при лечении злокачественной опухоли, выбранной из рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы. Наиболее предпочтительно другое лекарственное средство или другие лекарственные средства выбраны из группы, состоящей из паклитаксела (таксол®), доксорубицина, цисплатина, триоксида мышьяка, 5-фторурацила (5-FU), цитозинарабинозида (AraC), карбоплатина, 7-этил-10-гидроксикамптотецина (SN38), этопозида (VP16), мелфалана, дексаметазона, циклофосфамида, бортезомиба, эрлотиниба, трастузумаба, леналидомида (ревлимид®), интерлейкина-2 (IL-2), интерферона-α 2 (INF-α), дакарбазина (DTIC), бевацизумаба (авастин®), идарубицина, талидомида и ритуксимаба.
В другом варианте осуществления данное изобретение относится к способу лечения злокачественной опухоли, включающему введение нуждающемуся в таком лечении пациенту терапевтически эффективного количества аплидина, или аналога аплидина, или его фармацевтически приемлемого пролекарственного средства, соли, сольвата или гидрата и терапевтически эффективного количества другого лекарственного средства, эффективного для лечения злокачественной опухоли, или его фармацевтически приемлемого пролекарственного средства, соли, сольвата или гидрата, вводимого до, в течение или после введения аплидина или аналога аплидина. В дополнительном варианте осуществления изобретения вводят терапевтически эффективное количество третьего лекарственного средства, и его вводят до, в течение или после введения аплидина или аналога аплидина и второго лекарственного средства.
Предпочтительно другое лекарственное средство или другие лекарственные средства эффективны для лечения злокачественной опухоли, выбранной из рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы. Наиболее предпочтительно другое лекарственное средство или другие лекарственные средства выбраны из группы, состоящей из паклитаксела (таксол®), доксорубицина, цисплатина, триоксида мышьяка, 5-фторурацила (5-FU), цитозинарабинозида (AraC), карбоплатина, 7-этил-10-гидроксикамптотецина (SN38), этопозида (VP16), мелфалана, дексаметазона, циклофосфамида, бортезомиба, эрлотиниба, трастузумаба, леналидомида (ревлимид®), интерлейкина-2 (IL-2), интерферона-α 2 (INF-α), дакарбазина (DTIC), бевацизумаба (авастин®), идарубицина, талидомида и ритуксимаба. Другое лекарственное средство или другие лекарственные средства могут составлять часть той же композиции, или их можно предоставлять в виде отдельной композиции для введения в то же время или в другое время.
В другом аспекте данное изобретение относится к способу увеличения терапевтической эффективности лекарственного средства, эффективного для лечения злокачественной опухоли, предпочтительно лекарственного средства, эффективного для лечения злокачественной опухоли, выбранной из рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы, наиболее предпочтительно лекарственное средство выбрано из группы, состоящей из паклитаксела (таксол®), доксорубицина, цисплатина, триоксида мышьяка, 5-фторурацила (5-FU), цитозинарабинозида (AraC), карбоплатина, 7-этил-10-гидроксикамптотецина (SN38), этопозида (VP16), мелфалана, дексаметазона, циклофосфамида, бортезомиба, эрлотиниба, трастузумаба, леналидомида (ревлимид®), интерлейкина-2 (IL-2), интерферона-α 2 (INF-α), дакарбазина (DTIC), бевацизумаба (авастин®), идарубицина, талидомида и ритуксимаба или их фармацевтически приемлемых пролекарственных средств, солей, сольватов или гидратов, где способ включает введение нуждающемуся в этом пациенту определенного количества аплидина, или аналога аплидина, или его фармацевтически приемлемого пролекарственного средства, соли, сольвата или гидрата. Аплидин или аналог аплидина вводят до, в течение или после введения другого лекарственного средства. В дополнительном варианте осуществления изобретения вводят терапевтически эффективное количество третьего лекарственного средства, и его вводят до, в течение или после введения аплидина или аналога аплидина и второго лекарственного средства. Предпочтительно третье лекарственное средство представляет собой лекарственное средство, эффективное для лечения злокачественной опухоли, выбранной из рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы. Наиболее предпочтительно третье лекарственное средство выбрано из группы, состоящей из паклитаксела (таксол®), доксорубицина, цисплатина, триоксида мышьяка, 5-фторурацила (5-FU), цитозинарабинозида (AraC), карбоплатина, 7-этил-10-гидроксикамптотецина (SN38), этопозида (VP16), мелфалана, дексаметазона, циклофосфамида, бортезомиба, эрлотиниба, трастузумаба, леналидомида (ревлимид®), интерлейкина-2 (IL-2), интерферона-α 2 (INF-α), дакарбазина (DTIC), бевацизумаба (авастин®), идарубицина, талидомида и ритуксимаба или их фармацевтически приемлемых пролекарственных средств, солей, сольватов или гидратов.
В дополнительном аспекте данное изобретение относится к фармацевтической композиции, содержащей аплидин, или аналог аплидина, или его фармацевтически приемлемое пролекарственное средство, соль, сольват или гидрат и другое лекарственное средство, эффективное для лечения злокачественной опухоли. В дополнительном варианте осуществления изобретения фармацевтическая композиция дополнительно содержит третье лекарственное средство, также эффективное для лечения злокачественной опухоли. Предпочтительно другое лекарственное средство или другие лекарственные средства эффективны для лечения злокачественной опухоли, выбранной из рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы. Наиболее предпочтительно другое лекарственное средство или другие лекарственные средства выбраны из группы, состоящей из паклитаксела (таксол®), доксорубицина, цисплатина, триоксида мышьяка, 5-фторурацила (5-FU), цитозинарабинозида (AraC), карбоплатина, 7-этил-10-гидроксикамптотецина (SN38), этопозида (VP16), мелфалана, дексаметазона, циклофосфамида, бортезомиба, эрлотиниба, трастузумаба, леналидомида (ревлимид®), интерлейкина-2 (IL-2), интерферона-α 2 (INF-α), дакарбазина (DTIC), бевацизумаба (авастин®), идарубицина, талидомида и ритуксимаба.
Изобретение также относится к набору для применения при лечении или профилактике злокачественной опухоли, содержащему лекарственную форму аплидина, или аналога аплидина, или его фармацевтически приемлемого пролекарственного средства, соли, сольвата или гидрата, лекарственную форму другого лекарственного средства, эффективного для лечения злокачественной опухоли, или его фармацевтически приемлемого пролекарственного средства, соли, сольвата или гидрата и инструкции по применению каждого действующего средства в комбинации для лечения или профилактики злокачественной опухоли. В дополнительном варианте осуществления изобретения набор дополнительно содержит лекарственную форму третьего лекарственного средства, также эффективного для лечения злокачественной опухоли, или его фармацевтически приемлемого пролекарственного средства, соли, сольвата или гидрата. Предпочтительно другое лекарственное средство или другие лекарственные средства эффективны для лечения злокачественной опухоли, выбранной из рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы. Наиболее предпочтительно другое лекарственное средство или другие лекарственные средства выбраны из группы, состоящей из паклитаксела (таксол®), доксорубицина, цисплатина, триоксида мышьяка, 5-фторурацила (5-FU), цитозинарабинозида (AraC), карбоплатина, 7-этил-10-гидроксикамптотецина (SN38), этопозида (VP16), мелфалана, дексаметазона, циклофосфамида, бортезомиба, эрлотиниба, трастузумаба, леналидомида (ревлимид®), интерлейкина-2 (IL-2), интерферона-α 2 (INF-α), дакарбазина (DTIC), бевацизумаба (авастин®), идарубицина, талидомида и ритуксимаба.
В настоящее изобретение также включены эффективные способы комбинированной терапии на основе применения трех лекарственных средств: аплидина и аналогов аплидина и двух дополнительных лекарственных средств (второе лекарственное средство и третье лекарственное средство).
В одном из предпочтительных аспектов настоящее изобретение относится к синергическим сочетаниям.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
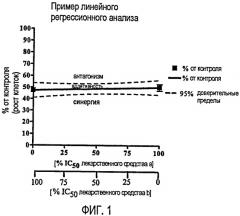
Фиг.1. Пример линейного регрессионного анализа, который представляет собой способ выявления наличия синергии.
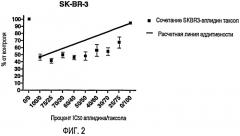
Фиг.2. Данные активности аплидина (Aplidin®) в сочетании с паклитакселом (Таксол®) против клеток SKBR3 in vitro.
Фиг.3. Данные активности аплидина (Aplidin®) в сочетании с паклитакселом (Таксол®) против клеток MOLT3 in vitro.
Фиг.4. Данные активности аплидина (Aplidin®) в сочетании с паклитакселом (Таксол®) против клеток PC3 in vitro.
Фиг.5. Данные активности аплидина (Aplidin®) в сочетании с паклитакселом (Таксол®) против клеток HL60 in vitro.
Фиг.6. Данные активности аплидина (Aplidin®) в сочетании с паклитакселом (Таксол®) против клеток MX1 in vitro.
Фиг.7. Данные активности аплидина (Aplidin®) в сочетании с паклитакселом (Таксол®) против клеток A549 in vitro.
Фиг.8. Данные активности аплидина (Aplidin®) в сочетании с доксорубицином (DOX) против клеток A549 in vitro.
Фиг.9. Данные активности аплидина (Aplidin®) в сочетании с доксорубицином (DOX) против клеток HT29 in vitro.
Фиг.10. Данные активности аплидина (Aplidin®) в сочетании с доксорубицином (DOX) против клеток PC3 in vitro.
Фиг.11. Данные активности аплидина (Aplidin®) в сочетании с доксорубицином (DOX) против клеток MOLT3 in vitro.
Фиг.12. Данные активности аплидина (Aplidin®) в сочетании с доксорубицином (DOX) против клеток MX1 in vitro.
Фиг.13. Данные активности аплидина (Aplidin®) в сочетании с доксорубицином (DOX) против клеток SKBR3 in vitro.
Фиг.14. Данные активности аплидина (AP, Aplidin®) в сочетании с цисплатином (DDP) против клеток MX1 in vitro.
Фиг.15. Данные активности аплидина (Aplidin®) в сочетании с цисплатином (цис-DDP) против клеток HT29 in vitro.
Фиг.16. Данные активности аплидина (APL, Aplidin®) в сочетании с цисплатином (цис-DDP, DDP) против клеток SKBR3 in vitro.
Фиг.17. Данные активности аплидина (Aplidin®) в сочетании с цисплатином (цис-DDP, DDP) против клеток MOLT3 in vitro.
Фиг.18. Данные активности аплидина (Aplidin®) в сочетании с цисплатином (цис-DDP, DDP) против клеток A549 in vitro.
Фиг.19. Данные активности аплидина (Aplidin®) в сочетании с триоксидом мышьяка (TRI) против клеток A549 in vitro.
Фиг.20. Данные активности аплидина (Aplidin®) в сочетании с триоксидом мышьяка (TRI) против клеток HT29 in vitro.
Фиг.21. Данные активности аплидина (Aplidin®) в сочетании с триоксидом мышьяка (TRI) против клеток PC3 in vitro.
Фиг.22. Данные активности аплидина (Aplidin®) в сочетании с триоксидом мышьяка (TRI) против клеток MOLT3 in vitro.
Фиг.23. Данные активности аплидина (Aplidin®) в сочетании с 5-фторурацилом (5FU) против клеток HL60 in vitro.
Фиг.24. Данные активности аплидина (Aplidin®) в сочетании с 5-фторурацилом (5FU) против клеток SKBR3 in vitro.
Фиг.25. Данные активности аплидина (Aplidin®) в сочетании с 5-фторурацилом (5FU) против клеток A549 in vitro.
Фиг.26. Данные активности аплидина (Aplidin®) в сочетании с 5-фторурацилом (5FU) против клеток PC3 in vitro.
Фиг.27. Данные активности аплидина (Aplidin®) в сочетании с 5-фторурацилом (5FU) против клеток HT29 in vitro.
Фиг.28. Данные активности аплидина (Aplidin®) в сочетании с цитозинарабинозидом (AraC) против клеток SKBR3 in vitro.
Фиг.29. Данные активности аплидина (Aplidin®) в сочетании с цитозинарабинозидом (AraC) против клеток A549 in vitro.
Фиг.30. Данные активности аплидина (Aplidin®) в сочетании с цитозинарабинозидом (AraC) против клеток PC3 in vitro.
Фиг.31. Данные активности аплидина (Aplidin®) в сочетании с цитозинарабинозидом (AraC) против клеток HL60 in vitro.
Фиг.32. Данные активности аплидина (Aplidin®) в сочетании с цитозинарабинозидом (AraC) против клеток HT29 in vitro.
Фиг.33. Данные активности аплидина (Aplidin®) в сочетании с карбоплатином в клетках PC3 in vitro.
Фиг.34. Данные активности аплидина (Aplidin®) в сочетании с карбоплатином в клетках HT29 in vitro.
Фиг.35. Данные активности аплидина (Aplidin®) в сочетании с карбоплатином в клетках A549 in vitro.
Фиг.36. Данные активности аплидина (Aplidin®) в сочетании с карбоплатином в клетках MOLT3 in vitro.
Фиг.37. Данные активности аплидина (Aplidin®) в сочетании с карбоплатином в клетках MX1 in vitro.
Фиг.38. Данные активности аплидина (Aplidin®) в сочетании с SN-38 в клетках A549 in vitro.
Фиг.39. Данные активности аплидина (Aplidin®) в сочетании с SN-38 в клетках SKBR3 in vitro.
Фиг.40. Данные активности аплидина (Aplidin®) в сочетании с SN-38 в клетках HL60 in vitro.
Фиг.41. Данные активности аплидина (Aplidin®) в сочетании с SN-38 в клетках PC3 in vitro.
Фиг.42A и 42B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток HL-60 in vitro.
Фиг.43A и 43B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток K562 in vitro.
Фиг.44A и 44B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток MOLT3 in vitro.
Фиг.45A и 45B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток MC116 in vitro.
Фиг.46A и 46B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток RAMOS in vitro.
Фиг.47A и 47B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток U937 in vitro.
Фиг.48A и 48B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток NCI-H929 in vitro.
Фиг.49A и 49B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток HUNS-1 in vitro.
Фиг.50A и 50B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток U266 B1 in vitro.
Фиг.51A и 51B. Данные активности аплидина (A, Aplidin®) в сочетании с VP16 (B) против клеток RPMI 8226 in vitro.
Фиг.52. Данные активности аплидина (Aplidin®) в сочетании с карбоплатином против клеток LOX-I-MVI in vitro.
Фиг.53. Данные активности аплидина (Aplidin®) в сочетании с карбоплатином против клеток UACC-257 in vitro.
Фиг.54. Ответ на дозу аплидина через 48 часов после обработки в клеточных линиях MM1S, MM1R, U266 и U266-LR7.
Фиг.55. Сравнение эффективности дозы аплидина (Aplidin®) и других лекарственных средств в клеточной линии MM1S (48 часов обработки).
Фиг.56. Сочетание аплидина (Aplidin®) и дексаметазона через 3 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.57. Сочетание аплидина (Aplidin®) и дексаметазона через 6 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.58. Сочетание аплидина (Aplidin®) и мелфалана через 3 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.59. Сочетание аплидина (Aplidin®) и мелфалана через 6 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.60. Сочетание аплидина (Aplidin®) и доксорубицина через 3 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.61. Сочетание аплидина (Aplidin®) и доксорубицина через 6 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.62. Сочетание аплидина (Aplidin®) и леналидомида (ревлимид®) через 3 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.63. Сочетание аплидина (Aplidin®) и леналидомида (ревлимид®) через 6 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.64. Сочетание аплидина (Aplidin®) и бортезомиба через 3 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.65. Сочетание аплидина (Aplidin®) и бортезомиба через 6 суток. A) Кривая "доза-эффект". B) Диаграмма Fa-CI.
Фиг.66. Динамика общего объема опухоли после начала обработки аплидином (Aplidin®) в качестве единственного средства или в сочетании с дакарбазином в опухолевых ксенотрансплантатах меланомы MRI-H-187.
Фиг.67. Динамика общего объема опухоли после начала обработки аплидином (Aplidin®) в качестве единственного средства или в сочетании с карбоплатином в опухолевых ксенотрансплантатах меланомы MRI-H-187.
Фиг.68. Динамика общего объема опухоли после начала обработки аплидином (Aplidin®) в качестве единственного средства или в сочетании с интерлейкином-2 (IL-2) в опухолевых ксенотрансплантатах меланомы MRI-H-187.
Фиг.69. Динамика общего объема опухоли после начала обработки аплидином (Aplidin®) в качестве единственного средства или в сочетании с интерфероном-α 2a (INF-α) в опухолевых ксенотрансплантатах меланомы MRI-H-187.
Фиг.70. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с дакарбазином (DTIC) в опухолевых ксенотрансплантатах меланомы LOX-IMVI.
Фиг.71. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с карбоплатином в опухолевых ксенотрансплантатах меланомы LOX-IMVI.
Фиг.72. Динамика общего объема опухоли после начала обработки аплидином (APL, Aplidin®) в качестве единственного средства или в сочетании с интерлейкином-2 (IL-2) в опухолевых ксенотрансплантатах меланомы LOX-IMVI.
Фиг.73. Динамика общего объема опухоли после начала обработки аплидином (APL, Aplidin®) в качестве единственного средства или в сочетании с интерфероном-α 2a (INF-α) в опухолевых ксенотрансплантатах меланомы LOX-IMV1.
Фиг.74. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с бевацизумабом (авастин®) в ксенотрансплантатах опухоли почки CaKi-1.
Фиг.75. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с интерлейкином-2 (IL-2) в ксенотрансплантатах опухоли почки CaKi-1.
Фиг.76. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с интерфероном-α 2a (INF-α 2a) в ксенотрансплантатах опухоли почки CaKi-1.
Фиг.77. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с бевацизумабом (Авастин®) в ксенотрансплантатах опухоли почки MRI-H121.
Фиг.78. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с интерлейкином-2 (IL- 2) в ксенотрансплантатах опухоли почки MRI-H121.
Фиг.79. Динамика общего объема опухоли после начала обработки аплидином (APL) в качестве единственного средства или в сочетании с интерфероном-α 2a (INF-α) в ксенотрансплантатах опухоли почки MRI-H121.
Фиг.80. Сочетание аплидин (A) + леналидомид (ревлимид®; R) + дексаметазон (D) в MM1S после 72 часов обработки. Дозы аплидина выражены в единицах нМ, дозы леналидомида выражены в единицах мкМ и дозы дексаметазона выражены в единицах нМ.
Фиг.81. Сочетание аплидин (A) + бортезомиб (B) + дексаметазон (D) в MM1S после 72 часов обработки. Дозы аплидина выражены в единицах нМ, дозы бортезомиба выражены в единицах нМ и дозы дексаметазона выражены в единицах нМ.
Фиг.82. Сочетание аплидин (A) + бортезомиб (B) + леналидомид (ревлимид®; R) в MM1S после 72 часов обработки. Дозы аплидина выражены в единицах нМ, дозы бортезомиба выражены в единицах нМ и дозы леналидомида выражены в единицах мкМ.
Фиг.83. Сочетание аплидин (A) + талидомид (T) + дексаметазон (D) в MM1S после 72 часов обработки. Дозы аплидина выражены в единицах нМ, дозы талидомида выражены в единицах мкМ и дозы дексаметазона выражены в единицах нМ.
Фиг.84. Сочетание аплидин (A) + мелфалан (M) + дексаметазон (D) в MM1S после 72 часов обработки. Дозы аплидина выражены в единицах нМ, дозы мелфалана выражены в единицах мкМ и дозы дексаметазона выражены в единицах нМ.
Фиг.85. Сочетание аплидин (A) + мелфалан (M) + бортезомиб (B) в MM1S после 72 часов обработки. Дозы аплидина выражены в единицах нМ, дозы мелфалана выражены в единицах мкМ и дозы бортезомиба выражены в единицах нМ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подразумевают, что "злокачественная опухоль" включает опухоли, неоплазии и любые другие злокачественные ткани или клетки. Настоящее изобретение относится к применению аплидина или аналога аплидина в комбинации для лечения злокачественной опухоли вообще, но более предпочтительно для лечения рака легких, рака молочной железы, рака толстого кишечника, рака предстательной железы, злокачественной опухоли почки, меланомы, множественной миеломы, лейкоза и лимфомы.
Для исследования возможного потенциирования других противораковых средств аплидином авторы изобретения проводили систематическое исследование сочетаний лекарственных средств на возможное применение для указанных выше типов злокачественных опухолей. Исследования комбинаций лекарственных средств проводили на различных типах клеточных линий. Исследования in vitro проводили с использованием таких линий опухолевых клеток, как линия NSCL A549, линия карциномы молочной железы MX1, линия промиелоцитарного лейкоза HL60, линия аденокарциномы толстого кишечника HT29, линия аденокарциномы предстательной железы PC3, линия аденокарциномы молочной железы SKBR3 и линия острого лимфобластного лейкоза (MOLT3), которые обладают различной чувствительностью к аплидину (от низкой до высокой). Также проводили дополнительные исследования с клеточными линиями лейкозов, лимфом, множественной миеломы и меланомы. Кроме того, для определения действия аплидина в сочетании с другими стандартными средствами также проводили исследования in vivo с использованием ксенотрансплантатов меланомы, опухоли почки, миеломы и лимфомы. Наконец, проводили исследования in vitro в линиях клеток множественной миеломы с применением тройных комбинаций, т.е. сочетая аплидин с двумя дополнительными стандартными средствами (второе и третье лекарственное средство).
В качестве основного заключения авторы изобретения обнаружили, что цитотоксичность аплидина в опухолевых клетках сильно увеличена в сочетании со многими из стандартных средств, применяемых для этой оценки. Основной синергический эффект наблюдали для сочетания аплидина с паклитакселом (таксол®), доксорубицином, цисплатином, триоксидом мышьяка, 5-фторурацилом (5-FU), цитозинарабинозидом (AraC), карбоплатином, 7-этил-10-гидроксикамптотецином (SN38), этопозидом (VP16), мелфаланом, дексаметазоном, циклофосфамидом, бортезомибом, эрлотинибом, трастузумабом, леналидомидом (ревлимид®), интерлейкином-2 (IL-2), интерфероном-α 2 (INF-α), дакарбазином (DTIC), бевацизумабом (авастин®), идарубицином, талидомидом и ритуксимабом. Дополнительно также обнаружено, что увеличение цитотоксичности также получали с применением тройных комбинаций аплидина с указанными выше средствами.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из рака молочной железы, лейкоза и рака предстательной железы, является сочетание аплидина с паклитакселом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из рака легких, рака толстого кишечника, рака предстательной железы и множественной миеломы, является сочетание аплидина с доксорубицином.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из рака молочной железы и рака толстого кишечника, является сочетание аплидина с цисплатином.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из рака легких, рака толстого кишечника и рака предстательной железы, является сочетание аплидина с триоксидом мышьяка.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из лейкоза, рака легких, рака молочной железы и рака предстательной железы, является сочетание аплидина с 5-фторурацилом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из рака легких, рака молочной железы и рака предстательной железы, является сочетание аплидина с цитозинарабинозидом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из рака толстого кишечника, рака предстательной железы и меланомы, является сочетание аплидина с карбоплатином.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения рака легких, является сочетание аплидина с SN38.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли, выбранной из лимфомы и множественной миеломы, является сочетание аплидина с этопозидом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является сочетание аплидина с дексаметазоном.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является сочетание аплидина с леналидомидом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является сочетание аплидина с бортезомибом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения меланомы, является сочетание аплидина с дакарбазином.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли почки, является сочетание аплидина с бевацизумабом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения злокачественной опухоли почки, является сочетание аплидина с интерлейкином-2.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является сочетание аплидина с мелфаланом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения лейкоза, является сочетание аплидина с идарубицином.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения лимфомы, является сочетание аплидина с ритуксимабом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является сочетание аплидина с талидомидом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является тройное сочетание аплидина с леналидомидом и дексаметазоном.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является тройное сочетание аплидина с бортезомибом и дексаметазоном.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является тройное сочетание аплидина с бортезомибом и леналидомидом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является тройное сочетание аплидина с бортезомибом и талидомидом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является тройное сочетание аплидина с дексаметазоном и талидомидом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является тройное сочетание аплидина с дексаметазоном и мелфаланом.
Особенно предпочтительным для лечения злокачественной опухоли, а более конкретно - для лечения множественной миеломы, является тройное сочетание аплидина с мелфаланом и бортезомибом.
Композиции по настоящему изобретению могут содержать все компоненты (лекарственные средства) в одной фармацевтически приемлемой фармацевтической форме. Альтернативно компоненты можно составлять отдельно и вводить в сочетании друг с другом. В настоящем изобретении можно использовать различные фармацевтически приемлемые формы, хорошо известные специалистам в данной области. Выбор соответствующей фармацевтической формы для применения согласно настоящему изобретению могут обычным способом проводить специалисты в данной области в зависимости от способа введения и характеристик растворимости компонентов композиции.
Примеры фармацевтических композиций, содержащих аплидин или аналог аплидина, включают жидкие композиции (растворы, суспензии или эмульсии), подходящие для внутривенного введения, и они могут содержать чистое соединение или соединение в сочетании с любым носителем или другими фармакологически активными соединениями. Растворенный аплидин продемонстрировал значительное разрушение в тестовых условиях тепловой и световой нагрузки, и была разработана лиофилизированная лекарственная форма, см. WO 99/42125, включенную в настоящий документ в качестве ссылки.
Введение аплидина или композиций по настоящему изобретению основано на протоколе дозирования предпочтительно посредством внутривенного вливания. Авторы изобретения предпочитают, чтобы использовали продолжительность вливания вплоть до 72 часов, более предпочтительно - от 1 до 24 часов, наиболее предпочтительно - приблизительно 1, приблизительно 3 или приблизительно 24 часа. Особенно желательна короткая продолжительность вливания, которая позволяет проводить обработку без содержания в госпитале, в течение ночи. Однако если нужно, вливание можно проводить приблизительно 24 часа или даже более. Вливание можно проводить с подходящими интервалами с изменяющимися схемами, иллюстративно: раз в неделю, два раза в неделю или с большей частотой в неделю, с повторением на каждой неделе, необязательно с пропусками, как правило, одной или нескольких недель.
Точная дозировка соединений сочетания варьирует в зависимости от конкретной фармацевтической формы, способа применения и конкретных участка, пациента и опухоли, подвергаемых обработке. В расчет следует принимать и другие факторы, такие как возраст, масса тела, пол, диета, время введения, скорость выведения, состояние пациента, сочетания лекарственных средств, реакции гиперчувствительности и тяжесть заболевания. Введение можно проводить непрерывно или периодически в пределах максимально переносимой дозы. Дополнительное руководство по введению аплидина приведено в WO 01/35974, включенной в настоящий документ в качестве ссылки в полном объеме.
В одном из аспектов настоящее изобретение относится к синергическим сочетаниям с применением аплидина или аналога аплидина. Признаки синергии можно легко выявить посредством тестирования сочетаний и анализа результатов, например посредством линейного регрессионного анализа. Иллюстрацией этого пункта служит фигура 1. Для выявления синергизма доступны альтернативные способы, такие как ана