Композиции и способы для лечения опухоли
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использовано для лечения множественной миеломы у пациента, рецидивировавшей после терапии бортезомибом или рефракторной. Для этого пациенту вводят антагонист VEGF, представляющий собой антитело к VEGF (бевацизумаб). Также предложен способ лечения множественной миеломы, рецидивировавшей после терапии алкилирующими средствами. Группа изобретений обеспечивает эффективность антитела к VEGF, для подавления чувствительных и/или устойчивых опухолей к бортезомибу. 4 н. и 44 з.п. ф-лы, 10 ил., 2 табл., 4 пр.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к композициям и способам для лечения опухолевого роста, включая рецидивирующий или рефрактерный опухолевый рост, с использованием антагонистов VEGF в режиме монотерапии или в комбинации с другими лекарственными средствами.
УРОВЕНЬ ТЕХНИКИ
Опухоли характеризуются патологическим разрастанием клеток и могут быть злокачественными или доброкачественными. Плазматические клетки (также называемые плазматическими В-клетками или плазмоцитами) развиваются из зрелых В-лимфоцитов (В-клеток) и обычно секретируют антитела для борьбы с чужеродными элементами в организме (например, бактериями или вирусными инфекциями). Наличие плазмоклеточных опухолей может снизить активность здоровых эритроцитов, лейкоцитов и тромбоцитов. Это состояние может привести к анемии или кровоточивости или снизить сопротивляемость инфекциям. Патологические плазматические клетки часто образуют опухоли в костях или мягких тканях организма. Плазмоклеточные опухоли также могут вырабатывать большое количество одного антитела, называемого М-белком (или моноклональным белком, миеломным белком или парапротеином), который не является необходимым для организма, не помогает бороться против инфекции и может вызвать повреждение почек. В некоторых случаях злокачественные плазматические клетки теряют способность синтезировать и соединять тяжелые и легкие цепи, в результате чего легкие цепи каппа и лямбда (также называемые белком Бенс-Джонса) выходят из клетки в кровь по отдельности и экскретируются с мочой. Примеры плазмоклеточных опухолей включают множественную миелому (MM, ММ), солитарную плазмоцитому кости (SPB, СПК), плазмоклеточные лейкозы и экстрамедуллярные плазмоцитомы (EMP, ЭМП).
Множественная миелома (MM, ММ) представляет собой злокачественную опухоль, характеризующуюся экспансией плазматических В-клеток, которые вырабатывают моноклональный иммуноглобулин (например, IgG, IgA, IgD, IgE или свободные каппа или лямбда-цепи). Общая выживаемость больных ММ сильно варьирует от нескольких месяцев до многих лет, составляя в среднем приблизительно пять лет. Анемия, гиперкальциемия и костные очаги коррелируют непосредственно с общей массой клеток миеломы и имеют важное прогностическое значение. Другие прогностические факторы включают возраст, пролиферативный индекс плазматических клеток, уровень β2-микроглобулина сыворотки, C-реактивного белка, тимидинкиназы и растворимого рецептора интерлейкина-6. Серьезные осложнения, такие как инфекция и почечная недостаточность, являются самыми частыми причинами смерти больных миеломой. Почти у всех больных множественной миеломой существует риск возможного рецидива (Kyle, RK et al., (2004) N Engl J Med 351:1860-1873).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу лечения рецидивирующей или рефрактерной к лечению ингибиторами протеасом опухоли у пациента, предусматривающему стадию введения антагониста VEGF. Настоящее изобретение также относится к способу лечения рецидивирующей или рефрактерной к алкилирующим средствам плазмоклеточной опухоли у пациента, предусматривающему стадию введения антагониста VEGF. Кроме того, настоящее изобретение относится к способу лечения рецидивирующей или рефрактерной опухоли у пациента, предусматривающему стадию введения антагониста VEGF и ингибитора протеасом. Настоящее изобретение дополнительно относится к способу лечения рецидивирующей или рефрактерной опухоли у пациента, предусматривающему стадию введения антагониста VEGF и талидомида или аналога талидомида.
Согласно одному варианту осуществления пациенту с рецидивирующей или рефрактерной опухолью дополнительно вводится талидомид или аналог талидомида. Согласно другому варианту осуществления пациенту с рецидивирующей или рефрактерной опухолью дополнительно вводится ингибитор протеасом. Согласно другому варианту осуществления пациенту с рецидивирующей или рефрактерной опухолью вводится антагонист VEGF в виде монотерапии.
Согласно еще одному варианту осуществления пациенту с рецидивирующей или рефрактерной опухолью дополнительно вводится дополнительное терапевтическое средство. Согласно одному варианту осуществления дополнительное терапевтическое средство выбрано из группы, состоящей из алкилирующего средства, стероида, бисфосфонатов и ингибитора протеасом. Согласно другому варианту осуществления дополнительное терапевтическое средство выбрано из группы, состоящей из мелфалана, преднизона, талидомида, адриамицина (доксорубицина), липосомного доксорубицина гидрохлорида для инъекций (Доксил®), бортезомиба (Велкейд®), леналидомида (CC-5013, Ревлимид®), дексаметазона, винкристина (Онковин®), кармустина и циклофосфамида (Цитоксан).
Согласно еще одному варианту осуществления пациенту с рецидивирующей или рефрактерной опухолью дополнительно проводится комбинированная терапия. В одном варианте осуществления комбинированная терапия выбрана из группы, состоящей из комбинации мелфалан/преднизон (MP), комбинации мелфалан/преднизон/талидомид (MPT), комбинации доксил/бортезомиб, комбинации талидомид/дексаметазон (TD), комбинации бортезомиб/доксорубицин/талидомид/дексаметазон (BATD), комбинации бортезомиб/талидомид (BT), комбинации бортезомиб/мелфалан/дексаметазон/талидомид (BMDT), комбинации бортезомиб/мелфалан/преднизон/талидомид(BMPT), комбинации бортезомиб/пэгилированный липосомальный доксорубицин/талидомид (BTD), бортезомиб/циклофосфамид/преднизон (BCP), комбинации винкристин/кармустин/мелфалан/циклофосфамид/преднизон (VBMCP) и комбинации винкристин/доксорубицин/дексаметазон (VAD).
В одном варианте осуществления ингибитор протеасом ингибирует протеасомы человека 20S или 26S. В другом варианте осуществления ингибитор протеасом выбран из группы, состоящей из бортезомиба, MG132, лактацистина, эпоксомицина и салиноспорамида A. В одном предпочтительном варианте осуществления ингибитором протеасом является бортезомиб. В другом варианте осуществления алкилирующим средством является мелфалан.
Согласно одному варианту осуществления опухоль представляет собой рак. Согласно другому варианту осуществления рак выбран из группы, состоящей из рака легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого), рака брюшины, гепатоцеллюлярного рака, рака желудка (включая рак желудочно-кишечного тракта), рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака ободочной кишки, колоректального рака, рака эндометрия или матки, рака слюнной железы, рака почки или ренального рака, рака печени, рака простаты, рака вульвы, рака щитовидной железы, гепатокарциномы, рака носоглотки, глиомы, рака головы и шеи и гематологических злокачественных опухолей или гемобластозов (например, В-клеточная опухоль). Согласно одному варианту осуществления гемобластоз выбран из группы, состоящей из В-клеточных лимфом, В-клеточных лейкозов, Т-клеточных лимфом и Т-клеточных лейкозов. Согласно одному варианту осуществления B-клеточная лимфома представляет собой неходжкинскую лимфому (NHL, НХЛ). В следующем варианте осуществления NHL (НХЛ) выбрана из группы, состоящей из фолликулярной лимфомы, мантийноклеточной лимфомы (MCL, МКЛ); и лимфомы маргинальной зоны. В другом варианте осуществления гемобластоз выбран из группы, состоящей из хронического лимфолейкоза (CLL, ХЛЛ); острого лимфобластного лейкоза (ALL, ОЛЛ); волосатоклеточного лейкоза; хронического миелоидного лейкоза и множественной миеломы.
Согласно одному варианту осуществления плазмоклеточная опухоль выбрана из группы, состоящей из множественной миеломы (MM, ММ), плазмоцитомы, макроглобулинемии, моноклональной гаммапатии неясного значения (MGUS, МГНЗ), плазмоклеточного лейкоза, гиперглобулинемической пурпуры и болезни Калера. Согласно одному предпочтительному варианту осуществления плазмоклеточная опухоль представляет собой множественную миелому.
Согласно одному варианту осуществления антагонист VEGF является антителом к VEGF, VEGF-Trap (например, продуктом слияния рецептора VEGF с Fc) или антителом к рецептору VEGF. Согласное еще одному варианту осуществления антитело к VEGF является антителом человека или гуманизированным антителом к VEGF. В одном предпочтительном варианте осуществления антитело к VEGF представляет собой антитело AVASTIN®.
Также рассматриваются композиции, содержащие комбинации терапевтических средств, представленных в настоящем изобретении. В одном варианте осуществления композиция содержит антагонист VEGF и ингибитор протеасом. В другом варианте осуществления композиция дополнительно содержит другое терапевтическое средство, выбранное из группы, состоящей из алкилирующего средства, стероида, бисфосфонатов и другого антагониста VEGF. Также рассматривается применение антагонистов VEGF, в отдельности или в комбинации с другими терапевтическими средствами, описанными в данном документе, для изготовления лекарственного препарата для лечения по показаниям, перечисленным в данном документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
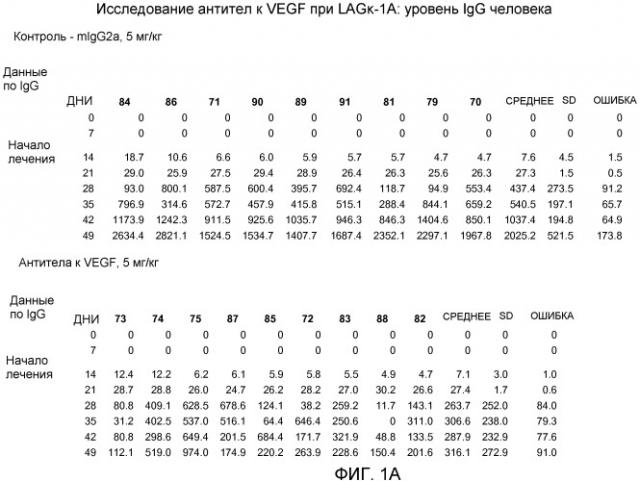
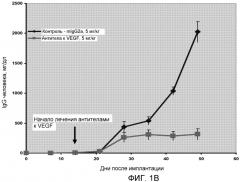
На фиг.1 показаны уровни IgG человека у мыши после имплантации опухоли LAGκ-1A и последующего лечения антителом к VEGF: (A) табличная форма и (B) графическая форма.
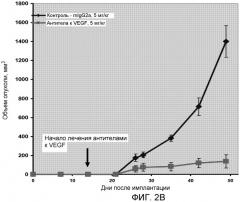
На фиг.2 изображен объем опухоли LAGκ-1A у мыши после имплантации опухоли и последующего лечения антителом к VEGF: (A) табличная форма и (B) графическая форма.
На фиг.3 показаны уровни IgG человека у мыши после имплантации опухоли LAGκ-1B и последующего лечения антителом к VEGF: (A) табличная форма и (B) графическая форма.
На фиг.4 изображен объем опухоли LAGκ-1B у мыши после имплантации опухоли и последующего лечения антителом к VEGF: (A) табличная форма и (B) графическая форма.
На фиг.5A показаны уровни IgG человека у мыши после имплантации опухоли LAGκ-1B и последующего введения антитела к VEGF на 21-й день.
На фиг.5B изображен объем опухоли LAGκ-1B у мыши после имплантации опухоли и последующего введения антитела к VEGF на 21-й день.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Протеасомы представляют собой цилиндрические протеазы, состоящие из множества субъединиц, которые были обнаружены у эукариот, эубактерий и архебактерий. Активные сайты протеасомы ориентированы в сторону центральной камеры, погруженной в толщу цилиндрической частицы. Эукариотические протеасомы имеют два размера: 20S-протеасома и значительно более крупная АТФ-зависимая 26S-протеасома. Последняя образуется, когда 20S-протеасома связывает одну или две мультисубъединичные, содержащие АТФазу частицы, известные как 19S регуляторные комплексы. 26S-протеасома отвечает за разрушение повсеместно распространенных белков и поэтому является неотъемлемой частью самых разных клеточных процессов, включая цикл деления клетки, контроль транскрипции, регулировку уровня ферментов и апоптоз. Как 20S-, так и 26S-протеасомы могут ассоциироваться с другими белковыми комплексами.
«Ингибитор протеасом» относится к средству, которое ингибирует протеазную активность протеасом (например, любую или все активности - химотрипсиновую, трипсиновую и пептидилглутамилпептид-гидролизующую). Согласно одному предпочтительному варианту осуществления протеасома является 20S- и/или 26S-протеасомой человека. Примеры ингибиторов протеасом включают бортезомиб, MG132, лактацистин, эпоксомицин и салиноспорамид A (NPI-0052, Nereus Pharmaceutical). См., например, структуры, раскрытые Voorhees, PM et al., (2006) 46:189-213, альдегиды пептидов из WO 95/24914, WO 91/13904, Iqbal et al. (1995) J. Med. Chem. 38:2276-2277, пептид-бороновые кислоты из WO 96/13266, лактацистин и аналоги лактацистина (Fenteany et al. (1994) Proc. Natl. Acad. Sci. USA 91:3358; WO 96/32105), а также салиноспорамид A (Macheria, VR, et al., (2005) 48:3684-7.
Термин «VEGF» или «VEGF», как используется в данном документе, относится к сосудистому фактору роста клеток эндотелия человека длиной 165 аминокислот и к близким ему сосудистым факторам роста клеток эндотелия человека длиной 121, 189 и 206 аминокислот, которые описаны Leung et al. Science, 246:1306 (1989), и Houck et al. Mol. Endocrin., 5:1806 (1991), вместе с встречающимися в природе аллельными и процессированными их формами. Термин «VEGF» также относится к VEGF видов, отличающихся от человека, таких как мышь, крыса или примат. Иногда VEGF конкретного вида указан термином, таким как hVEGF для VEGF человека, mVEGF для VEGF мыши и т.д. Термин «VEGF» также используется по отношению к укороченным формам полипептида, содержащим аминокислоты 8-109 или 1-109 сосудистого фактора роста эндотелиальных клеток человека длиной 165 аминокислот. Ссылка на любые такие формы VEGF может быть идентифицирована в настоящей заявке, например, «VEGF (8-109)», «VEGF (1-109)» или «VEGF165». Положения аминокислот в «укороченном» природном VEGF нумеруются, как указано для природной последовательности VEGF. Например, аминокислота в 17 положении (метионин) в укороченном природном VEGF тоже является 17 положением (метионин) в природном VEGF. Укороченный природный VEGF обладает аффинностью к KDR и рецепторам Flt-1, сопоставимой с таковой природного VEGF.
«Антагонист VEGF» относится к молекуле, способной нейтрализовать, блокировать, ингибировать, уничтожать, снижать или вмешиваться в активность VEGF, включая его связывание с одним и более рецепторами VEGF. Антагонисты VEGF включают антитела к VEGF и их фрагменты, связывающие антиген; аптамер; рецепторные молекулы и производные, которые специфично связываются с VEGF, тем самым препятствуя его связыванию с одним или более рецепторами; антитела к рецептору VEGF и антагонисты рецептора VEGF, такие как малые молекулы-ингибиторы тирозинкиназ VEGFR. Примеры антагонистов VEGF включают, но не ограничиваются ими, FLT-Fc, KDR-Fc, FLT/KDR-Fc, ваталаниб (PTK-787/ZK222584), SU-5416 (семаксаниб), SU-6668, SU-11248, SU-14813, AZD-6474, AZD-2171, CGP-41251, CEP-5214, BIBF1000, VGA1102, CP-547632, CEP-7055, AG-013736, IM-842 (дипептид L-глутамила и L-триптофана) или GW-786034, а также антагонисты, описанные в WO 02/36564, WO 99/52869, WO 00/18734, WO 00/73297, WO 01/27080, WO 01/27081, WO 01/32651, WO 01/60814, WO 99/48868 и WO 98/35958.
«Антитело к VEGF» является антителом, которое связывается с VEGF с достаточной аффинностью и специфичностью. Предпочтительно, антитело к VEGF по изобретению может быть использовано как терапевтическое средство для «нацеливания» или воздействия на заболевание или состояние, связанное с активностью VEGF. Антитело к VEGF обычно не будет связываться с другими гомологами VEGF, например VEGF-B или VEGF-C, и другими факторами роста, например P1GF, PDGF или bFGF. Предпочтительное антитело к VEGF является моноклональным антителом, которое связывается с тем же самым эпитопом, что и моноклональное антитело к VEGF A4.6.1, вырабатываемое гибридомой ATCC HB 10709. Более предпочтительно антитело к VEGF представляет собой рекомбинантное гуманизированное моноклональное антитело к VEGF, полученное по Presta et al. (1997) Cancer Res. 57:4593-4599, включая, без ограничения, антитело, известное как бевацизумаб (BV; антитело AVASTIN®).
Антитело к VEGF «бевацизумаб (BV)», также известное как «rhuMAb VEGF» или «AVASTIN®», является рекомбинантным гуманизированным моноклональным антителом к VEGF, полученным по Presta et al. (1997) Cancer Res. 57:4593-4599. Бевацизумаб содержит мутантные каркасные области IgG1 человека и антигенсвязывающие, определяющие комплементарность области от мышиного моноклонального антитела к hVEGF A.4.6.1, которое блокирует связывание VEGF человека с его рецепторами. Приблизительно 93% аминокислотной последовательности бевацизумаба, включая большинство каркасных областей, получено от IgG1 человека, и приблизительно 7% последовательности получены от мышиного антитела A4.6.1. Бевацизумаб имеет молекулярную массу приблизительно 149000 Да и гликозилирован.
«Рефрактерный» относится к устойчивости или отсутствию ответа заболевания или состояния на лечение (например, количество опухолевых плазматических клеток возрастает, несмотря на проводимое лечение). Если не указано иначе, термин «рефрактерный» относится к устойчивости или отсутствию ответа на любое предыдущее лечение, включая, но не ограничиваясь ими, химиотерапию и трансплантацию стволовых клеток.
«Рецидивирующий» относится к возвращению заболевания к предыдущему состоянию, особенно к возобновлению симптомов после явного или частичного выздоровления. Если не указано иначе, «рецидивирование» относится к процессу возвращения или к возвращению заболевания, имевшего место до предыдущего лечения, включая, но не ограничиваясь ими, химиотерапию и трансплантацию стволовых клеток.
Термины «рак» и «раковый» относятся к физиологическому состоянию или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, но не ограничиваются ими, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких типов рака включают плоскоклеточный рак, рак легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого), рак брюшины, гепатоцеллюлярный рак, рак желудка (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, рак эндометрия или матки, рак слюнной железы, рак почки или ренальный рак, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени, рак носоглотки, глиому и различные типы рака головы и шеи, а также гематологические злокачественные опухоли или гемобластозы, например, В-клеточную лимфому (включая лимфому низкой степени злокачественности/фолликулярную неходжкинскую лимфому (NHL, НХЛ), НХЛ из мелких лимфоцитов (SL), НХЛ промежуточной степени злокачественности/фолликулярную НХЛ, диффузную НХЛ промежуточной степени злокачественности; иммунобластную НХЛ высокой степени злокачественности; лимфобластную НХЛ высокой степени злокачественности; НХЛ высокой степени злокачественности из мелких клеток с нерасщепленными ядрами; массивную НХЛ; мантийноклеточную лимфому (MCL, МКЛ); СПИД-ассоциированные лимфомы и макроглобулинемию Вальденстрема); хронический лимфолейкоз (CLL, ХЛЛ); острый лимфобластный лейкоз (ALL, ОЛЛ); волосатоклеточный лейкоз; хронический миелоидный лейкоз, множественную миелому и посттрансплантационное лимфопролиферативное заболевание (PTLD).
«В-клеточная опухоль» относится к патологическому росту В-клеток, который может быть злокачественным или доброкачественным и который часто характеризуется бесконтрольным делением клеток. В-клеточная опухоль включает, но не ограничивается ими, плазмоклеточную опухоль, болезнь Ходжкина, включая болезнь Ходжкина с лимфоидным преобладанием (LPHD); неходжкинскую лимфому (NHL, НХЛ); фолликулярные центроклеточные лимфомы (FCC); острый лимфолейкоз (ALL, ОЛЛ); хронический лимфолейкоз (CLL, ХЛЛ); волосатоклеточный лейкоз и CD20-положительные опухоли. Неходжкинская лимфома включает НХЛ низкой степени злокачественности/фолликулярную НХЛ, НХЛ из мелких лимфоцитов (SL), НХЛ промежуточной степени злокачественности/фолликулярную НХЛ, диффузную НХЛ промежуточной степени злокачественности, иммунобластную НХЛ высокой степени злокачественности, лимфобластную НХЛ высокой степени злокачественности, НХЛ высокой степени злокачественности из мелких клеток с нерасщепленными ядрами, массивную НХЛ, плазмоцитоидную лимфоцитарную лимфому; мантийноклеточную лимфому; СПИД-ассоциированные лимфомы и макроглобулинемию Вальденстрема. Лечение рецидивов этих типов рака также рассматривается. LPHD представляет собой тип болезни Ходжкина, которая имеет тенденцию к частым рецидивам, несмотря на химиотерапию или лучевую терапию. CLL (ХЛЛ) представляет собой один из четырех основных типов лейкоза. Опухоль из зрелых В-клеток, называемых лимфоцитами, CLL (ХЛЛ), проявляется прогрессирующим накоплением клеток в крови, костном мозге и лимфатических тканях. Индолентная лимфома является медленно развивающимся, неизлечимым заболеванием, при котором средняя продолжительность жизни варьирует от 6 до 10 лет, сопровождаясь многочисленными периодами ремиссии и рецидивов.
Термин «неходжкинская лимфома» или «NHL, НХЛ», как используется в данном документе, относится к раку лимфатической системы, отличающемуся от лимфомы Ходжкина. Лимфому Ходжкина, как правило, можно отличить от неходжкинской лимфомы по наличию в лимфоме Ходжкина клеток Рид-Штернберга и отсутствию указанных клеток в неходжкинской лимфоме. Примеры неходжкинских лимфом, охватываемых использующимся в настоящем документе термином, включают любую НХЛ, которая могла быть идентифицирована как таковая специалистом в данной области (например, онкологом или патоморфологом) по схемам классификации, известным в данной области, например по схеме Revised European-American Lymphoma (REAL), как описано в Color Atlas of Clinical Hematology, Third Edition; A. Victor Hoffbrand and John E. Pettit (eds.) (Harcourt Publishers Limited 2000) (см., в частности, Fig. 11.57, 11.58 и/или 11.59). Более конкретные примеры включают, но не ограничиваются ими, рецидивирующую или рефрактерную НХЛ, первичную НХЛ низкой степени злокачественности, НХЛ III/IV стадии, резистентную к химиотерапии НХЛ, лимфобластную лимфому и/или лейкоз из предшественников В-клеток, мелкоклеточную лимфоцитарную лимфому, В-клеточный хронический лимфолейкоз и/или пролимфоцитарный лейкоз и/или лимфому из мелких лимфоцитов, В-клеточную пролимфоцитарную лимфому, иммуноцитому и/или лимфоплазмоцитарную лимфому, В-клеточную лимфому маргинальной зоны, лимфому маргинальной зоны селезенки, экстранодальную лимфому маргинальной зоны - MALT, нодальную лимфому маргинальной зоны, волосатоклеточный лейкоз, плазмоцитому и/или плазмоклеточную миелому, лимфому низкой степени злокачественности/фолликулярную лимфому, лимфому промежуточной степени злокачественности/фолликулярную НХЛ, мантийноклеточную лимфому, лимфому центра фолликула (фолликулярную), диффузную НХЛ промежуточной степени злокачественности, диффузную В-крупноклеточную лимфому, агрессивную НХЛ (включая агрессивную первичную НХЛ и рецидив НХЛ), рецидив НХЛ после аутотрансплантации стволовых клеток или рефрактерную к нему НХЛ, первичную медиастинальную В-крупноклеточную лимфому, первичную лимфому серозных оболочек, высокозлокачественную иммунобластную НХЛ, высокозлокачественную лимфобластную НХЛ, высокозлокачественную НХЛ из мелких клеток с нерасщепленными ядрами, НХЛ с массивным поражением, лимфому Беркитта, лимфобластный лейкоз и/или лимфому из предшественников (периферических) Т-клеток, Т-клеточную лимфому и/или лейкоз взрослых, Т-клеточный хронический лимфоцитарный и/или пролимфоцитарный лейкоз, лейкоз из крупных гранулярных лимфоцитов, грибовидный микоз и/или синдром Сезари, экстранодальную лимфому (назального типа) из естественных киллерных клеток/Т-клеточную лимфому, энтеропатическую лимфому Т-клеточного типа, гепатоспленическую Т-клеточную лимфому, подкожную панникулитоподобную Т-клеточную лимфому, кожные лимфомы, анапластическую крупноклеточную лимфому, ангиоцентрическую лимфому, интестинальную Т-клеточную лимфому, периферическую Т-клеточную лимфому (без дополнительного уточнения) и ангиоиммунобластную Т-клеточную лимфому.
«Плазмоклеточная опухоль», как используется в данном документе, относится к патологическому росту плазматических клеток, который может быть злокачественным или доброкачественным и который часто характеризуется бесконтрольным делением клеток. Примеры плазмоклеточных опухолей включают множественную миелому (ММ), плазмоцитому (например, экстрамедуллярную плазмоцитому (EMP), солитарную плазмоцитому кости (SPB), злокачественную плазмоцитому), макроглобулинемию (например, макроглобулинемию Вальденстрема или лимфоплазмоцитарный лейкоз), моноклональную гаммапатию неясного значения (MGUS, МГНЗ), плазмоклеточный лейкоз, гиперглобулинемическую пурпуру и болезнь Калера.
Множественная миелома характеризуется, среди прочего, разрушением костей, почечной недостаточностью, анемией и гиперкальциемией. Общие симптомы ММ включают слабость, костную боль и рецидивирующие инфекции. По мере того как возрастает число клеток миеломы, уменьшается число эритроцитов, лейкоцитов и тромбоцитов. Клетки миеломы также повреждают и ослабляют твердые части костей. Однако иногда множественная миелома не вызывает симптомов. В редких случаях множественная миелома может вызывать органную недостаточность. Это может быть обусловлено состоянием, именуемым амилоидозом. Белки-антитела синтезируются и могут связываться друг с другом и накапливаться в органах, таких как почки и сердце. В результате органы могут стать неэластичными и перестать функционировать.
Плазмоцитома представляет собой тип плазмоклеточной опухоли, при которой патологические плазматические клетки (клетки миеломы) собираются в одном месте и образуют единственную опухоль. Плазмоцитома может образоваться в костном мозге или может быть экстрамедуллярной (находиться в мягких тканях за пределами костного мозга). Плазмоцитома кости часто трансформируется во множественную миелому. Экстрамедуллярные плазмоцитомы обычно образуются в тканях глотки и придаточных пазух носа.
При макроглобулинемии патологические плазматические клетки образуются в костном мозге, лимфатических узлах и/или селезенке. Клетки производят слишком много М-белка, который становится причиной повышенной вязкости крови. Лимфатические узлы, печень и селезенка могут увеличиваться. Повышенная вязкость крови может вызвать проблемы с кровотоком в мелких кровеносных сосудах. Симптомы макроглобулинемии зависят от того, какие органы поражены. У большинства больных макроглобулинемией нет никаких симптомов. При этом типе плазмоклеточной опухоли имеются патологические плазматические клетки в костном мозге, но рак отсутствует. Патологические плазматические клетки продуцируют М-белок, который может быть обнаружен во время обычных исследований крови или мочи. У большинства пациентов количество М-белка остается постоянным и нет никаких симптомов или проблем. У некоторых пациентов MGUS (МГНЗ) может позже трансформироваться в более серьезное заболевание, такое как множественная миелома или лимфома.
Макроглобулинемия Вальденстрема (WM, МВ) является редкой индолентной (медленно растущей) неходжкинской лимфомой (рак, который возникает в клетках иммунной системы). МВ также называют лимфоплазмоцитарной лимфомой. МВ возникает в плазматических клетках, которые происходят от лейкоцитов, называемых В-лимфоцитами или B-клетками. Макроглобулинемия, поражающая пожилых, особенно женщин, характеризуется анемией, гиперглобулинемией и пролиферацией клеток, напоминающих лейкоциты или плазматические клетки, в костном мозге. При МВ патологические плазматические клетки размножаются неконтролируемо, продуцируя большое количество белка, названного моноклональным макроглобулином (IgM). Высокие уровни IgM в крови вызывают гипервязкость (сгущение или вязкость) крови, которая служит причиной многих симптомов Вальденстрема.
Примеры терапевтических средств и комбинации терапевтических средств, применимых по настоящему изобретению, включают антитело AVASTIN®, бисфосфонаты, аналоги талидомида, бортезомиб, мелфалан; преднизон; талидомид; адриамицин (доксорубицин); липосомальный доксорубицина гидрохлорид для инъекций (Доксил®), бортезомиб (Велкейд®); леналидомид (CC-5013, Ревлимид®); дексаметазон; винкристин (Онковин®), кармустин, циклофосфамид (Цитоксан), комбинацию мелфалан/преднизон/талидомид (MPT); комбинацию талидомид/дексаметазон (TD); комбинации бортезомиб/доксорубицин/талидомид/дексаметазон (BATD); комбинации бортезомиб/мелфалан/дексаметазон/талидомид (BMDT); комбинации бортезомиб/мелфалан/преднизон/талидомид(BMPT); комбинации бортезомиб/пэгилированный липосомальный доксорубицин/талидомид (BTD) и другие комбинации, включающие алкилирующие средства, и комбинации, включающие кортикостероиды.
Алкилирующие средства включают, но не ограничиваются ими, мелфалан и циклофосфамид. Пример комбинированной терапии на основе алкилирующих средств включает, но не ограничивается ими, винкристин, кармустин, мелфалан, циклофосфамид, преднизон (VBMCP).
«Стероиды» включают, но не ограничиваются ими, кортикостероиды, такие как дексаметазон и преднизон. Пример комбинированной терапии на основе кортикостероида включает, без ограничения, винкристин/доксорубицин/дексаметазон (VAD).
«Бисфосфонаты» включают, но не ограничиваются ими, памидронат (например, Аредиа® и другие), золедроновую кислоту (например, Зомета®) и клодронат (например, Бонефос®).
«Аналоги талидомида» относятся к иммуномодулирующим аналогам талидомида, включая, но не ограничиваясь ими, леналидомид (Ревлимид®), CC-4047 (Актимид™), CC11006, ENMD-0995 и CC11006,. См. также, Machado, AL et al., (2002) Bioorganic & Med. Chem. Lets. 15:1169-1172; Lepper, ER et al., (2004)) J. Med. Chem. 47:2219-2217; патенты США №№7719106 и 7041680.
«Терапия ингибитором протеасом» относится к любому терапевтическому лечению, предусматривающему стадию введения ингибитора протеасом.
«Терапия алкилирующим средством» относится к любому терапевтическому лечению, предусматривающему стадию введения алкилирующего средства.
«Лечение талидомидом или аналогом талидомида» относится к любому терапевтическому лечению, предусматривающему стадию введения талидомида или аналога талидомида соответственно.
«Хроническое» введение относится к непрерывному введению средства или средств в противоположность «острому» введению, чтобы поддержать начальный терапевтический эффект (активность) длительное время.
«Прерывистое» введение представляет собой лечение, которое проводится не непрерывно, а циклично.
Введение «в комбинации с» одним или более дополнительными терапевтическими средствами включает одновременное и последовательное введение терапевтических средств в любом порядке.
«Эффективное количество» терапевтического средства, как раскрыто в данном документе, является количеством, достаточным для выполнения конкретно сформулированной цели. «Эффективное количество» может быть определено эмпирически и рядом способов, относящихся к сформулированной цели.
Термин «терапевтически эффективное количество» относится к количеству терапевтического средства по настоящему изобретению, эффективно «лечащего» заболевание или расстройство у млекопитающего (также называемого пациентом). В случае рака терапевтически эффективное количество лекарственного средства может уменьшить число раковых клеток; уменьшить размер опухоли; ингибировать (то есть до некоторой степени замедлить, а предпочтительно остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть до некоторой степени замедлить, а предпочтительно остановить) метастазирование опухоли; ингибировать до некоторой степени рост опухоли; и/или уменьшить до некоторой степени один или более симптомов, связанных с раком. См. определение в данном документе термина «лечение». В зависимости от того, предупреждает ли лекарственное средство рост и/или уничтожает существующие раковые клетки, его можно отнести к цитостатическому и/или цитотоксическому. Терапевтически эффективное количество может быть количеством, подавляющим рост, или цитотоксическим количеством в зависимости от терапевтического средства и заболевания, подвергаемого лечению.
«Лечение» или «облегчение» относится к терапевтическим мероприятиям, при которых у объекта предупреждают или замедляют (уменьшают) целевое патологическое состояние или расстройство. Те, которым необходимо лечение, включают тех, у кого расстройство уже имеется, а также тех, которые склонны к развитию расстройства, или тех, у которых необходимо предупредить развитие расстройства. Эти термины указывают, что терапевтическое и профилактическое применение в данном документе считаются успешными, если они ослабляют, уменьшают или облегчают симптомы, осложнения или другие проблемы, связанные с заболеванием, или уменьшают или снижают вероятность появления или частоту симптомов, осложнений или других проблем, связанных с заболеванием.
«Подавляющее рост количество» терапевтического средства по настоящему изобретению является количеством, способным ингибировать рост клеток, особенно опухолевых, например раковых клеток in vitro или in vivo. «Подавляющее рост количество» терапевтического средства по настоящему изобретению для целей ингибирования роста опухолевых клеток можно определить эмпирически, с помощью известных способов или примеров, приведенных в данном документе.
«Цитотоксическое количество» терапевтического средства по настоящему изобретению является количеством, способным вызывать деструкцию клетки, особенно опухолевой, например раковой клетки in vitro или in vivo. «Цитотоксическое количество» для целей ингибирования роста опухолевых клеток можно определить эмпирически и с помощью способов, известных в данной области техники.
Термин «антитело» используется в самом широком смысле и конкретно охватывает, например, одиночные моноклональные антитела (включая агонистические, антагонистические и нейтрализующие антитела), композиции антител с полиэпитопной специфичностью, поликлональные антитела, одноцепочечные антиантитела и фрагменты антител (см. ниже), при условии, что они специфично связываются с природным полипептидом и/или проявляют биологическую активность или иммунологическую активность по настоящему изобретению. Согласно одному варианту осуществления антитело связывается с олигомерной формой целевого белка, например с тримерной формой. Согласно другому варианту осуществления антитело специфично связывается с белком, причем связывание может ингибироваться моноклональным антителом по настоящему изобретению (например, осажденным антителом по настоящему изобретению и т.д.). Фраза «функциональный фрагмент или аналог» антитела относится к соединению, имеющему качественную биологическую активность, общую с антителом, к которому он относится. Например, функциональный фрагмент или аналог антитела по настоящему изобретению может быть фрагментом или аналогом, который может специфично связываться с VEGF. В одном варианте осуществления антитело может предупредить или, по существу, ослабить способность VEGF вызывать пролиферацию клеток. Термин «иммуноглобулин» (Ig) в данном документе используется взаимозаменяемо с термином «антитело».
«Выделенное антитело» представляет собой антитело, которое было идентифицировано и отделено и/или выделено из компонента своей природной среды. Загрязняющими компонентами природной среды являются вещества, которые могли бы препятствовать диагностическому или терапевтическому использованию антитела; они могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело будет очищено 1) до более 95 мас.% антитела, что определяется способом Lowry, и наиболее предпочтительно до более 99 мас.%, 2) в известной степени, достаточной для получения по меньшей мере 15 остатков, относящихся к N-концу или внутренней аминокислотной последовательности, при помощи секвенатора с вращающейся чашей или 3) до однородности путем SDS-PAGE (ДСН-ПААГ) при восстанавливающих или невосстанавливающих условиях с использованием синего Кумасси или, предпочтительно, серебрения. Выделенное антитело включает антитело in situ внутри рекомбинантных клеток, поскольку в таком случае будет отсутствовать по меньшей мере один компонент природной среды антитела. Однако, как правило, выделенное антитело будет получено в ходе по меньшей мере одной стадии очистки.
Основная 4-цепочечная единица антитела представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей (антитело IgM состоит из 5 основных гетеротетрамерных единиц наряду с дополнительным полипептидом, называемым J-цепью, и поэтому содержит 10 антигенсвязывающих участков, в то время как секретируемые антитела IgA могут полимеризироваться с образованием поливалентных скоплений, содержащих 2-5 основных 4-цепочечных единиц наряду с J-цепью). В случае IgG 4-цепочечная единица обычно имеет молекулярную массу приблизительно 150000 дальтон. Каждая L-цепь связана с H-цепью одним ковалентным дисульфидным мостиком, в то время как две H-цепи связаны друг с другом одним и более дисульфидными мостиками в зависимости от изотипа Н-цепи. Каж