Полипептидный комплекс, содержащий непептидильный полимер, обладающий тремя функциональными концами
Иллюстрации
Показать всеИзобретение относится к области биохимии. Представлен белковый комплекс с улучшенными активностью длительного действия и биостабильностью, содержащий физиологически активный полипептид, Fc-домен иммуноглобулина и непептидильный полимер, обладающий тремя функциональными концами. Раскрыт способ получения белкового комплекса, состоящего из физиологически активного полипептида, Fc-домена иммуноглобулина и непептидильного полимера, обладающего тремя функциональными концами. Представлена фармацевтическая композиция, содержащая эффективное количество указанного белкового комплекса, обладающая улучшенной устойчивостью in-vivo физиологически активного полипептида. Изобретение позволяет получить белковый комплекс с улучшенными активностью длительного действия и биостабильностью. 4 н. и 20 з.п. ф-лы, 3 ил., 4 табл., 9 пр.
Реферат
Область техники
Настоящее изобретение относится к белковому комплексу физиологически активного полипептида с димерным белком, обеспечивающему длительно действующую активность. Более конкретно, настоящее изобретение относится к белковому комплексу, в котором физиологически активный полипептид и димерный белок связаны с непептидильным полимером, обладающим тремя функциональными концами (3 плечами), посредством соответствующей ковалентной связи, и к способу его получения.
Уровень техники
Из-за низкой стабильности полипептиды, как правило, подвержены денатурации и деградации протеазами и теряют свою активность. С другой стороны, пептиды являются относительно небольшими по размеру, так что они легко выделяются через почки.
Чтобы поддерживать их желательный уровень концентраций в крови и титры, таким образом, белковые лекарственные средства, содержащие полипептиды или пептиды в качестве активных ингредиентов, необходимо вводить часто. Однако, поскольку белковые лекарственные средства существуют, по большей части, в форме, подходящей для инъекций, для поддержания соответствующих уровней в крови физиологически активных полипептидов или пептидов необходимы частые инъекции, вызывающие значительную боль у пациента. Чтобы преодолеть эти проблемы, предприняты попытки обеспечения максимальных лечебных эффектов посредством увеличения стабильности белковых лекарственных средств в крови и посредством поддержания высоких уровней лекарственного средства в крови в течение длительного периода времени. Необходимо, чтобы эти средства для долговечности белковых лекарственных средств не только увеличивали стабильность белковых лекарственных средств и поддерживали достаточные титры самих лекарственных средств, но также не вызывали иммунных ответов у пациентов.
Общепринятым образом высокорастворимые полимеры, такие как полиэтиленгликоль (PEG), химически прививают на поверхность белков с целью стабилизации белков, предотвращая контактирование протеаз с белками и супрессируя потерю пептидов малого размера в почках. Привитый к специфическому участку или к множеству различных участков белков PEG является применимым для стабилизации и предотвращения гидролиза белков без создания заслуживающих внимания побочных эффектов. Кроме того, привитый PEG увеличивает молекулярную массу белков, таким образом ограничивая потерю белков в почках и поддерживая физиологическую активность белков.
Например, в WO 2006/076471 описано применение натрийуретического пептида B-типа (BNP) в лечении застойной сердечной недостаточности. BNP связывается с рецептором A натрийуретического пептида (NPR-A) для запуска синтеза cGMP, таким образом уменьшая артериальное кровяное давление. Описано, что при пегилировании BNP продлевается его физиологическая активность на длительный период времени. В патенте США № 6924264 описано также увеличение периода активности эксендина-4 посредством прививки PEG на остаток лизина.
Чтобы увеличить его физиологическую активность, лекарственный полипептид присоединяют к обоим концам PEG для формирования бис-конъюгата (Патент США № 5738846). С другой стороны, два различных лекарственных белка присоединяют к соответствующим концам PEG для формирования белкового комплекса, обладающего двумя различными видами физиологической активности (WO 92/16221). Однако не обнаружено значимости этих белковых лекарственных средств в отношении поддержания активности.
Опубликовано также, что увеличена стабильность слитого белка, в котором G-CSF и альбумин человека присоединены к одному PEG (Kinstler et al. Pharmaceutical Research 12(12): 1883-1888, 1995). Однако обнаружено, что у модифицированного лекарственного средства со структурой G-CSF-PEG-альбумин время удержания увеличено только приблизительно в четыре раза по сравнению с природными лекарственными средствами отдельно, и время полужизни в сыворотке только слабо увеличено. Таким образом, модифицированное лекарственное средство не применяют на практике в качестве долговечного средства.
При соединении с PEG пептиды становятся настолько стабильными, чтобы продлить свою персистенцию in vivo. Однако при придании высокой молекулярной массы PEG делает титр физиологически активного пептида значительно низким и уменьшает реакционную способность по отношению к пептидам, приводя к низкому выходу.
Альтернативно, для увеличения стабильности физиологически активных белков in vivo прибегают к генной рекомбинации. Ген, кодирующий белок, высокостабильный в крови, связывают с геном, кодирующим интересующий физиологически активный белок, с последующей трансформацией клеток животных, которые затем культивируют для продукции слитого белка.
Например, слитый белок, в котором альбумин или его фрагмент, известный как наиболее эффективный для стабилизации белков к настоящему времени, слит с физиологически активным интересующим белком (WO 93/15199 и 93/15200, публикация EP № 413622). А также у слитого белка из интерферона альфа и альбумина, продуцируемого в Human Genome Sciences (торговое наименование: Альбуферон) увеличено время полужизни в сыворотке от 5 часов до 93 часов, но он страдает критическим недостатком уменьшения биологической активности до менее чем 5% активности наивного интерферона (Osborn et al., J. Phar. Exp. Ther. 303(2): 540-548, 2002).
Что касается пептидов, их модификации упомянуты в WO 02/46227, где описано, что GLP-1, эксендин-4 и их аналоги сливают с человеческим сывороточным альбумином или фрагментами иммуноглобулина (Fc) с использованием способов генетической рекомбинации, и в Патенте США № 6756480, где описаны слитые белки из паратиреоидного гормона (PTH) или его аналогов и фрагментов иммуноглобулина (Fc). Этими способами можно преодолевать низкий выход пегилирования и неспецифичность, но они обладают теми недостатками, что время полужизни в сыворотке не является значительно увеличенным, и в некоторых случаях приводят к низким титрам. Различные пептидные линкеры используют для максимального увеличения времени полужизни в сыворотке, но они обладают высокой способностью вызывать иммунные ответы. При введении пептид, обладающий дисульфидной связью, такой как BNP, с высокой вероятностью индуцирует неправильное сворачивание и таким образом его трудно применять.
Известно также, что другие различные слитые белки получают присоединением Fc-домена иммуноглобулина к интерферону (Публикация патента Кореи № 2003-9464), рецептору интерлейкина-4, рецептору интерлейкина-7 или рецептору эритропоэтина (Патент Кореи № 249572) посредством генетической рекомбинации. В Патентной публикации PCT № WO 01/03737 описан слитый белок, в котором цитокин или фактор роста присоединен посредством олигопептидного линкера к Fc-фрагменту иммуноглобулина. В патенте США № 5116964 описан LHR (гликопротеин поверхности клеток лимфоцитов) или белок CD4, который сливают с N- или C-концом Fc-домена иммуноглобулина с использованием способа генетической рекомбинации. А также в Патенте США № 5349053 описан слитый белок, в котором IL-2 присоединен к Fc-домену иммуноглобулина. Описано множество других слитых с Fc белков, сконструированных с использованием способов генетической рекомбинации, примеры которых включают в себя слитый белок из Fc-домена иммуноглобулина с интерфероном-бета или его производное (Патентная публикация PCT № WO 00/23472), Fc-домена иммуноглобулина с рецептором IL-5 (Патент США № 5712121), Fc-домена иммуноглобулина G4 с интерфероном альфа (Патент США № 5723125) и Fc-домена иммуноглобулина G2 с белком CD4 (Патент США № 6451313). С другой стороны, в Патенте США № 5605690 объяснено применение модифицированного Fc-домена иммуноглобулина для продукции слитых белков. Например, Fc иммуноглобулина с аминокислотными остатками, модифицированными, в частности, до участков связывания комплемента или до участков связывания рецептора, используют для получения слитого белка TNFR-Fc IgG1 с использованием способа генетической рекомбинации. Другие слитые белки с модифицированным Fc-доменом иммуноглобулина, полученные с использованием способов генетической рекомбинации, описаны в Патентах США № 6277375, 6410008 и 6444792.
Иммуноглобулины функционируют как антитела, вызывая антителозависимую клеточную цитотоксичность (ADCC) или комплементзависимую цитотоксичность (CDC), и опубликовано, что цепи сахара, присутствующие в Fc-домене иммуноглобулина, играют важную роль в ADCC и CDC (Burton D., Molec. Immun. 22, 161-206, 1985). Известно, что иммуноглобулины сами по себе, свободные от цепей сахаров, обладают сходством по времени полужизни в сыворотке с иммуноглобулинами, обладающими цепями сахаров, но обладают 10-1000-кратным уменьшением силы связывания комплемента и силы связывания рецептора (Waldmann H., Eur. J. Immunol. 23, 403-411, 1993; Morrison S., J. Immunol. 143, 2595-2601, 1989).
В Патенте США № 6660843 описано слияние Fc-домена с интересующим пептидом посредством линкера и продукция слитого белка в E. coli с использованием способа генной рекомбинации. В случае использования для получения комплексов линкер позволяет отбор участков конъюгации между двумя интересующими белками и их ориентацию и позволяет получение комплексов в форме гомогенных или гетерогенных мономеров, димеров или мультимеров. Кроме того, при использовании этого способа можно получать комплексы с более низкой стоимостью, чем при использовании клеток млекопитающих. Кроме того, можно получать комплексы в свободных от цепей сахаров формах. Однако из-за одновременной продукции интересующего белка и Fc-домена иммуноглобулина в E. coli этот способ сложно применять к белку-мишени, когда природная форма белка-мишени обладает цепью сахаров. Принимая преимущества телец включения, этот способ сильно подвержен индукции неправильного сворачивания. В слитых с Fc белках, полученных с использованием способов генетической рекомбинации, слияние возможно только в конкретных участках, то есть на N- или C-конце Fc-домена иммуноглобулина. Слитые с Fc белки экспрессируются только в формах гомогенных димеров, но не в мономерных формах. Кроме того, слияние возможно только между гликозилированными белками или между агликозилированными белками, но невозможно между гликозилированными белками и агликозилированными белками. Если оно присутствует, аминокислотная последовательность, вновь сформированная в результате слияния, может индуцировать иммунный ответ. Более того, линкер может являться чувствительным к ферментативной деградации.
При разработке слитых белков с использованием Fc-доменов иммуноглобулинов нигде в предшествующих публикациях не предпринимали попыток получить комплексы белков-мишеней с природным Fc человека посредством сшивающего агента. Fc-домены иммуноглобулинов можно получать в клетках млекопитающих или E. coli с использованием способов генетической рекомбинации, но нигде в предшествующих публикациях не предпринимали попыток получить только природные Fc-домены иммуноглобулинов, свободные от белков-мишеней, с высоким выходом и переводить их в долговечные формы. Кроме того, не предпринимали попыток получить комплексы рекомбинантного Fc иммуноглобулина с белками-мишенями посредством сшивающих агентов.
Как таковые, множество различных способов осуществляли для конъюгации физиологически активных полипептидов с полимерами. В общепринятых способах можно улучшать стабильность полипептидов, но со значительным уменьшением активности или можно улучшать активность независимо от стабильности. Таким образом, все еще существует необходимость способа для увеличения стабильности белковых лекарственных средств с минимальным уменьшением индуцированной модификацией активности.
В этом контексте авторы настоящего изобретения разработали белковый комплекс с высокой активностью, время полужизни в сыворотке которого улучшено посредством присоединения иммуноглобулина и физиологически активного полипептида соответственно к противоположным концам непептидильного линкера, как описано в Патентах Кореи № 10-0725315 и 10-0775343, полное содержание которых приведено в качестве ссылки.
Белковый комплекс, в котором иммуноглобулин и физиологически активный полипептид соответственно присоединены к противоположным концам непептидильного линкера, общепринятым образом получают присоединением непептидильного полимера предпочтительно к физиологически активному полипептиду и затем к Fc-домену иммуноглобулина. Однако этот общепринятый способ приводит к множеству нежелательных загрязнений, кроме того, приводит к потере большого количества физиологически активного полипептида. То есть общепринятый способ является экономически невыгодным при его промышленном применении, и полученный комплекс необходимо очищать до некоторой степени сложным способом. В случае когда физиологически активный полипептид присутствует в форме димера, он образует форму мостика с непептидильным полимером на обоих концах, так что он не может образовывать комплекс с Fc иммуноглобулина или может образовывать комплекс, но с очень низким выходом. С другой стороны, когда Fc-домен иммуноглобулина сначала присоединяют к непептидильному полимеру, также возникают сходные проблемы. Поскольку Fc иммуноглобулина представляет собой гомодимер с двумя N-концами в близком соседстве друг с другом, соответствующие связи формируются между двумя N-концами Fc иммуноглобулина и противоположными концами непептидильного полимера с образованием формы мостика, так что не остается функциональных концов для реакции с физиологически активным полипептидом. Соответственно, выход продукции значительно уменьшается.
Описание изобретения
Техническая проблема
Приведшие к настоящему изобретению интенсивные и тщательные исследования белковых комплексов, проводимые авторами настоящего изобретения, имеющие целью преодоление проблем, встречающихся в предшествующей области техники, привели к обнаружению того, что применение непептидильного полимера с 3 плечами в качестве линкера для получения белкового комплекса, состоящего из димерного белка и физиологически активного полипептида, предотвращает потери физиологически активного полипептида со значительным увеличением выхода продукции, позволяет очистку комплекса простым способом и придает структурную стабильность белковому комплексу с удлинением времени полужизни в сыворотке при сохранении в то же самое время его биологической активности.
Решение проблемы
Таким образом, целью настоящего изобретения является предоставление белкового комплекса, в котором физиологически активный полипептид, непептидильный полимер с 3 плечами и димерный белок связаны ковалентной связью, и способа его получения.
Другой целью настоящего изобретения является предоставление средства для продления долговечности белкового лекарственного средства, содержащего белковый комплекс, продлевающего время полужизни в сыворотке физиологически активного полипептида при сохранении его биологической активности.
Полезные эффекты изобретения
Обладая структурой, в которой физиологически активный полипептид и димерный белок присоединены к непептидильному полимеру с 3 плечами посредством ковалентных связей, белковый комплекс по настоящему изобретению может поддерживать высокую концентрацию активного полипептида в крови в течение длительного периода времени, оказывая стабильные лечебные эффекты.
Кроме того, способ получения белкового комплекса в соответствии с настоящим изобретением может значительно уменьшать количество физиологически активного полипептида, необходимого по общепринятому способу с использованием непептидильного полимера с 2 плечами и по сравнению с общепринятым способом пользуется преимуществом включения более простых способов очистки и значительного увеличения выхода продукции. В частности, персистирующие белковые комплексы с димерными, физиологически активными полипептидами предпочтительно получали с использованием способа по настоящему изобретению.
Краткое описание чертежей
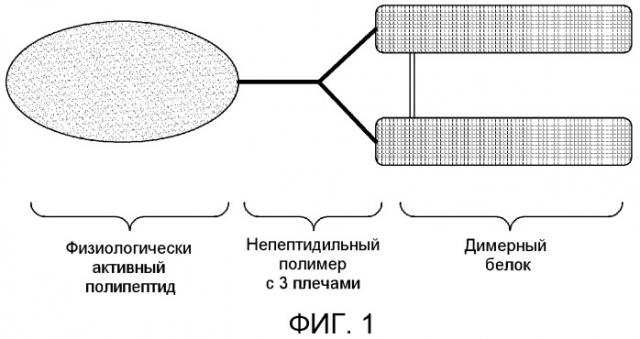
На фиг. 1 показано репрезентативное изображение белкового комплекса с использованием непептидильного полимера, обладающего тремя функциональными концами (3 плечами).
На фиг. 2 показана эффективность in vivo комплекса Fc иммуноглобулина-PEG с 3 плечами-Октреотида(N) на графиках (HM11760B: комплекс Fc иммуноглобулина-PEG с 3 плечами-Октреотида(N), Сандостатин-LAR: состав с замедленным высвобождением октреотида).
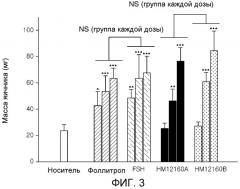
На фиг. 3 показана эффективность in vivo комплекса Fc иммуноглобулина-PEG с 3 плечами-FSH(N) (HM12160A: комплекс Fc иммуноглобулина-PEG с 2 плечами-FSH(N), HM12160B: комплекс Fc иммуноглобулина-PEG с 3 плечами-FSH(N)).
Наилучший способ осуществления изобретения
В соответствии с его аспектами настоящее изобретение относится к белковому комплексу, в котором физиологически активный полипептид и димерный белок ковалентно присоединены к непептидильному полимеру с 3 плечами.
Как применяют в настоящем документе, термин «белковый комплекс» или «комплекс» предназначен для обозначения структуры, состоящей из по меньшей мере одного физиологически активного полипептида, по меньшей мере одного непептидильного полимера с 3 плечами и по меньшей мере одного димерного белка, с соединением между ними посредством ковалентных связей. Чтобы отличать от «комплекса», термин «конъюгат» применяют в настоящем документе для обозначения структуры, в которой только пары физиологически активного полипептида, непептидильного полимера и димерного белка соединены между собой посредством ковалентной связи.
Белковый комплекс по настоящему изобретению представляет собой белковое лекарственное средство, модифицированное для увеличения его персистенции in vivo и минимального уменьшения его биологической активности. Настоящее изобретение относится к применению непептидильного полимера с 3 плечами для соединения посредством него физиологически активного полипептида и димерного белка для образования белкового комплекса, таким образом позволяя применение способа получения, посредством которого можно предотвращать потери физиологически активного полипептида, и белковый комплекс может быть настолько структурно стабильным, чтобы его можно было легко очищать.
Как применяют в настоящем документе, термин «димерный белок» обозначает белок с двумя N-концами. Предпочтительным является Fc-домен иммуноглобулина, который можно использовать в качестве носителя. Физиологически активные гомодимеры или гетеродимеры также включены в объем димерного белка.
Fc-домен иммуноглобулина является достаточно стабильным для использования в качестве носителя для лекарственного средства, поскольку он является биологически разлагаемым полипептидом, подвергающимся метаболизму in vivo. Кроме того, благодаря относительно небольшой молекулярной массе Fc-домен иммуноглобулина обладает преимуществами по сравнению с полными молекулами иммуноглобулина в отношении выделения, очистки и выхода комплекса. Кроме того, поскольку он является свободным от Fab, который очень отличается по аминокислотной последовательности между антителами, Fc сильно способствует гомогенности комплекса и, как ожидают, снижает индукцию антигенности.
Термин «Fc-домен иммуноглобулина», как применяют в настоящем документе, предназначен для обозначения константного домена 2 тяжелой цепи (CH2) и константного домена 3 тяжелой цепи (CH3), которые свободны от вариабельных доменов тяжелой и легкой цепи, константного домена 1 тяжелой цепи (CH1) и константного домена 1 легкой цепи (CL1) и могут содержать шарнирную область. Fc-домен иммуноглобулина по настоящему изобретению может представлять собой удлиненный Fc домен, дополнительно содержащий частичный или полный константный домен 1 тяжелой цепи (CH1) и/или константный домен 1 легкой цепи (CL1) и свободный от вариабельных доменов тяжелой и легкой цепи, если он обеспечивает эффект, по существу такой же или более сильный по сравнению с эффектом природной формы. Альтернативно, Fc домен может представлять собой укороченную форму CH2 и/или CH3 с отсутствием значительной части соответствующей аминокислотной последовательности. Для обобщения, Fc-домен иммуноглобулина по настоящему изобретению может представлять собой 1) CH1 домен, CH2 домен, CH3 домен и CH4 домен, 2) CH1 домен и CH2 домен, 3) CH1 домен и CH3 домен, 4) CH2 домен и CH3 домен, 5) комбинацию одного или нескольких доменов и шарнирной области иммуноглобулина (или части шарнира) или 6) димер, состоящий из каждого из константного домена легкой цепи и константного домена легкой цепи.
Кроме того, термин «Fc-домен иммуноглобулина», как применяют в настоящем документе, предназначен, чтобы включать не только природные аминокислотные последовательности, но также их мутанты. Мутант аминокислотной последовательности означает аминокислотную последовательность, отличающуюся от природной последовательности делецией, вставкой, неконсервативной или консервативной заменой одного или нескольких аминокислотных остатков или их сочетаниями. Например, аминокислотные остатки в положениях 214-238, 297-299, 318-322 или 327-331 Fc IgG, известные как играющие важную роль в связывании антитела, можно модифицировать так, чтобы использовать в качестве подходящих участков связывания. Кроме того, возможны различные мутанты, например, с отсутствием остатка, формирующего дисульфидную связь, или нескольких N-концевых аминокислот природного Fc, или с дополнительным остатком метионина на N-конце природного Fc. Кроме того, эффекторные функции можно прекращать удалением связывающего комплемент мотива, например связывающего C1q мотива, или мотива ADCC (антителозависимой опосредованной клетками цитотоксичности). Можно сделать ссылку на WO 97/34631 и WO 96/32478 относительно получения мутантов аминокислотной последовательности Fc-доменов иммуноглобулинов.
Замены аминокислот, не изменяющие активность природных белков или пептидов, в целом известны в данной области (H. Neurath, R. L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее типичные замены происходят между Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly. При необходимости, аминокислоты можно подвергать модификации, такой как фосфорилирование, сульфатирование, акрилирование, гликозилирование, метилирование, фарнезилирование, ацетилирование, амидирование и т.д.
Вышеописанные мутанты Fc, предпочтительно, представляют собой функциональные эквиваленты их природных форм, таким образом являются сходными по биологической активности с улучшением стабильности структуры по отношению к нагреванию и pH.
Fc-домен может представлять собой природную форму, выделенную из человека и других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или может являться рекомбинантным или производным из них, полученным из трансформированных клеток животных или микроорганизмов. В первом случае тотальный иммуноглобулин выделяют из людей или животных с последующей обработкой протеазой. При обработке папаином тотальный иммуноглобулин разделяют на Fab и Fc. Пепсин расщепляет тотальный иммуноглобулин на pF'c и F(ab)2. От этих фрагментов Fc или pF'c можно отделить с использованием эксклюзионной хроматографии. Предпочтительным является рекомбинантный Fc-домен иммуноглобулина, полученный из Fc-домена человека в микроорганизмах.
Fc-домен иммуноглобулина, применимый по настоящему изобретению, может обладать цепью сахаров, по длине меньшей, равной или более длинной, чем в природном Fc-домене, или может не иметь цепей сахаров. Добавление, уменьшение или удаление цепи сахаров Fc иммуноглобулина можно осуществлять с использованием общепринятого способа, такого как химический способ, ферментативный способ или способ генетической рекомбинации с использованием микроорганизма. Дегликозилированный Fc-домен иммуноглобулина обладает значительно уменьшенной силой связывания комплемента (C1q) и обладает малой или не обладает антителозависимой опосредуемой клетками цитотоксичностью или комплементзависимой цитотоксичностью и таким образом не индуцирует ненужных иммунных ответов. В этом контексте дегликозилированные или агликозилированные Fc-домены иммуноглобулинов предпочтительно соответствуют функционированию в качестве носителей лекарственного средства.
Как применяют в настоящем документе, термин «дегликозилирование» относится к ферментативному удалению цепи сахаров из природного Fc. Термин «агликозилирование» относится к отсутствию цепей сахаров в Fc-домене из-за его продукции в эукариотах и предпочтительно в E. coli.
Fc-домен иммуноглобулина может происходить из животных, включая человека, коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, при предпочтительности человеческого происхождения. Кроме того, Fc-домен иммуноглобулина, применимый по настоящему изобретению, можно получать из IgG, IgA, IgD, IgE, IgM и их комбинаций или их гибридов. Предпочтительно, его получают из IgG или IgM, которые являются более распространенными, чем другие типы иммуноглобулинов, и наиболее предпочтительно из IgG, который, как известно, продлевает время полужизни в сыворотке связывающих лиганд белков.
Кроме того, Fc-домен иммуноглобулина может существовать в форме димеров или мультимеров (комбинаций Fc иммуноглобулина), каждый из которых содержит гликозилированные иммуноглобулины, состоящие из доменов одного и того же происхождения.
Термин «комбинация», как применяют в настоящем документе, означает, что полипептиды, кодирующие одноцепочечные Fc-фрагменты иммуноглобулина одного и того же происхождения, присоединены к одноцепочечному полипептиду другого происхождения для формирования димера или мультимера. То есть димер или мультимер можно получать комбинацией двух или более фрагментов, выбранных из Fc-фрагментов Fc IgG, Fc IgA, Fc IgM, Fc IgD и Fc IgE.
Термин «гибрид», как применяют в настоящем документе, означает, что последовательности, кодирующие два или более Fc-фрагментов иммуноглобулинов различного происхождения, присутствуют в одноцепочечном Fc-фрагменте иммуноглобулина. По настоящему изобретению возможны различные гибридные формы. Например, Fc-домен состоит из от одного до четырех различных доменов, выбранных из CH1, CH2, CH3 и CH4 Fc IgG, Fc IgM, Fc IgA, Fc IgE и Fc IgD, и может содержать шарнирную область.
IgG также далее разделяют на подклассы IgG1, IgG2, IgG3 и IgG4, и их комбинации или гибриды предусмотрены по настоящему изобретению. Предпочтительным является Fc-домен IgG2 или IgG4 с наибольшим предпочтением Fc-домена IgG4, свободного от эффекторных функций, таких как комплементзависимая цитотоксичность (CDC).
Соответственно, агликозилированный Fc-домен IgG4 человека является наиболее предпочтительным носителем лекарственного средства. Fc-домен человеческого происхождения является преимущественным по сравнению с Fc-доменом не относящегося к человеку происхождения, поскольку последний может действовать как антиген в организме, индуцируя продукцию антител против него.
Настоящее изобретение относится к присоединению белкового лекарственного средства к димерному белку посредством непептидильного полимера.
По настоящему изобретению непептидильный полимер обозначает биосовместимый полимер, состоящий из двух или более повторяющихся единиц, присоединенных друг к другу посредством ковалентной связи, отличной от пептидной связи.
Общепринятые пептидильные линкеры, используемые в слитых белках, полученных посредством слияния в рамке считывания, страдают недостатком простого расщепления in vivo протеазами, что приводит к невозможности обеспечения времени полужизни в сыворотке активного лекарственного средства, настолько долгого, какое ожидают, когда носитель остается интактным. В отличие от этого полимер по настоящему изобретению является устойчивым к ферментативной деградации, поддерживая время полужизни в сыворотке лекарственного средства настолько долгим, как это обеспечивается, когда носитель остается интактным. До тех пор пока он действует, как упомянуто выше, то есть является устойчивым к протеазам in vivo, любой полимер можно использовать по настоящему изобретению без применения к нему ограничений. Молекулярная масса непептидильного полимера, применимого по настоящему изобретению, лежит в диапазоне от 1 до 100 кДа и предпочтительно от 1 до 20 кДа. Непептидильный полимер по настоящему изобретению, который конъюгируют с Fc-доменом иммуноглобулина, может представлять собой полимер или комбинацию различных полимеров.
Примеры непептидильного полимера, применимого по настоящему изобретению, включают в себя такие биоразлагаемые полимеры, как полиэтиленгликоль, полипропиленгликоль, сополимер этиленгликоля и пропиленгликоля, полиоксиэтилированный полиол, поливиниловый спирт, полисахарид, декстран, поливинилэтиловый эфир, такие биоразлагаемые полимеры, как PLA (полимолочная кислота) и PLGA (сополимер молочной и гликолевой кислот), липополимеры, хитины, гиалуроновая кислота и их комбинации с предпочтением полиэтиленгликоля. Кроме того, их производные, которые известны в данной области или которые можно легко получить с использованием общепринятого способа, включены в объем настоящего изобретения.
Непептидильные полимеры, применяемые по настоящему изобретению, обладают функциональными группами, с которыми может связываться Fc-домен иммуноглобулина и белковое лекарственное средство.
В отличие от предшествующих способов получения белкового комплекса с использованием непептидильного полимера, обладающего двумя функциональными концами (2 плечами) (Патент Кореи № 10-0725315), настоящее изобретение относится к непептидильному полимеру с 3 плечами. В отличие от общепринятого непептидильного полимера, который обладает одним функциональным концом и ответвлениями от коровой молекулы, непептидильный полимер, применимый по настоящему изобретению, обладает тремя функциональными концами, из которых два отвечают за формирование ковалентных связей с димерным белком, в то время как оставшийся один ковалентно присоединен к физиологически активному полипептиду.
Более подробно, поскольку Fc иммуноглобулина представляет собой гомодимер с двумя N-концами в близком соседстве друг с другом, соответствующие связи формируются между двумя N-концами Fc иммуноглобулина и противоположными концами непептидильного полимера. Таким образом, когда непептидильный полимер с 2 плечами сначала формирует ковалентные связи с Fc-доменом иммуноглобулина, не остается функциональных концов, которые могут вступать в реакцию с физиологически активным полипептидом, что приводит к значительному уменьшению выхода продукции. Таким образом проводят реакцию физиологически активного полипептида до непептидильного полимера с 2 плечами с Fc-доменом иммуноглобулина. Однако, когда предварительно проводят реакцию с физиологически активным полипептидом, образуется множество нежелательных примесей, таким образом приводя к потере физиологически активного полипептида. В отличие от этого является возможным проводить реакцию непептидильного полимера с 3 плечами с Fc-доменом иммуноглобулина до реакции с физиологически активным полипептидом, поскольку два из трех его функциональных концов отвечают за два N-конца Fc иммуноглобулина, в то время как оставшийся его функциональный конец может нацеливаться на физиологически активный полипептид. Таким образом можно получать белковый комплекс с высоким выходом. На практике обнаружили, что выход продукции увеличивается в два-девять раз по сравнению с применением непептидильных полимеров с 2 плечами.
Три концевых функциональных группы непептидильного полимера могут связываться с N-концом свободными остатками лизина, гистидина или цистеина Fc-домена иммуноглобулина и физиологически активного полипептида.
Предпочтительно, три концевые функциональные группы непептидильных полимеров выбирают из альдегидных групп, пропиональдегидных групп, бутилальдегидных групп, малеинимидных групп и сукцинимидных производных. Примеры сукцинимидных производных, применимых по настоящему изобретению, включают в себя сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил и сукцинимидилкарбонат. Предпочтительными являются альдегидные группы. При присутствии на трех концах непептидильного полимера реакционноспособные альдегидные группы могут минимизировать неспецифические реакции и являются эффективными для формирования связей между физиологически активным полипептидом и димерным белком. Кроме того, конечный продукт, образованный посредством восстановительного алкилирования с помощью альдегида, является намного более стабильным, чем продукт, образованный с помощью амидных связей. Как правило, альдегидные функциональные группы избирательно реагируют с N-концами при низком pH, в то время как формируют ковалентную связь с остатком лизина при высоком pH, например pH 9,0. Три концевые функциональные группы непептидильного полимера могут являться одинаковыми или отличающимися друг от друга.
В соответствии с настоящим изобретением конъюгат димерного белка с непептидильным полимером присоединяют к физиологически активному полипептиду с формированием белкового комплекса.
В настоящем документе термин «физиологически активный полипептид», «физиологически активный белок», «активный белок», «активный полипептид» или «белковое лекарственное средство» обозначает полипептид, пептид или белок, обладающие некоторой антагонистической активностью против физиологического события in vivo, и эти термины можно использовать взаимозаменяемо.
Физиологически активные полипептиды, применимые в белковом комплексе по настоящему изобретению, можно проиллюстрировать примерами гормонов, цитокинов, интерлейкинов, связывающих интерлейкин белков, ферментов, антител, факторов роста, факторов транскрипции, факторов крови, вакцин, структурных белков, белков-лигандов, рецепторов, антигенов поверхности клеток, антагонистов рецепторов и их производных или аналогов.
Конкретные примеры физиологически активных полипептидов, применимых по настоящему изобретению, включают в себя человеческие гормоны роста, высвобождающие гормон роста гормоны, высвобождающие гормон роста пептиды, интерфероны и рецепторы интерферона (например, интерферон-α, -β и -γ, растворимые рецепторы интерферона типа I), колониестимулирующие факторы, глюкагоноподобные пептиды (GLP-1 и т.д.), пептиды эксендина-4, ANP, BNP, CNP, DNP, связанные с G-белком рецепторы, интерлейкины (например, интерлейкин-1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12, -13, -14, -15, -16, -17, -18, -19, -20, -21, -22, -23, -24, -25, -26, -27, -28, -29, -30) и рецепторы интерлейкина (например, рецептор IL-1, рецептор IL-4 и т.д.), ферменты (например, глюкоцереброзидаза, идуронат-2-сульфатаза, α-галактозидаза-A, α-L-идуронидаза, бутирилхолинэстераза, хитиназа, глутаматдекарбоксилаза, имиглюцераза, липаза, уриказа, ацетилгидролаза фактора активации тромбоцитов, нейтральная эндопептидаза, миелопероксидаза и т.д.), связывающие интерлейкины и цитокины белки (например, IL-18bp, связывающий TNF белок и т.д.), факторы активации макрофагов, пептиды макрофагов, факторы B-клеток, факторы T-клеток, белок A, ингибиторы аллергии, гликопротеины некроза клеток, иммунотоксины, лимфотоксины, фактор некроза опухоли, супрессоры опухолей, трансформирующий фактор роста, антитрипсин альфа-1, альбумин, α-лактальбумин, аполипопротеин-E, эритропоэтин, гликозилированный эритропоэтин, ангиопоэтины, гемоглобин, тромбин, активирующие рецепторы тромбина пептиды, тромбомодулин, фактор крови VII, VIIa, VIII, IX и XIII, активаторы плазминогена, связывающие фибрин пептиды, урокиназа, стрептокиназа, гирудин, белок C, C-реактивный белок, ингибитор ренина, ингибитор коллагеназы, супероксиддисмутаза, лептин, тромбоцитарный фактор роста, эпителиальный фактор роста, эпидермальный фактор роста, ангиостатин, ангиотензин, фактор роста кости, стимулирующий рост костей белок, кальцитонин, инсулин, соматостатин, октреотид (агонист соматостатина), атриопептин, индуцирующий образование хряща фактор, элкатонин, фактор активации соединительной ткани, ингибитор пути тканевого фактора, фолликулостимулирующий гормон, лютеинизирующий гормон, гормон, высвобождающий лютеинизирующий гормон, факторы роста нервной ткани (например, фактор роста нервной ткани,