Способ оптимизации лечения лейкоза, положительного по филадельфийской хромосоме, ингибиторами ab1-тирозинкиназы
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и может быть использована для лечения лейкоза, положительного по филадельфийской хромосоме (лейкоза Ph+). Способ лечения хронического миелоидного лейкоза (ХМЛ) или острого лимфобластического лейкоза, положительного по филадельфийской хромосоме (Ph+ALL), в группе пациентов-людей включает стадии: (а) введения предварительно определенного фиксированного количества иматиниба или его фармацевтически приемлемой соли пациентам-людям, нуждающимся в этом, (б) отбора по меньшей мере одного образца крови у указанных пациентов в течение первых трех месяцев лечения, (в) определения минимального уровня в плазме (Смин) иматиниба и (г) подбора дозы иматиниба или его фармацевтически приемлемой соли, таким образом, чтобы величина Смин между 1000 нг/мл и 3000 нг/мл была достигнута у каждого пациента, у которого пороговая величина Смин 1000 нг/мл не была достигнута до подбора дозы. Группа изобретений включает также применение иматиниба или его фармацевтически приемлемой соли для получения лекарственного средства для лечения лейкоза Ph+. Группа изобретений позволяет минимизировать или избежать формирования устойчивости, потери эффективности и риска возникновения рецидива у людей-пациентов с ХМЛ или лейкозом Ph+ALL, которых лечат иматинибом или его фармацевтически приемлемой солью. 3 н. и 11 з.п. ф-лы, 8 ил., 2 табл., 2 пр.
Реферат
Настоящее изобретение относится к способу лечения лейкоза, положительного по филадельфийской хромосоме (лейкоза Ph+) в группе пациентов. В частности, настоящее изобретение относится к способу лечения хронического миелоидного лейкоза (ХМЛ) в группе пациентов.
При ХМЛ взаимно сбалансированная хромосомная транслокация в кроветворных стволовых клетках (КСК) приводит к формированию гибридного гена BCR-ABL. Этот ген кодирует онкогенный гибридный белок Bcr-Abl. ABL кодирует жестко регулируемую протеинтирозинкиназу, которая играет фундаментальную роль в регуляции пролиферации клеток, адгезии и апоптозе, а BCR-ABL гибридный ген кодирует конститутивно активированную киназу, которая трансформирует КСК для получения фенотипа, проявляющего разрегулированную клональную пролиферацию, пониженную способность к адгезии на строме костного мозга, снижает апоптический ответ на мутагенный стимул, что способствует накоплению постепенно становящихся более злокачественными трансформаций. Образуемые гранулоциты не могут развиться в зрелые лимфоциты и попадают в кровеносное русло, что приводит к дефициту зрелых клеток и повышенной чувствительности к инфекции. Были описаны АТФ-конкурентные ингибиторы Bcr-Abl, которые предохраняют киназу от активирования митогенного и антиапоптического метаболических путей (например, киназа Р-3 и STAT5), приводящие к гибели клеток с фенотипом BCR-ABL и, в результате, обеспечивают эффективную терапию против ХМЛ.
В мае 2001 года соль N-{5-[4-(4-метилпиперазинометил)бензоиламидо]-2-метилфенил-4-(3-пиридил)-2-пиримидинамин мезилат (иматиниб мезилат, STI571, продукт Glivec®) была одобрена Управлением по контролю за продуктами и лекарствами США (FDA) для лечения ХМЛ у пациентов, которых не удается лечить интерфероном-альфа (IFN). Уже в июне 2000 года первые пациенты с ХМЛ были включены в международное рандомизированное исследование интерферона и STI571 (International Randomized Study of Interferon and STI571 - IRIS). Амбициозная третья фаза исследования была уникальна и по размеру, и по области охвата. Было исследовано более 1000 пациентов в 16 странах для проведения теснейшего сопоставления между продуктом Glivec® и интерфероном-альфа (S.G.O'Brien, F.Guilhot, R.A.Larson и др., N.Engl. J. Med. 348, 2003, cc. 994-1004). Иматиниб в суточной дозе 400 мг проявляет большую эффективность по сравнению с IFN+Ara-C для вновь диагностированных пациентов с ХМЛ в хронической фазе (ХМЛ-ХФ). Ранее полученные в ходе пятилетних исследований данные по программе IRIS показали установленную кумулятивную скорость полного цитогенетического ответа (ПЦО) у 87% пациентов, получавших первичное лечение иматинибом, и среднее выживание 89% (Druker B.J., Guilhot F., O'Brien S.G. и др. N. Engl. J. Med. 355, 2006, cc.2408-2417). Отмечено, что среди пациентов, достигших ПЦО и главного молекулярного ответа (ГМО) на протяжении 18 месяцев от начала лечения, не было таких, у которых к 60 месяцу было бы прогрессирование болезни до ускоренной или бластической фазы.
По настоящее время причина вариабельности ответов на иматиниб мезилат при лечении хронического ХМЛ в полной мере не установлена. Предшествующие исследования были сосредоточены на клеточных механизмах устойчивости к иматинибу. Хотя фармакокинетический мониторинг широко применяют в разных разделах медицины, например неврологии, кардиологии и психиатрии, его редко применяют в клинической онкологической практике. Фармакокинетические исследования пациентов с ХМЛ, подвергаемых лечению иматинибом мезилатом, показали, что концентрации иматиниба в плазме на протяжении времени применения иматиниба коррелируют с дозой иматиниба мезилата, а масса тела или площадь поверхности тела имеют небольшое значение. Peng и др. определяли концентрацию иматиниба в плазме и установили режим применения иматиниба по показателям концентрации в плазме (Peng В., Hayes M., Resta D. и др. J. Clin. Oncol. 22, 2004, cc.935-942). Mahon и др. (Blood, 106, 2005, с.565А) измеряли концентрацию иматиниба в крови при поддержке режима лечения.
Настоящее изобретение относится к способу, позволяющему минимизировать или избежать формирования устойчивости, потери эффективности и риска возникновения рецидива у людей-пациентов с ХМЛ, которых лечат ингибитором Bcr-Abl тирозинкиназы. Основываясь на результатах исследований, проведенных в Университете Бордо и по программе IRIS, по корреляции фармакокинетических данных с цитогенетическим и молекулярным ответами у вновь диагностированных пациентов с ХМЛ в хронической фазе (ХМЛ-ХФ), неожиданно было установлено, что лечение ХМЛ с применением ингибитора тирозинкиназы Bcr-Abl может быть оптимизировано подбором дозы ингибитора тирозинкиназы Bcr-Abl для конкретного пациента таким образом, что специфический минимальный уровень в плазме (Смин) достигается у каждого отдельного пациента. Индивидуальный подбор дозы для каждого пациента необходим, учитывая высокую степень индивидуальной вариабельность величины Смин при введении одной и той же дозы ингибитора Bcr-Abl тирозинкиназы разным пациентам, установленную в исследовании IRIS. Настоящее изобретение предусматривает в первую очередь схемы индивидуального лечения для отдельных пациентов с ХМЛ, основанные на пониженном пороге Смин, поскольку было установлено, что этот параметр коррелирует с повышенным уровнем выживания.
ХМЛ относится к группе Ph+ лейкозов. Результаты, полученные на группе пациентов с ХМЛ и описанные в настоящем изобретении, могут быть непосредственно перенесены на всю группу лейкозов Ph+. Это связано с тем, что для лейкозов группы Ph+ свойственно наличие филадельфийской хромосомы, приводящей к образованию гибридного белка Bcr-Abl. Этот белок является мишенью всех ингибиторов Bcr-Abl.
Аббревиатура «Ph+ALL» в контексте настоящего изобретения означает острый лимфобластический лейкоз при наличии филадельфийской хромосомы (Philadelphia chromosome positive acute lymphoblastic leukemia).
Понятие «главный молекулярный ответ (ГМО)» в контексте настоящего изобретения означает снижение на три порядка транскриптов BCR-ABL, подсчитанных в периферической крови, используя реального времени количественную обратной транскриптазы полимеразную цепную реакцию, предпочтительно через 12 месяцев лечения, например 12 месяцев лечения иматинибом мезилатом.
Понятие «полный цитогенный ответ (ПЦО)» в контексте настоящего изобретения означает 0% филадельфийской хромосомы на стадии метафазы по меньшей мере в 20-25 клетках на стадии метафазы в аспирате костного мозга (Colombat M., Fort M.P., Chollet С. и др. Haematologica, 91, 2006, сс.162-168).
Понятие «способ лечения» в контексте настоящего изобретения означает также способ предупреждения заболеваний, указанных в настоящем изобретении, т.е. профилактическое введение фармацевтической композиции, включающей ингибитор Bcr-Abl тирозинкиназы, здоровым пациентам для предупреждения развития заболеваний, указанных в настоящем изобретении.
Понятия «подбор дозы» и «подобранная доза» в контексте настоящего изобретения предпочтительно означает, что соответствующую дозу повышают или понижают. В более широком смысле в настоящем изобретении понятия «подбор дозы» и «подобранная доза» также предусматривают ситуацию, при которой доза остается неизменной.
Понятие «ингибитор Bcr-Abl тирозинкиназы» в контексте настоящего изобретения означает органические соединения, которые проявляют ингибирование с-Abl или Bcr-Abl из лизатов трансфецированных клеток с величиной IC50 менее 0,1 мкМ в исследованиях киназы in vitro, выполненных на иммунопреципитатах в исследовании, описанном B.J.Druker и др. Nat. Med. 2, 1996, cc.561-566.
Таким образом, в широком смысле слова, настоящее изобретение относится к способу лечения лейкоза Ph+, например, ХМЛ или Ph+ALL, в группе пациентов, включающему стадии:
(а) введения предварительно установленного фиксированного количества ингибитора Bcr-Abl тирозинкиназы или его фармацевтически приемлемой соли людям, больным лейкозом Ph+,
(б) отбора по меньшей мере одного образца крови у указанных пациентов,
(в) определения самого низкого уровня в плазме (Смин) ингибитора тирозинкиназы Bcr-Abl или его метаболита, а также степеней ГМО,
(г) оценки разделяющего потенциала самых низких концентраций ГМО в плазме и выявления пороговой величины Смин для оптимальной чувствительности и специфичности, например, с помощью анализа характеристической кривой (Receiver Operating Characteristic - ROC-кривой), и
(д) подбора дозы ингибитора тирозинкиназы Bcr-Abl или его фармацевтически приемлемой соли, применяемой для конкретных пациентов из указанной группы пациентов и, необязательно, для будущих пациентов с лейкозом Ph+ таким образом, чтобы величина Смин у каждого отдельного пациента равнялась или превышала пороговую величину Смин, установленную на стадии (г).
Точнее настоящее изобретение относится к способу лечения ХМЛ в группе людей, включающему стадии:
(а) введения предварительно установленного фиксированного количества ингибитора тирозинкиназы Bcr-Abl или его фармацевтически приемлемой соли людям-пациентам, больным ХМЛ, нуждающимся в этом,
(б) отбора по меньшей мере одного образца крови у указанных пациентов,
(в) определения величины Смин ингибитора тирозинкиназы Bcr-Abl или его метаболита, а также степеней ГМО,
(г) оценки разделяющего потенциала самых низких концентраций ГМО в плазме и выявления пороговой величины Смин для оптимальной чувствительности и специфичности, например, с помощью анализа характеристической кривой (ROC-кривой), и
(д) подбора дозы ингибитора тирозинкиназы Bcr-Abl или его фармацевтически приемлемой соли, применяемой для конкретных пациентов из указанной группы пациентов и, необязательно, для будущих пациентов с ХМЛ таким образом, чтобы величина Смин у каждого отдельного пациента равнялась или превышала пороговую величину Смин, установленную на стадии (г).
С помощью описанной выше методологии установлено, что пороговое значение Смин для ингибитора тирозинкиназы Bcr-Abl иматиниба может составлять примерно 800 нг/мл, более предпочтительно примерно 1000 нг/мл. Верхний предел уровня в плазме соответствует уровню, который ниже, но близко прилегает к уровню в крови, вызывающему доза-предельную токсичность (ДПТ) у отдельного пациента. Обычно наблюдаемый верхний предел составляет примерно 3500 нг/мл, иногда примерно 3000 нг/мл.
Таким образом, согласно еще одному из объектов настоящее изобретение связано со способом лечения лейкоза Ph+, особенно ХМЛ или Ph+ALL, у пациента, включающим стадии:
(а) введения предварительно установленного фиксированного количества иматиниба или его фармацевтически приемлемой соли, например пероральной суточной дозой 400 мг или 800 мг соли иматиниба мономезилата, людям-пациентам, больным лейкозом Ph+,
(б) отбора по меньшей мере одного образца крови у указанного пациента, например, в течение первых 12 месяцев лечения,
(в) определения величины Смин иматиниба, и
(г) подбора дозы иматиниба или его фармацевтически приемлемой соли таким образом, чтобы величина Смин у указанного пациента достигала по меньшей мере примерно 800 нг/мл, особенно примерно от 800 до примерно 3500 нг/мл, предпочтительно величина Смин достигает от 1000 до примерно 3000 нг/мл иматиниба.
В широком смысле слова настоящее изобретение предусматривает способ лечения лейкоза Ph+, особенно ХМЛ или Ph+ALL, у человека-пациента, причем дозу иматиниба или его фармацевтически приемлемой соли подбирают таким образом, что величина Смин у указанного пациента поддерживается по меньшей мере на уровне примерно 800 нг/мл, особенно примерно от 800 до примерно 3500 нг/мл, предпочтительно величина Смин поддерживается на уровне от 1000 до примерно 3000 нг/мл иматиниба.
Более конкретно настоящее изобретение относится к способу лечения ХМЛ у людей-пациентов, включающему стадии:
(а) введения предварительно определенного фиксированного количества иматиниба или его фармацевтически приемлемой соли человеку-пациенту с ХМЛ, нуждающемуся в этом,
(б) отбора по меньшей мере одного образца крови от указанного пациента, например, в течение первых 12 месяцев, особенно первых 3 месяцев, более предпочтительно первых 30 суток лечения,
(в) определения самого низкого уровня в плазме (Смин) иматиниба, и
(г) подбора дозы иматиниба или его фармацевтически приемлемой соли таким образом, чтобы величина Смин у указанного пациента достигала по меньшей мере 800 нг/мл, особенно примерно от 800 до примерно 3500 нг/мл иматиниба.
В последнем указанном способе дозу фармацевтически приемлемой соли иматиниба подбирают предпочтительно таким образом, что величина Смин достигает примерно от 1000 до примерно 3000 нг/мл иматиниба у указанного пациента, более предпочтительно величина Смин составляет примерно 1000 нг/мл.
Метаболизм иматиниба происходит через систему цитохрома Р450, причем CYP3A4 является главным изоферментом, ответственным за метаболизм иматиниба, хотя CYP1A2, CYP2D6, CYP2C9 и CYP2C19 также участвуют в этом метаболизме, но в небольшой степени. Один важный метаболит, N-{5-[4-(4-пиперазинометил)бензоиламидо]-2-метилфенил-4-(3-пиридил)-2-пиримидинамин (CGP74588), выявляемый в крови, обладает биологическим действием, близким к действию иматиниба, и представляет примерно 20% от исходного уровня лекарственного средства в плазме у пациентов. Из-за свойственной вариабельности действия ферментов CYP (Wilkinson G.R., J. Pharmacokinet. Biopharm., 24, 1996, cc.475-490), установлена высокая вариабельность, присущая пациентам, при экспозиции иматинибом пациентов с ХМЛ (Peng B.M., Hayes M., Resta D. и др. J. Clin. Oncol. 22, 2004, cc.935-942). Было установлено, что лекарственные средства, которые ингибируют или индуцируют изофермент CYP3A4, влияют на фармакокинетические показатели иматиниба (Bolton А.Е., Peng В., Hubert M. и др. Cancer Chemother. Pharmacol. 53. 2004, cc.102-106, Dutreix С., Peng В., Mehring G. и др. Cancer Chemother. Pharmacol. 54, 2004, cc.290-294, Smith P.F., Bullock J.M., Booker B.M. и др. Pharmacother. 24 (11), 2004, cc.1508-1514, Frye R.F., Fitzgerald S.M., Lagattuta T.F., Hruska M.W., Egorin M.J. Clin. Pharmacol. Ther. 76, 2004, cc.323-329).
Таким образом, в другом варианте осуществления настоящего изобретения предусмотрен способ лечения ХМЛ у людей-пациентов, включающий стадии:
(а) введения предварительно определенного фиксированного количества иматиниба или его фармацевтически приемлемой соли человеку-пациенту с ХМЛ, нуждающемуся в этом,
(б) отбора по меньшей мере одного образца крови от указанного пациента, например, в течение первых 12 месяцев, особенно первых 3 месяцев, более предпочтительно первых 30 суток лечения,
(в) определения самого низкого уровня в плазме (Смин) N-{5-[4-(пиперазинметил)бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамина (CGP74588), и
(г) подбора дозы иматиниба или его фармацевтически приемлемой соли таким образом, чтобы величина Смин у указанного пациента достигала по меньшей мере 150, особенно примерно от 150 до примерно 800 нг/мл N-{5-[4-(пиперазинметил)бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамина.
В последнем указанном способе дозу фармацевтически приемлемой соли иматиниба подбирают предпочтительно таким образом, что величина Смин у указанного пациента достигает примерно от 250 до примерно 700 нг/мл N-{5-[4-(пиперазинметил)бензоиламидо]-2-метилфенил-4-(3-пиридил)-2-пиримидинамина.
Кроме того, настоящее изобретение относится к применению ингибитора тирозинкиназы Bcr-Abl или его фармацевтически приемлемой соли для получения лекарственного средства для лечения лейкоза Ph+, согласно которому:
(а) предварительно определенное фиксированное количество ингибитора тирозинкиназы Bcr-Abl или его фармацевтически приемлемой соли вводят людям-пациентам с лейкозом Ph+,
(б) отбирают по меньшей мере один образец крови от указанных пациентов,
(в) определяют в плазме самый низкий уровень (Смин) ингибитора тирозинкиназы Bcr-Abl или его метаболита, а также степеней ГМО,
(г) оценивают разделяющий потенциал самых низких концентраций ГМО в плазме и выявляют пороговую величину Смин для оптимальной чувствительности и специфичности, и
(д) дозу ингибитора тирозинкиназы Bcr-Abl или его фармацевтически приемлемой соли, применяемой к определенным пациентам из указанной группы пациентов и, необязательно, будущим пациентам с лейкозом Ph+, подбирают таким образом, что величина Смин, достигнутая у каждого отдельного пациента, равна или превышает пороговую величину Смин, полученную на стадии (г). Лейкоз Ph+ предпочтительно является ХМЛ или Ph+ALL. По меньшей мере один образец крови отбирают в первые 12 месяцев, особенно в первые 3 месяца, предпочтительно в первые 30 суток лечения.
Кроме того, настоящее изобретение относится к применению иматиниба или его фармацевтически приемлемой соли для получения лекарственного средства для лечения лейкоза Ph+, в котором:
(а) заранее определенное фиксированное количество иматиниба или его фармацевтически приемлемой соли, например пероральную суточную дозу 400 мг или 800 мг иматиниба мономезилата, вводят человеку-пациенту с лейкозом Ph+,
(б) по меньшей мере, один образец крови отбирают в первые 12 месяцев, особенно в первые 3 месяца, в частности в первые 30 суток лечения,
(в) определяют в плазме самый низкий уровень (Смин) иматиниба, и
(г) дозу иматиниба или его фармацевтически приемлемой соли подбирают таким образом, что величина Смин у указанных пациентов достигает по меньшей мере 800, особенно примерно от 800 до примерно 3500 нг/мл иматиниба, особенно примерно от 1000 до примерно 3000 нг/мл иматиниба. Лейкоз Ph+ является Ph+ALL или, предпочтительно, ХМЛ.
Другой объект настоящего изобретения относится к применению иматиниба или его фармацевтически приемлемой соли для получения лекарственного средства для лечения лейкоза Ph+, согласно которому:
(а) предварительно определенное фиксированное количество иматиниба или его фармацевтически приемлемой соли, например пероральную дозу 400 мг или 800 мг соли иматиниба мономезилата, вводят людям-пациентам с лейкозом Ph+,
(б) отбирают по меньшей мере один образец крови от указанного пациента в течение первых 12 месяцев лечения, особенно в первые 3 месяца, предпочтительно в первые 30 суток лечения,
(в) определяют в плазме минимальный уровень (Смин) N-{5-[4-(пиперазинметил)бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамина, и
(г) дозу иматиниба или его фармацевтически приемлемой соли подбирают таким образом, что величина Смин у указанного пациента достигает по меньшей мере 150, особенно примерно от 150 до примерно 800 нг/мл, предпочтительно примерно от 250 до примерно 700 нг/мл N-{5-[4-(пиперазинметил)бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамина.
В одном из вариантов осуществления настоящего изобретения предварительно определенное фиксированное количество относится к стадии (а), представляющей терапевтически эффективное количество.
В настоящем изобретении предпочтительно применяют соль иматиниб мономезилат на стадии (а), например, при пероральной суточной дозе примерно от 200 до примерно 800 мг, предпочтительно в суточной дозе примерно 400 мг.
Способ, описанный в настоящем изобретении, особенно полезен для пациентов с ХМЛ, оцененным по шкале Сокаля (ШС). Способы определения по ШС известны специалистам в данной области.
Другим важным объектом настоящего изобретения является применение иматиниба или его фармацевтически приемлемой соли, особенно иматиниба мезилата, для получения лекарственного средства для лечения лейкоза Ph+, причем дозу фармацевтически приемлемой соли подбирают таким образом, что величина Смин у указанного пациента поддерживается равной по меньшей мере 800 нг/мл, например, примерно 1000 нг/мл.
Краткое описание фигур
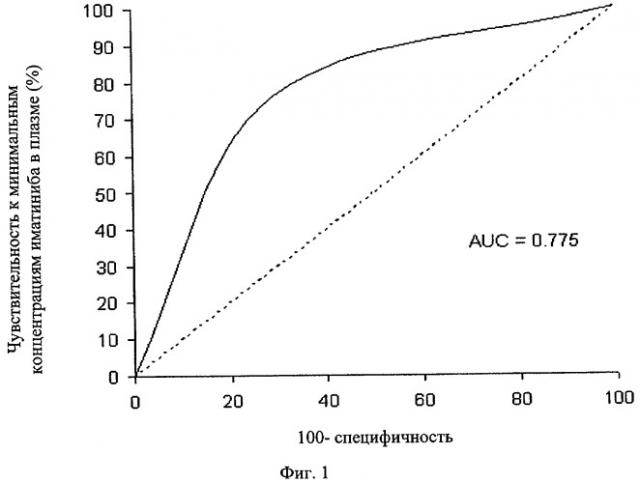
Фиг.1. Анализ ROC-кривой. Анализ характеристической кривой (RОС) проводят для оценки разделяющего потенциала самых низких концентраций ГМО в плазме и выявления пороговой величины в плазме для оптимальной чувствительности и специфичности. Площадь под ROC-кривой (AUC) составила 0,775 при наилучшей чувствительности (76,5%) и специфичности (70,6%) при пороговой концентрации в плазме 1002 нг/мл. Такая величина пороговой концентрации (1002 нг/мл) в значительной степени связана с наличием ГМО (вероятность успешного исхода 7,83; доверительный интервал 95%, 2,58-23,76; Р<0,001).
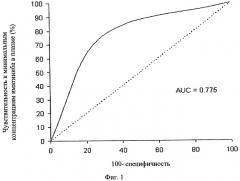
Фиг.2. График рамки-диаграммы. ГМО означает главный молекулярный ответ (снижение уровней транскрипции BCR-ABL на три порядка). График показывает дисперсию вокруг медианы для пациентов с ГМО (34 пациента, средняя величина = 1350,2 нг/мл) и для тех пациентов, у которых ответ отсутствует ГМО (34 пациента, средняя величина = 885,5 нг/мл). Линия через каждую рамку является медианой. Нижний край означает первый квартиль, а верхняя линия означает третий квартиль. Планка погрешностей обозначает минимальные и максимальные значения. Нижняя линия показывает целевую концентрацию 493,6 нг/мл (1 мкМ/мл), требуемую для индукции гибели BCR-ABL-клеток in vitro. Верхняя линия показывает концентрацию 1002 нг/мл, представляющую эффективное пороговое значение минимальной концентрации иматиниба в плазме при лечении ХМЛ.
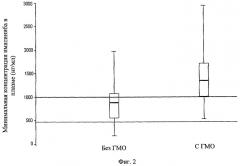
Фиг.3. Вариабельность уровня Смин иматиниба, полученная в исследовании IRIS у пациентов, каждый из которых получал суточную дозу 400 мг иматиниба мезилата.
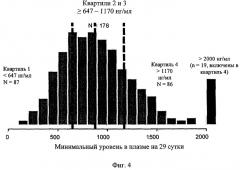
Фиг.4. Распределение уровней Смин иматиниба при суточной дозе 400 мг на 29 сутки (n=351).
Фиг.5. Минимальный уровень иматиниба в зависимости от массы тела или площади поверхности тела.
Фиг.6. Полный цитогенетический ответ (ПЦО) и главный молекулярный ответ (ГМО) в зависимости от минимального уровня иматиниба (29 сутки).
Фиг.7. Минимальные уровни в плазме, соответствующие достижению полного цитогенетического ответа (ПЦО) или неполного ЦО у пациентов с ЧМЛ-ХФ. Верхний и нижний края рамки представляют 75-й и 25-й процентили. Планки погрешностей выше и ниже рамки представляют 90-й и 10-й процентили, а точки представляют 95-й и 5-й процентили.
Фиг.8. Величины бессобытийного выживания (event-free survival - EFS) сгруппированы в зависимости от минимальных фармакокинетических показателей уровней иматиниба по квартилям. Группа Q1 показана самой низкой линией, группа Q2-Q3 соответствует линии в центре, а группа Q4 соответствует самой высокой линии.
Ингибитор трозинкиназы Bcr-Abl, применяемый в настоящем изобретении, например, соединения формулы I:
,
где
R1 обозначает 4-пиразинил, 1-метил-1H-пирролил; амино- или амини-низший алкилзамещенный фенил, причем аминогруппа в каждом случае является свободной, алкилированной или ацилированной; 1H-индолил или 1Н-имидазолил, связанный с атомом углерода пятичленного кольца; или незамещенный или низший алкил-замещенный пиридил, связанный с атомом углерода кольца, и незамещенный или замещенный по атому азота кислородом;
R2 и R3 каждый независимо обозначают водород или низший алкил;
один или два из радикалов R4, R5, R6, R7 и R8 обозначает нитро, фторзамещенный низший алкокси или радикал формулы II:
,
где R9 обозначает водород или низший алкил,
Х обозначает оксо, тио, имино, N-низший алкилимино, гидроксиимино или O-низший алкилгидроксиимино,
Y обозначает кислород или группу NH,
n обозначает 0 или 1, и
R10 обозначает алифатический радикал, имеющий по меньшей мере 5 атомов углерода, или ароматический, ароматический-алифатический, циклоалифатический, циклоалифатический-алифатический, гетероциклический или гетероциклический-алифатический радикал, а оставшиеся радикалы R4, R5, R6, R7 и R8 обозначают каждый независимо от других водород, низший алкил, который незамещен или замещен свободными или алкилированными амино, пиперазинил, пиперидинил, пирролидинил или морфолинил, или низший алканоил, трифторметил, свободная, этерифицированная или эсрерифицированная гидроксигруппа, свободная, алкилированная или ацилированная аминогруппа, или свободная или эстерифицированная карбоксигруппа, или соль такого соединения, обладающая по меньшей мере одной группой формирования соли.
Соединения формулы I впервые подробно описаны в патентной заявке US 5521184, в частности в формуле изобретения и в виде конечных продуктов рабочих примеров, сущность которых включена в настоящую заявку в виде ссылки. В приведенном выше определении соединения формулы I радикалы и символы имеют значения, предусмотренные в US 5521184. Предпочтительно соединение формулы I является 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-(пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид (иматиниб). Иматиниб также может быть получен в соответствии со способами, описанными в WO 03/066613.
Для целей настоящего изобретения иматиниб предпочтительно применяют в форме соли мономезилата. Иматиниб мономезилат также может быть получен в соответствии со способами, описанными в патенте US 6894051, сущность которого включена в настоящее изобретение в виде ссылки. Кроме того, в патент включены соответствующие полиморфы, например кристаллические модификации, описанные в нем.
На стадии (а) способа, описанного выше, предпочтительная суточная доза примерно от 200 и примерно до 800 мг, например, 400 мг, соли мономезилата, вводится перорально. Иматиниб мономезилат может быть введен в дозированных формах, описанных в US 5521184, US 6894051, US 2005-0267125 или WO 2006/121941.
Отбор образцов крови у пациентов с ХМЛ на стадии (б) методов, описанных в настоящем изобретении, может быть осуществлен стандартными методами, известными в данной области. Соответствующая методика определения уровня в плазме Смин иматиниба и N-{5-[4-(пиперазинометил)бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамина описана R.Bakhtiar и др. в J.Chromatogr. В.Analyt. Nechnol. Biomed. Life Sci. 768, 2002, cc.325-340.
Примеры
Приводимые ниже примеры иллюстрируют настоящее изобретение, но не ограничивают его. Примеры только описывают способ применения настоящего изобретения. Количества ингредиентов, представленные в виде процентов от массы фармацевтической композиции в каждом из примеров, приведены ниже.
Пример 1. План исследования, статистический анализ и результаты исследования в Бордо
Пациенты
Пациенты, включенные в настоящее исследование, находятся на хронической стадии или на прогрессирующей стадии ХМЛ. Они поступили из Отделения гематологии и болезней крови Центрального госпиталя Бордо и из Института Bergonie Регионального онкологического центра. Всех пациентов лечат перорально стандартными дозами иматиниба мезилата (т.е. 400 мг или 600 мг один раз в сутки для пациентов на хронической стадии или на прогрессирующей стадии ХМЛ, соответственно) на протяжении по меньшей мере 12 месяцев. При исследовании группы пациентов анализируют образцы крови, которые отбирали в интервале от июня 2004 г. по март 2006 г. для выявления связи между концентрациями иматиниба в плазме и ответом на лечение. Исключающими критериями являются начало лечения иматинибом мезилатом менее чем за один год до исследования, бластный криз до лечения иматинибом мезилатом или во время такого лечения, отбор крови, произведенный за пределами времени, когда была минимальная концентрация, плохая податливость лечению, идентификация генной мутации (мутаций) в домене киназы в Bcr-Abl.
Количественная характеристика ответа на лечение
Цитогенетический ответ на лечение иматинибом мезилатом оценивают, используя традиционный цитогенетический анализ метастазов костного мозга. Цитогенетические иммунокомпетентные клетки определяют в качестве имеющих ПЦО, т.е. 0% метастазов, положительных по филадельфийской хромосоме, по меньшей мере среди 25 клеток на стадии метафазы в аспирате костного мозга (Colombat M., Fort M.P., Chollet С. и др. Haematologica 91, 2006, cc.162-168). Используют реального времени количественную обратной транскриптазы полимеразную цепную реакцию для оценки уровней транскрипта BCR-ABL и количественной оценки молекулярного ответа (Colombat M., Fort M.P., Chollet С. и др. Haematologica, 91, 2006, cc.162-168). Вкратце, отбирают периферийную кровь, обработанную антикоагулянтом EDTA, для экстракции РНК с последующим проведением реального времени количественной обратной транскриптазы полимеразной цепной реакции. Общую РНК экстрагируют из клеток периферической крови пациентов стандартными методами. Подсчет транскриптов BCR-ABL проводят с учетом ранее сделанных рекомендаций по координации результатов (Hughes Т.Р., Hochhaus А. и др., Blood 108, 2006, cc.28-37). В связи с этим получают результаты, используя ген ABL в качестве генного контроля, и выражают в виде процента BCR-ABL/ABL. Стандартизированный базовый уровень подсчитывают, измеряя соотношение BCR-ABL/ABL у 40 пациентов с ХМЛ на хронической стадии в крови, собранной до начала какого-либо лечения. Для каждого образца используют такой базовый уровень для оценки и измерения уменьшения транскрипта BCR-ABL. ГМО определяют в качестве уменьшения уровня транскрипта BCR-ABL по меньшей мере на три порядка, через 12 месяцев лечения иматинибом мезилатом (Hughes Т.Р., Kaeda J., Branford S. и др., New Engl. J. Med. 349, 2003, сс.1423-1432).
Количественная оценка концентраций иматиниба в плазме
Образцы крови для количественного анализа иматиниба отбирают на стадии устойчивости в интервале 21-27 ч после последнего введения лекарственного средства. Концентрации иматиниба в плазме определяют, используя высокоэффективную жидкостную хроматографию в сочетании с электроспрей-ионизирующей тандемной масс-спектрометрией (Titier К., Picard S., Ducint D. и др., Ther. Drug Monit., 27, 2005, сс.634-640. [Erratum, Ther. Drug Monit., 27, 2005, с.810.]). Чистые контрольные образцы иматиниба мезилата и его внутреннего стандарта (иматиниба-DS) были любезно предоставлены фирмой Novartis (Rueil-Malmaison, Франция). Образец препарата, представляющий экстракт жидкости жидкостью, приготовляют из 200 мкл плазмы. Затем 5 мкл экстракта закалывают в хроматографическую систему. Блок высокоэффективной жидкостной хроматографии состоит из отдельного модуля Alliance® 2690 (фирма Waters, Милфорд, Массачусетс, США), управляемого компьютерным обеспечением Masslynx®. Иматиниб и иматиниб-D8 разделяют на колонке с обратной фазой (X-Terra® RP18, [100×2,1 мм, 5 мкм], фирма Waters) в градиенте буфера ацентонитрилформиат. Анализ общего времени пробега составляет 6 мин при скорости тока 0,3 мл/мин. Количество иматиниба определяют, используя тандемную масс-спектрометрию (QuattroMicro®, фирма Waters, Милфорд, Массачусетс, США) с электроспрей-ионизирующей границей раздела в режиме положительных ионов. Конусный потенциал устанавливают на 40 вольт для иматиниба и его внутреннего стандарта, а энергию столкновений устанавливают на 30 электрон-вольт для двух соединений. Иматиниб и иматиниб-D8 выявляют в контрольных переключениях множественного отклика. Для количественного подсчета область пика, соответствующую m/z 494,2→394,1 реакции (иматиниб), измеряют относительно области пика m/z 502,2→394,1 реакции (внутренний стандарт). Выявление иматиниба подтверждают вторым специфическим переключением множественного отклика: m/z 494,2→217,2.
Статистический анализ
Для количественных переменных сравнение средних величин двух групп проводят, используя тест Стьюдента или ранговый критерий Уилкоксона по необходимости. При наличии более двух групп применяют дисперсионный анализ или тест Крускала-Уоллиса. Для качественных переменных сравнение пропорций проводят, используя тест χ2 или точный критерий Фишера по необходимости. В устойчивом состоянии вариабельность минимальных концентраций иматиниба в плазме выражают в виде следующих параметров: средние минимальные концентрации в плазме, стандартное отклонение (СО), коэффициент вариаций, средний, первый и третий квартили, максимальные и минимальные величины минимальных концентраций в плазме.
Последовательно сравнивают полный цитогенетический ответ (ПЦО) и главный молекулярный ответ (ГМО) в группах пациентов, отвечающих и не отвечающих на лечение, в связи со средними минимальными концентрациями иматиниба в плазме. Возможную корреляцию выявляют между ГМО и следующими переменными: количественными показателями, например возрастом и шкалой Сокаля; качественными показателями, например полом и группой риска по Сокалю, поздней фазой ХМЛ в начале лечения иматинибом мезилатом, введением интерферона до лечения иматинибом мезилатом, суточным дозовым уровнем иматиниба мезилата. Оценивают какие-либо корреляции между уровнями транскрипции BCR-ABL и временным диапазоном от даты начала лечения иматинибом мезилатом до даты оценки молекулярного анализа.
Анализ ROC-кривой проводят с применением поливариантной логистической регрессионной модели, с учетом пола и возраста, для оценки разделяющего потенциала самых низких концентраций ГМО в плазме и для выявления пороговой величины в плазме для оптимальной чувствительности и специфичности. Результаты выражают в виде соотношения вероятностей, 95% доверительного интервала, величины Р теста Вальда.
Двусторонние величины Р устанавливают для статистических тестов (Р<0,05 показанной значимости). Все анализы выполняют, используя программное обеспечение SAS Software (версия 9.1, Кэри, Северная Каролина, США).
Пациенты, включенные в исследование
В исследовании анализируют девяносто пять пациентов с ХМЛ, которые согласились в нем участвовать. Одного пациента исключают, поскольку у него обнаружен бластический кризис. Двадцать пять пациентов исключают, поскольку у них ненадлежащим образом были взять анализы крови, т.е. образцы для определения минимальной концентрации иматиниба были взяты за пределами установленных временных рамок. Одного пациента исключают, поскольку у него установили слабую реакцию на лечение иматинибом: у этого пациента нет кроветворного ответа и уровни иматиниба в плазме ниже 10 нг/мл. Одного пациента исключают, поскольку мутация G250E была идентифицирована в домене киназы в Bcr-Abl. В итоге, 68 пациентов с ХМЛ включают в исследование. 50 пациентов и 18 пациентов лечат дозами 400 мг и 600 мг иматиниба, соответственно, один раз в сутки.
Вариабельность минимальных уровней иматиниба в плазме среди пациентов
Вариации минимальных концентраций иматиниба в плазме для каждой суточной дозы иматиниба мезилата (400 мг и 600 мг) показаны в табл.1.1. Эти концентрации иматиниба в высокой степени переменчивы и варьируют от 181 до 2947 нг/мл, подтверждая высокую вариабельность у субъектов минимальных концентраций иматиниба в плазме для определенной суточной дозы, описанную ранее у субъектов (Peng В., Hayes М., Resta D. и др. J. Clin. Oncol. 22, 2004, cc.935-942).
| Таблица 1.1. | ||||||||
| Вариабельность минимальных концентраций иматиниба в плазме у пациентов (n=68*). | ||||||||
| Уровень суточной дозы | Разброс относительно средней величины | Среднее значение | Q25† | Q75‡ | Минимум | Максимум | ||
| Среднее значение | СО** | KB*** | ||||||
| 400 мг | 1058 | 557 | 52,6 | 99,7 | 722 | 1285 | 181 | 2947 |
| 600 мг | 1444 | 710 | 49,2 | 1315 | 902 | 1629 | 603 | 2922 |
| * Параметры вариаций минимальных концентраций иматиниба в плазме, выраженных в нг/мл и представленных для каждой суточной дозы введения иматиниба мезилата: 400 мг (50 пациентов) и 600 мг (18 пациентов). Эти результаты получены при анализе образцов крови (используя высокоэффективную жидкостную хроматографию, соединенную с электроспрей-ионизирующей тандемной масс-спектрометрией) в равновесном состоянии у 68 пациентов с ХМЛ, включенных в это исследование. | ||||||||
| ** Стандартное отклонение (СО) | ||||||||
| *** Коэффициент вариации, выраженный в процентах (KB) | ||||||||
| † Q25 - первый квартиль | ||||||||
| ‡ Q75 - третий квартиль |
Описание пациентов в связи с ответами на лечение иматинибом
Из 68 пациентов с ХМЛ, включенных в исследование, 56 достигают ПЦО после по меньшей мере одного года лечения. Средняя величина (±СО) минимальных концентраций иматиниба в плазме составляет 1123,3±616,6 нг/мл и 694,2±556,0 нг/мл у пациентов с ПЦО (56 пациентов) и без ПЦО (12 пациентов), соответственно (Р=0,02). Молекулярные ответы в связи с основными свойствами 68 пациентов с ХМЛ, классифицированных в зависимости от наличия или отсутствия ГМО, суммированы в табл.1.2. Средние минимальные концентрации иматиниба в плазме существенно выше в группе с ГМО (1452,1±649,1 нг/мл), чем в группе без ГМО (869,3±427,5 нг/мл, Р<0,001). Существенные различия отсутствуют при ежедневном дозировании иматиниба мезилата у пациентов с ГМО или без ГМО. Кроме того, главный молекулярный ответ (ГМО) на иматиниб не связан со сл