Терапевтическое применение по меньшей мере одного ботулинического нейротоксина для лечения боли, индуцированной по меньшей мере одним противораковым агентом
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и предназначена для лечения или предупреждения постхимиотерапевтической боли или болей, индуцированных противораковым агентом. Заявлено применение по меньшей мере одного ботулинического нейротоксина типа А для получения лекарственного средства для лечения или предупреждения постхимиотерапевтической боли или болей. Заявлен также способ лечения или предупреждения постхимиотерапевтической боли или болей путем локального введения указанного лекарственного средства, позволяющего достичь генерализованного эффекта. Использование заявленной группы изобретений обеспечивает высокий терапевтический эффект. 2 н. и 30 з.п. ф-лы, 2 пр., 3 ил.
Реферат
Изобретение относится к применению по меньшей мере одного ботулинического нейротоксина для получения лекарственного средства, предназначенного для лечения или предупреждения постхимиотерапевтической боли или болей, ассоциированных с противораковым лечением.
Невропатия после химиотерапевтического лечения, которая заключается в боли, вызванной химиотерапией, которую применяют для борьбы с раком, остается до сих пор патологией, трудно поддающейся облегчению или излечиванию. Этот тип боли отличается от боли, вызванной самими раковыми опухолями. Практически, невропатия после химиотерапевтического лечения индуцируется противораковым агентом, который вводят пациентам с лечебной целью.
Невропатические боли после химиотерапевтического лечения имеют конкретные семиологические признаки. Как правило, эти боли характеризуются, среди прочего, непрекращающейся диффузной болью, подобной жжению, без ритмических болей механического или воспалительного характера. На этом непрерывном болевом фоне могут возникнуть другие симптомы: спонтанные приступы стреляющих болей, колющие боли, особенно колющие боли на концах конечностей, или же боль, подобная электрическому разряду. Топография этих болевых симптомов соответствует распределению, совместимому с систематизацией болевых синдромов на основе повреждений периферической или центральной нервной системы. Иначе говоря, топография названных невропатических болей после химиотерапевтического лечения не зависит от топографии раковых опухолей.
Из известных методов лечения этой боли можно назвать, например, введение антиконвульсантов, антидепрессантов или опиатных соединений, таких как морфин, который был выделен в самом начале XIX-го века немецким фармацевтом Фридрихом Сертюрнером из опия, основным компонентом которого является морфин.
Кроме того, Всемирная Организация Здравоохранения установила трехступенчатое правило назначения болеутоляющих лекарственных средств, которое показало себя эффективным на 70% пациентов:
ступень I: неопиоидные анальгетики при слабых или умеренных болях;
ступень II: опиоидные анальгетики умеренной силы, ассоциированные с неопиоидными соединениями, при умеренных и сильных болях;
ступень III: сильные опиоидные анальгетики при сильных и очень сильных болях.
Однако применение имеющихся в настоящее время соединений, которые позволяют снизить боль, вызванную противораковым лечением, не вполне удовлетворительно, поскольку требует использования высоких доз соединений или повторного и частого введения соединения, что может развить резистентность организма к этому соединению или привыкание к нему. Кроме того, эти методы борьбы с болью могут вызвать побочные эффекты, которые присоединяются к побочным эффектам, вызванным самим раком.
Следовательно, создалась необходимость найти иное средство для лечения этих невропатических болей после химиотерапевтического лечения.
Изобретение предлагает также решение задачи, заключающейся в создании нового способа лечения боли, вызванной лечением с помощью противоракового агента.
Неожиданно изобретателям удалось обнаружить, что введение ботулинического нейротоксина создает болеутоляющий эффект при лечении боли, вызванной химиотерапевтическим лечением.
В этой связи согласно изобретению предлагается применение по меньшей мере одного ботулинического нейротоксина для получения лекарственного средства, предназначенного для лечения или предупреждения постхимиотерапевтической боли или болей.
Изобретение имеет основополагающие преимущества, в частности, в том, что позволяет избежать или предупредить боль, являющуюся следствием лечения противораковым агентом, и, следовательно, позволяет увеличить дозировку лечебного средства без увеличения боли.
Наконец, преимущество изобретения заключается и в том, что оно может быть использовано в любой отрасли промышленности, в частности в фармацевтической, ветеринарной, косметической промышленности.
Другие преимущества и характеристики изобретения станут понятными при чтении описания и примеров, представленных ниже исключительно в целью иллюстрации и не являющихся ограничивающими.
Термин «боль» в контексте настоящего изобретения означает «любой неприятный эмоциональный опыт или неприятное ощущение, ассоциированное с повреждением ткани, настоящим или потенциальным, или описанное пациентом в таких терминах».
Под выражением «ботулинический нейротоксин» понимают ботулинический токсин, который представляет собой либо свободный белок (т.е свободный от любого комплексообразующего белка), либо белковый комплекс, причем упомянутый белковый комплекс может включать, например, гемагглютинин (белок НА), ассоциированный с ботулиническим нейротоксином, либо белковый фрагмент.
Под выражением «ботулинический токсин» понимают молекулу, обладающую биологической активностью ботулинического токсина, молекула может быть, например, либо белком, либо полипептидом, либо пептидом, либо слитым белком, либо укороченным белком, либо химерным белком, либо мутированным белком или рекомбинантным белком.
Под выражением «биологическая активность ботулинического токсина» понимают в контексте настоящего изобретения либо мышечный паралич, либо ингибирование эксоцитоза, в частности эксоцитоза ацетилхолина или другого нейропереносчика.
Под белком, полипептидом или пептидом понимают в контексте настоящего изобретения полимер из аминокислот, природных или не природных, левовращающих и не левовращающих, правовращающих и не правовращающих.
Под химерным белком понимают в контексте настоящего изобретения белок, полученный в результате ассоциации разных типов молекул, например в результате ассоциации липидов, гликолипидов, пептидов, полипептидов, протеинов, гликопротеинов, углеводов, полисахаридов, нуклеиновых кислот, полиэтиленгликоля и т.д.
Ботулинический токсин, в частности ботулинический токсин типа А1 (Dysport®, продаваемый фирмой Ipsen, или Botox®, продаваемый фирмой Allergan), используется начиная с 80-х годов для лечения у человека многих и разных заболеваний/нарушений. Среди заболеваний/нарушений, которые могут лечиться ботулиническим токсином, можно назвать, среди прочих, мышечные нарушения (например, блефароспазм, спастичность у взрослых или детей или тортиколис), мигрень, боль мышечного происхождения, диабет, гипергидроз (или повышенная потливость), гиперсаливация или морщины.
Ботулинический нейротоксин, чистый или квазичистый, может быть получен из белкового комплекса, включающего ботулинический токсин, например, согласно способу, описанному в документе Current topics in Microbiology and Immunology (1995), 195, c.151-154. Ботулинический нейротоксин, чистый или квазичистый, может быть получен, например, очисткой ферменативной среды или культурального бульона, содержащего штамм Clostridium Botulinum и обогащенного, например, мясным и кормовым белком.
Настоящее изобретение относится, прежде всего, к применению по меньшей мере одного ботулинического нейротоксина для получения лекарственного средства, предназначенного для лечения или предотвращения постхимиотерапевтической боли или болей.
Более конкретно, настоящее изобретение относится к применению по меньшей мере одного ботулинического нейротоксина для получения лекарственного средства, предназначенного для лечения или предотвращения постхимиотерапевтических болей, при условии, что ботулинический нейротоксин вводят локальным путем, позволяющим достичь генерализованного эффекта.
Предпочтительно, настоящее изобретение не относится ни к лечению раков, ни опухолей, ни болей, индуцированных опухолями, в частности болей, ассоциированных с опухолями костей.
Предпочтительно, применение согласно настоящему изобретению по меньшей мере одного ботулинического нейротоксина для получения лекарственного средства позволяет лечить или предупреждать постхимиотерапевтические боли, индуцированные противораковым агентом или его солями или его производными.
Предпочтительно, противораковый агент или его соли или его производные выбирают из следующих соединений или их смесей: таксаны, соли платины или другие противораковые агенты.
Предпочтительно, противораковый агент или его соли или его производные выбирают из таксанов, таких как, например, доцетаксел, паклитаксел (таксол), или их смесей.
Предпочтительно, противораковый агент или его соли или его производные выбирают из солей платины, таких как, например, цисплатин, оксалиплатин или карбоплатин, или их смеси.
Предпочтительно, противораковый агент или его соли или его производные выбирают из винкристина, винбластина, этопозида, тенипозида, Ara-A (аденозид-арабинозида), Ara-C (цитарабина), флуорурацила, прокарбазина, винорелбина, гемцитабина или из продуктов или смесей продуктов, таких как паклитаксел/карбоплатин, паклитаксел/антрациклины, паклитаксел/карбоплатин/гемцитабин, паклитаксел/эстрамустин, доцетаксел/цисплатин, доцетаксел/доксорубицин, доцетаксел/винорелбин, доцетаксел/трастузумаб, доцетаксел/капецитабин или цисплатин/циклофосфамид, цисплатин/иринотекан, карбоплатин/топотекан, карбоплатин/эстрамустин, этопозид/эстрамустин, винбластин/эстрамустин.
Под солью понимают фармацевтически приемлемую соль и, в частности, аддитивные соли с неорганическими кислотами, такие как гидрохлорид, гидробромид, гидройодид, сульфат, фосфат, дифосфат и нитрат, или с органическими кислотами, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, пальмоат и стеарат. В объем настоящего изобретения входят также, если они пригодны для использования, соли, образованные с основаниями, такими как гидроксид натрия или калия. Другие примеры фармацевтически приемлемых солей можно найти в документе “Salt selection for basic drugs”, Int. J. Pharm. (1986), 33, 201-217.
Предпочтительно, ботулинический нейротоксин позволяет обеспечить системный эффект.
Под «системным эффектом» понимают в контексте настоящего изобретения локальное введение, позволяющее достичь генерализованного эффекта.
Согласно предпочтительному применению согласно изобретению ботулинический нейротоксин вводят внутримышечным путем, внутрикожным или подкожным путем.
Предпочтительно, ботулинический нейротоксин, используемый согласно изобретению, выбирают из ботулинических нейротоксинов типа А, А1, А2, В, С, С1, D, E, F или G.
Ботулинический нейротоксин типа А1 соответствует по существу классическому ботулиническому токсину, который принято называть ботулиническим токсином типа А, без отличия в подтипе. Ботулинический нейротоксин типа А1 выпускается под наименованием DYSPORT® или BOTOX®.
Согласно изобретению ботулинический нейротоксин типа А1 может соответствовать либо комплексу ботулинического токсина А1 с гемагглютинином, либо ботулиническому токсину типа А1, свободному от каких-либо комплексообразующих белков.
Ботулинический токсин типа А2 сначала был обнаружен у детей, больных бутулизмом в 1990 (Sakaguchi et al., Int. J. Food Microbiol. (1990), 11, 231-242). Этот токсин по иммунологическим и биохимическим характеристикам отличается от ботулинического токсина типа А1.
Ботулинический токсин типа А2 может быть выделен из следующих штаммов: Kyoto-F, Chiba-H, Y-8036, 7103-H, 7105-H, KZ1828, NCTC2012 или NCTC9837 (Cordoba et al., System. Appl. Microbiol. (1995), 18, 13-22; Franciosa et al., abstract presented at 40th Interagency Botulism Research Coordinating Committee (IBRCC) Meeting, November 2003).
Предпочтительно, ботулинический нейротоксин, используемый согласно изобретению, является ботулиническим токсином типа А1.
В соответствии с вариантом изобретения, ботулинический нейротоксин, используемый согласно изобретению, является ботулиническим токсином типа А2, выделенным из штамма Clostridium botulinum, зарегистрированным под номером NCTC9837, и является доступным в коллекции National Collection of Type Cultures - Central Public Health Laboratory - London - UK. NCTC9837 Mauritius 1955.
Ботулинический токсин типа А2 отличается от токсина А1, среди прочего, своей последовательностью аминокислот, своей молекулярной массой, иммунологическими и генетическими характеристиками (Kubota et al., Biochem. Biophys. Res. Commun. (1996), 224(3), 843-848).
В соответствии с предпочтительным вариантом, ботулинический нейротоксин, используемый согласно изобретению, является модифицированным ботулиническим нейротоксином, имеющим по меньшей мере одну исключенную, модифицированную или замененную аминокислоту.
Предпочтительно, ботулинический нейротоксин, используемый согласно изобретению, ассоциирован по меньшей мере с одним полисахаридом или со смесью нескольких полисахаридов.
Под полисахаридом понимают в контексте настоящего изобретения полимер, содержащий по меньшей мере 2 мономера, где мономерами являются сахариды. Это определение включает дисахариды.
В рамках изобретения полисахариды могут быть ионными и/или неионными.
Предпочтительно, композиция включает по меньшей мере один полисахарид, содержащий в наибольшем количестве звенья глюкозы. Термин «в наибольшем количестве» означает, что глюкоза является мажоритарной по числу мономерных звеньев.
В качестве примера подходящих полисахаридов для применения согласно изобретению можно назвать крахмал, производные крахмала, гидроксиэтилкрахмал, в частности 2-гидроксиэтилкрахмал.
Подходящие полисахариды согласно настоящему изобретению, могут быть замещены, в частности могут быть замещены алкильными, алкоксильными радикалами или алкильными радикалами, которые сами замещены спиртовыми группами.
В соответствии с вариантом изобретения, количество полисахарида, соответствующее настоящему изобретению, составляет по меньшей мере 1 мкг полисахарида на 1 единицу ботулинического токсина. В зависимости от выбранного полисахарида можно использовать по меньшей мере 0,5 мкг полисахарида на 1 единицу ботулинического токсина.
Предпочтительно, ботулинический нейротоксин, используемый согласно изобретению, ассоциирован по меньшей мере с одним поверхностно-активным веществом или со смесью нескольких поверхностно-активных веществ.
В контексте настоящего изобретения под поверхностно-активным веществом понимают эмульгирующий или солюбилизирующий агент.
В рамках изобретения используемые поверхностно-активные вещества выбирают из катионных, анионных или неионных поверхностно-активных веществ.
Предпочтительно, ботулинический нейротоксин, используемый согласно изобретению, ассоциирован по меньшей мере с одним поверхностно-активным веществом или со смесью нескольких поверхностно-активных веществ, выбираемых из катионных, анионных или неионных поверхностно-активных веществ.
Предпочтительно, ботулинический нейротоксин, используемый согласно изобретению, ассоциирован по меньшей мере с одним поверхностно-активным веществом, выбираемым из неионных поверхностно-акивных веществ группы полисорбатов.
Среди соединений группы полисорбатов можно назвать полисорбат 20, полисорбат 21, полисорбат 40, полисорбат 60, полисорбат 61, полисорбат 65, полисорбат 80, полисорбат 81, полисорбат 85, полисорбат 120, полисорбат 80-ацетат.
Предпочтительным поверхностно-активным веществом согласно варианту изобретения является полисорбат 80.
Ботулинический нейротоксин, используемый согласно изобретению, предпочтительно может вводиться инъекционным путем, например путем внутримышечной, внутрикожной или подкожной инъекции, или же топическим нанесением, например путем наложения пластыря.
В случае инъекций согласно изобретению ботулинический нейротоксин может быть ассоциирован с агентом, улучшающим впрыскивание, называемым носителем для инъекций или вектором для инъекций.
Доза используемого ботулинического нейротоксина согласно изобретению, предусмотренная для лечения или предупреждения заболеваний или нарушений, указанных выше, варьирует в зависимости от способа введения, возраста и массы пациента, подвергающегося лечению, а также от состояния последнего, и исходя из этих данных доза окончательно устанавливается лечащим врачом или ветеринаром. Это количество, определяемое лечащим врачом или ветеринаром, называется в настоящем описании «терапевтически эффективным количеством».
Предпочтительно, ботулинический нейротоксин, используемый согласно изобретению, вводят в дозе от 0,01 Ед. до 1500 Ед., предпочтительно, в дозе от 0,01 Ед. до 1000 Ед., более предпочтительно, от 0,1 до 500 Ед., более конкретно, в дозе от 0,1 до 100 Ед., еще более конкретно, в дозе от 1 до 20 Ед., причем эти количества не зависят ни от типа ботулинического токсина, ни от его происхождения. (Определение единицы токсина (Ед.) дано в экспериментальной части.)
Настоящее изобретение относится к применению ботулинического нейротоксина, описанного выше, для получения лекарственного средства, предназначенного для лечения или предупреждения постхимиотерапевтической боли или болей, т.е. болей, связанных с лечением против рака.
Под выражением «рак» понимают в контексте изобретения любой тип рака, т.е. инвазивный, не инвазивный, инфильтрующий, гормональный, не гормональный, локализованный или метастазный.
В соответствии с предпочтительным применением согласно изобретению ботулинический нейротоксин позволяет лечить или предупредить постхимиотерапевтическую боль или боли у пациентов, больных, например, раком толстой кишки, прямой кишки, молочной железы, легких, поджелудочной железы, яичек, почек, матки, яичника, простаты, кожи, костей, спинного мозга, а также пациентов, пораженных саркомами, карциномами, фиброаденомами, нейробластомами, лейкемией, лимфомами или меланомами.
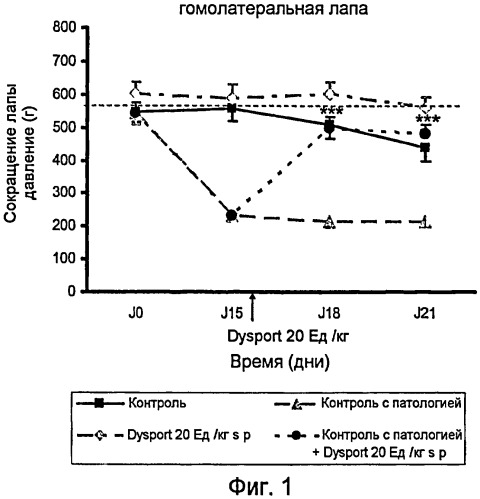
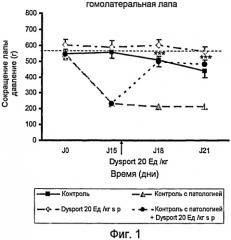
На фиг.1 представлено действие ботулинического токсина типа А1 на правую лапу после инъекции в подподошвенную область правой лапы (гомолатеральной) на модели периферической невропатии, индуцированной паклитакселем.
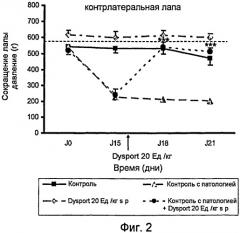
На фиг.2 представлено действие ботулинического токсина типа А1 на левую лапу (контрлатеральную) после инъекции в подподошвенную область правой лапы (гомолатеральную) на модели периферической невропатии, индуцированной паклитакселем.
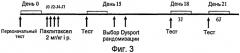
На фиг.3 представлен протокол введения инъекций.
Следующие примеры иллюстрируют изобретение, без ограничения его объема.
ПРИМЕРЫ
Определение количества ботулинического нейротоксина, используемого согласно изобретению, осуществляли путем определения летальной дозы DL50. Под символом DL50 понимают согласно изобретению летальную дозу или же полулетальную дозу данного вещества. Это означает дозу (или количество), которая приводит к смерти 50% тестируемых животных одной группы. Единица токсина (U) соответствует DL50 мышей при интраперитональном введении.
Модель невропатии, индуцированной введением противоракового агента
Активность Dysport® (ботулинический токсин типа А1) оценивали в тесте in vivo на модели периферической невропатии, индуцированной введением противоракового агента: паклитакселя (Taxol®).
Самцов крыс линии Sprague Dawley (Charles River) массой 160 г выдерживали в закрытом помещении в течение 6 дней в условиях безвыгульного содержания животных. Были составлены 4 группы, состоящие из не менее 10 животных.
Невропатию индуцировали путем интраперитональной инъекции (i.p.) объемом 2 мг/кг паклитакселя в дни J0, J2, J4 и J7.
Перед первой инъекцией крысам присваивали номера, затем взвешивали и оценивали ноцицепцию (болевой порог) после механической стимуляции, проводимой при возрастающем давлении: первоначальное давление (210 г/мм2) на две задние лапы крыс осуществляли с помощью альгометра в соответствии с методом Randall и Selitto. Эти измерения позволили определить базовые значения (J0) перед развитием невропатии.
Снижение ноцицептивого порога, соответствующего невропатическому поражению, было максимальным между 14-м и 24-м днем после первой инъекции паклитакселя. Ноцицептивный порог двух задних лап крыс заметно снизился. Исследования невропатии были проведены, таким образом, между 14-м и 24-м днем на 2 задних лапах крыс. В описываемом случае, измерение ноцицепции проводили в день J18 и в день J21.
В день эксперимента (J15) крыс взвешивали, измеряли ноцицепцию и животных, у которых не развилась невропатия на этот день (снижение ноцицепции по сравнению с измерениями в день J0), исключали из исследования. Инъецировали Dysport в подподошвенную область задней правой лапы (гомолатеральной) крыс и измеряли ноцицепцию на 2 задних лапах (гомолатеральной и контрлатеральной) спустя 3 дня и 6 дней после его введения.
Действие Dysport на развитие невропатии, индуцированной таксолом
На фиг.1 показано действие Dysport (ботулинический токсин типа А1) на правую лапу после его инъекции в подподошвенную область правой лапы (гомолатеральной) на модели периферической невропатии, индуцированной паклитакселем.
Контрольный эксперимент проводили для установления порога переносимости боли крысой, когда к ее лапам прикладывали возрастающее давление; группа этих крыс была обработана носителем паклитакселя (монтанокс 3% в NaCl 0,9%) путем интраперитонального введения и носителем Dysport (NaCl 0,9%) путем подподошвенного введения. В период от J0 до J21 порог ноцицептивной боли составил около 500 г/мм2.
Контрольный эксперимент с патологией проводили для установления порога переносимости боли крысой, когда к ее лапам прикладывали возрастающее давление; группа этих крыс была обработана паклитакселем интраперитональным путем и носителем Dysport (NaCl 0,9%) подподошвенным путем. В день 0 этот порог составил 544 г/мм2, затем снизился до 232 г/мм2 в день 15, до 216 г/мм2 в день 18 и составил 216 г/мм2 в день 21. Эти результаты показывают, что после инъекции i.p. паклитаксела чувствительность лап крыс увеличилась в результате приложенного к лапам давления.
Введение Dysport в дозе 20 Ед./кг подподошвенным путем группе животных, обработанных только одним носителем паклитакселя (монтанокс 3% в NaCl 0,9%) интраперитональным путем, показало, что порог переносимости боли крысой не изменился значительным образом. Болевой порог, возникший в результате механической стимуляции, приложенной к лапам крыс, находился в период от J0 до J21 на уровне 590 г/мм2.
Введение Dysport в дозе 20 Ед./кг подподошвенным путем (s.p.) группе животных, обработанных паклитакселем, показал, что порог переносимости боли крысой на ее правой лапе увеличился. Болевой порог, возникший в результате механической стимуляции, приложенной к лапам крыс, значительно увеличился, достигнув 500 г/мм2 в день J18 (т.е. 3 дня спустя после обработки Dysport) и 480 г/мм2 в день J21 (т.е. 6 дней спустя после обработки Dysport) против 232 г/мм2 в день J15 (до обработки Dysport).
На фиг.2 показано действие Dysport (ботулинический токсин типа А1) на левую лапу (контралатеральную) в результате инъекции в подподошвенную область правой лапы (гомолатеральной) на модели периферической невропатии, индуцированной паклитакселем.
Контрольный эксперимент проводили для установления порога переносимости боли крысой, когда к ее лапам прикладывали возрастающее давление; группа этих крыс была обработана носителем паклитакселя (монтанокс 3% в NaCl 0,9%) интраперитональным путем и носителем Dysport (NaCl 0,9%) подподошвенным путем. В период от J0 до J21 порог ноцицептивной боли составил около 500 г/мм2.
Контрольный эксперимент с патологией проводили для установления порога переносимости боли крысой, когда к ее лапам прикладывали возрастающее давление; группа этих крыс была обработана паклитакселем интраперитональным путем и носителем Dysport (NaCl 0,9%) подподошвенным путем. В день 0 этот порог составил 536 г/мм2, затем снизился до 228 г/мм2 в день 15, до 216 г/мм2 в день 18 и составил 204 г/мм2 в день 21. Эти результаты показывают, что после инъекции i.p. паклитакселя чувствительность лапок крыс увеличилась после приложенного к лапам давления.
Введение Dysport в дозе 20 Ед./кг подподошвенным путем группе животных, обработанных только одним носителем паклитакселя (монтанокс 3% в NaCl 0,9%) интраперитональным путем, показывает, что порог переносимости боли крысой не изменился значительным образом. Болевой порог, возникший в результате механической стимуляции, приложенной к лапам крыс, находился в период от J0 до J21 на уровне 610 г/мм2.
Введение в правую лапку Dysport в дозе 20 Ед./кг подподошвенным путем группе животных, обработанных паклитакселем, показало, что порог переносимости боли крысой на ее левой лапе увеличился. Болевой порог, возникший в результате механической стимуляции, приложенной к лапам крыс, значительно увеличился, достигнув 540 г/мм2 в день J18 (т.е. 3 дня спустя после обработки Dysport) и 512 г/мм2 в день J21 (т.е. 6 дней спустя после обработки Dysport) против 244 г/мм2 в день J15 (до обработки Dysport).
Эти результаты показывают, что в этом тесте на периферическую невропатию, индуцированную четырьмя последовательными системными инъекциями паклитакселя, введение Dysport подподошвенным путем в правую лапу крыс индуцирует анальгетический эффект, который был определен на двух задних лапах крыс.
1. Применение по меньшей мере одного ботулинического нейротоксина типа А для получения лекарственного средства, предназначенного для лечения или предупреждения постхимиотерапевтической боли или болей, путем локального введения, позволяющего достичь генерализованного эффекта.
2. Применение по п.1, отличающееся тем, что постхимиотерапевтическая боль или боли индуцированы противораковым агентом или его солями.
3. Применение по п.1, отличающееся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из следующих соединений или их смесей: таксаны или соли платины.
4. Применение по п.1, отличающееся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из доцетакселя, паклитакселя (таксола) или их смесей.
5. Применение по п.3, отличающееся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из цисплатина, оксалиплатина или карбоплатина или их смесей.
6. Применение по п.1, отличающееся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из винкристина, винбластина, этопозида, тенипозида, Ara-А (аденозид-арабинозида), Ara-С (цитарабина), флуорурацила, прокарбазина, винорелбина, гемцитабина, или из продуктов или смесей продуктов, таких как паклитаксел/карбоплатин, паклитаксел/антрациклины, паклитаксел/карбоплатин/гемцитабин, паклитаксел/эстрамустин, доцетаксел/цисплатин, доцетаксел/доксорубицин, доцетаксел/винорелбин, доцетаксел/трастузумаб, доцетаксел/капецитабин или цисплатин/циклофосфамид, цисплатин/иринотекан, карбоплатин/топотекан, карбоплатин/эстрамустин, этопозид/эстрамустин, винбластин/эстрамустин.
7. Применение по п.1, отличающееся тем, что ботулинический нейротоксин вводят внутримышечным, внутрикожным или подкожным путем.
8. Применение по п.1, отличающееся тем, что ботулинический нейротоксин выбирают из ботулинических нейротоксинов подтипов А1 или А2.
9. Применение по п.1, отличающееся тем, что ботулинический нейротоксин является ботулиническим токсином подтипа А1.
10. Применение по п.1, отличающееся тем, что ботулинический нейротоксин ассоциирован по меньшей мере с одним полисахаридом или со смесью нескольких полисахаридов.
11. Применение по п.10, отличающееся тем, что полисахарид представляет собой 2-гидроксиэтилкрахмал.
12. Применение по п.1, отличающееся тем, что ботулинический нейротоксин является модифицированным ботулиническим нейротоксином, имеющим по меньшей мере одну исключенную, модифицированную или замененную аминокислоту.
13. Применение по п.1, отличающееся тем, что ботулинический нейротоксин ассоциирован по меньшей мере с одним поверхностно-активным веществом или со смесью поверхностно-активных веществ, выбираемых из катионных, анионных или неионных поверхностно-активных веществ.
14. Применение по п.1, отличающееся тем, что ботулинический нейротоксин ассоциирован по меньшей мере с одним поверхностно-активным веществом, выбираемым из поверхностно-активных веществ группы полисорбатов.
15. Применение по п.1, отличающееся тем, что ботулинический нейротоксин вводят в дозе от 0,01 Ед. и 1500 Ед.
16. Применение по п.1, отличающееся тем, что постхимиотерапевтическая боль или боли возникают у пациентов, больных раком толстой кишки, прямой кишки, молочной железы, легких, поджелудочной железы, яичек, почек, матки, яичника, предстательной железы, кожи, костей, спинного мозга, а также у пациентов, пораженных саркомами, карциномами, фиброаденомами, нейробластомами, лейкемией, лимфомами или меланомами.
17. Способ лечения или предупреждения постхимиотерапевтической боли или болей, включающий локальное введение лекарственного средства, содержащего ботулинический нейротоксин типа А, позволяющее достичь генерализованного эффекта.
18. Способ по п.17, отличающийся тем, что постхимиотерапевтическая боль или боли индуцированы противораковым агентом или его солями.
19. Способ по п.18, отличающийся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из следующих соединений или их смесей: таксаны или соли платины.
20. Способ по п.17, отличающийся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из доцетакселя, паклитакселя (таксола) или их смесей.
21. Способ по п.19, отличающийся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из цисплатина, оксалиплатина или карбоплатина или их смесей.
22. Способ по п.17, отличающийся тем, что постхимиотерапевтическая боль или боли вызваны противораковым агентом или его солями, выбранными из винкристина, винбластина, этопозида, тенипозида, Ara-А (аденозид-арабинозида), Ara-С (цитарабина), флуорурацила, прокарбазина, винорелбина, гемцитабина, или из продуктов или смесей продуктов, таких как паклитаксел/карбоплатин, паклитаксел/антрациклины, паклитаксел/карбоплатин/гемцитабин, паклитаксел/эстрамустин, доцетаксел/цисплатин, доцетаксел/доксорубицин, доцетаксел/винорелбин, доцетаксел/трастузумаб, доцетаксел/капецитабин или цисплатин/циклофосфамид, цисплатин/иринотекан, карбоплатин/топотекан, карбоплатин/эстрамустин, этопозид/эстрамустин, винбластин/эстрамустин.
23. Способ по п.17, отличающийся тем, что ботулинический нейротоксин вводят внутримышечным, внутрикожным или подкожным путем.
24. Способ по п.17, отличающийся тем, что ботулинический нейротоксин выбирают из ботулинических нейротоксинов типа А1 или А2.
25. Способ по п.17, отличающийся тем, что ботулинический нейротоксин является ботулиническим токсином типа А1.
26. Способ по п.17, отличающийся тем, что ботулинический нейротоксин ассоциирован по меньшей мере с одним полисахаридом или со смесью нескольких полисахаридов.
27. Способ по п.26, отличающийся тем, что полисахарид представляет собой 2-гидроксиэтилкрахмал.
28. Способ по п.17, отличающийся тем, что ботулинический нейротоксин является модифицированным ботулиническим нейротоксином, имеющим по меньшей мере одну исключенную, модифицированную или замененную аминокислоту.
29. Способ по п.17, отличающийся тем, что ботулинический нейротоксин ассоциирован по меньшей мере с одним поверхностно-активным веществом или со смесью поверхностно-активных веществ, выбираемых из катионных, анионных или неионных поверхностно-активных веществ.
30. Способ по п.17, отличающийся тем, что ботулинический нейротоксин ассоциирован по меньшей мере с одним поверхностно-активным веществом, выбираемым из поверхностно-активных веществ группы полисорбатов.
31. Способ по п.17, отличающийся тем, что ботулинический нейротоксин вводят в дозе от 0,01 Ед. и 1500 Ед.
32. Способ по п.17, отличающийся тем, что постхимиотерапевтическая боль или боли возникают у пациентов, больных раком толстой кишки, прямой кишки, молочной железы, легких, поджелудочной железы, яичек, почек, матки, яичника, предстательной железы, кожи, костей, спинного мозга, а также у пациентов, пораженных саркомами, карциномами, фиброаденомами, нейробластомами, лейкемией, лимфомами или меланомами.