Бензолсульфаномидные cоединения, пригодные для лечения расстройств, которые восприимчивы к модуляции дофаминового рецептора d3
Иллюстрации
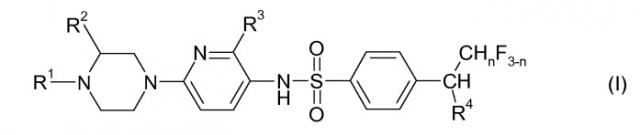
Показать всеИзобретение относится к соединениям формулы I
где R1 выбран из группы, состоящей из водорода и линейного C1-С3 алкила; R2 представляет собой водород или метил; R3 выбран из группы, состоящей из водорода, C1-C2-алкила и C1-С2-алкокси, R4 представляет собой С1-С2-алкил; n представляет собой 0, 1 или 2; и физиологически устойчивые соли этих соединений. Изобретение также относится к фармацевтической композиции, включающей, по меньшей мере, одно соединение формулы (I) и обладающей активностью и селективностью в отношении дофаминового рецептора D3, к применению соединений формулы I для лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3, и далее к способу лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3 или агонистов дофамина D3, включающему введение эффективного количества, по меньшей мере, одного соединения или физиологически устойчивой кислотно-аддитивной соли формулы I нуждающемуся в этом субъекту. Технический результат: получены и описаны новые соединения, которые могут найти свое применение в лечении заболеваний нервной системы. 7 н. и 20 з.п. ф-лы, 18 пр., 1 табл.
Реферат
Уровень техники
Настоящее изобретение относится к новым N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидным соединениям, в частности к соединениям формулы I, описанным в настоящем документе. Соединения обладают полезными терапевтическими свойствами и пригодны, в частности, для лечения заболеваний, которые восприимчивы к модуляции дофаминового рецептора D3.
Нейроны получают свою информацию посредством, среди прочего, рецептора, сопряженного с G-белком. Большое число веществ проявляет свое воздействие посредством этих рецепторов. Одним из них является дофамин. Существуют подтвержденные данные относительно присутствия дофамина и его физиологического назначения в качестве нейромедиатора. Расстройства в дофаминергической системе передачи приводят к заболеваниям центральной нервной системы, которые включают, например, шизофрению, депрессию и болезнь Паркинсона. Эти заболевания и другие лечат с помощью лекарственных средств, которые взаимодействуют с дофаминовыми рецепторами.
Вплоть до 1990 было четко определено фармакологически два подтипа дофаминового рецептора, названных рецепторами D1 и D2. Позднее третий подтип был найден, а именно рецептор D3, который, по-видимому, опосредует некоторые эффекты нейролептических и антипаркинсонических лекарственных средств (J. C. Schwartz et al., "The Dopamine D3 Receptor as a Target for Antipsychotics" in Novel Antipsychotic Drugs, H. Y. Meltzer, ed., Raven Press, New York 1992, pages 135-144; M. Dooley et al., Drugs and Aging 1998, 12:495-514; J.N. Joyce, Pharmacology and Therapeutics 2001, 90:231-59, "The Dopamine D3 Receptor as a Therapeutic Target for Antipsychotic and Antiparkinsonian Drugs"). После этого дофаминовые рецепторы были разделены на два семейства. С одной стороны, существует группа D2, состоящая из рецепторов D2, D3 и D4, и, с другой стороны, группа D1, состоящая из рецепторов D1 и D5.
В то время как рецепторы D1 и D2 широко распределены, рецепторы D3, по-видимому, экспрессируются региоселективно. Таким образом, эти рецепторы предпочтительно следует искать в лимбической системе и проекционных областях мезолимбической дофаминовой системы, особенно в прилежащем ядре, но также в других областях, таких как миндалевидная железа. Благодаря этой относительно региоселективной экспрессии рецепторы D3 рассматривают в качестве цели, обладающей несколькими побочными эффектами, и допускают, что, в то время когда селективный лиганд D3 обладал бы свойствами известных нейролептических лекарственных средств, он бы не имел их побочные неврологические эффекты, опосредованные дофаминовым рецептором D2 (P. Sokoloff et al., Arzneim. Forsch./Drug Res. 42(1):224 (1992), "Localization and Function of the D3 Dopamine Receptor"; P. Sokoloff et al., Nature, 347:146 (1990), "Molecular Cloning and Characterization of a Novel Dopamine Receptor (D3) as a Target for Neuroleptics").
N-(6-Пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения, обладающие аффиностью к дофаминовому рецептору D3, были описаны ранее на различных событиях, как, например, в WO2004/089905. Эти соединения обладают высокими аффиностями в отношении дофаминового рецептора D3 и, следовательно, были предложены в качестве пригодных для лечения заболеваний центральной нервной системы. К сожалению, их селективность в отношении рецептора D3 не всегда является удовлетворительной. Более того, некоторые из этих соединений имеют неудовлетворительный профиль DMPK (DMPK: метаболическая стабильность и/или фармакокинетика) и/или могут проявлять сердечно-сосудистые взаимодействия. Следовательно, существует постоянная потребность в обеспечении новыми соединениями, которые обладают улучшенной селективностью в отношении рецепторов D3 или улучшенным фармакологическим профилем, таким как профиль DMPK, и/или могут проявлять меньшие сердечно-сосудистые взаимодействия.
Сущность изобретения
Сейчас было найдено, что определенные N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения проявляют (с удивительной и неожиданной степенью) весьма селективное связывание с дофаминовым рецептором D3, а также удовлетворительный профиль DMPK, в частности относительно метаболической стабильности, и/или удовлетворительный сердечно-сосудистый профиль, т.е. соединения проявляют меньшие сердечно-сосудистые взаимодействия. Такими соединениями являются соединения, имеющие общую формулу I, их физиологически устойчивые соли и их N-оксиды:
где
R1 выбран из группы, состоящей из водорода, линейного C1-C3 алкила и фторированного линейного C1-C3 алкила;
R2 представляет собой водород или метил;
R3 выбран из группы, состоящей из водорода, галогена, C1-C2-алкила, фторированного C1-C2-алкила, C1-C2-алкокси и фторированного C1-C2-алкокси,
R4 представляет собой C1-C2-алкил или фторированный C1-C2-алкил; и
n представляет собой 0, 1 или 2.
Следовательно, настоящее изобретение относится к N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидным соединениям общей формулы I, а также к их физиологически устойчивым солям и к N-оксидам соединений I и их физиологически устойчивым солям.
Настоящее изобретение также относится к фармацевтической композиции, которая включает, по меньшей мере, одно N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидное соединение формулы I и/или, по меньшей мере, одну физиологически устойчивую соль I и/или его N-окид, где приемлемо совместно с физиологически приемлемыми носителями и/или вспомогательными веществами.
Настоящее изобретение также относится к способу лечения расстройств, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3 или агонистов дофамина D3, включающему введение эффективного количества, по меньшей мере, одного N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидного соединения формулы I, и/или, по меньшей мере, одной физиологически устойчивой кислотно-аддитивной соли I, и/или его N-оксида нуждающемуся в этом субъекту.
Подробное описание настоящего изобретения
Заболевания, которые восприимчивы к воздействию антагонистов дофаминового рецептора D3 или агонистов, включают расстройства и заболевания центральной нервной системы, в частности эмоциональные потрясения, нервные потрясения, стрессовые потрясения и соматоформные нарушения и психозы, и особенно шизофрению, депрессию, биполярное расстройство, наркотическую зависимость и токсикоманию (также называемую наркоманией), слабоумие, большое депрессивное расстройство, беспокойство, аутизм, дефицитарное расстройство внимания с (или без) повышенной активностью и расстройством личности. Кроме того, D3-опосредованные заболевания могут включать нарушения функции почки, в частности нарушения функции почки, которые вызваны диабетом, таким как сахарный диабет, также называемый диабетической нефропатией (смотри WO 00/67847).
В соответствии с изобретением одно или более соединений общей формулы I, имеющие значения, упомянутые вначале, могут быть использованы для лечения вышеупомянутых показаний. В случае если соединения формулы I обладают одним или более центрами ассиметрии, также возможно использовать энантиомерные смеси, в частности рацемические, диастереомерные смеси и таутомерные смеси; предпочтительными, однако, являются соответствующие по существу чистые энантиомеры, диастереомеры и таутомеры.
Подобным образом возможно использовать физиологически устойчивые соли соединений формулы I, особенно кислотно-аддитивные соли с физиологически устойчивыми кислотами. Примерами подходящих физиологически устойчивых органических и неорганических кислот являются хлороводородная кислота, бромоводородная кислота, фосфорная кислота, азотная кислота, серная кислота, органические сульфоновые кислоты, имеющие от 1 до 12 атомов углерода, например C1-C4-алкилсульфоновые кислоты, такие как метансульфоновая кислота, циклоалифатические сульфоновые кислоты, такие как S-(+)-10-камфорсульфоновые кислоты, и ароматические сульфоновые кислоты, такие как бензолсульфоновая кислота и толуолсульфоновая кислота, ди- и трикарбоновые кислоты и гидроксикарбоновые кислоты, имеющие от 2 до 10 атомов углерода, такие как щавелевая кислота, малоновая кислота, малеиновая кислота, фумаровая кислота, муциновая кислота, молочная кислота, винная кислота, лимонная кислота, гликолиевая кислота и адипиновая кислота, а также цис- и транс-коричная кислота, фуранкарбоновая кислота и бензойная кислота. Другие используемые кислоты описаны в Fortschritte der Arzneimittelforschung [Advances in Drug Research], Volume 10, pages 224 ff., Birkhauser Verlag, Basel and Stuttgart, 1966. Физиологически устойчивые соли соединений формулы I могут присутствовать в виде моно-, бис-, трис- и тетракис-солей, то есть они могут содержать 1, 2, 3 или 4 вышеупомянутых молекул кислоты на молекулу формулы I. Молекулы кислоты могут находиться в своей кислотной форме или в виде аниона.
Используемый в настоящем описании C1-C3 алкил представляет собой разветвленную или с неразветвленной цепью алкильную группу, содержащую 1, 2 или 3 атома углерода. Примерами таких групп являются метильная, этильная, н-пропильная и изопропильная.
Используемый в настоящем описании фторированный C1-C3 алкил представляет собой разветвленную или с неразветвленной цепью алкильную группу, содержащую 1, 2 или 3 атома углерода, где, по меньшей мере, один, например 1, 2, 3, 4 или 5, атом водорода или все атомы водорода заменены атомами фтора. Примерами таких групп являются фторметильная, дифторметильная, трифторметильная, 2-фторэтильная, 2,2-дифторэтильная, 2,2,2-трифторэтильная, 1,1,2,2-тетрафторэтильная, 3,3,3-трифторпропильная, 1-метил-2-фторэтильная, 1-метил-2,2-дифторэтильная, 1-метил-2,2,2-трифторэтильная и 1,1,1,3,3,3-гексафторпропан-2-ильная.
Используемый в настоящем описании C1-C2 алкокси представляет собой алкильную группу с неразветвленной цепью, содержащую 1 или 2 атома углерода, которая присоединена к остальной молекуле через атом кислорода. Примерами таких групп являются метокси и этокси.
Используемый в настоящем описании фторированный C1-C2 алкокси представляет собой алкоксигруппу в качестве, как определено выше, где, по меньшей мере, один, например 1, 2, 3, 4 или 5 атомов водорода, заменен атомами фтора. Примерами таких групп являются фторметокси, дифторметокси, трифторметокси, 2-фторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси и 1,1,2,2-тетрафторэтокси.
Первый предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R1 представляет собой водород.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R1 представляет собой этил или н-пропил.
Дополнительный предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, где R2 представляет собой метил. В соединениях, где R2 представляет собой метил, атом углерода, который несет R2, создает хиральный центр. Таким образом, конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой метил и где атом углерода, который несет R2, имеет S-конфигурацию. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой метил и где атом углерода, который несет R2, имеет R-конфигурацию.
Подобным образом предпочтительными являются смеси соединений, где атом углерода, который несет R2, имеет S-конфигурацию или R-конфигурацию соответственно. Эти смеси могут содержать равные количества или неравные количества соединения I, которое имеет R-конфигурацию относительно группы CH-R2, и соединения, которое имеет S-конфигурацию относительно CH-R2.
Предпочтительные смеси содержат S-изомер в избытке или являются энантиомерно чистыми относительно CH-R2.
Термин "энантиомерно чистый" означает, что смесь содержит соответствующее соединение в энантиомерном избытке, по меньшей мере 80%, в частности, по меньшей мере, 90% (ee).
Дополнительный предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой водород.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где R3 выбран из группы, состоящей из водорода, фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси. В частности, R3 выбирают из водорода, метила или метокси. Особенно предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R3 представляет собой метил. Дополнительный особенно предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R3 представляет собой метокси.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где n представляет собой 1.
Особенно предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где n представляет собой 2.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил. В соединениях по настоящему изобретению атом углерода, который несет R4, создает хиральный центр. Таким образом, конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил, и где атом углерода, который несет R4, имеет S-конфигурацию. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил, и где атом углерода, который несет R4, имеет R-конфигурацию.
Подобным образом предпочтительными являются смеси соединений, где атом углерода, который несет R4, имеет S-конфигурацию или R-конфигурацию соответственно. Эти смеси могут содержать равные количества или неравные количества соединения I, которое имеет R-конфигурацию относительно группы CH-R2, и соединения, которое имеет S-конфигурацию относительно CH-R4. Предпочтительные смеси содержат один S-изомер в избытке или являются энантиомерно чистыми относительно CH-R4.
Термин "энантиомерно чистый" означает, что смесь содержит соответствующее соединение в энантиомерном избытке, по меньшей мере, 80%, в частности, по меньшей мере, 90% (ee).
Особенно предпочтительный вариант осуществления Ia изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 1.
Дополнительный особенно предпочтительный вариант осуществления Ib изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 2.
Дополнительный особенно предпочтительный вариант осуществления Ic изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 0.
Соединения вариантов осуществления Ia, Ib и Ic имеют два хиральных центра и таким образом могут существовать в четырех разных стереоизомерных формах, а именно в форме
1. RR-соединения, где оба атома: атом углерода, несущий радикал R4, и атом углерода, несущий радикал R2, имеют R-конфигурацию,
2. SS-соединения, где оба атома: атом углерода, несущий радикал R4, и атом углерода, несущий радикал R2, имеют S-конфигурацию,
3. RS-соединения, где атом углерода, несущий радикал R4, имеет R-конфигурацию, в то время как атом углерода, несущий радикал R2, имеет S-конфигурацию, и
4. SR-соединения, где атом углерода, несущий радикал R4, имеет S-конфигурацию, в то время как атом углерода, несущий радикал R2, имеет R-конфигурацию.
Соединения вариантов осуществления Ia, Ib и Ic могут присутствовать в виде диастереомерных смесей, где RR-, SS-, RS- и SR-соединения могут присутствовать в равных или неравных количествах, как энантиомерные (рацемические или нерацемические) смеси, т.е. в виде смеси RR-соединения с SS-соединением или в виде смеси RS-соединения с SR-соединением, а также в форме чистых диастереомеров. Термин "чистый диастереомер" означает, что соответствующий диастереомер состоит из, по меньшей мере, на 80% и особенно, по меньшей мере, на 90% соответствующего соединения I, т.е. другие диастереомеры присутствуют в количествах, меньших чем 20%, в частности меньших чем 10%, из расчета на общее количество соединения I.
Примеры соединений варианта осуществления Ia включают 4-(2,2-Дифтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в качестве диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в качестве смеси RS-соединения с SR-соединением.
Примеры соединений варианта осуществления Ib включают 4-(2-Фтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в виде диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в качестве смеси RS-соединения с SR-соединением.
Примеры соединений варианта осуществления Ic включают 4-(2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в виде диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в виде смеси RS-соединения с SR-соединением.
Дополнительный особенно предпочтительный вариант осуществления Id изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 1.
Дополнительный особенно предпочтительный вариант осуществления Ie изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 2.
Дополнительный особенно предпочтительный вариант осуществления If изобретение относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 0.
Соединения вариантов осуществления Id, Ie и If могут присутствовать в виде рацемических или нерацемических смесей R-энантиомера с S-энантиомером, а также в форме чистого энантиомера. Термин "чистый энантиомер" означает, что соответствующий энантиомер состоит, по меньшей мере, на 80% и особенно, по меньшей мере, на 90% соответствующего соединения I, т.е. другой энантиомер присутствует в количествах, меньших чем 20%, в частности меньших чем 10%, из расчета на общее количество соединения I.
Примеры соединений варианта осуществления Id включают 4-(2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Id дополнительно включают 4-(2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Ie включают 4-(2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Ie дополнительно включают 4-(2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления If включают 4-(2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления If дополнительно включают N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((R)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид,
N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид.
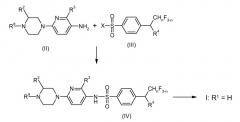
Соединения I по изобретению получают по аналогии со способами, известными из литературы. Важный подход к соединениям по изобретению предлагается реакцией 2-(пиперазин-1-ил)-5-аминопиридинового соединения II с производным бензолсульфоновой кислоты III, как показано на схеме 1.
Схема 1:
На схеме 1 n, R2, R3 и R4 имеют ранее указанные значения. Ra представляет собой защитную группу азота или выбрана из линейного C1-C3 алкила и фторированного линейного C1-C3 алкила. Подходящие N-защитные группы описаны, например, в PJ. Kocienski "Protecting Groups", 2nd ed., Georg Thieme Verlag, Stuttgart 2000, pp 186-237 и в указанной в настоящем документе литературе. Предпочтительными примерами N-защитных групп являются, например оксикарбонильные группы, такие как C1-C6-алкоксикарбонильная, например, метоксикарбонильная, этоксикарбонильная и Boc (третбутоксикарбонильная) и другие оксикарбонильные группы, такие как бензилоксикарбонильная (Cbz), аллилоксикарбонильная, 9-флуоренилметоксикарбонильная (Fmoc) и 2-триметилсилилэтоксикарбонильная (Teoc) или 2-пропенильная (аллил). X представляет собой нуклеофильно замещаемую уходящую группу, в частности атом галогена и, особенно, хлора или брома.
Соединения формулы IV, где Ra представляет собой защитную группу азота, в частности C1-C6-алкоксикарбонильную группу, такую как метоксикарбонильную, этоксикарбонильную и Boc (третбутоксикарбонильная), являются новыми и таким образом также образуют часть настоящего изобретения.
Соединения формулы IV, где Ra представляет собой линейный C1-C3 алкил или фторированный линейный C1-C3 алкил, относятся к соединениям I, где R1 представляет собой линейный C1-C3 алкил или фторированный линейный C1-C3 алкил.
Реакция, указанная на схеме 1, проходит при условиях реакции, которые общеприняты для получения арилсульфонамидных соединений или арилсульфоновых сложных эфиров соответственно и которые описаны, например, в J. March, Advanced Organic Chemistry, 3rd edition, John Wiley & Sons, New York, 1985, p 444 и указанной в настоящем документе литературе, European J. Org. Chem. 2002 (13), pp. 2094-2108, Tetrahedron 2001, 57 (27) pp. 5885-5895, Bioorganic and Medicinal Chemistry Letters, 2000, 10(8), pp. 835-838 and Synthesis 2000 (1 ), pp. 103-108.
Реакцию обычно проводят в инертном растворителе, например в простом эфире, таком как диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран, галогеноуглеводороде, таком как дихлорметан, алифатическом или циклоалифатическом углеводороде, таком как пентан, гексан или циклогексан, или ароматическом углеводороде, таком как толуол, ксилен, кумол и подобные, или в смеси вышеупомянутых растворителей.
Реакцию соединения II с соединением III обычно проводят в присутствии вспомогательного основания. Подходящими основаниями являются неорганические основания, такие как карбонат натрия или карбонат калия или гидрокарбонат натрия или гидрокарбонат калия, и органические основания, например триалкиламины, такие как триэтиламин, или пиридиновые соединения, такие как пиридин, диметилпиридин и подобные. Последние из упомянутых соединений можно в то же время использовать в качестве растворителей. Вспомогательные основания обычно применяют, по меньшей мере, в эквимолярных количествах из расчета на соединение амина II.
Реакция соединения II с соединением III приводит к соединению IV, с которого в случае, если Ra представляет собой N-защитную группу, снимают защитную группу с получением соединения общей формулы I, где R1 представляет собой водород. Снятие защитной группы соединения IV может быть достигнуто стандартными способами, например, с помощью способов, описанных в PJ. Kocienski "Protecting Groups", 2nd ed., Georg Thieme Verlag, Stuttgart 2000, pp 186-237, и в указанной в настоящем документе литературе. Общепринятые способы могут быть затем использованы для реакции этих соединений с алкилирующим агентом R1'-Z, в котором R1' представляет собой C1-C3-алкил или фторированный C1-C3-алкил, и Z представляет собой нуклеофильно замещаемую уходящую группу (например, галоген, такой как хлор, бром или йод), с получением соединения I, в котором R1 представляет собой C1-C3-алкил или фторированный C1-C3-алкил. Условия реакции, необходимые для этого, раскрыты, например, в WO 02/83652, Tetrahedron 2000, 56(38) pp. 7553-7560 и Synlett. 2000 (4), pp. 475-480.
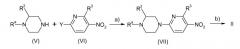
Соединения общей формулы II сами по себе известны или могут быть получены способом, показанным на схеме 2.
Схема 2:
На схеме 2 Ra, R2, и R3 имеют ранее указанные значения. Y представляет собой нуклеофильно замещаемую уходящую группу, в частности атом галогена, например хлор или бром, или алкилсульфонильную группу, например метилсульфонил.
Реакция, показанная на стадии a) схемы 2, проходит при условиях реакции, которые являются общепринятыми для нуклеофильного замещения на ароматический радикал и которые описаны, например, в Tetrahedron 1999, 55(33), pp. 10243-10252, J. Med. Chem. 1997, 40(22), pp. 3679-3686 и Synthetic Communications, 1993, 23(5), pp. 591-599. По необходимости, может быть выгодным преобразовать кольцевой атом азота в пиридиновом кольце в его N-оксид (смотри, например, Angew. Chem. Int. Ed. Engl., 2002 41(11), pp. 1937-1940, J. Med. Chem. 1985, 28(2), pp. 248-252 и Tetrahedron Lett. 2002 43(17) pp. 3121-3123). В связи с последующим восстановлением нитрогруппы в VII (стадия b) N-оксидная группа также восстанавливается. Для этого восстановление проводят, например, в присутствии солей индия.
Если Y в соединении VI представляет собой бром, сопряжение на стадии a) схемы 2 может также быть достигнуто при катализе на палладии в присутствии вспомогательного основания, например карбоната щелочного металла, такого как карбонат цезия. Особенно подходящими палладиевыми катализаторами в этой связи являются соединения палладия (0) или соединения палладия, которые способны образовать соединение палладия (0) при условиях реакции, например дихлорид палладия, тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0), преимущественно в комбинации с фосфиновыми лигандами, например, триарилфосфины, такие как трифенилфосфин, триалкилфосфины, такие как трибутилфосфин, и циклоалкилфосфины, такие как трициклогексилфосфин, и, особенно, используя фосфиновые хелатные лиганды, такие как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил. Условия, которые являются необходимыми для реакций этой природы, описаны, например, в Tetrahedron Lett. 2001, 42(22), p. 3681 и Tetrahedron Lett. 2002, 43(12), pp. 2171-2173.
На стадии b) нитрогруппу в соединении VII восстанавливают до NH2 группы с получением соединения II. Условия реакции, которые являются необходимыми для стадии b), относятся к общепринятым условиям для восстановления ароматических нитрогрупп, которые широко были описаны в литературе (смотри, например, J. March, Advanced Organic Chemistry, 3rd ed., J. Wiley & Sons, New-York, 1985, p. 1183 и литературу, указанную в этой ссылке). Восстановление может быть достигнуто, например, с помощью взаимодействия нитросоединения VII с помощью металла, такого как железо, цинк или олово, при кислотных условиях реакции, т.е. используя образующийся водород или используя сложный гидрид, такой как литийалюмогидрид или боргидрид натрия, предпочтительно в присутствии соединений переходного металла никеля или кобальта, таких как NiCl2(P(фенил)3)2 или CoCl2,(смотри Ono et al. Chem. Ind. (London), 1983 p.480), или используя NaBH2S3 (смотри Lalancette et al. Can. J. Chem. 49, 1971, p. 2990), делая возможным проведение этих восстановлений в зависимости от конкретного реагента в веществе или в растворителе или разбавителе. С другой стороны, восстановление VII до II может быть проведено с помощью водорода в присутствии катализатора переходного металла, например, используя водород в присутствии катализаторов, основанных на платине, палладие, никеле, рутении или родии. Катализаторы могут содержать переходный металл в элементарной форме или в форме сложного соединения, соли или оксида переходного металла, делая возможным, для цели изменения активности, использование общепринятых со-лигандов, например органических фосфиновых соединений, таких как трифенилфосфин, трициклогексилфосфин или три-н-бутилфосфины или фосфиты. Катализатор обычно применяют в количествах от 0,001 до 1 моль на моль соединения VII, рассчитанные на металл катализатора. В предпочтительном варианте восстановление осуществляют, используя хлорид олова (II) по аналогии со способами, описанными в Bioorganic and Medicinal Chemistry Letters, 2002, 12(15), pp. 1917-1919 и J. Med. Chem. 2002, 45(21), pp. 4679-4688. Реакцию VII с хлоридом олова (II) предпочтительно проводят в инертном органическом растворителе, предпочтительно спирте, таком как метанол, этанол, изопропанол или бутанол.
N-оксиды соединения формулы I могут быть получены с помощью обработки соединения формулы I окисляющим агентом, в частности неорганическим или органическим пероксидом или гидропероксидом, таким как пероксид водорода, или перкарбоновыми кислотами, такими как надуксусная кислота, надбензойная кислота или м-хлорпербензойная кислота.
Если не указано другого, вышеописанные реакции в основном проводят в растворителе при температурах между комнатной температурой и температурой кипения используемого растворителя. С другой стороны, энергия активации, которая необходима для реакции, может быть введена в реакционную смесь, используя микроволны, некоторые из которых, оказывается, имеют значение, в частности в случае, если реакции катализируются с помощью переходных металлов (относительно реакций, использующих микроволны, смотри Tetrahedron 2001, 57, p. 9199 ff. p. 9225 ff., а также, в общем случае, "Microwaves in Organic Synthesis", Andre Loupy (Ed.), Wiley-VCH 2002).
Примерами растворителей, которые могут быть использованы, являются простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран, апротонные полярные растворители, такие как диметилформамид, диметилсульфоксид, диметоксиэтан и ацетонитрил, ароматические углеводороды, такие как толуол и ксилен, кетоны, такие как ацетон или метилэтилкетон, га