3-(3,4-диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорид, анальгетическое и противомикробное средство
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к новому биологически активному соединению класса индазола: 3-(3,4-диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлориду (I), имеющему приведенную ниже формулу. Заявляемое соединение проявляет анальгетическую активность в дозе, почти в 2 раза меньшей, чем анальгин, превосходя его при этом по уровню действия. Кроме того, оно проявляет высокую бактериостатическую активность в отношении Staphylococcus aureus (3,8 мкг/мл) и выраженную бактериостатичекую активность в отношении Staphylococcus epidermidis (15,6-31,2 мкг/мл), Staphylococcus saprophyticus (250 мкг/мл) и грибка Candida albicans (500-1000 мкг/мл), а также бактерицидную активность в отношении трех названных видов стафилококков (соответственно 62,5, 500 и 1000 мкг/мл), превосходя по уровню действия фенилсалицилат. Соединение (I) относится к малотоксичным (ЛД50=1500 мг/кг). Кроме того, изобретение относится к анальгетическому и противомикробному средствам, представляющим собой соединение (I). 3 н.п. ф-лы, 2 табл., 2 пр.
Реферат
Изобретение относится к области органической химии, а именно новому биологически активному соединению класса индазола: 3-(3,4-диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлориду, провляющему анальгетическую и антимикробную активность, что позволяет предложить его использование в медицине в качестве анальгетического и антимикробного средства.
В практической медицине известен препарат метамизол натрия (анальгин), аналогичный по фармакологическому (анальгетическому) действию [Машковский М.Д. Лекарственные средства, 16-е изд. - М., Новая Волна: издатель Умеренков, 2010, с.164-165]. По антимикробному действию аналогичен препарат фенилсалицилат [там же, с.950-951].
Близкими по структуре к предполагаемым соединениям являются 1,3-диарилциклоалканопиразолы (индазолы), представляющие собой ингибиторы циклооксигеназы и противовоспалительные агенты (см. Ferro М., Sui Z., Wachter M. Preparation of 1,3 and 2,3-diarylcycloalkano and cycloalkeno pyrazoles as selective inhibitors of cyclooxygenase-2 and antiflammatory agents, Pat. US 6083969; Chem. Abstracts, 2000, Vol.133, №7, 89521f). Ближайший среди них аналог имеет следующую структуру:
Сведения об анальгетической и антимикробной активности аналогов отсутствуют.
Более близкими структурными аналогами к заявляемым соединениям, взятыми за прототип, являются основания общей формулы
где R =n-толил, n-нитрофенил (см. Михайловский А.Г., Алиев З.Г., Базина Н.Г., Пантюхин А.А., Вахрин М.И., 2-Ароилциклогексаноны в синтезе азолов, ХГС, 2010, №6, с.905-911). Их основное отличие по структуре от заявляемого соединения в том, что они содержат другие радикалы и являются основаниями, а не гидрохлоридами. Данных об анальгетической и антимикробной активности этих соединений в литературе не имеется.
Задачей создания изобретении является расширение арсенала средств воздействия на живой организм.
Поставленная задача решается посредством синтеза 3-(3,4-диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорида (I) формулы:
Поставленная задача решается анальгетическим средством, представляющим собой 3-(3,4-Диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорид (I) формулы:
Поставленная задача решается противомикробным средством, представляющим собой 3-(3,4-Диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорид (I) формулы:
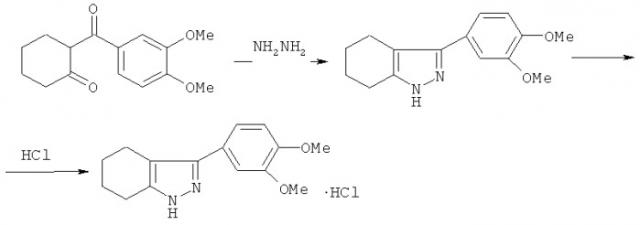
Соединение I получают взаимодействием 2-(3,4-диметоксибензоил)-циклогексанона с гидразингидратом в среде изопропанола при кипячении в течение 30 минут с последующим выделением целевых продуктов известными приемами. Реакция идет по схеме, приведенной ниже.
Методика получения исходного дикетона аналогична изложенной нами ранее (см. Михайловский А.Г., Алиев З.Г., Базина Н.Г., Пантюхин А.А., Вахрин М.И. 2-Ароилциклогексаноны в синтезе азолов, ХГС, 2010, №6, с.905-911).
Технический результат, получаемый при реализации изобретения, состоит в получении малотоксичного соединения с высоким выходом и высокой анальгетической и антимикробной активностью. Методика синтеза проста, исходные соединения легкодоступны.
Пример 1. Синтез 3-(3,4-диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорида (I). К раствору 2.62 г (0.01 моль) 2-(3,4-диметоксибензоил)-циклогексанона в 10 мл кипящего 2-пропанола прибавляли 0.7 мл (15 ммоль) (0.015 моль) 70% раствора гидразингидрата. Смесь кипятили 30 минут, охлаждали до 20°С, разбавляли 100 мл ледяной воды, выпавший осадок отфильтровывали, сушили, растворяли в 150 мл этилацетата и пропусканием сухого газообразного HCl получали гидрохдорид (I), который отфильтровывали, сушили и перекристаллизовывали из 2-пропанола. Выход 67%. Тпл. 238-240°С. Соединение I: C15H18N2O2·HCl.
Найдено, %: С 60.93; Н 6.37; N 9.58; Cl 12.03;
Вычислено, %: С 61.11; Н 6.50; N 9.51; Cl 8.93;
Соединение I представляет собой бесцветное кристаллические вещество, легко растворимо в ДМСО, ДМФА, хлороформе, трудно растворимо в воде и спирте. Устойчиво при хранении в обычных условиях.
В ИК спектре основания соединения I, снятом в пасте в вазелиновом масле, присутствуют полосы валентных колебаний групп NH индазольного цикла (3250 см-1). Получение основания вещества I: водную суспензию обрабатывают избытком водного раствора аммиака, полученное основание отфильтровывают, тщательно промывая водой, и сушат.
Спектр ПМР гидрохлорида I снят в CDCl3 (300 МГц), внутренний эталон - ГМДС. Спектр содержит (δ, м.д.): 1.79-1.81 мультиплет, 4Н, 5,6-(СН2)2; 2.63-2.69 мультиплет, 4Н, 4-СН2 и 7-СН2; 3.85 с, 3H, (СН3О) и 3.89 с, 3H, (СН3О); 6.85-7.10, мультиплет (3H, Ar); 12.63 синглет (2NH+).
Фармакологические исследования предлагаемого соединения включают определение острой токсичности, анальгетической и антимикробной активности.
Пример 2. Первичным этапом исследования было изучение соединения (I) на острую токсичность. Токсичность изучали на белых мышах (самках) массой 16-18 гр. при однократном оральном введении. Наблюдение велось в течение 6 суток, ежедневно отмечалось поведение и гибель животных (Беленький М.Л. Элементы количественной оценки фармакологического эффекта. - Л.: Медгиз, 1963 г.).
Оценку анальгетических свойств изучали на беспородных мышах массой 18-22 грамм методом термического раздражения "горячая пластинка" по Эдди и Леймбах (Eddy N.B., Leimbah D.J.-Pharmacol and Exper. Ther. 1953, 385-393).
Исследуемые препараты вводили внутрибрюшинно в виде взвеси в 2% крахмальной слизи в дозе 50 мг/кг. У интактных животных латентный период оборонительного рефлекса не превышает 10 сек. Показателем болевой чувствительности служила длительность пребывания животного на горячей пластинке до момента облизывания задних лапок, измеряемая в секундах.
В качестве стандартного препарата использовали метамизол натрия (анальгин). Результаты эксперимента представлены в таблице 1.
| Таблица 1 | |||||
| Оценка анальгетической активности соединения (I). | |||||
| № п/п | Соединение | Кол-во животных в опыте (n) | Доза и путь введения мг/кг | (ЛД50), МГ/КГ орально | Время оборонительного рефлекса через 2,5 часа |
| 1. | I | n=10 | 1500 мг/кг орально | 1500. | 22,60±1,44 |
| 2. | Контроль 2% крахм. слизь | n=6 | 50 мг/кг, в/б | - | 10,75±1,63 |
| 3. | Анальгин | n=6 | *93 мг/кг (ЕД50), в/б | *3300 | 16,33±3,02 |
| *Величины ЕД50 и ЛД50 для анальгина взяты из книги: Сигидин Я.А., Шварц Г.Я., Арзамасцев А.П., Либерман С.С. Лекарственная терапия воспалительного процесса: Экспериментальная и клиническая фармакология противовоспалительных препаратов. М.: Медицина, 1988. - 240 с. |
Как видно из данных таблицы, заявляемое соединение увеличивает время оборонительного рефлекса на 22,60±1,44 минуты, что выше, чем у препарата сравнения анальгина (16,33±3,02 минуты). При этом следует учесть, что испытуемая доза анальгина (93 мг/кг) почти в 2 раза превосходит дозу соединения (I) (50 мг/мл). Таким образом, испытуемое соединение по сравнению с анальгином оказывается более активным в 2 раза. Согласно приведенным данным литературы, анальгин по сравнению с предлагаемым соединением менее токсичен (ЛД50=3300 мг/мл). У соединения (I) для этой величины определено значение 1500 мг/мл). В то же время согласно классификации К.К.Сидорова оно оказывается малотоксичным, что делает его перспективным в качестве лекарственного препарата.
Пример. 3 Противомикробная активность.
Для определения противомикробной активности использовали общепринятый метод двукратных серийных разведении (Першин Г.Н. Методы экспериментальной химиотерапии. - М.: Медицина, 1971, с.109). Противомикробные свойства определяли на 4-х музейных штаммах, полученных из коллекции ФГУН ГИСК им. Л.А.Тарасовича Роспотребнадзора (г.Москва): Staphylococcus aureus (штамм 906), Staphylococcus epidermidis (штамм 52186), Staphylococcus saprophyticus (штамм 15305) и Candida albicans №24433 ATCC. Эксперименты начинали с подготовки исходных разведении в питательном бульоне музейных микроорганизмов из суточной агаровой культуры по оптическому стандартному образцу мутности (ОСО) на 10 ME. Микробная нагрузка соответствовала 2,5×105 микробных тел в 1 мл. Микробную взвесь вносили в приготовленные разведения препарата в питательной среде (соединение растворяли в 0,5 мл ДМСО). Факт ингибирования (торможения) роста бактерий и дрожжеподобных грибков отмечали после 20-ти часового термостатирования при 37°С.
Результаты бактерицидного эффекта фиксировали через 7 суток при 37°С, а окончательно - после высева на твердый скошенный агар (РПА). Максимально испытанная концентрация соединений соответствовала 1 000,0 мкг/мл. Противомикробную (ингибирующую и бактерицидную) активность оценивали по минимально действующей концентрации.
Результаты эксперимента представлены в таблице 2. Как видно из таблицы, соединение I подавляет рост золотистого стафилококка в концентрации 3,9 мкг/мл, эпидермального стафилококка - >15,6<31,2 мкг/мл, сапрофитного стафилококка - 250 мкг/мл. Соответствующее бактерицидное действие в отношении этих культур составляет 62,5, 500 >1000 мкг/мл. Соединение подавляет рост культуры Candida Albicans в интервале >500<1000 мкг/мл, бактерицидного эффекта не обнаружено.
| Таблица 2. | |||||||||
| Результаты исследований соединения (I) на Противомикробную активность | |||||||||
| № п/п | Шифр соединения | St. aureus | St. epidermidis | St. saprophyticus | Cand. albicans | ||||
| МИК* | МБК** | МИК* | МБК** | МИК* | МБК** | МИК* | МБК** | ||
| 1. | Е-7 | 3,9 | 62,5 | >15,6<31,2 | 500,0 | 250,0 | >1000,0 | >500,0<1000,0 | - |
| 2. | Фенилсалицилат | 750 | 2000 | >1000, 0 | >1000, 0 | >1000, 0 | >1000,0 | - | - |
| 3. | Контроль ДМСО | рост | рост | рост | рост | ||||
| Примечание: *МИК - минимальная ингибирующая концентрация, мкг/мл; | |||||||||
| **МБК - минимальная бактерицидная концентрация, мкг/мл; | |||||||||
| (-) - отсутствие противомикробного действия. | |||||||||
| результаты по ПМА на St. aureus получены на образце от 22. 06. 2010 г.(per. номер 1480 ЕНИ ПГНИУ) |
Препарат сравнения фенилсалицилат проявляет слабую активность в отношении золотистого стафилококка (750 мг/мл), в отношении остальных видов стафилококка он практически неактивен, в отношении Candida albicans неактивен.
Таким образом, предлагаемое соединение проявляет анальгетическую активность, почти в 2 раза более высокую, чем анальгин. Кроме того, оно проявляет высокую бактериостатическую активность в отношении Staphylococcus aureus и выраженную бактериостатичекую активность в отношении Staphylococcus epidermidis, Staphylococcus saprophyticus и грибка Candida albicans, а также бактерицидную активность в отношении трех названных видов стафилококков, превосходя по уровню действия фенилсалицилат. Соединение относится к малотоксичным. С учетом того, что соединение (I) превосходит по уровню действия препараты, применяемые в медицинской практике, оно может найти применение в медицине в качестве анальгетического и антимикробного средства.
1. 3-(3,4-Диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорид (I) формулы:
2. Анальгетическое средство, представляющее собой 3-(3,4-диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорид (I) формулы:
3. Противомикробное средство, представляющее собой 3-(3,4-диметоксифенил)-4,5,6,7-тетрагидроиндазола гидрохлорид (I) формулы: