Новый моногидрат производного нафтиридина и способ его получения
Иллюстрации
Показать всеИзобретение относится к новому соединению, а именно моногидрату 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-с)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-2(1Н)-она, который обладает сильной антибактериальной активностью. Это соединение обладает высокой степенью безопасности и применимо в производстве лекарственных препаратов в качестве исходного лекарственного средства. Кроме того, описан способ получения моногидрата 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-с)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-2(1Н)-она формулы 19 и способы получения промежуточных соединений.
7 н. и 1 з.п. ф-лы, 1 табл., 1 ил., 17 пр.
Реферат
ОБЛАСТЬ ТЕХНИЧЕСКОГО ПРИМЕНЕНИЯ
Настоящее изобретение относится к новому моногидрату производного нафтиридина и способу его получения.
УРОВЕНЬ ТЕХНИКИ
В медицинской практике используют большое разнообразие антибиотиков и синтетических антибактериальных средств для лечения инфекционных заболеваний. Однако недавно были обнаружены резистентные бактерии, такие как метициллин-резистентные Staphylococcus aureus (MRSA), ванкомицин-резистентные Enterococcus (VRE) и пенициллин-резистентные Streptococcus pneumoniae (PRSP). Лечение пациентов, инфицированных такими резистентными микроорганизмами, представляло серьезную проблему. В дополнение, появились полирезистентные микроорганизмы, которые приобрели резистентность к многочисленным лекарственным препаратам. Инфекционные заболевания, вызываемые полирезистентными микроорганизмами, как заболевания, трудно поддающиеся лечению, представляли собой крупные общемировые проблемы.
Появление противомикробных средств, которые эффективны против этих резистентных микроорганизмов, было крайне необходимо, и, например, соединение хинолона, считающееся эффективным против MRSA, раскрыто в WO 99/07682 (ПАТЕНТНЫЙ ДОКУМЕНТ 1). Более того, соединения, раскрытые в WO 2004/002490 (ПАТЕНТНЫЙ ДОКУМЕНТ 2) и в WO 2004/002992 (ПАТЕНТНЫЙ ДОКУМЕНТ 3), известны как соединения, имеющие механизмы действия, отличные от механизмов действия существующих лекарственных средств.
ПАТЕНТНЫЙ ДОКУМЕНТ 1: Публикация международного патента, брошюра № WO 99/07682
ПАТЕНТНЫЙ ДОКУМЕНТ 2: Публикация международного патента, брошюра № WO 2004/002490
ПАТЕНТНЫЙ ДОКУМЕНТ 3: Публикация международного патента, брошюра № WO 2004/002992
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, КОТОРЫЕ ДОЛЖНО РЕШАТЬ ИЗОБРЕТЕНИЕ
Существует потребность в разработке лекарственного средства, обладающего высокой степенью безопасности и сильной антибактериальной активностью, направленной против грамположительных бактерий, грамотрицательных бактерий и резистентных бактерий. Кроме того, большие ожидания связывали с применимым способом получения этого лекарственного средства и генерируемыми в производстве применимыми промежуточными продуктами.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
В таких условиях авторы настоящего изобретения проводили обширные исследования и обнаружили, что моногидрат 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-c)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-2(1H)-она (1) обладает сильной антибактериальной активностью и высокой степенью безопасности; (2) не обнаруживает способности расплываться, поглощая влагу из атмосферы, или гигроскопичности; (3) легкий в обращении; (4) получается при использовании растворителя, безопасного для человеческого организма; (5) получается в условиях, которые не приносят существенного вреда окружающей среде; и (6) пригоден для массового производства.
Кроме того, авторы настоящего изобретения обнаружили, что моногидрат 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-c)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-(1H)-она легко может быть получен посредством взаимодействия
(1) производного нафтиридина, представляемого формулой [7]
[Формула 7]
и получаемого взаимодействием производного пиридина, представляемого формулой [1]
[Формула 1]
,
с эфиром акриловой кислоты с образованием производного акриловой кислоты, представляемого общей формулой [2]
[Формула 2]
,
где R1 представляет собой алкильную группу,
затем, восстанавливая/циклизируя полученное производное акриловой кислоты с образованием производного дигидронафтиридина, представляемого формулой [3]
[Формула 3]
,
затем взаимодействием полученного производного дигидронафтиридина с соединением, представляемым общей формулой [4]
[Формула 4]
,
где L1 представляет собой уходящую группу; Y представляет собой защищаемую карбонильную группу,
получают производное дигидронафтиридина, представляемое общей формулой [5]
[Формула 5]
,
где заместитель Y определен выше,
затем, окисляя полученное производное дигидронафтиридина с образованием производного нафтиридина, представляемого общей формулой [6]
[Формула 6]
,
где заместитель Y определен выше,
и затем удаляя защиту полученного производного нафтиридина с помощью
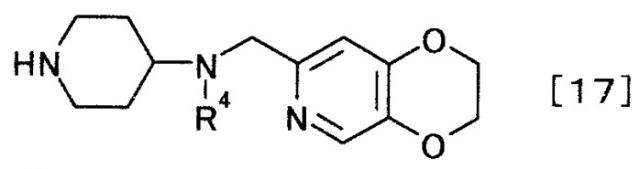
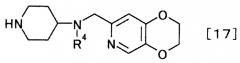
(2) производного пиперидина, представляемого общей формулой [17]
[Формула 17]
,
где R4 представляет собой иминозащитную группу,
и получаемого взаимодействием производного койевой кислоты, представляемого общей формулой [8]
[Формула 8]
,
где R2 является защитной группой гидроксила,
с соединением, представляемым общей формулой [9]
[Формула 9]
,
где L2 представляет собой уходящую группу; X представляет собой уходящую группу,
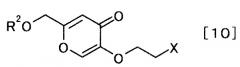
чтобы получить производное койевой кислоты, представляемое общей формулой [10]
[Формула 10]
,
где R2 и X определены выше,
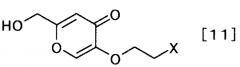
затем удаляя защиту полученного производного койевой кислоты, с образованием производного койевой кислоты, представляемого общей формулой [11]
[Формула 11]
,
где X определен выше,
затем взаимодействием полученного производного койевой кислоты с аммиаком получают производное пиридина, представляемое формулой [12]
[Формула 12]
,
затем, окисляя полученное производное пиридина, чтобы получить производное пиридина, представляемое формулой [13] [Формула 13]
,
затем взаимодействием полученного производного пиридина с производным пиперидина, представляемым общей формулой [14]
[Формула 14]
,
где R3 представляет собой иминозащитную группу,
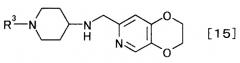
получают производное пиперидина, представляемого общей формулой [15]
[Формула 15]
,
где R3 определен выше,
затем защищают иминогруппу, чтобы получить производное пиперидина, представляемого общей формулой [16]
[Формула 16]
,
где R4 определен выше; R3 определен выше,
и затем удаляют защиту у полученного производного пиперидина, чтобы получить (3) производное нафтиридина, представляемое общей формулой [18]
[Формула 18]
,
где R4 определен выше,
и затем удаляют защиту полученного производного нафтиридина.
Авторы изобретения далее обнаружили, что производное койевой кислоты, представляемое общей формулой [19]
[Формула 19]
,
где R2a представляет собой атом водорода или защитную группу гидроксила, X представляет собой уходящую группу, является важным промежуточным продуктом производства.
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
Моногидрат 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-c)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-2(1H)-она по настоящему изобретению (1) обладает сильной антибактериальной активностью и высокой степенью безопасности, (2) не обнаруживает способности расплываться, поглощая влагу из атмосферы, или гигроскопичности, (3) является легким в обращении, (4) получается при использовании безопасного для человеческого организма растворителя, (5) получается в условиях, которые не приносят большого вреда окружающей среде, и (6) является пригодным для массового производства и, следовательно, применим в качестве массового фармацевтического препарата.
Способ получения по настоящему изобретению имеет такие особенности как (1) высокий выход, (2) отсутствие необходимости использования колоночной хроматографии на силикагеле, (3) следовательно, незначительное количество отходов и (4) неиспользование токсичных или неустойчивых реагентов, и, следовательно, применим для получения моногидрата 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-c)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-2(1H)-она.
Кроме того, производное койевой кислоты, представляемое общей формулой [19]
[Формула 19]
,
где R2a и X определены выше, является полезным промежуточным продуктом производства.
НАИЛУЧШИЙ ПУТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В дальнейшем настоящее изобретение будет описано подробно. В настоящем описании изобретения, если не будет оговорено иначе, термин «атом галогена» обозначает, например, атом фтора, атом хлора, атом брома и атом йода. Термин «алкильная группа» обозначает, например, C1-6 алкильную группу с разветвленной или неразветвленной цепью, такую как метильная, этильная, пропильная, изопропильная, бутильная, втор-бутильная, изобутильная, трет-бутильная и пентильная группа. Термин «аралкильная группа» обозначает, например, ар-C1-6 алкильную группу, такую как бензил, дифенилметил, тритил, фенетил и нафтилметил. Термин «алкоксиалкильная группа» обозначает, например, C1-6 алкилокси C1-6 алкильную группу, такую как метоксиметил и 1-этоксиэтил. Термин «аралкилоксиалкильная группа» обозначает, например, ар-C1-6 алкилокси C1-6 алкильную группу, такую как бензилоксиметил и фенетилоксиметил. Термин «алкилсульфонильная группа» обозначает, например, C1-6 алкилсульфонильную группу, такую как метилсульфонил, трифторметилсульфонил и этилсульфонил. Термин «арилсульфонильная группа» обозначает, например, группу, такую как бензолсульфонил и толуолсульфонил. Термин «алкилсульфонилоксигруппа» обозначает, например, C1-6 алкилсульфонилоксигруппу, такую как метилсульфонилокси, трифторметилсульфонилокси и этилсульфонилокси. Термин «арилсульфонилоксигруппа» обозначает, например, такую группу, как бензолсульфонилокси и толуолсульфонилокси.
Термин «ацильная группа» обозначает, например, формильную группу, C2-6 алканоильную группу c прямой или разветвленной цепью, такую как ацетил, пропионил, бутирил, изовалерил и пивалоил, и ар-C1-6 алкилкарбонильную группу, такую как бензилкарбонил; циклическую карбонильную группу, такую как бензоил и нафтоил, и гетероциклическую карбонильную группу, такую как никотионил, теноил, пирролизинокарбонил и фуроил. Термин «алкоксикарбонильная группа» обозначает, например, C1-6 алкилоксикарбонильную группу c прямой или разветвленной цепью, такую как метоксикарбонил, этоксикарбонил, 1,1-диметилпропоксикарбонил, изопропоксикарбонил, 2-этилгексилоксикарбонил, трет-бутоксикарбонил и трет-пентилоксикарбонил. Термин «аралкилоксикарбонильная группа» обозначает, например, ар-C1-6 алкилоксикарбонильную группу, такую как бензилоксикарбонил и фенетилоксикарбонил.
Термин «кислородсодержащая гетероциклическая группа» обозначает, например, группу, такую как тетрагидропиранил и тетрагидрофуранил. Термин «серосодержащая гетероциклическая группа» обозначает, например, группу, такую как тетрагидротиопиранил. Термин «защищенная карбонильная группа» обозначает, например, группу, образованную из карбонильной группы и спирта, такую как (гидрокси)(метокси)метилен, (гидрокси)(этокси)метилен, (гидрокси)(пропокси)метилен, (гидрокси)(изопропокси)метилен, (гидрокси)(бутокси)метилен, (гидрокси)(пентилокси)метилен, (гидрокси)(гексилокси)метилен, (гидрокси)(гептилокси)метилен, (гидрокси)(октилокси)метилен, (гидрокси)(1,1-диметилпропокси)метилен, диметоксиметилен, диэтоксиметилен, дипропоксиметилен, диизопропоксиметилен, дибутоксиметилен, бис(бензилокси)метилен, 1,3-диоксолан-2-илиден и 1,3-диоксан-2-илиден, группу, образованную из карбонильной группы и тиола, такую как бис(метилтио)метилен, бис(этилтио)метилен, бис(бензилтио)метилен, 1,3-дитиолан-2-илиден и 1,3-дитиан-2-илиден, и группу, такую как оксазолин-2-илиден, имидазолидин-2-илиден и тиазолидин-2-илиден. Термин «уходящая группа» обозначает, например, атом галогена, алкилсульфонилоксигруппу и арилсульфонилоксигруппу.
Термин «гидроксилзащитная группа» охватывает все группы, которые представляют собой обычные применимые защитные группы гидроксила. Примеры включают группы, описанные в «Greene's Protective Groups in Organic Synthesis» by M. Wuts и W. Greene, 4th edition, John Wiley & Sons, INC., 2006, p.16-366. Конкретные примеры включают ацильную группу, алкоксикарбонильную группу, аралкилоксикарбонильную группу, алкильную группу, аралкильную группу, кислородсодержащую гетероциклическую группу, серосодержащую гетероциклическую группу, алкоксиалкильную группу, аралкилоксиалкильную группу, алкилсульфонильную группу и арилсульфонильную группу.
Термин «иминозащитная группа» охватывает все группы, которые используют в качестве обычной иминозащитной группы. Примеры включают группы, описанные в «Greene's Protective Groups in Organic Synthesis» by M. Wuts и W. Greene, 4th edition, John Wiley & Sons, INC., 2006, p.696-926. Конкретные примеры включают ацильную группу, алкоксикарбонильную группу, аралкилоксикарбонильную группу, аралкильную группу, алкилсульфонильную группу и арилсульфонильную группу.
Предпочтительные моногидраты 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-c)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-2(1H)-она, используемые в настоящем изобретении, представляют собой нижеследующие соединения.
Кристаллы моногидрата 1-(2-(4-((2,3-дигидро(1,4)диоксино(2,3-c)пиридин-7-илметил)амино)пиперидин-1-ил)этил)-7-фтор-1,5-нафтиридин-2(1H)-она, имеющие углы дифракции 2θ, составляющие 6,8°; 8,2°; 14,2° и 15,7°, на порошковой рентгеновской дифрактограмме, являются предпочтительными.
В дополнение, характерные пики порошковой дифракции рентгеновских лучей могут меняться в зависимости от условий измерений. По этой причине пик порошковой дифракции рентгеновских лучей соединения по настоящему изобретению не следует строго интерпретировать.
В настоящем изобретении предпочтительные способы получения включают нижеследующие способы.
Способ получения, в котором R1 представляет собой этильную группу, пропильную группу или бутильную группу, является предпочтительным; при этом способ получения, в котором R1 является бутильной группой, является более предпочтительным.
Способ получения, в котором R2 представляет собой ацильную группу, аралкильную группу или кислородсодержащую гетероциклическую группу, является предпочтительным. При этом способ получения, в котором R2 представляет собой кислородсодержащую гетероциклическую группу, является более предпочтительным, и способ получения, в котором R2 представляет собой тетрагидропиранильную группу, является еще более предпочтительным.
Способ получения, в котором R3 является ацильной группой, алкоксикарбонильной группой или аралкильной группой, является предпочтительным. При этом способ получения, в котором R3 представляет собой аралкильную группу, является более предпочтительным, а способ получения, в котором R3 представляет собой бензильную группу, является еще более предпочтительным.
Способ получения, в котором R4 представляет собой ацильную группу, алкоксикарбонильную группу или аралкильную группу, является предпочтительным. При этом способ получения, в котором R4 представляет собой ацильную группу или алкоксикарбонильную группу, является более предпочтительным, а способ получения, в котором R4 представляет собой алкоксикарбонильную группу, является еще более предпочтительным.
Способ получения, в котором X представляет собой атом хлора, является предпочтительным.
Способ получения, в котором Y представляет собой диметоксиметиленовую группу, диэтоксиметиленовую группу, дипропоксиметиленовую группу, 1,3-диоксолан-2-илиденовую группу или 1,3-диоксан-2-илиденовую группу, является предпочтительным. При этом способ получения, в котором Y представляет собой диметоксиметиленовую группу, диэтоксиметиленовую группу или 1,3-диоксолан-2-илиденовую группу, является более предпочтительным, а способ получения, в котором Y представляет собой диметоксиметиленовую группу, является еще более предпочтительным.
Для соединения, представляемого общей формулой [19], предпочтительные соединения включают нижеследующие соединения.
Соединение, в котором R2a представляет собой атом водорода, ацильную группу, аралкильную группу или кислородсодержащую гетероциклическую группу, является предпочтительным. При этом соединение, в котором R2a представляет собой атом водорода или кислородсодержащую гетероциклическую группу, является более предпочтительным, при том, что соединение, в котором R2a представляет собой атом водорода или тетрагидропиранильную группу, является еще более предпочтительным; и соединение, в котором R2a представляет собой атом водорода, является наиболее предпочтительным.
Способ получения по настоящему изобретению описан далее.
[Способ получения 1]
,
где R1 определен выше.
(1-1)
Соединение общей формулы [2] может быть получено взаимодействием соединения формулы [1] с эфиром акриловой кислоты в присутствии катализатора, в присутствии или отсутствие основания, и в присутствии или отсутствие лиганда. Реакцию можно осуществлять, например, способом, описанным в «Chem. Rev.» by I.P.Beletskaya и A.V.Cheprakov, 2000, Vol.100, p.3009-3066; или любым способом, ему соответствующим.
(1-2)
Соединение формулы [3] может быть получено посредством восстановления/циклизации соединения общей формулы [2] в присутствии катализатора.
Реакцию восстановления можно осуществлять, например, способом, описанным в «Comprehensive Organic Transformations» by Richard C. Larock, VCH Publishers, INC., 1989, p.6-17; или любым способом, ему соответствующим.
Растворитель, используемый в реакции восстановления, может быть любым растворителем постольку, поскольку он не оказывает влияния на течение реакции. Примеры включают в себя спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля, дибутиловый эфир и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; сложные эфиры, такие как этилацетат и бутилацетат; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; кетоны, такие как ацетон и 2-бутанон, а также воду. Эти растворители могут быть использованы в смеси. Предпочтительными примерами растворителей являются метанол и этанол.
Катализатор, используемый в реакции восстановления, включает в себя, например, палладий на угольном носителе, ацетат палладия, оксид платины, родий на угольном носителе и хлорид рутения. Предпочтительным катализатором является палладий на угольном носителе.
Восстановитель, используемый в реакции восстановления, включает в себя, например, водород; муравьиную кислоту; формиаты, такие как формиат натрия, формиат аммония и формиат триэтиламмония; и циклогексан. Предпочтительные восстановители включают водород и муравьиную кислоту.
Количество используемого катализатора может составлять массу соединения общей формулы [2], умноженную на величину, принимающую значения от 0,001 до 5, предпочтительно, массу, умноженную на величину, принимающую значения от 0,01 до 0,5.
Количество восстановителя может представлять число молей соединения общей формулы [2], умноженное на величину, принимающую значения от 1 до 100, предпочтительно, от 1 до 5.
Реакцию восстановления можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение времени от 30 минут до 120 часов.
Растворитель, используемый в реакции циклизации, может быть любым растворителем постольку, поскольку он не оказывает влияние на течение реакции. Примеры включают в себя спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля, дибутиловый эфир и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; сложные эфиры, такие как этилацетат и бутилацетат; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; кетоны, такие как ацетон и 2-бутанон, а также воду. Эти растворители могут быть использованы в смеси. Предпочтительные растворители включают в себя толуол и ксилол.
Реакцию циклизации можно осуществлять при температуре от 0 до 200°C, предпочтительно от 50 до 130°C, в течение времени от 30 минут до 120 часов.
(1-3)
Соединение формулы [3] может быть получено взаимодействием соединения формулы [1] с эфиром акриловой кислоты, в присутствии катализатора, в присутствии или отсутствие основания, в присутствии или отсутствие лиганда и в присутствии восстановителя. Реакция представляет собой реакцию, протекающую в одном сосуде, с получением соединения формулы [3]. Реакцию можно осуществлять, согласно способу получения (1-1) и способу получения (1-2).
[Способ получения 2]
,
где L1 и Y определены выше.
(2-1)
Известные соединения общей формулы [4] представляют собой, например, 2-(2-бромметил)-1,3-диоксолан, 2-бром-1,1-диэтоксиэтан и 2-бром-1,1-диметоксиэтан.
Соединение общей формулы [5] можно получить взаимодействием соединения общей формулы [4] с соединением формулы [3] в присутствии основания.
Растворитель, используемый в этой реакции, может быть любым растворителем постольку, поскольку он не оказывает влияния на течение реакции. Примеры включают в себя амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; сложные эфиры, такие как этилацетат, а также воду. Эти растворители могут быть использованы в смеси. Предпочтительными растворителями являются N,N-диметилацетамид и диметисульфоксид.
Основание, используемое в этой реакции, включает в себя, например, органические основания, такие как пиридин, диметиламинопиридин, триэтиламин, трет-бутилат натрия и трет-бутилат калия, а также неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, фосфат калия и карбонат цезия. Предпочтительными основаниями являются карбонат калия и фосфат калия.
Количества основания и используемого соединения общей формулы [4] могут представлять число молей соединения общей формулы [3], умноженное на величину, составляющую от 1 до 50, предпочтительно от 1 до 5.
Реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение времени от 30 минут до 48 часов.
(2-2)
Соединение общей формулы [6] можно получить окислением соединения общей формулы [5] в присутствии или отсутствие радикальных инициаторов, в присутствии или отсутствие основания. Реакцию можно осуществлять, например, способами, описанными в Chem. Rev., by Djerassi C., p.271-317, Vol.43, 1948 и «Bioorg. Med. Chem. Lett.», by Julianne A. Hunt, 2003, Vol.13, p.467-470, или любыми способами, им соответствующими.
Растворитель, используемый в этой реакции, может представлять собой любой растворитель постольку, поскольку он не оказывает влияния на течение реакции. Примеры включают амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол и хлорбензол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; а также сложные эфиры, такие как этилацетат. Эти растворители можно использовать в смеси. Предпочтительным растворителем является хлорбензол.
Окислитель, используемый в этой реакции, включает в себя, например, бромид, хлор, йод, N-бромсукцинимид, N-хлорсукцинимид, N-йодсукцинимид и диоксид марганца. Предпочтительным окислителем является N-бромсукцинимид.
Радикальный инициатор, используемый в этой реакции по мере необходимости, включает в себя, например, азобисизобутиронитрил, бензоилпероксид и 2,2'-азобис(4-метокси-2,4-диметилвалеронитрил). Предпочтительным радикальным инициатором является 2,2'-азобис(4-метокси-2,4-диметилвалеронитрил).
Основание, используемое в этой реакции по мере необходимости, включает в себя, например, органические основания, такие как пиридин, диметиламинопиридин, триэтиламин, трет-бутилат натрия и трет-бутилат калия, а также неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия, бикарбонат натрия, карбонат натрия, карбонат калия, карбонат бария и карбонат цезия. Предпочтительным основанием является карбонат калия.
Количество используемого окислителя представляет число молей соединения общей формулы [5], умноженное на величину, составляющую от 1 до 30, предпочтительно от 1 до 5.
Количество радикального инициатора, используемого по мере необходимости, представляет число молей соединения общей формулы [5], умноженное на величину, составляющую от 0,0001 до 0,5, предпочтительно от 0,001 до 0,1.
Реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение времени, составляющего от 30 минут до 48 часов.
Соединение общей формулы [6] представляет собой, например, 1-(2,2-диэтоксиэтил)-7-фтор-1,5-нафтиридин-2(1H)-он. 1-(2,2-диэтоксиэтил)-7-фтор-1,5-нафтиридин-2(1H)-он можно получить взаимодействием 7-фтор-1,5-нафтиридин-2(1H)-она с 2-бром-1,1-диэтоксиэтаном.
Реакцию можно осуществлять способом, описанным в WO 2007/138974, или любым способом, ему соответствующим.
(2-3)
Соединение формулы [7] можно получить, удаляя защиту соединения общей формулы [6]. Реакцию можно осуществлять, например, способом, описанным в «Greene's Protective Groups in Organic Synthesis» by M. Wuts и W. Greene, 4th edition, John Wiley & Sons, INC., 2006, p.435-505, или любым способом, с ним согласующимся.
[Способ получения 3]
где R2, R3, R4, L2 и X определены выше.
Соединение общей формулы [8] может быть получено из койевой кислоты.
(3-1)
Известные соединения общей формулы [9] включают в себя, например, 1-бром-2-хлорэтан и 1,2-дибромэтан.
Соединение общей формулы [10] можно получать взаимодействием соединения общей формулы [9] с соединением общей формулы [8] в присутствии основания.
Реакцию можно осуществить согласно способу получения 2-1.
(3-2)
Соединение общей формулы [11] можно получать, удаляя защиту соединения общей формулы [10]. Реакцию можно осуществлять, например, способом, описанным в «Greene's Protective Groups in Organic Synthesis» by M. Wuts и W. Greene, 4th edition, John Wiley & Sons, INC., 2006, p.16-366, или любым способом, с ним согласующимся.
Кроме того, соединение общей формулы [11] может быть получено взаимодействием соединения общей формулы [9] с койевой кислотой. Реакцию можно осуществлять согласно способу получения 3-1.
(3-3)
Соединение формулы [12] может быть получено взаимодействием соединения общей формулы [11] с аммиаком.
Растворитель, используемый в этой реакции, может быть любым растворителем постольку, поскольку он не оказывает влияния на течение реакции. Примеры включают в себя спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; сложные эфиры, такие как этилацетат; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон, а также воду. Эти растворители могут быть использованы в смеси. Предпочтительный растворитель включает воду.
Аммиак, используемый в этой реакции, включает в себя аммиачную воду и так далее. Количество используемого аммиака представляет число молей соединения общей формулы [11], умноженное на величину, составляющую от 1 до 100, предпочтительно от 1 до 30.
Реакцию можно осуществлять при температуре в интервале от комнатной температуры до 150°C, предпочтительно от 50 до 100°C, в течение периода времени от 30 минут до 120 часов.
(3-4)
Соединение формулы [13] можно получать окислением соединения формулы [12]. Реакцию можно осуществлять способами, описанными в «Advanced Organic Chemistry», by Jerry March, the 4th edition, John Wiley & Sons, INC., 1992, p.1167-1171; и «Comprehensive Organic Transformations» by Richard С. Larock, VCH Publishers, INC., 1989, p.604-614; или любым способом, с ними согласующимся.
Растворитель, используемый в реакции, может быть любым растворителем постольку, поскольку он не оказывает влияния на течение реакции. Примеры включают в себя галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; сложные эфиры, такие как этилацетат; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон; кислоты, такие как уксусная кислота, а также воду. Эти растворители могут быть использованы в смеси. Предпочтительный растворитель включает тетрагидрофуран.
Окислитель, используемый в этой реакции, включает в себя, например, диметилсульфоксид, триоксид хрома, диоксид марганца и хлористый хромил. Предпочтительный окислитель включает диоксид марганца.
Количество окислителя, используемого в реакции, представляет число молей соединения общей формулы [12], умноженное на величину, составляющую от 1 до 30, предпочтительно от 1 до 5.
Реакцию можно осуществлять при температуре от -78 до 200°C, предпочтительно от 0 до 100°C, в течение периода времени от 30 минут до 48 часов.
(3-5)
Соединение общей формулы [15] может быть получено взаимодействием соединения общей формулы [14] с соединением формулы [13] в присутствии восстановителя. Реакцию можно осуществлять способами, описанными в WO 02/50061, WO 02/56882, «Advanced Organic Chemistry», by Jerry March, the 4th edition, John Wiley & Sons, INC., 1992, p.898-900; и «Comprehensive Organic Transformations» by Richard С. Larock, VCH Publishers, INC., 1989, p.421-425; или любым способом, с ними согласующимся.
Растворитель, используемый в этой реакции, может быть любым растворителем постольку, поскольку он не оказывает влияния на течение реакции. Примеры включают в себя спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; сложные эфиры, такие как этилацетат; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон, а также воду. Эти растворители могут быть использованы в смеси. Предпочтительный растворитель включает в себя метанол.
Восстановитель, используемый в этой реакции, включает в себя, например, гидридные комплексы, такие как алюмогидрид лития, триацетоксиборогидрид натрия, цианоборогидрид натрия и борогидрид натрия, боран, натрий, а также амальгаму натрия. Можно также альтернативно использовать электролитическое восстановление, где в качестве катода используют медь или платину; каталитическое восстановление, в котором используют никель Ренея, оксид платины или палладиевую чернь, а также можно использовать восстановление, в котором используют состав «цинк/кислота». Предпочтительный восстановитель включает в себя борогидрид натрия. Борогидрид натрия можно использовать в твердом виде или в виде раствора.
Количества соединения общей формулы [14] и восстановителя, используемого в реакции, представляют величину, составляющую от 1 до 50, предпочтительно от 1 до 5, умноженную на число молей соединения общей формулы [13].
Реакцию можно осуществлять при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение периода времени от 10 минут до 120 часов.
(3-6)
Соединение общей формулы [16] может быть получено посредством защиты иминогруппы соединения общей формулы [15]. Реакцию можно осуществить, например, способом, описанным в «Greene's Protective Groups in Organic Synthesis» by M. Wuts и W. Greene, 4th edition, John Wiley & Sons, INC., 2006, p.696-926, или любым способом, с ним согласующимся.
(3-7)
Соединение общей формулы [17] может быть получено удалением защиты соединения общей формулы [16]. Реакцию можно осуществлять, например, способом, описанным в «Greene's Protective Groups in Organic Synthesis» by M. Wuts и W. Greene, 4th edition, John Wiley & Sons, INC., 2006, p.696-926; или любым способом, с ним согласующимся.
[Способ получения 4]
где R4 определен выше.
(4-1)
Соединение общей формулы [18] может быть получено взаимодействием соединения общей формулы [17] с соединением общей формулы [7]. Реакцию можно осуществить в соответствии со способом получения 3-5.
(4-2)
Соединение формулы [20] может быть получено удалением защиты соединения общей формулы [18], с последующей кристаллизацией в результате нейтрализации. Реакцию удаления защиты можно осуществлять, например, способом, описанным в «Greene's Protective Groups in Organic Synthesis» by M. Wuts и W. Greene, 4th edition, John Wiley & Sons, INC., 2006, p.696-926, или любым способом, с ним согласующимся.
Растворитель, используемый в этой реакции, может быть любым растворителем постольку, поскольку он не оказывает неблагоприятного воздействия на течение реакции. Примеры включают в себя смешанные растворители из воды и органических растворителей, а также воду.
Органический растворитель включает в себя, например, спирты, такие как метанол, этанол, 2-пропанол и 2-метил-2-пропанол; галогенированные углеводороды, такие как метиленхлорид, хлороформ и дихлорэтан; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диоксан, тетрагидрофуран, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля и монометиловый эфир этиленгликоля; сульфоксиды, такие как диметилсульфоксид; сложные эфиры, такие как этилацетат; кетоны, такие как ацетон и 2-бутанон; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид и 1-метил-2-пирролидон. Эти растворители могут быть использованы в смеси. Предпочтительные растворители включают смешанные растворители из воды и спиртов, а также воду; при этом вода является более предпочтительной.
Когда используют смешанные растворители из воды и органического(их) растворителя(ей), то отношение воды к органическому(им) растворителю(ям) (вода/органический растворитель) находится в диапазоне предпочтительно от 100/0 до 50/50, более предпочтительно от 100/0 до 80/10.
Реакцию можно осуществлять при температуре от -20 до 120°C, предпочтительно от 10 до 80°C, в течение периода времени от 10 минут до 120 часов.
Способ получения по настоящему изобретению обладает такими свойствами, как (1) высокий выход, (2) отсутствие необходимости в колоночной хроматографии на силикагеле (3) и, следовательно, незначительные производственные отходы, (4) неиспользование токсичных или неустойчивых реагентов, и, следовательно п