Составы для перорального введения лекарственных средств и родственные способы
Иллюстрации
Показать всеИзобретение относится к составу для доставки амфотерицина В и других лекарственных средств, где состав содержит активный ингредиент, один или более сложных эфиров глицерина и жирных кислот и один или более содержащих полиэтиленоксид сложных эфиров жирных кислот, где соотношение сложных эфиров глицерина и жирных кислот и содержащих полиэтиленоксид сложных эфиров жирных кислот составляет приблизительно от 20:80 до приблизительно 80:20 об./об. Состав применяется для создания лекарственного средства с улучшенной биодоступностью для лечения инфекционных заболеваний. 7 н. и 6 з.п. ф-лы, 21 ил., 8 табл., 4 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по Предварительной заявке США № 60/940307, поданной 25 мая 2007 года, Предварительной заявке США № 60/976708, поданной 1 октября 2007 года, и Предварительной заявке США № 61/041478, поданной 1 апреля 2008 года. Полное содержание каждой заявки включено в настоящее описание в качестве ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Каждый год только на Индийском субконтиненте более 500000 индивидуумов выступают в роли хозяина для Leishmania donovani, бессимптомно развивающегося паразита, который проникает в макрофаги, быстро инфильтрует жизненно важные органы и в конечном счете приводит к тяжелой инфекции висцеральной ретикулоэндотелиальной системы. Висцеральный лейшманиоз, также известный как Кала-азар, является наиболее преобладающим среди слабых и молодых в популяции. Оставленные без лечения, почти все инфицированные индивидуумы умирают. Висцеральный лейшманиоз поражает более 200 миллионов людей из 62 стран. Терапевтический арсенал против Leishmania ограничен небольшим числом вводимых парентерально средств, при ежесуточных инъекциях соединения пятивалентной сурьмы. Хотя и более дорогой, чем соединения сурьмы, амфотерицин B (AmpB) обладает 97% эффективностью лечения, и для него не опубликовано устойчивости. Однако, лекарственная терапия включает в себя IV введение в течение 30-40 суток и связана с возникающими при инфузии побочными эффектами (лихорадка, озноб, боль в костях, тромбофлебит). Дозолимитирующая токсичность, которая может даже влиять на возможность достижения лечения, представляет собой почечную недостаточность. Кроме того, из-за непомерно высокой стоимости и сложного способа введения лекарственного средства, амфотерицин B недоступен для многих пациентов.
В развитых странах диссеминированные грибковые инфекции, такие как кандидоз, гистоплазмоз, кокцидиоз и аспергиллез, находятся на подъеме, поражая пациентов с раком, реципиентов транстплантатов органов, пациентов с диабетом и пациентов с HIV/СПИД. У этих пациентов инвазивные грибковые инфекции могут обуславливать настолько много, как 30% смертей. Несмотря на развитие ряда новых противогрибковых средств, амфотерицин B, полученный в виде вводимой IV мицеллы, и липосомных дисперсий, остается одним из наиболее эффективных средств для лечения системных грибковых инфекций. Кроме того, для AmpB изучали ряд подходов к парентеральным составам. Несмотря на эффективность, ограничениями этих парентеральных составов амфотерицина B являются проблемы безопасности, связанные с введением (инфекция постоянного катетера, озноб и потрясающий озноб пациента из-за гемолиза RBC, зависимая от дозы почечная токсичность), возможность введения парентеральных продуктов в отдаленных местах и высокая стоимость лекарственного средства.
Разработка эффективного и безопасного перорального состава амфотерицина B может иметь важные применения в лечении диссеминированных грибковых инфекций и может кардинально расширить доступ к лечению висцерального лейшманиоза. Однако биодоступность AmpB является ничтожной из-за низкой растворимости в воде и нестабильности при низком pH, обнаруженном в желудочном соке. Такие ограничения применимы также к множеству других лекарственных средств, для которых пероральные составы являются желательными.
Существует необходимость в эффективных и безопасных пероральных составах амфотерицина B, так же как многих других лекарственных средств, обеспечивающих расширенную биодоступность и/или увеличенную стабильность интересующего лекарственного средства при низком pH, обнаруженном в желудочном соке. Настоящее изобретение направлено на удовлетворение этих нужд и предоставляет дополнительные родственные преимущества.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям для получения лекарственных средств, составам лекарственных средств на основе композиций, способам введения лекарственных средств с использованием составов и способам лечения состояний и заболеваний с использованием составов.
В одном аспекте изобретение относится к составу амфотерицина B, содержащему
(a) амфотерицин B;
(b) один или более сложных эфиров глицерина и жирных кислот; и
(c) один или более содержащих полиэтиленоксид фосфолипидов или один или более содержащих полиэтиленоксид сложных эфиров жирных кислот.
В одном варианте осуществления амфотерицин B присутствует в составе в количестве от приблизительно 0,5 до приблизительно 10 мг/мл состава. В одном варианте осуществления амфотерицин B присутствует в составе в количестве приблизительно 5 мг/мл. В другом варианте осуществления амфотерицин B присутствует в составе в количестве приблизительно 7 мг/мл.
В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 32 до приблизительно 52% по массе моноглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 30 до приблизительно 50% по массе диглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 5 до приблизительно 20% по массе триглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат более приблизительно 60% по массе моно-, ди- и триглицеридов олеиновой кислоты.
В одном варианте осуществления содержащие полиэтиленоксид фосфолипиды содержат сложный эфир насыщенных жирных кислот C8-C22 и соли фосфатидилэтаноламин полиэтиленгликоля. В одном варианте осуществления содержащие полиэтиленоксид фосфолипиды содержат соль дистеароилфосфатидилэтаноламин полиэтиленгликоля. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля выбрана из группы, состоящей из соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 350, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 550, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 750, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 1000, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 2000 и их смесей. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля присутствует в составе в количестве от 1 мМ до приблизительно 30 мМ на основании объема состава. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля представляет собой соль аммония или соль натрия.
В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат сложный эфир полиэтиленоксида и насыщенных жирных кислот C8-C22. В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат сложный эфир полиэтиленоксида и насыщенных жирных кислот C12-C18. В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот выбраны из группы, состоящей из сложных эфиров лауриновой кислоты, сложных эфиров пальмитиновой кислоты, сложных эфиров стеариновой кислоты и их смесей. В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат полиэтиленоксид, обладающий средней молекулярной массой от приблизительно 750 до приблизительно 2000.
В одном варианте осуществления соотношение сложных эфиров глицерина и жирных кислот и содержащих полиэтиленоксид сложных эфиров жирных кислот составляет от приблизительно 20:80 до приблизительно 80:20 об./об. В одном варианте осуществления соотношение сложных эфиров глицерина и жирных кислот и содержащих полиэтиленоксид сложных эфиров жирных кислот составляет приблизительно 60:40 об./об.
В одном варианте осуществления состав дополнительно содержит глицерин в количестве менее приблизительно 10% по массе.
В одном варианте осуществления состав представляет собой самоэмульгирующуюся систему доставки лекарственного средства.
В другом аспекте изобретение относится к способу введения амфотерицина B, включающему в себя введение состава амфотерицина B по изобретению нуждающемуся в этом субъекту. В одном варианте осуществления состав вводят перорально. В другом варианте осуществления состав вводят местно.
В другом аспекте изобретение относится к способу лечения инфекционного заболевания, поддающегося лечению введением амфотерицина B, включающему в себя введение нуждающемуся в этом субъекту терапевтически эффективного количества состава амфотерицина B по изобретению. В одном варианте осуществления состав вводят перорально. В другом варианте осуществления состав вводят местно.
Заболевания, поддающиеся лечению составами, включают в себя грибковые инфекции, висцеральный лейшманиоз, кожный лейшманиоз, болезнь Чагаса, болезнь Альцгеймера или фебрильную нейтропению. Грибковые инфекции, поддающиеся лечению составами, включают в себя аспергиллез, бластомикоз, кандидоз, кокцидиоидомикоз, критококкоз, гистоплазмоз, мукормикоз, паракокцидиоидомикоз или споротрихоз.
В другом аспекте изобретение относится к составу для доставки лекарственного средства, содержащему
(a) лекарственное средство;
(b) один или более сложных эфиров глицерина и жирных кислот; и
(c) один или более содержащих полиэтиленоксид фосфолипидов или один или более содержащих полиэтиленоксид сложных эфиров жирных кислот.
В одном варианте осуществления лекарственное средство присутствует в составе в количестве от приблизительно 0,1 мг/мл до приблизительно 25 мг/мл состава.
В конкретных вариантах осуществления лекарственное средство выбрано из группы, состоящей из противораковых средств, антибиотиков, противовирусных лекарственных средств, противогрибковых средств, средств против прионов, противоамебных средств, нестероидных противовоспалительных лекарственных средств, средств против аллергии, иммунодепрессивных средств, лекарственных средств против коронарной недостаточности, анальгетиков, местных анестетиков, анксиолитических средств, седативных средств, снотворных средств, средств, облегчающих мигрень, лекарственных средств против укачивания и противорвотных средств.
В конкретных вариантах осуществления лекарственное средство выбрано из группы, состоящей из тетрациклина, доксициклина, окситетрациклина, хлорамфеникола, эритромицина, ацикловира, идоксуридина, тромантадина, миконазола, кетоконазола, флуконазола, итраконазола, эконазола, гризеофульвина, амфотерицина B, нистатина, метронидазола, бензоата метронидазола, тинидазола, индометацина, ибупрофена, пироксикама, диклофенака, кромогликата динатрия, нитроглицерина, изосорбида динитрата, верапамила, нифедипина, дилтиазема, дигоксина, морфина, циклоспоринов, бупренорфина, лидокаина, диазепама, нитразепама, флуразепама, эстазолама, флунитразепама, триазолама, альпразолама, мидазолама, темазепама, лорметазепама, бротизолама, клобазама, клоназепама, лоразепама, оксазепама, бусипрона, суматриптана, производных эрготамина, циннаризина, антигистаминных средств, ондансетрона, трописетрона, гранизетрона, метоклопрамида, дисульфирама, витамина K, паклитаксела, доцетаксела, камптотецина, SN38, цисплатина и карбоплатина.
В одном варианте осуществления состав дополнительно содержит второе лекарственное средство.
В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 32 до приблизительно 52% по массе моноглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 30 до приблизительно 50% по массе диглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 5 до приблизительно 20% по массе триглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат более приблизительно 60% по массе моно-, ди- и триглицеридов олеиновой кислоты.
В одном варианте осуществления содержащие полиэтиленоксид фосфолипиды содержат сложный эфир насыщенных жирных кислот C8-C22 и соли фосфатидилэтаноламин полиэтиленгликоля. В одном варианте осуществления содержащие полиэтиленоксид фосфолипиды содержат соль дистеароилфосфатидилэтаноламин полиэтиленгликоля. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля выбрана из группы, состоящей из соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 350, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 550, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 750, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 1000, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 2000 и их смесей. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля присутствует в составе в количестве от 1 мМ до приблизительно 30 мM на основании объема состава. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля представляет собой соль аммония или соль натрия.
В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат сложный эфир полиэтиленоксида и насыщенных жирных кислот C8-C22. В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат сложный эфир полиэтиленоксида и насыщенных жирных кислот C12-C18. В одном варианте осуществления содержащий полиэтиленоксид сложный эфир жирных кислот выбран из группы, состоящей из сложных эфиров лауриновой кислоты, сложных эфиров пальмитиновой кислоты, сложных эфиров стеариновой кислоты и их смесей. В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат полиэтиленоксид, обладающий средней молекулярной массой от приблизительно 750 до приблизительно 2000.
В одном варианте осуществления соотношение сложных эфиров глицерина и жирных кислот и содержащих полиэтиленоксид сложных эфиров жирных кислот составляет от приблизительно 20:80 до приблизительно 80:20 об./об. В одном варианте осуществления соотношение сложных эфиров глицерина и жирных кислот и содержащих полиэтиленоксид сложных эфиров жирных кислот составляет приблизительно 60:40 об./об.
В одном варианте осуществления состав дополнительно содержит глицерин в количестве менее приблизительно 10% по массе.
В одном варианте осуществления состав представляет собой самоэмульгирующуюся систему доставки лекарственного средства.
В другом аспекте изобретение относится к способу введения лекарственного средства, включающему в себя введение состава лекарственного средства по изобретению субъекту, нуждающемуся в таком средстве. В одном варианте осуществления состав вводят перорально. В другом варианте осуществления состав вводят местно.
В другом аспекте изобретение относится к композиции для получения лекарственного средства, содержащей
(a) один или более сложных эфиров глицерина и жирных кислот; и
(b) один или более содержащих полиэтиленоксид фосфолипидов или один или более содержащих полиэтиленоксид сложных эфиров жирных кислот.
В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 32 до приблизительно 52% по массе моноглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 30 до приблизительно 50% по массе диглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат от приблизительно 5 до приблизительно 20% по массе триглицеридов жирных кислот. В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат более приблизительно 60% по массе моно-, ди- и триглицеридов олеиновой кислоты.
В одном варианте осуществления содержащие полиэтиленоксид фосфолипиды содержат сложный эфир насыщенных жирных кислот C8-C22 и соли фосфатидилэтаноламин полиэтиленгликоля. В одном варианте осуществления содержащие полиэтиленоксид фосфолипиды содержат соль дистеароилфосфатидилэтаноламин полиэтиленгликоля. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля выбрана из группы, состоящей из соли дистеароилфосфатидилэтаноламин полиэтиленгликоль 350, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 550, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 750, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 1000, соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 2000 и их смесей. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля присутствует в составе в количестве от 1 мМ до приблизительно 30 мМ на основании объема состава. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля представляет собой соль аммония или соль натрия.
В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат сложный эфир полиэтиленоксида и насыщенных жирных кислот C8-C22. В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат сложный эфир полиэтиленоксида и насыщенных жирных кислот C12-C18. В одном варианте осуществления содержащий полиэтиленоксид сложный эфир жирных кислот выбран из группы, состоящей из сложных эфиров лауриновой кислоты, сложных эфиров пальмитиновой кислоты, сложных эфиров стеариновой кислоты и их смесей. В одном варианте осуществления содержащие полиэтиленоксид сложные эфиры жирных кислот содержат полиэтиленоксид, обладающий средней молекулярной массой от приблизительно 750 до приблизительно 2000.
В одном варианте осуществления композиция дополнительно содержит глицерин в количестве менее приблизительно 10% по массе.
В другом аспекте изобретение относится к способу получения лекарственного средства, включающему в себя комбинирование лекарственного средства с композицией по изобретению для получения лекарственного средства.
ОПИСАНИЕ РИСУНКОВ
Вышеупомянутые аспекты и многие из сопутствующих преимуществ по этому изобретению более легко оценить, поскольку они становятся более понятными со ссылкой на следующее подробное описание, взятое вместе с сопровождающими рисунками.
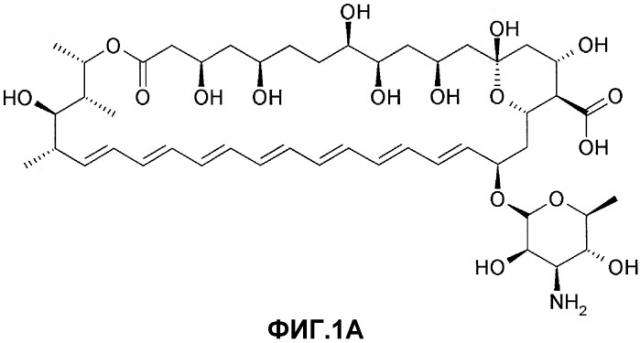
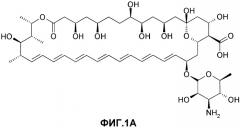
На фиг.1A проиллюстрирована химическая структура амфотерицина B (AmpB).
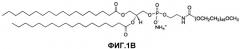
На фиг.1B проиллюстрирована химическая структура соли аммония дистеароилфосфатидилэтаноламин полиэтиленгликоля 2000 (DSPE-PEG-2000).
На фиг.2 сравнивают концентрацию AmpB (мкг/мл) в составе AmpB/PECEOL® и репрезентативных составах AmpB по изобретению (AmpB/PECEOL®/DSPE-PEG-2000), содержащих DSPE-PEG-2000 в концентрациях 5, 10 и 15 мМ.
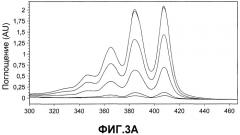
На фиг.3A сравнивают спектры УФ-поглощения в течение времени для репрезентативных составов AmpB по изобретению (PECEOL®/DSPE-PEG) в различных концентрациях (0,5-15 мкг/мл), инкубированных в воспроизводимом желудочном соке (SGF).
На фиг.3B сравнивают стандартные кривые по данным на фиг.2A, объединенным с использованием высоты пика при 407 нм для построения стандартных кривых поглощения AmpB в зависимости от концентрации. Различные стандартные кривые получали для каждого состава, где менялась молекулярная масса DSPE-PEG.
На фиг.4 сравнивают стабильность AmpB в репрезентативных составах по изобретению (PECEOL®/DSPE-PEG 350, 550, 750 и 2000) с составом AmpB/PECEOL® при 37°C в воспроизводимом желудочном соке как функции от времени (10, 30 и 120 минут).
НА фиг.5A и 5B сравнивают стабильность AmpB в репрезентативных составах по изобретению (PECEOL®/DSPE-PEG 350, 550, 750 и 2000, обозначенных PEG 350, 550, 750, 2000, соответственно) с составом AmpB/PECEOL® при 37°C в воспроизводимой интестинальной жидкости голодного состояния (FSSIF) без лецитина (5A) и с лецитином (5B) как функции от времени (10, 30, 60 и 120 минут).
На фиг.6 сравнивают стабильность AmpB в репрезентативных составах по изобретению (PECEOL®/DSPE-PEG 350, 550, 750 и 2000, обозначенных PEG 350, 550, 750, 2000, соответственно) с составом AmpB/PECEOL® при 37°C в воспроизводимой интестинальной жидкости (SIF) с ферментами панкреатина, как функции от времени (10, 30, 60 и 120 минут).
На фиг.7 сравнивают концентрацию Candida albicans (КОЕ/мл) в почках крыс, инфицированных Candida albicans и обработанных контрольным составом, составом AmpB/PECEOL® (10 мг/кг), репрезентативным составом AmpB по изобретению (AmpB/PECEOL®/DSPE-PEG-2000, обозначенный AmpB/DSPE-PEG-2000, 10 мг/кг) и внутривенным ABELCET® (обозначенный ABLC, 5 мг/мл).
На фиг.8 сравнивают концентрацию Candida albicans (КОЕ/мл) в органах крыс, инфицированных Candida albicans и обработанных контрольным составом, составом AmpB/PECEOL® (10 мг/кг), репрезентативным составом AmpB по изобретению (AmpB/PECEOL®/DSPE-PEG-2000, обозначенный AmpB/DSPE-PEG-2000, 10 мг/кг) и внутривенным ABELCET® (обозначенный ABLC, 5 мг/мл).
На фиг.9 сравнивают креатинин в плазме (мг/дл) у крыс, инфицированных Candida albicans и обработанных контрольным составом, составом AmpB/PECEOL® (10 мг/кг), репрезентативным составом AmpB по изобретению (AmpB/PECEOL®/DSPE-PEG-2000, обозначенный AmpB/DSPE-PEG-2000, 10 мг/кг) и внутривенным ABELCET® (обозначенный ABLC, 5 мг/мл) (ноль, 0 часов и 48 часов).
На фиг.10A, 10B и 10C сравнивают концентрацию AmpB (мг/мл) в репрезентативных составах AmpB по изобретению (AmpB/PECEOL®/GELUCIRE® 44/14; AmpB/PECEOL®/GELUCIRE® 50/13 и AmpB/PECEOL®/GELUCIRE® 53/10) при различных соотношениях PECEOL®:GELUCIRE® (60:40, 50:50 и 40:60 об./об.) через 2, 4 и 24 часа.
На фиг.11 сравнивают концентрацию AmpB (% исходной концентрации, 5 мг/мл) с течением времени (0, 1, 5, 7, 15, 21, 28, 36, 43, 49 и 56 суток) для состава AmpB/PECEOL® (обозначенный PECEOL®) и репрезентативных составов AmpB по изобретению (AmpB/PECEOL®GELUCIRE® 44/14, 50/50; и AmpB/PECEOL®/DSPE-PEG-2000, 15 мМ DSPE-PEG-2000).
На фиг.12 сравнивают концентрацию AmpB (% от исходной концентрации, 5 мг/мл) с течением времени (10, 30, 45, 60, 90 и 120 минут) в воспроизводимом желудочном соке (SGF) для состава AmpB/PECEOL® и репрезентативных составов AmpB по изобретению (AmpB/PECEOL®/GELUCIRE® 44/14, 50/50; и AmpB/PECEOL®/DSPE-PEG-2000, 15 мМ DSPE-PEG-2000).
На фиг.13 сравнивают концентрацию AmpB (% от исходной концентрации, 5 мг/мл) с течением времени (10, 30, 45, 60, 90, 120 и 240 минут) в воспроизводимой интестинальной жидкости сытого состояния (FeSSIF) для состава AmpB/PECEOL® и репрезентативного состава AmpB по изобретению (AmpB/PECEOL®/GELUCIRE® 44/14, 50/50).
На фиг.14 сравнивают концентрацию AmpB (% от исходной концентрации, 5 мг/мл) с течением времени (10, 30, 45, 60, 90, 120 и 240 минут) в воспроизводимой интестинальной жидкости сытого состояния (FeSSIF) с ферментом для состава AmpB/PECEOL® и репрезентативного состава AmpB по изобретению (AmpB/PECEOL®GELUCIRE® 44/14, 50/50).
На фиг.15 сравнивают концентрацию AmpB (% от исходной концентрации, 5 мг/мл) с течением времени (10, 30, 45, 60, 90, 120 и 240 минут) в воспроизводимой интестинальной жидкости голодного состояния (FaSSIF) для состава AmpB/PECEOL® и репрезентативного состава AmpB по изобретению (AmpB/PECEOL®GELUCIRE® 44/14, 50/50).
На фиг.16 сравнивают концентрацию AmpB (% от исходной концентрации, 10 мг/мл) репрезентативного состава AmpB по изобретению (AmpB/PECEOL®/DSPE-PEG-2000, 15 мМ DSPE-PEG-2000) через семь суток при комнатной температуре и при 43°C (AmpB измерен по УФ-поглощению центрифугированных образцов после указанного времени).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям для получения лекарственных средств. Композиции являются эффективными для солюбилизации лекарственных средств, в частности, труднорастворимых лекарственных средств. Композиции преимущественно увеличивают биодоступность лекарственных средств. Изобретение относится также к составам лекарственных средств на основе композиций, которые являются эффективными для доставки лекарственных средств, в частности, перорального введения лекарственных средств. Составы амфотерицина B используют здесь в качестве прототипического примера, однако, специалисту в данной области понятно, что такие составы являются применимыми к множеству лекарственных средств. Соответственно, в одном аспекте изобретение относится к составам амфотерицина B на основе композиций. Составы амфотерицина B эффективно солюбилизуют амфотерицин B, обеспечивая составы, обладающие увеличенными концентрациями амфотерицина B и, в то же самое время, обеспечивая увеличенную биодоступность амфотерицина B.
Составы амфотерицина B
В одном аспекте настоящее изобретение относится к составам амфотерицина B, способам получения составов, способам введения амфотерицина B с использованием составов и способам лечения заболеваний, поддающихся лечению амфотерицином B, посредством введения составов.
Амфотерицин B является эффективным противогрибковым средством, и в настоящее время, является лекарственным средством выбора для лечения большинства тяжелых системных грибковых инфекций. Лекарственное средство сильно связывается с эргостеролом, главным стероловым компонентом мембран грибковых клеток, образуя в мембранах поры, вызывающие разрушение мембраны, проницаемость клеток и лизис.
Амфотерицин B обладает ограничениями для клинического введения из-за серьезных неблагоприятных свойств. Во-первых, амфотерицин B обладает сильной аффинностью связывания для холестерина, стерола, присутствующего в большинстве мембран клеток млекопитающих, и таким образом, является способным разрушать клетки-хозяева. Это приводит к почечной токсичности лекарственного средства. Во-вторых, амфотерицин B не всасывается в желудочно-кишечном тракте (GIT) из-за его плохой растворимости и его чувствительности к кислой среде в желудке. Чтобы преодолеть эту проблему, амфотерицин B используют парентерально в форме липосомной (AMBISOME®) или в форме коллоидной дисперсии (FUNGIZONE®, ABELCET®) для лечения конкретных системных грибковых инфекций (Arikan and Rex, 2001. Lipid-based antifungal agents: current status. Curr. Pharm. Des. 5, 393-415).
Однако, внутривенная инъекция и инфузия амфотерицина B обладает значительными недостатками. Во-первых, внутривенная инъекция и инфузия амфотерицина B связана со значительными колебаниями концентраций лекарственного средства в крови и побочными эффектами, такими как нефротоксичность (Miiller et al., 2000, Nanosuspensions Nanosuspensions for the formulation of poorly soluble drugs-rationale for development and what we can expect for the future. In: Nielloud, F., Marti-Mestres, G. (Eds.), Pharmaceutical emulsions and suspensions. Plenum Press/Marcel Dekker, New York, pp. 383-408). Во-вторых, в дополнение к высокой стоимости, инъекция и инфузия состава амфотерицина B обладает также низким соблюдением режима введения и техническими проблемами с введением в эндемических странах.
В одном варианте осуществления настоящее изобретение преодолевает эти недостатки предоставлением состава амфотерицина B, который можно вводить перорально. Можно ожидать, что пероральные составы амфотерицина B по изобретению могут улучшать соблюдение условий введения пациентом и улучшать фармакокинетику лекарственного средства, и увеличивать всасывание амфотерицина B в GI тракте.
Амфотерицин B представляет собой противогрибковый полиеновый антибиотик, полученный из Streptomyces nodosus M4575. Амфотерицин B химически обозначают как [1R-(1R*,3S*,5R*,6R*,9R*,11R*,15S*,16R*,17R*,18S*,19E,21E,23E,25E, 27E,29E,31E,33R*,35S*,36R*,37S,)]-33-[(3-амино-3,6-дидезокси-β-D-маннопиранозил)окси]1,3,5,6,9,11,17,37-октагидрокси-15,16,18-триметил-13-оксо-14,39-диоксабицикло-[33,3,1]нонатриаконта-19,21,23,25,27,29,31-гептен-36-карбоновую кислоту. Химическая структура амфотерицина B показана на фиг.1A. Кристаллический амфотерицин B является нерастворимым в воде.
В одном аспекте настоящее изобретение относится к составам амфотерицина B. Составы амфотерицина по изобретению содержат
(a) амфотерицин B;
(b) один или более сложных эфиров глицерина и жирных кислот; и
(c) один или более содержащих полиэтиленоксид фосфолипидов или один или более содержащих полиэтиленоксид сложных эфиров жирных кислот.
В репрезентативных составах амфотерицин B присутствует в количестве от приблизительно 0,5 до приблизительно 10 мг/мл состава. В одном варианте осуществления амфотерицин B или его фармацевтически приемлемая соль присутствует в составе в количестве приблизительно 5 мг/мл. В одном варианте осуществления амфотерицин B или его фармацевтически приемлемая соль присутствует в составе в количестве приблизительно 7 мг/мл.
Составы амфотерицина B содержат один или более сложных эфиров глицерина и жирных кислот, и как правило, смесь сложных эфиров глицерина и жирных кислот. Как применяют в настоящем документе термин «сложные эфиры глицерина и жирных кислот» относится к сложным эфирам, сформированным между глицерином и одной или более жирными кислотами, включая сложные моно-, ди- и три-эфиры (т.е. глицериды). Пригодные жирные кислоты включают в себя насыщенные и ненасыщенные жирные кислоты, обладающие от восьми (8) до двадцати двух (22) атомов углерода (т.е. жирные кислоты C8-C22). В конкретных вариантах осуществления пригодные жирные кислоты включают в себя жирные кислоты C12-C18.
Сложные эфиры глицерина и жирных кислот, применимые в составах, можно получать из коммерчески доступных источников. Репрезентативным источником сложных эфиров глицерина и жирных кислот является смесь моно-, ди- и триэфиров, коммерчески доступная как PECEOL® (Gattefosse, Saint Priest Cedex, France), с общепринятым обозначением «глицерилолеат» или «глицерилмоноолеат». Когда PECEOL® используют в качестве источника сложных эфиров глицерина и жирных кислот в составах, сложные эфиры глицерина и жирных кислот содержат от приблизительно 32 до приблизительно 52% по массе моноглицеридов жирных кислот, от приблизительно 30 до приблизительно 50% по массе диглицеридов жирных кислот и от приблизительно 5 до приблизительно 20% по массе триглицеридов жирных кислот. Сложные эфиры глицерина и жирных кислот содержат более приблизительно 60% по массе моно-, ди- и триглицеридов олеиновой кислоты (C18:1). Другие сложные эфиры глицерина и жирных кислот включают в себя сложные эфиры пальмитиновой кислоты (C16) (менее приблизительно 12%), стеариновой кислоты (C18) (менее приблизительно 6%), линолевой кислоты (C18:2) (менее приблизительно 35%), линоленовой кислоты (C18:3) (менее приблизительно 2%), арахидиновой кислоты (C20) (менее приблизительно 2%) и айкозеновой кислоты (C20:1) (менее приблизительно 2%). PECEOL® может также содержать свободный глицерин (как правило, приблизительно 1%). В одном варианте осуществления сложные эфиры глицерина и жирных кислот содержат приблизительно 44% по массе моноглицеридов жирных кислот, приблизительно 45% по массе диглицеридов жирных кислот и приблизительно 9% по массе триглицеридов жирных кислот, и сложные эфиры глицерина и жирных кислот содержат приблизительно 78% по массе моно-, ди- и триглицеридов олеиновой кислоты (C18:1). Другие сложные эфиры глицерина и жирных кислот включают в себя сложные эфиры пальмитиновой кислоты (C16) (приблизительно 4%), стеариновая кислота (C18) (приблизительно 2%), линолевой кислоты (C18:2) (приблизительно 12%), линоленовой кислоты (C18:3) (менее приблизительно 1%), арахидиновой кислоты (C20) (менее приблизительно 1%) и айкозеновой кислоты (C20:1) (менее приблизительно 1%).
В конкретных вариантах осуществления составы по изобретению могут содержать глицерин в количестве менее приблизительно 10% по массе.
Составы амфотерицина B: Содержащие полиэтиленоксид фосфолипиды (DSPE-PEG). Составы амфотерицина B содержат один или более полиэтоксилированных липидов. В одном варианте осуществления полиэтоксилированные липиды представляют собой содержащие полиэтиленоксид фосфолипиды или смесь содержащих полиэтиленоксид фосфолипидов. В другом варианте осуществления полиэтоксилированные липиды представляют собой содержащие полиэтиленоксид сложные эфиры жирных кислот или смесь содержащих полиэтиленоксид сложных эфиров жирных кислот.
Соответственно, в одном варианте осуществления составы амфотерицина B по изобретению содержат
(a) амфотерицин B;
(b) один или более сложных эфиров глицерина и жирных кислот; и
(c) один или более содержащих полиэтиленоксид фосфолипидов.
Как применяют в настоящем документе термин «содержащий полиэтиленоксид фосфолипид» относится к фосфолипиду, содержащему группу полиэтиленоксида (т.е. группу полиэтиленгликоля), ковалентно присоединенную к фосфолипиду, как правило, посредством карбаматной или сложноэфирной связи. Фосфолипиды получены из глицерина и могут содержать группу фосфатного сложного эфира и две группы сложного эфира жирных кислот. Пригодные жирные кислоты включают в себя насыщенные и ненасыщенные жирные кислоты, обладающие от восьми (8) до двадцати двух (22) атомов углерода (т.е. жирные кислоты C8-C22). В конкретных вариантах осуществления пригодные жирные кислоты включают в себя насыщенные жирные кислоты C12-C18. Репрезентативные содержащие полиэтиленоксид фосфолипиды включают в себя сложные эфиры насыщенных жирных кислот C8-C22 и соли фосфатидилэтаноламин полиэтиленгликоля. В конкретных вариантах осуществления пригодные жирные кислоты включают в себя насыщенные жирные кислоты C12-C18.
Молекулярную массу группы полиэтиленоксида содержащего полиэтиленоксид фосфолипида можно менять для оптимизации растворимости лекарственного средства (например, амфотерицина B) в составе. Репрезентативные средние молекулярные массы для групп полиэтиленоксида могут составлять от приблизительно 200 до приблизительно 5000 (например, PEG 200-PEG 5000).
В одном варианте осуществления содержащие полиэтиленоксид фосфолипиды представляют собой соли дистеароилфосфатидилэтаноламин полиэтиленгликоля. Репрезентативные соли дистеароилфосфатидилэтаноламин полиэтиленгликоля включают в себя соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 350 (DSPE-PEG-350), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 550 (DSPE-PEG-550), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 750 (DSPE-PEG-750), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 1000 (DSPE-PEG-1000), соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 1500 (DSPE-PEG-1500) и соли дистеароилфосфатидилэтаноламин полиэтиленгликоля 2000 (DSPE-PEG-2000). Можно использовать также смеси. Для вышеуказанных солей дистеароилфосфатидилэтаноламин полиэтиленгликоля, число (например, 350, 550, 750, 1000 и 2000) обозначает среднюю молекулярную массу группы полиэтиленоксида. Обозначения для этих солей, применяемые в настоящем документе, указаны в скобках выше.
Пригодные соли дистеароилфосфатидилэтаноламин полиэтиленгликоля включают в себя соли аммония и натрия.
Химическая структура соли аммония дистеароилфосфатидилэтаноламин полиэтиленгликоля 2000 (DSPE-PEG-2000) проиллюстрирована на фиг.1B. Ссылаясь на фиг.1B, содержащий полиэтиленоксид фосфолипид содержит фосфатную сложноэфирную группу и две группы сложных эфиров жирных кислот (стеаратные), и группу полиэтиленоксида, ковалентно присоединенную к аминогруппе фосфатидилэтаноламина посредством карбаматной связи.
Как отмечено выше, содержащий полиэтиленоксид фосфолипид влияет на способность состава солюбилизировать лекарственное средство. Как правило, чем больше количество содержащего полиэтиленоксид фосфолипида, тем больше солюбилизирующая емкость состава для труднорастворимых лекарственных средств. Содержащий полиэтиленоксид фосфолипид может присутствовать в составе в количестве от приблизительно 1 мМ до приблизительно 30 мМ на основании объема состава. В конкретных вариантах осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля присутствует в составе в количестве от 1 мМ до приблизительно 30 мМ на основании объема состава. В одном варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля присутствует в составе в количестве приблизительно 15 мМ на основании объема состава.
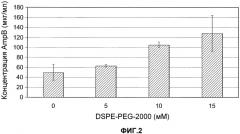
На фиг.2 сравнивают концентрацию амфотерицина B (мкг/мл) в составе AmpB/PECEOL® (не содержащем содержащих полиэтиленоксид фосфолипидов или содержащих полиэтиленоксид сложных эфиров жирных кислот) и репрезентативных составах AmpB по изобретению (AmpB/PECEOL®/DSPE-PEG-2000), содержащих DSPE-PEG-2000 в концентрациях 5, 10 и 15 мМ. AmpB измерен по УФ-поглощению центрифугированных образцов через 24 часа при 45°C.
В одном варианте осуществления составы амфотерицина B по изобретению содержат
(a) амфотерицин B;
(b) сложнее эфиры олеиновой кислоты и глицерина; и
(c) соль дистеароилфосфатидилэтаноламин полиэтиленгликоля.
В одном варианте осуществления состав амфотерицина B по изобретению содержит амфотерицин B, PECEOL® и соль дистеароилфосфатидилэтаноламин полиэтиленгликоля. В этом варианте осуществления соль дистеароилфосфатидилэтаноламин полиэтиленгликоля присутствует в количестве вплоть до приблизительно 30 мМ.
Получение и характеризация репрезентативных составов амфотерицина B по изобретению, включающих содержащие полиэтиленоксид фосфолипиды, описаны в примере 1.
Составы амфотерицина B, включающие содержащие полиэтиленоксид фосфолипиды, включают амфотерици