Производные хинолина, в частности 5,6,7-замещенные 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олы, способ получения и применение соединений
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным хинолинов, общей формулы (I), где R1 означает Н, метокси, R2 означает Н, метокси, R3 означает Н, метокси, или их фармацевтически приемлемые соли с кислотами, обладающие антимикобактериальной активностью. Также изобретение относится к способу получения соединений формулы (I) и их применению для лечения инфекционных заболеваний микобактериальной природы, в частности туберкулеза. Технический результат: получены новые производные хлорхинолина, обладающие полезными биологическими свойствами. 3 н. и 1 з.п. ф-лы, 2 ил. 3 табл., 4 пр.
Реферат
Изобретение относится к биологически активным веществам, в частности к производным замещенных хинолинов, обладающих цитостатической и цитотоксической активностью в отношении микобактерий, а именно к замещенным производным 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олов общей формулы (I), к способу их получения, а также к применению их в качестве антимикобактериальных агентов, в частности субстанций лекарственных препаратов (средств) с целью лечения туберкулеза и других инфекционных заболеваний микобактериальной природы.
По данным ВОЗ, ежегодно более 8-9 млн. человек заболевают туберкулезом, возбудителем которого является бактериальная палочка Micobacterium Tuberculosis. При этом смертность от резистентных и нерезистентных форм колеблется от 20 до 30% (2-3 млн. человек). Используемые в настоящее время подходы к лечению данного заболевания основаны на комбинированной терапии рядом лекарственных препаратов, таких как этамбутол, изониазид, рифампицин, пиразинамид, циклосерин и др. Принимая во внимание возрастающую во всем мире заболеваемость резистентными формами туберкулеза, а также относительно высокую токсичность вышеназванных препаратов и достаточно продолжительный их прием, поиск новых химических веществ, обладающих высокой противомикобактериальной активностью, является актуальной задачей современной медицины и фармакологии.
В последнее время синтезирован и исследован на активность в отношении микобактерий ряд производных диарилхинолинового ряда общей формулы (II) [WO 2004/011436, 05.02.2004, WO 2008068270, 12.06.2008, WO 2006/125769, 30.11.2006], структура которых является родственной используемому с начала 17 века для лечения инфекционных заболеваний хинину:
где R1 - Н, галоген, галоалкил, циано-, гидрокси-, арил, гетарил, алкил, алкилокси-, алкилтио-, алкилоксиалкил, алкилтиоалкил, арилалкил;
R2 - Н, гидрокси, тио-, алкилокси-, алкилоксиалкилокси-, алкилтио-, моно- и диалкиламино-;
R3 - водород, галоген, алкил;
R4 - нафтил, галонафтил, фенил, галоидарил, арилалкил, пиридинил, алкил, тиенил;
R5, R6 - алкил, Н, бензил, имидазолил, гетарил, алкилтио-, пиримидил
Из RU 2404971, 27.11.2010 известны производные хинолина общей формулы (III)
где R1 означает галоген, R2 означает галоген, R3 означает гидрокси, R4, R5 означают C1-С3-алкил, R6 означает арил, R7 означает арил, n=1 или 2, а также их фармацевтически приемлемые соли с кислотами, обладающие активностью в отношении микобактерий.
В указанных патентах описан способ получения этих производных, заключающийся во взаимодействии 3-арилметилхинолинов и соответствующих ацетофенонов и ацетилнафталинов под действием металлирующих агентов, в частности диизопропиламида лития.
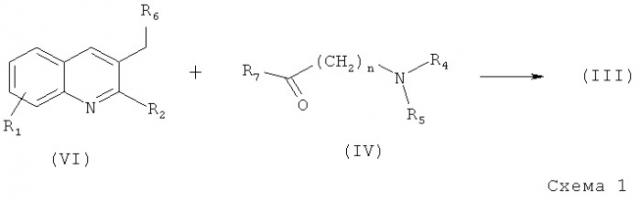
Соединения общей формулы (III), исходя из патента №2404971, 27.11.2010, могут быть получены из полупродуктов (VI) и (IV) с использованием металлирующего реагента, например дизнопропиламида лития, в частности получаемого in situ из бутиллития и дизнопропиламина в подходящем растворителе, предпочтительно эфирного типа, например таких, как тетрагидрофуран (ТГФ), диэтиловый эфир, диизопропиловый эфир, метилтретбутиловый эфир и их смеси, а также смеси с другими растворителями или сорастворителями (Схема 1). Все радикалы имеют определения, как в формуле (III). Реакция может быть легко проведена в интервале температур от -70 до +20°С, предпочтительно от -70 до -20°С.
Образовавшаяся в ходе реакции смесь диастереомеров может быть разделена с использованием известных методов, таких как хроматография или кристаллизация диастереомерных солей.
Наличие в положении R2 атома хлора при прочих равных не критично сказывается на цитостатической активности полученных соединений в отношении микобактерий, в то время как их химический синтез упрощается на одну стадию, что сказывается на практическом выходе целевых продуктов.
В то же время наличие двух галоидных заместителей в хинолиновом ядре является причиной низкой растворимости соответствующих арилхинолинов в ряду растворителей, применяемых в металлоорганической химии (таких как ТГФ, диэтиловый эфир), результатом чего является слабая воспроизводимость условий процесса литирования при масштабировании реакции, сопровождаемая, как правило, низкими выходами конечных соединений.
Задача настоящего изобретения заключается во введении в хинолиновое ядро арилхинолина, вместо атома галогена, электронодонорных заместителей с целью увеличения растворимости полупродуктов общей формулы (VI) в ТГФ при температурах ниже -50°С, а также получении новых соединений формулы (I) с повышенным воспроизводимым практическим выходом, а также с улучшенной противобактериальной активностью.
Итак, технической задачей изобретения является получение новых соединений - производных хинолина [общей формулы (I)] с воспроизводимым практическим выходом, обладающих повышенной противобактериальной активностью, а также их фармацевтически приемлемых солей с кислотами, а также расширение арсенала средств при лечении туберкулеза и других инфекционных заболеваний микобактериальной природы.
Технический результат достигается получением замещенных производных 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олов, обладающих антимикобактериальной активностью, а именно таких производных хинолина, как 5,6,7-защищенные 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олы общей формулы (I)
где R1 означает Н, метокси;
R2 означает Н, метокси;
R3 означает Н, метокси;
а также их фармацевтически приемлемые соли с кислотами.
Изобретение также относится к способу получения указанных новых замещенных производных 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олов, обладающих антимикобактериальной активностью, путем взаимодействия замещенных 3-арилметилхинолинов, например, общей формулы (VI):
где R1-R3 означают указанные выше значения (заместители);
и 2-(N,N)-диметиламиноэтил-1-нафтилкетона (IV):
в среде органического растворителя под действием металлирующих агентов в виде органических амидов металлов при температурах в диапазоне от -70 до +20°С в течение 1-3 часов. В способе получения указанных замещенных хинолинов общей формулы (I) по изобретению в качестве металлирующих агентов могут быть использованы органические амиды металлов, такие как диизопропиламид лития, диэтиламид лития, 2,2,6,6-тетраметилпиперидид лития и.т.д.
Фармацевтически приемлемые соли с кислотами указанных замещенных производных хинолинов общей формулы (I) характеризуются тем, что содержат терапевтически активные нетоксичные солевые формы, образуемые соединениями формулы (I), с кислотами. Указанные соли с кислотами могут быть получены обработкой веществ в виде свободных оснований, представленных формулой (I), подходящими неорганическими и органическими кислотами.
Такими кислотами являются, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфокислота, п-толуолсульфоновая кислота, цикламовая кислота, салициловая кислота, п-аминосалициловая кислота.
Было обнаружено, что соединения по изобретению имеют антимикобактериальную активность, в связи с чем могут быть использованы для лечения инфекционных заболеваний, вызываемых Mycobacterium tuberculosis, в частности могут быть применены в качестве биологически активного компонента (действующего начала) при получении лекарственных препаратов (средств) для лечения туберкулеза, то есть для получения противотуберкулезных лекарственных средств.
Общее описание синтеза
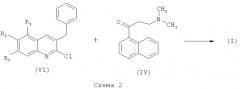
Соединения по изобретению формулы (I) могут быть получены из промежуточного соединения формулы (VI) и промежуточного соединения формулы (IV) с использованием металлирующего реагента, такого как диэтиламид лития, в частности получаемого in situ из н-бутиллития и диэтиламина в подходящем растворителе, таком как ТГФ, диэтиловый эфир, диизопропиловый эфир, метилтретбутиловый эфир и их смесях, а также в смесях с другими растворителями и сорастворителями (Схема 2). Все радикалы имеют определения, как в формуле (I). Реакцию проводят в диапазоне температур от -70 до +20°С, предпочтительно при -70°С в течение 1-3 часов.
Образованная в результате реакции смесь диастереомеров (I-1+I-2) может быть разделена с использованием известных методов, таких как хроматография или кристаллизация диастереомерных солей.
Исходные соединения и промежуточные продукты формул (VI) и (IV) являются соединениями, которые либо коммерчески доступны, либо могут быть получены обычными методами, известными в литературе [D.Mabire, et al., Med. Chem., 2005, 48, 2134-2153].
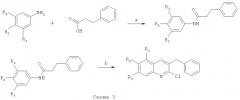
Например, промежуточные соединения формулы (VI) могут быть получены по схеме 3:
где R1 означает Н, метокси;
R2 означает Н, метокси;
R3 означает Н, метокси.
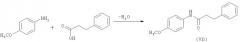
Синтез по представленной схеме включает стадию (а), в которой замещенный ариламин подвергают взаимодействию с 3-фенилпропионовой кислотой в присутствии подходящих катализатора (сильная кислота Льюиса) и инертного растворителя, такого как бензол или толуол. Процесс проводят в интервале температур от 20 до 110°С, предпочтительно при кипении реакционной массы.
На следующей стадии (b) продукт присоединения, полученный на стадии (а), подвергают взаимодействию с хлорокисью фосфора (POCl3) в присутствии N,N-диметилформамида (формилирование по Вильсмейеру-Хааку с последующей циклизацией). Реакция может быть осуществлена в интервале температур от 20 до 80°С, предпочтительно при 75°С.
Продукты реакций (а) и (b) могут быть выделены в индивидуальном виде и очищены при помощи экстракции, кристаллизации или хроматографии. Продукты реакции (I), существующие в виде диастереомеров, могут быть очищены методом хиральной препаративной высокоэффективной жидкостной хроматографии.
Нижеследующие примеры поясняют данное изобретение без его ограничения.
А. Получение промежуточных соединений (общий метод)
Пример 1
Получение промежуточного соединения (Vb).
К смеси 123 г (1 моль) 4-метоксианилина и 150 г (1 моль) 3-фенилпропановой кислоты добавляют 200 мл бензола, 7,01 г (0,05 моль) эфирата трехфтористого бора или 5 г (0,08 моль) борной кислоты и кипятят при перемешивании в течение 5 часов. Полученный продукт охлаждают, отфильтровывают, промывают толуолом, ректифицированным спиртом и водой. Сушат до постоянной массы. Практический выход промежуточного соединения (Vb) - 240 г (92,5%).
Пример 2
Получение соединения (VIb)
К охлажденной до 10°С смеси 84 г (1,15 моль) диметилформамида и 160 г (0,627 моль) промежуточного соединения (Vb) в 600 мл хлороформа добавляют по каплям 300 мл (480 г, 3,13 моль) хлорокиси фосфора, после чего полученный раствор кипятят в течении ночи. Охладив до комнатной температуры, реакционную массу затем выливают в смесь воды со льдом, органический слой промывают водным раствором Na2CO3, дистиллированной водой, сушат над MgSO4, фильтруют и растворитель отгоняют в вакууме. Остаток кристаллизуют из метанола. Практический выход промежуточного соединения (VIb) - 95 г (53%).
Пример 3
Получение соединения (IV)
Смесь 340 г (2 моль) 1-ацетилнафталина, 56 г (1,86 моль) параформа и 200 г (2,07 моль) гидрохлорида диметиламина в 700 мл дихлорэтана кипятят 1,5 часа, охлаждают до комнатной температуры, отфильтровываают выпавший осадок, обрабатывают его водным аммиаком и диэтиловым эфиром. Органический слой промывают водой, сушат над MgSO4, фильтруют и растворитель отгоняют досуха. Выход промежуточного соединения (IV) - 335 г (79%).
Б. Получение соединений по изобретению
Пример 4. 1-(6-метокси-2-хлор-хинолин-3-ил)-4-диметиламино-2-(1-нафтил-ил)-1-фенил-бутан-2-ол (Ib).
К охлажденному до -30°С раствору 190 г (0,83 моль) промежуточного нафтилкетона (IV) в 2 л абсолютированного ТГФ в токе аргона присыпают 50 г (0,68 моль) диэтиламида лития. Смесь перемешивают 1 час, охлаждают до -70°С и прикапывают 129 г (0,45 моль) промежуточного арилхинолина (VIb) в 500 мл ТТФ. Смесь выдерживают 30 минут, далее отогревают до 20°С, после чего добавляют 120 мл ледяной уксусной кислоты. Отогретую до комнатной температуры реакционную массу упаривают досуха, растворяют в хлороформе, промывают несколько раз водой. Органический слой сушат над MgSO4, а растворитель отгоняют. Целевые продукты (I-1b и I-2b) в виде отдельных диастереоизомерных пар выделяют при помощи препаративной хиральной высокоэффективной жидкостной хроматографии. Практический выход смеси диастереомерных пар (I-1b+I-2b) в соотношении 1:1 составил 134,5 г (85,5%).
Полученные соединения в виде диастереомерных пар на отдельные энантиомеры не разделяли. При этом арабское обозначение "1" соединения характеризует диастереомерную пару с минимальным временем удерживания на хроматографической системе (RRSS-конфигурация диастереомерного центра), в то время обозначение "2" характеризует диастереомерную пару с RSSR-конфигурацией, и соответственно максимальным временем удерживания.
Производные (I-1a+I-1b, а также I-1c-e+I-2с-е) были получены путем, аналогичным описанному для (I-1b+I-2b). Практические выходы синтезированных веществ, а также их массспектральные характеристики приведены в нижеследующей Табл.1:
| Таблица 1 | |||||
| Соединение | R1 | R2 | R3 | [М+Н]+* | Выход, % |
| Ia | Н | Н | Н | 454 | 61,1 |
| Ib | Н | ОСН3 | Н | 484 | 85,5 |
| Ic | ОСН3 | ОСН3 | ОСН3 | 544 | 39,5 |
| Н | 498 | 29,5 | |||
| Ie | Н | ОСН3 | ОСН3 | 514 | 84,4 |
| *Основной пик в электроспрей масс-спектре (ESI-MS) с положительным режимом ионизации.**Практический выход смеси диастереомерных пар |
Описание методики определения антибактериальной активности полученных соединений
Антимикобактериальное действие приведенных в Табл.1 соединений изучали по динамике роста штамма M.tuberculosis H37Rv в обогащенной жидкой среде Middlebrook 7H9 в присутствии различных концентраций (0,312 мкг/мл, 0,625 мкг/мл, 1,25 мкг/мл, 2,5 мкг/мл, 5 мкг/мл, 10 мкг/мл, 20 мкг/мл, 40 мкг/мл) по сравнению с ростом этих штаммов на среде, не содержащей соединений, и среде, содержащей препарат 1-го ряда рифампицин в тех же концентрациях.
Микобактериальная суспензия засевалась в количестве 105 КОЕ/мл. Каждую из концентраций, включая контрольные пробирки без соединения и пробирки с рифампицином, исследовали в трипликатах.
Детекцию роста культуры микобактерий проводили с помощью автоматизированной системы учета роста культур Bactec MGIT 960 (Becton Dickenson, USA) в специальных пробирках MGIT, содержащих связанный флюорофор под полупроницаемой мембраной на дне пробирки. Детекция роста микобактериальных культур проводилась каждый час с помощью программного обеспечения Epicenter (Becton Dickenson, USA). Динамика деления микобактериальных клеток выражалась в относительных единицах флюоресценции (ОЕФ).
Время проведения эксперимента составило 42 дня согласно протоколу Becton Dickinson. После этого все выросшие культуры были подвергнуты контролю на видовую специфичность (принадлежность к микобактериям туберкулеза).
Бактериостатическую активность соединения оценивали:
1) по задержке начала роста культуры по сравнению с контролем без препаратов
2) по продолжительности фазы активного деления.
Результаты исследования вышеназванных соединений на антимикобактериальную активность, выраженные в единице MIC100, приведены в Таблице 2:
| Таблица 2 | |
| Соединение | MIC100, мкг/мл* |
| I-1a** | >40 |
| I-2а | 10 |
| I-1b | 20 |
| I-2b | 5 |
| I-1c | >25 |
| I-2c | >25 |
| I-2d | 5 |
| I-1e | >25 |
| I-2e | >25 |
| *концентрация соединения, при которой наблюдается полная потеря роста культуры M.tuberculosis в течение 42-х дней.**каждое соединение испытывалось в виде диастереомерной пары и на отдельные энантиомеры не разделялось. |
На примере соединения (I-2b, «R2OMe») показана динамика роста штамма H37Rv M.tuberculosis при экспонировании различными концентрациями (Рис.1).
Определение бактерицидной активности в отношении МБТ соединений (Ia-b) in vitro в автоматизированной системе Bactec MGIT 960
Для проверки бактерицидной активности были отобраны пробирки, содержащие тестируемые соединения (Ia-b) и рифампицин в концентрациях, при которых не наблюдался рост чувствительного лабораторного штамма M.tuberculosis H37Rv на протяжении всего эксперимента по определению бактериостатической активности. Согласно этому в исследование вошли соединения (I-1b) (20 мкг/мл и 40 мкг/мл), (I-2а) (10 мкг/мл, 20 мкг/мл и 40 мкг/мл) и (I-2b) (5 мкг/мл, 10 мкг/мл, 20 мкг/мл и 40 мкг/мл). В качестве контроля была пересеяна культура МБТ, культивируемая без препарата, и культура МБТ, экспонировавшаяся с рифампицином в концентрациях 0,625 мкг/мл, 1,25 мкг/мл, 2,5 мкг/мл, 5 мкг/мл, 10 мкг/мл, 20 мкг/мл и 40 мкг/мл, на которых не было зафиксировано роста культуры. Соединение (I-1а), не приведшее к подавлению роста культуры МБТ ни на одной из тестируемых концентраций, не использовалось при определении бактерицидной активности.
Для отмывки осадка от присутствующего в среде препарата пробирки центрифугировали при 3000 об/мин в течение 15 минут при комнатной температуре, после чего удаляли супернатант. В каждую пробирку к осадку добавляли 7 мл стерильного физиологического раствора и ресуспендировали осадок. Затем пробирки с содержимым центрифугировали при 3000 об/мин 15 минут и снова удаляли супернатант. Процедуру отмывки стерильным физиологическим раствором повторяли 2 раза. Отмытый таким образом от препаратов осадок (весь объем микобактерий) из каждой пробирки засевали в пробирки со свежей средой Middlebrook 7H9, обогащенной ростовыми добавками (Becton Dickinson). Наличие бактерицидной активности соединений (I-2а), (I-1b) и (I-2b) оценивалось по отсутствию роста отмытой от препаратов культуры в течение 42-х дней инкубации.
Полученные результаты приведены в Таблице 3 и на Рис.2. На рис.2 показана кривая роста штамма М.tuberculosis H37Rv в свежей среде после экспозиции с соединением «R2OMe» (I-2b) в концентрации 5, 10, 20 и 40 мкг/мл.
| Таблица 3 | |||
| Соединение | Концентрация (мкг/мл) | Начало роста культуры, инкубация 42 дня (дни) | |
| Среднее | СО | ||
| H37Rv без препарата | 3,33 | 0,07 | |
| Рифампицин | 0,625 | 8,50 | 0,09 |
| 1,25 | Нет роста | ||
| 2,5 | Нет роста | ||
| 5 | Нет роста | ||
| 10 | Нет роста | ||
| 20 | Нет роста | ||
| 40 | Нет роста | ||
| I-1b | 20 | 12,63 | 1,15 |
| 40 | 17,42 | 0,97 | |
| I-2а | 10 | 14,13 | 1,18 |
| 20 | 13,92 | 1,11 | |
| 40 | 18,63 | 1,26 | |
| I-2b | 5 | 12,67 | 1,47 |
| 10 | Нет роста | ||
| 20 | Нет роста | ||
| 40 | Нет роста |
Из приведенных в Таблице 2 и Таблице 3 результатов видно, что соединения (I-2b) и (I-2d) проявили достаточно высокую противотуберкулезную активность в отношении штамма микобактерии H37Rv, сравнимую (одного порядка) с таковой при использовании рифампицина (1 мкг/мл), в то время как вещество (I-2b) показало также и бактерицидную активность (10 мкг/мл, Рис.2). Полученные результаты являются основанием для дальнейших испытании выделенных веществ на зараженных животных с последующим их применением в качестве действующего начала новых и перспективных противотуберкулезных препаратов. Высокий же практический выход соединения (I-2b) позволяет сделать вывод о положительной рентабельности производства такой субстанции при высокотоннажных загрузках.
1. Производные хинолина, в частности 5,6,7-замещенные 1-(2-хлорхинолин-3-ил)-4-диметиламино-2-(нафталин-1-ил)-1-фенилбутан-2-олы общей формулы (I) где R1 означает Н, метокси, R2 означает Н, метокси, R3 означает Н, метокси, или их фармацевтически приемлемые соли с кислотами, обладающие антимикобактериальной активностью.
2. Способ получения соединений формулы (I) по п.1 путем взаимодействия замещенных 3-арилметилхинолинов и арилкетонов под действием металлирующих агентов.
3. Способ по п.2, отличающийся тем, что в качестве металлирующего агента используют диэтиламид лития.
4. Применение соединений по п.1 для лечения инфекционных заболеваний микобактериальной природы, в частности туберкулеза.