Средство, проявляющее антиагрегантную активность
Иллюстрации
Показать всеИзобретение относится к биологически активному веществу, проявляющему антиагрегантные свойства. Технический результат: получено средство на основе нового соединения гидрохлорида (2Е)-3-[1-(2-гидрокси-3-пиперидин-1-илпропил)-1Н-индол-3-ил]-1-(2-тиенил)проп-2-ен-1-она формулы I, обладающее антиагрегантным действием:
Указанное средство может быть использовано в медицине для получения препарата для предотвращения состояний, связанных с повышением тромбогенного потенциала крови. 2 табл., 1 пр.
Реферат
Изобретение относится к фармакологии, а именно к биологически активному веществу, проявляющему антиагрегантные свойства. Полученные данные могут быть использованы для создания нового эффективного отечественного препарата на основе синтетической субстанции вещества, для предотвращения тромботических состояний.
Тромбообразование играет ключевую роль в патогенезе ишемических нарушений в различных органах и системах человеческого организма (Г.Н.Сушкевич. Патогенез и лабораторная диагностика гемостатических нарушений при тромбофилиях различного генеза. Лабораторная медицина, №10, 2009, с.11-22). Такие заболевания, как инфаркт миокарда, ишемическая болезнь сердца (ИБС), острый коронарный синдром (ОКС), ишемический инсульт, гипертоническая болезнь, преходящие нарушения кровообращения, сахарный диабет, сопровождаются воспалительными и атеросклеротическими повреждениями сосудов, приводящим к ранней инвалидизации (Аронов Д.М., Лупанов В.П. Атеросклероз и коронарная болезнь сердца. М. Триада - X, 2009, 248 с.; Randal J.Vestrick, Mary E.Winn, Daniel T.Eitzman Murine Models of Vascular Thrombosis. Arteriosclerosis, Thrombosis, and Vascular Biology, 27, 2007, p.2079-2093; A.E.May, P.Seizer, М.Gawaz Platelets: Inflammatory firebugs of Wascular Walls. Arteriosclerosis, Thrombosis, and Vascular Biology, 28, 2008, p.5-10; Natarajan A., Zaman A.G. Marshal S.M. Platelet hyperactivity in type 2 diabetes: role of antiplatelet agents. Diab.Vasc. Dis Res., 5(2), 2008, p.138-144).
Однако несмотря на то, что за последнее время был достигнут значительный прогресс в изучении механизмов нарушения агрегации тромбоцитов, арсенал средств фармакологической коррекции нарушений тромбоцитарно-сосудистого-гемостаза весьма ограничен.
В настоящее время выделяют всего три группы антитромбоцитарных препаратов, в основе разделения которых лежат принципы доказательной медицины, учитывающие эффективность и наличие побочных действий.
Первая группа, составляющая основу современной антитромбоцитарной терапии, - ингибиторы циклооксигеназы (ЦОГ): ацетилсалициловая кислота, вторая группа - тиенопиридины (тиклопидин, клопидогрель, празугрель) - селективно блокируют АДФ-рецептор P2Y12 в тромбоцитах и третья группа - блокаторы гликопротеиновых рецепторов IIb/IIIa для внутривенного применения (абциксимаб, эптифибатид, тирофибан, фрамон) (М.А.Чарная, Ю.А.Морозов. Современные антиагрегантные препараты и их применение в клинике (обзор). Болезни аорты и ее путей, 2009. - №1. - С.34-40; Yao-Zu Xiang, Li-Yuan Kang, Xiu-Mei Gao et al. Strategies for antiplatelet targets and agents, Thrombosis Research, 2008, 123, p.35-49; Mousa S.A.Jeske W.P., Fareed J. Antiplatelet therapy prasugrel: a novel platelet ADP P2YI2 receptor antagonist. Clin. Appl. Thromb.Hemost, 16(2), 2010, p.170-176).
В то же время использование таких препаратов ограничено наличием у них ряда нежелательных эффектов, таких как желудочно-кишечные кровотечения, наличие резистентности и др. (Sanderson S., Emery J., Baglin T., Kinmonth A.L. Narrative review: aspirin resistance and its clinical implications. Ann Intern Med, 142, 2005, p-370-380; Добровольский А.В. Клопидогрел в лечении заболеваний сердечно-сосудистой системы. Русский медицинский журнал, №8, 2009, с.558-570).
Это делает весьма актуальным вопрос поиска новых соединений с антиагрегантной активностью.
Техническим результатом изобретения является выявление в ряду 3-(2-карбонилвинил)индола соединений с антиагрегантными свойствами.
Изобретение относится к новым производным в ряду 3-(2-карбонилвинил)индола, а именно к гидрохлориду (2Е)-3-[1-(2-гидрокси-3-пиперидин-1-илпропил)-1H-индол-3-ил]-1-(2-тиенил)проп-2-ен-1-она формулы I:
обладающему антиагрегантной активностью.
Большинство лекарственных веществ индольного ряда обладают психотропным действием [Р.С.Вартанян. Синтез основных лекарственных средств - М.: МИА, 2005 г.].
В ряду 3-(2-карбонилвинил)индола не известны соединения, обладающие антиагрегантной активностью. Наиболее близкими по структуре к соединению I являются гидрогалогениды 3-[1-(2-гидрокси-3-пиперидин-1-ил-пропил)-1H-индол-3-ил]-1-фенил-пропенона формулы II, обладающие местноанестезирующим действием при поверхностной, инфильтрационной, проводниковой и эпидуральной анестезиях [Суздалев К.Ф., Денькина С.В., Галенко-Ярошевский П.А., Варлашкина И.А., Чередник И.Л., Шейх-Заде Ю.Р., Таран О.А., Тахчиди Х.П., Сахнов С.Н., Дольская О.А., Лисицына Н.П., Бгуашева Б.А., Богус С.К. Гидрогалогениды 3-[1-(2-гидрокси-3-пиперидин-1-ил-пропил)-1H-индол-3-ил]-1-фенил-пропенона, обладающие местноанестезирующей и антиаритмической активностью. Положительное решение по заявке на патент №2008153019/04(069836), от 18.05.2010, приоритет от 31.12.2008].
Техническим результатом изобретения являются новые соединения в ряду 3-(2-карбонилвинил)индола, проявляющие новое для данного ряда антиагрегантное действие, более эффективное, чем у известного, широко применяемого антиагрегантного средства - ацетилсалициловой кислоты.
Технический результат изобретения достигается соединениям формулы I.
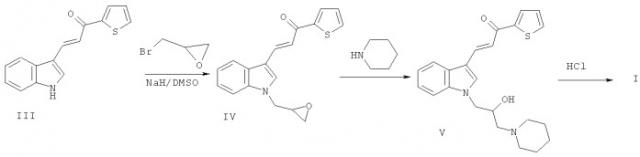
Для получения соединения I проводят N-алкилирование халкона III эпибромгидрином с образованием продукта IV. Взаимодействие вещества IV с пиперидином и перевод полученного аминоспирта V в гидрохлорид обычным методом дает соединение I.
Ниже приведена методика синтеза предлагаемого соединения.
Пример 1. Гидрохлорид (2Е)-3-[1-(2-гидрокси-3-пиперидин-1-илпропил)-1H-индол-3-ил]-1-(2-тиенил)проп-2-ен-1-она I
Стадия 1. (2E)-3-[1-(оксиран-2-илметил)-1H-индол-3-ил]-1-(2-тиенил)проп-2-ен-1-он IV. К 4.15 г (0.104 моль) 60%-ной суспензии гидрида натрия в минеральном масле в 70 мл сухого диметилсульфоксида (DMSO) добавляют при перемешивании 21.9 г (0.097 моль) (2E)-3-(1H-индол-3-ил)-1-(2-тиенил)проп-2-ен-1-она III в течение 30 мин. Через 1 ч, когда выделение водорода заканчивается, добавляют 21.5 мл (0.261 моль) эпибромгидрина. Через 3.5 ч темно-красный цвет раствора меняется на темно-желтый. Добавляют по каплям 30 мл воды и 5 мл изопропилового спирта и инициируют кристаллизацию трением. Смесь оставляют на ночь в холодильнике. Выпавший осадок отфильтровывают, промывают смесью диметилсульфоксида с водой (1:1), затем метанолом и перекристаллизовывают из 400 мл изопропилового спирта. Выход - 15.9 г (43%). Тпл.=142-144°С. Найдено, %: С 72,33; Н 5,41; N 4,89. C17H15NOS. Вычислено, %: С 72.57; Н 5,37; N 4,98. ИК-спектр (вазелин, масло), см-1: 1638 (С=O); 1572 (С=С). Спектр 1Н ЯМР (CDCl3), δ, м.д.: 2.45-2.55 (1Н, м, ОСН2); 2.85-2.93 (1Н, м, OCH2); 3.28-3.58 (1Н, м, СН); 4.18 (1Н, дд, NCH2); 4.55 (1Н, дд, NCH2); 7.18-8.17 (10Н, м, аром. Н и СН-СН).
Стадия 2. 3-[1-(2-гидрокси-3-пиперидин-1-ил-пропил)-1Н-индол-3-ил]-1-фенил-пропенон V. Смесь 0.61 г (0.002 моль) 3-(1-оксиранметил-1Н-индол-3-ил)-1-фенилпропенона IV и 0.4 мл (0.004 моль) пиперидина кипятят в 5 мл толуола 8 ч. Реакционную смесь охлаждают и разбавляют петролейным эфиром в два раза. Кристаллизацию вызывают трением. Выпавшее желтое вещество перекристаллизовывают из изопропилового спирта. Выход 0.55 г (71%) Т.пл. 108-110°С. Найдено, %: С 77,2; Н 7,4; N 7,1. C25H28N2O2. Вычислено, %: С 77,3; Н 7,3; N 7,2. ИК-спектр (вазелин, масло), см-1: 3413 (ОН); 1633 (С=O); 1577 (С=С). Спектр 1H ЯМР (CDCl3), δ, м.д.: 1.40-1.60 (6Н, м, 3СН2); 2.20-2.60 (6Н, м, 2NСН2пиперид, NCH2инд); 3.89 (1Н, шс, ОН); 4.00-4.30 (3Н, м, C H _ − C H _ 2 N ); 7.21-8.15 (10Н, м аром. Н и СН=СН).
Стадия 3. Гидрохлорид 3-[1-(2-гидрокси-3-пиперидин-1-ил-пропил)-1Н-индол-3-ил]-1-фенил-пропенона Ia (R=Н, Х=Cl). 3-[1-(2-Гидрокси-3-пиперидин-1-ил-пропил)-1H-индол-3-ил]-1-фенил-пропенон V, 0.777 г (0.002 моль) растворяют в 5 мл ацетона на холоду и подкисляют насыщенным раствором HCl в изопропиловом спирте. Добавляют диэтиловый эфир. Кристаллизацию вызывают трением. Выпавшее желтое вещество отфильтровывают, промывают диэтиловым эфиром. Выход 0.714 г (84%) Т.пл.=176°С. Найдено, %: С 70,5; Н 6,9; N 6,5. C25H28N2O2·HCl. Вычислено, %: С 70,6; Н 6,8; N 6,6. ИК-спектр (вазелин, масло), см-1: 3217 (ОН); 2667-2473 (широкие полосы NH);1627 (С=O); 1573 (С=С). Спектр 1Н ЯМР (CDCl3), δ, м.д.: 1.33-2.09 (6Н, м, 3CH2 пиперид); 2.84-3.58 (6Н, м, 3HCH2пиперид); 4.19-4.60 (3Н, м, Nинд-СН2); 5.98 (1Н, шс, ОН); 7.18-8.10 (10Н, м, аром Н и СН-СН); 10.70 (1Н, уширен, с N+Нпиперид).
Ниже приведены материалы, методы и результаты исследований антиагрегантной активности данного соединения, а также его токсичность.
Исследования были выполнены на 5 кроликах породы «Шиншилла» массой 4-4,5 кг, 70 белых нелинейных крысах, массой 350-400 г. До проведения эксперимента животные содержались в условиях вивария с естественным световым режимом на полноценном, сбалансированном по содержанию питательных веществ рационе (в соответствии с ГОСТ Р 50258-92). Содержание животных отвечало Международным рекомендациям Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997) и правилам лабораторной практики при проведении доклинических исследований в РФ.
При проведении опытов по выявлению антиагрегантной активности использовались следующие реактивы: аденозин-5-дифосфорная кислота (АДФ) («Sigma» США), ацетилсалициловая кислота («Sigma» США).
Изучение антиагрегантной активности in vitro проводили на двухканальном лазерном анализаторе агрегации (модель 220 LA) научно-производственной фирмы «Биола» (г.Москва). Определение агрегации тромбоцитов проводили по методу Born G. (Born G.V.R. Aggregation of bloodplatelets by adenosine diphoshate and its reversal//Nature, 194, 1962, - p.927-929) в модификации Габбасова З.А. и др. (З.А.Габбасов, Е.Г.Попов, И.Ю.Гаврилов и др. Лабораторное дело, N.10, 15-18 (1989) на модели АДФ индуцированной агрегации тромбоцитов.
Исследования проводили на богатой тромбоцитами плазме, полученной по способу, описанному В.А.Люсовым (Люсов В.А., Белоусовым Ю.Б., Савенков М.П. // Лабораторное дело, №8, 1975, с.462-468).
В ходе эксперимента в кювету агрегометра последовательно вносили 300 мкл богатой тромбоцитами плазмы и раствор исследуемого соединения I в концентрации 1×10-4 М, 1×10-5 М, 1×10-6 M. Пробы инкубировали в термостатируемых ячейках агрегометра при 37°С в течение 5 минут. После включения записи в кювету добавляли индуктор агрегации - АДФ. В качестве препарата сравнения использовалась ацетилсалициловая кислота.
Изучение показателя ЕС50 проводили по описанной выше методике с переменной концентрацией исследуемого вещества. Расчет ЕС50 производился с использованием метода регрессионного анализа в программе Microsoft Excell 2006.
Острую токсичность определяли на белых половозрелых нелинейных мышах обоего пола при внутрибрюшинном введении соединений согласно требованиям и инструкциям Федеральной службы по надзору в сфере здравоохранения и социального развития (под ред. Хабреева Р.У., 2005). Наблюдение за животными вели в течение 2 недель после однократного введения веществ, отмечая динамику симптоматики отравления и фиксируя количество погибших животных, с последующим расчетом величины LD50.
Широту терапевтического действия веществ оценивали по условному терапевтическому индексу - отношение величины LD50 к ЕС50.
Статистическая обработка результатов проводилась с использованием критерия Манна-Уитни. Для обработки результатов использовались статистическая программа «Satistika 6.0» и программное обеспечение Microsoft Excell 2006.
При исследовании соединения I на наличие антиагрегантной активности «in vitro» в концентрации 1×10-4 M было обнаружено, что данное соединение ингибирует агрегацию тромбоцитов на 80,2%, а в концентрациях 1×10-5 и 1×10-6 M на 33,2 и 23,7% соответственно. ЕС50 соединения I при этом составила составила 4,86×10-5 М (табл.1).
Препарат сравнения ацетилсалициловая кислота также дозозависимо ингибировала процессы агрегации тромбоцитов, индуцированные АДФ.
В концентрации 1×10-3 M данный препарат снижал степень агрегации тромбоцитов на 53,4%. В более низких концентрациях 1×10-4 и 1×10-5 M ацетилсалициловая кислота ингибировала процессы агрегации тромбоцитов на 29,3 и 3,1% соответственно. ЕС50 ацетилсалициловой кислоты при этом составила 7,1×10-4 М (табл.1).
LD50 соединения I составила 200 мг/кг. Для наиболее адекватного сравнения безопасности соединений был рассчитан условный терапевтический индекс. Для соединения I он составил 9,5 а для ацетилсалициловой кислоты - 2,41. Данные представлены в таблице 2.
Таким образом по ЕС50 соединение I превосходит препарат сравнения ацетилсалициловую кислоту в 14,5 раза, а по условному терапевтическому индексу в 4 раза.
| Таблица 1 | |||||
| Влияние соединения I и ацетилсалициловой кислоты на АДФ-индуцированную агрегацию тромбоцитов кролика (опыты in vitro) (M±m). | |||||
| N п/п | Название соединений | Агрегация тромбоцитов (Δ% по отношению к контролю) | |||
| 1×10-3 M | 1×10-4 M | 1×10-5 M | 1×10-6 M | ||
| 1. | Соединение I | 80,24±7,16 | 33,2±4,36 | 23,69±7,18 | |
| 2. | Ацетилсалициловая кислота | 53,4±4,23* | 29,3±3,4* | 3,1±1,9 | |
| * - (p≤0,05), данные достоверны по отношению к контролю |
| Таблица 2 | |||||
| Сравнительная антиагрегантная активность соединения I и ацетилсалициловой кислоты по ЕС50 и условному терапевтическому индексу | |||||
| № п/п | Исследуемое вещество | ЕС50, М | ЕС50, мг/л | LD50, мг/кг | Условный терапевтический индекс |
| 1. | Соединение I | 4,86×10-5 | 21,0 | 200 | 9,5 |
| 2. | Ацетилсалициловая кислота | 7,1×10-4 | 128,5 | 310 | 2,41 |
Применение гидрохлорид (2Е)-3-[1-(2-гидрокси-3-пиперидин-1-илпропил)-1Н-индол-3-ил]-1-(2-тиенил)проп-2-ен-1-она I в качестве средства, проявляющего антиагрегантные свойства.