Способы ингибирования ангиогенеза с помощью антагонистов egfl8
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к средствам, ингибирующим ангиогенез, и может быть использовано в медицине. Способ предусматривает введение антагониста EGFL8 индивидууму с патологическим состоянием, связанным с ангиогенезом. Изобретение позволяет ингибировать рост сосудов в патологических, например, опухолевых тканях. 13 з.п. ф-лы, 4 ил., 2 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет предварительной заявки США No. 61/020,960, поданной 14 января 2008, описание которой в полном объеме включено в настоящее описание в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к композициям и способам, которые могут использоваться для лечения состояний и заболеваний, связанных с ангиогенезом. В частности, настоящее изобретение относится к антагонистам EGF-подобного домена 8 (EGFL8).
ПРЕДПОСЫЛКИ ДЛЯ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В настоящем время хорошо известно, что ангиогенез является важным звеном патогенеза различных расстройств. В их число входят солидные опухоли и метастазы, атеросклероз, ретролентальная фиброплазия, гемангиомы, хроническое воспаление, заболевания, связанные с внутриглазной неоваскуляризацией, такие как пролиферативные ретинопатии, например, диабетическая ретинопатия, окклюзия ретинальных вен (RVO), возрастная дегенерация желтого пятна (AMD), неоваскулярная глаукома, иммунологическое отторжение трансплантированной ткани роговицы и других тканей, ревматоидный артрит и псориаз. Duda et al. J. Clin. Oncology 25(26): 4033-42 (2007); Kesisis et al. Curr. Pharm. Des. 13: 2795-809 (2007); Zhang & Ma Prog. Ret. & Eye Res. 26: 1-37 (2007).
В случае опухолевого роста ангиогенез обеспечивает клеткам опухоли преимущества в росте и автономной пролиферации по сравнению с нормальными клетками. Обычно опухоль начинается с одиночной патологической клетки, которая способна расти только лишь до размера в несколько кубических миллиметров, обусловленного расстоянием до ближайшего доступного капиллярного русла, и она в течение долгого периода может оставаться в “спящем” состоянии, без дальнейшего роста или диссеминации. Затем некоторые опухолевые клетки переключаются на ангиогенный фенотип для активации эндотелиальных клеток (ЭК), которые пролиферируют и созревают во вновь образованные капиллярные кровеносные сосуды. Указанные вновь образованные кровеносные сосуды обеспечивают возможность не только непрерывного роста первичной опухоли, но также диссеминации и реколонизации метастатических опухолевых клеток. Механизмы, которые контролируют ангиогенное переключение, не совсем понятны, но считается, что неоваскуляризация опухолевой массы приводит к чистому балансу совокупности стимуляторов и ингибиторов ангиогенеза.
На сегодняшний день показано, что значительное количество молекул, в основном секретируемых факторов, продуцируемых окружающими клетками, регулирует дифференцировку, пролиферацию, миграцию ЭК и их коалесценцию в шнуроподобные структуры. Например, фактор роста сосудистого эндотелия (VEGF) идентифицирован как ключевой фактор, участвующий в стимулирующем ангиогенезе и индуцирующий сосудистую проницаемость. Ferrara et al., Endocr. Rev.18: 4-25 (1997). Кроме того, было показано, что ECM-связанный белок, называемый белком, подобным эпидермальному фактору роста 7 (EGFL7), экспрессируется эндотелиальными клетками и играет роль в ангиогенезе. Parker et al., Nature 428: 754-58 (2004); Fitch et al., Dev. Dynamics 230: 316-24 (2004); Campagnolo et al., Am. J. Path. 167(1): 275-284 (2005); Schmidt et al., Development, 134(16): 2913-23. (2007), патентная заявка США US2007/0031437. В публикации Fitch et al. описан также паралог Egfl7, обозначаемый Egfl8, и указано, что его экспрессия подобна экспрессии Egfl7, но что при этом EGFL7 и EGFL8 могут функционально и не перекрываться.
Несмотря на многочисленные успехи в области ангиогенеза, все еще остается потребность в идентификации мишеней и разработке средств, которые могут дополнить или повысить эффективность существующей антиангиогенной терапии.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, по крайней мере отчасти, основано на открытии того факта, что EGF-подобный домен 8 (EGFL8) участвует в процессе ангиогенеза. Соответственно, настоящее изобретение относится к новым композициям и к их применению для ингибирования патологических процессов с участием ангиогенного компонента.
В одном из аспектов настоящее изобретение относится к способу уменьшения или ингибирования ангиогенеза у индивида с патологическим состоянием, связанным с ангиогенезом, предусматривающим введение указанному индивиду антагониста EGFL8. В некоторых вариантах осуществления антагонист EGFL8 представляет собой антитело против EGFL8. В некоторых вариантах осуществления указанным патологическим состоянием является новообразование, например, карцинома. В определенных вариантах осуществления указанный способ дополнительно включает введение химиотерапевтического средства. В некоторых вариантах осуществления указанное патологическое состояние связано с болезнями глаза. В некоторых вариантах осуществления указанным патологическим состоянием является заболевание, связанное с внутриглазной неоваскуляризацией.
В некоторых вариантах осуществления указанный способ дополнительно включает введение указанному индивиду второго антиангиогенного средства. В определенных вариантах осуществления указанное второе антиангиогенное средство вводят до или после введения антагониста EGFL8. В других вариантах осуществления указанное второе антиангиогенное средство вводят одновременно с антагонистом EGFL8. В некоторых вариантах осуществления указанным вторым антиангиогенным средством является антагонист EGFL7 или антагонист фактора роста клеток сосудистого эндотелия (VEGF), например, антитело против EGFL7 или антитело против VEGF (например, бевацизумаб).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГУРЕ 1A и ФИГУРЕ 1B показан характер экспрессии Egfl7 и Egfl8 в краниальной сосудистой сети эмбриона мыши E10.5.
На ФИГУРЕ 2 показана стратегия, используемая для получения нокаутных по Egfl8 мышей.
На ФИГУРЕ 3 показан сосудистый фенотип в сетчатке глаза мышей Egfl7+/-, Egfl8-/- и Egfl7-/-, Egfl8-/-.
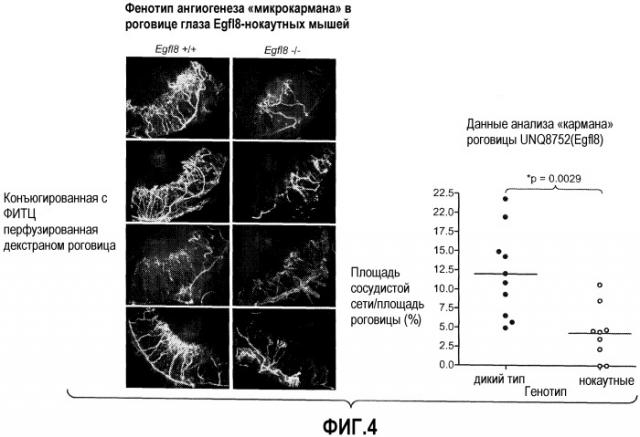
На ФИГУРЕ 4 показан фенотип ангиогенеза «микрокармана» в роговице глаза у нокаутных по Egfl8 мышей.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Определения
Если не указано иначе, используемые в данном описании технические и научные термины обозначают то же, что обычно известно специалисту в той области, к которой относится настоящее изобретение. См., например, Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, NY 1994); Sambrook et al., Molecular Cloning, A Laboratory Manual Cold Spring Harbor Press (Cold Spring Harbor, NY 1989). Для целей, преследуемых в настоящем изобретении, некоторые термины определены ниже.
Используемые в данном описании термины "EGFL8" и "полипептид EGFL8" относятся к полипептиду с аминокислотной последовательностью природным образом полученного полипептида EGFL8, независимо от способа его получения или от того, из какого биологического вида он получен. Таким образом, EGFL8 может иметь аминокислотную последовательность полученного природным образом EGFL8 человека, EGFL8 мыши или EGFL8, полученного из любого другого биологического вида. Полноразмерная аминокислотная последовательность EGFL8 человека является следующей:
MGSRAELCTLLGGFSFLLLLIPGEGAKGGSLRESQGVCSKQTLVVPLHYNESYSQPVYKPY LTLCAGRRICSTYRTMYRVMWREVRREVQQTHAVCCQGWKKRHPGALTCEAICAKPCLNGG VCVRPDQCECAPGWGGKHCHVDVDECRTSITLCSHHCFNTAGSFTCGCPHDLVLGVDGRTC MEGSPEPPTSASILSVAVREAEKDERALKQEIHELRGRLERLEQWAGQAGAWVRAVLPVPP EELQPEQVAELWGRGDRIESLSDQVLLLEERLGACSCEDNSLGLGVNHR (SEQ ID NO:1).
Полноразмерная аминокислотная последовательность EGFL8 мыши является следующей:
MGLWAELCISLRGLSFFLVLMTGEGTRGGSFKESLGVCSKQTLLVPLRYNESYSQPVYKPY LTLCAGRRICSTYRTTYRVAWREVRREVPQTHVVCCQGWKKPHPGALTCDAICSKPCLNGG VCTGPDRCECAPGWGGKHCHVDVDECRASLTLCSHGCLNTLGSFLCSCPHPLVLGLDGRTC AGGPPESPTSASILSVAVREADSEEERALRWEVAELRGRLEKLEQWATQAGAWVRAVLPMP PEELRPEQVAELWGRGDRIESLSDQVLLLEERLGACACEDNSLGPSLRG (SEQ ID NO:2).
Такие полипептиды EGFL8 могут быть выделены из природных источников или могут быть получены рекомбинантным и/или синтетическим путями.
"Выделенный, EGFL8" означает EGFL8, который очищен из источника EGFL8 или который получен рекомбинантным или синтетическим путем и очищен. Очищенный EGFL8 является по существу свободным от других полипептидов или пептидов. В данном описании "по существу свободный" означает имеющий менее приблизительно 5%, предпочтительно, менее приблизительно 2%, более предпочтительно, менее приблизительно 1%, еще более предпочтительно, менее приблизительно 0,5%, и наиболее предпочтительно, менее приблизительно 0,1% примесей других белков.
Термин "антагонист" используется в данном описании в наиболее широком смысле и включает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность EGFL8. Подходящие антагонистические молекулы включают, в частности, антагонистические антитела или фрагменты антител, варианты фрагментов или аминокислотных последовательностей нативного полипептида EGFL8, пептидов, растворимых фрагментов рецептора (рецепторов) EGFL8, антисмысловые РНК, рибозимы, iРНК, низкомолекулярные органические молекулы и т.д. Способы идентификации антагонистов полипептида EGFL8 могут включать приведение полипептида EGFL8 в контакт с антагонистической молекулой-кандидатом и измерение детектируемого изменения на уровне одной или более биологических активностей, в норме связанных с полипептидом EGFL8.
"Активный" или "активность" в связи с преследуемыми в данном описании целями относится к форме(формам) EGFL8, которая сохраняет биологическую и/или иммунологическую активность EGFL8, причем "биологическая" активность относится к биологической функции (либо ингибирующей, либо стимулирующей), вызываемой EGFL8 и отличной от способности индуцировать выработку антитела против антигенного эпитопа, содержащегося в EGFL8, а "иммунологическая" активность относится к способности индуцировать выработку антитела против антигенного эпитопа, содержащегося в EGFL8. Основными биологическими активностями EGFL8 являются его способность стимулировать сосудообразование и поддерживать адгезивные и миграционные свойства эндотелиальных клеток.
"Рецептором EGFL8" является молекула, с которой соединяется EGFL8 и которая опосредует биологическую активность EGFL8.
Термин "антитело" используется в данном описании в наиболее широком смысле и охватывает, в частности, антитело человека, не являющиеся человеческими (например, мышиные) и гуманизированные моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), а также любые фрагменты антител, которые проявляют требуемую биологическую активность.
"Нативные антитела" обычно являются гетеротетрамерными гликопротеинами размером приблизительно в 150000 Дальтон, состоящими из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных связей среди тяжелых цепей иммуноглобулинов различных изотипов варьирует. Каждая тяжелая и легкая цепь имеет также регулярно расположенные дисульфидные мостики внутри цепи. Каждая тяжелая и легкая цепь на одном конце имеет вариабельный домен (VH) с последующим рядом константных доменов. Каждая легкая цепь на одном конце имеет вариабельный домен (VL), а на другом конце имеет константный домен; константный домен легкой цепи совпадает с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи совпадает с вариабельным доменом тяжелой цепи. Считается, что конкретные аминокислотные остатки образуют сопряжение между вариабельными доменами легкой и тяжелой цепи.
При расщеплении антител папаином образуется два идентичных антиген-связывающих фрагмента, которые называются "Fab"-фрагментами, каждый из которых содержит единственный антиген-связывающий участок, и остальной "Fc"-фрагмент, название которого отражает его повышенную способность к кристаллизации. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антиген-связывающих участка и который сохраняет способность к поперечному связыванию с антигеном.
"Fv" представляет собой минимальный фрагмент антитела, который полностью содержит участок распознавания и связывания антигена. Указанный участок состоит из димера вариабельных доменов одной легкой цепи и одной тяжелой цепи, находящихся в тесной нековалентной ассоциации друг с другом.
Fab-фрагмент содержит также константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков к карбокси-концу их CH1-домена тяжелой цепи, включая один или более цистеинов из шарнирной области антитела. Обозначение Fab'-SH используется в данном описании в отношении Fab'-фрагмента, в котором цистеиновый остаток(остатки) константных доменов несет свободную тиоловую группу. F(ab')2-фрагменты антитела первоначально продуцируются в виде пары Fab'-фрагментов, между которыми содержатся шарнирные цистеины. Остальные варианты химического связывания фрагментов антитела хорошо известны.
"Легкие цепи" антител (иммуноглобулинов) из любых видов позвоночных могут быть отнесены к одному из двух совершенно различных типов цепей, называемых каппа (κ) и лямбда (λ) на основе аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константных доменов их тяжелых цепей, иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются, соответственно, α, δ, ε, γ и μ. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
"Фрагменты антитела" содержат часть полноразмерного антитела, обычно его антиген-связывающий или вариабельный домен. Примеры фрагментов антитела включают Fab-, Fab'-, F(ab')2- и Fv- фрагменты.
Используемый в данном описании термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, то есть индивидуальные антитела, составляющие указанную популяцию, идентичны, за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифическими, направленными на единственный антигенный участок. Кроме того, в отличие от препаратов обычных (поликлональных) антител, которые, как правило, включают различные антитела, направленные на различные детерминанты (эпитопы), каждое моноклональное антитело направлено на единственную детерминанту конкретного антигена. Уточнение "моноклональное" указывает на характер антитела как антитела, полученного из по существу гомогенной популяции антител и не должно быть истолковано как указание на то, что такое антитело получено тем или иным конкретным методом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature 256: 495 (1975), или могут быть получены с помощью методов рекомбинантной ДНК (см., например, патент США No. 4816567). "Моноклональные антитела" могут быть также выделены из библиотек фаговых антител с использованием технологий, описанных Clackson et al., Nature 352: 624-628 (1991), и, например, Marks et al., J. Mol. Biol. 222: 581-597 (1991).
В данном описании моноклональные антитела включают, в частности, "химерные" антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих конкретному классу или подклассу антител, тогда как остальная цепь(цепи) идентична или гомологична соответствующим последовательностям в антителах, полученных из других видов или принадлежащих другому классу или подклассу антител, а также во фрагментах таких антител, которые обладают требуемой биологической активностью (патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)).
"Гуманизированные" формы антител, не являющихся антителами человека (например, антител мыши), являются химерными антителами, которые содержат минимальную последовательность, полученную из иммуноглобулина, не являющегося иммуноглобулином человека. По большей частью гуманизированные антитела являются иммуноглобулинами человека (реципиентское антитело), в которых остатки гипервариабельной области реципиента заменены остатками гипервариабельной области отличных от человека видов (донорское антитело), таких как мышь, крыса, кролик или отличный от человека примат, имеющих требуемую специфичность, аффинность и эффективность. В некоторых случаях остатки области рамки считывания (FR) иммуноглобулина человека заменены соответствующими остатками иммуноглобулина не-человеческой природы. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаруживаются в реципиентском антителе или в донорском антителе. Такие модификации производят для дальнейшего повышения эффективности антитела. Обычно гуманизированное антитело содержит все из по меньшей мере одного, обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные области соответствуют таковым иммуноглобулина не-человеческой природы, а все или по существу все области FR имеют последовательность иммуноглобулина человека. Гуманизированное антитело необязательно содержит также по меньшей мере часть константной области иммуноглобулина (Fc), как правило, таковую иммуноглобулина человека. Для ознакомления с дальнейшими подробностями см. Jones et al. Nature 321: 522-525 (1986); Reichmann et al. Nature 332: 323-329 (1988); и Presta Curr. Op. Struct. Biol. 2: 593-596 (1992).
В данном описании под "лечением" подразумевается подход, обеспечивающий улучшение или требуемые клинические результаты. Для целей, преследуемых данным изобретением, улучшение или требуемые клинические результаты включают, не ограничиваясь перечисленным, детектируемое или недетектируемое облегчение симптомов, ослабление выраженности заболевания, стабилизацию (то есть отсутствие ухудшения) состояния болезни, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение состояния болезни и ремиссию (будь то частичная или полная ремиссия). "Лечение" может означать также увеличение выживаемости по сравнению с выживаемостью в отсутствие лечения. "Лечение" представляет собой вмешательство, предпринимаемое с целью предотвращения развития или внесения изменений в патологический процесс, связанный с заболеванием. Соответственно, "лечение" относится как к терпевтическому воздействию, так и к профилактическим или превентивным мерам. Таковые в случае необходимости лечения включают меры, предпринимаемые уже при наличии расстройства, а также такие меры, которые призваны предотвратить расстройство. В частности, лечение может непосредственно предотвратить, замедлить или иным способом снизить патологические явления дегенерации или повреждения клеток, такие как патологические явления, связанные с опухолевыми клетками при лечении злокачественной опухоли, или может придать клеткам большую чувствительность к лечению под действием других терапевтических средств.
"Хроническое" введение относится к введению средства(средств) в непрерывном режиме, в отличие от кратковременного режима, с целью поддержания первоначального терапевтического эффекта (активности) в течение длительного периода. "Периодическое" введение представляет собой лечение, которое не является лечением, проводимым последовательно и без перерыва, а скорее является лечением, циклическим по природе.
В данном описании термин "опухоль" относится к любому неопластическому росту и пролиферации клеток, будь то злокачественные или доброкачественные опухоли, а также ко всем предраковым и злокачественным клеткам и тканям.
Термины "рак" и "злокачественный" описывают или относятся к физиологическому состоянию у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, не ограничиваясь перечисленным, карциному, лимфому, бластому, саркому и лейкемию. Более конкретные примеры таких злокачественных состояний включают плоскоклеточный рак, рак легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшины, гепатоцеллюлярный рак, гастральный рак или рак желудка (включая желудочно-кишечный рак), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, почечный или ренальный рак, рак печени, рак предстательной железы, рак наружных женских половых органов, рак щитовидной железы, карциному печени и разные типы рака головы и шеи, а также B-клеточную лимфому (включая низкодифференцированную/ /фолликулярную неходжкинскую лимфому (NHL); мелкоклеточную лимфоцитарную (SL) NHL; среднедифференцированную/фолликулярную NHL; среднедифференцированную диффузную NHL; высокодифференцированную иммунобластную NHL; высокодифференцированную лимфобластную NHL; высокодифференцированную мелкоклеточную NHL с нерассеченными ядрами; массивное поражение при лимфогранулематозе; лимфому клеток мантийной ткани; СПИД-связанную лимфому; и макроглобулинемию Вальденстрема); хроническую лимфоцитарную лейкемию (CLL); острый лимфобластный лейкоз (ALL); волосатоклеточную лейкемию; хронический миелобластный лейкоз; и посттрансплантационный лимфопролиферативный синдром (PTLD), а также аномальную васкулярную пролиферацию, связанную с факоматозом, отек (например, связанный с опухолями мозга) и синдром Мейгса.
"Химиотерапевтическим средством" является химическое соединение, используемое при лечении злокачественной опухоли. В это определение включаются также противогормональные средства, которые действуют в качестве регуляторов или ингибиторов действия гормонов на опухоли, таких как антиэстрогены и селективные модуляторы эстрогенных рецепторов (SERM).
"Заболеванием внутриглазной неоваскуляризации" является заболевание, характеризующееся неоваскуляризацией глаза. Примеры заболеваний внутриглазной неоваскуляризации включают, не ограничиваясь перечисленным, пролиферативные ретинопатии, включая пролиферативную диабетическую ретинопатию, хороидальную неоваскуляризацию (CNV), возрастную дегенерацию желтого пятна (AMD), диабетическую и другие связанные с ишемией ретинопатии, диабетический отек зоны желтого пятна (DME), патологическую миопию, болезнь Гиппеля-Линдау, гистоплазмоз глаза, окклюзию центральных вен сетчатки (CRVO), разветвленную окклюзию центральных вен сетчатки (BRVO), неоваскуляризацию роговицы, неоваскуляризацию сетчатки, ретинопатию недоношенных (ROP), субконъюнктивальное кровоизлияние, гипертензивную ретинопатию и т.д.
"Патология" заболевания включает все явления, которые нарушают хорошее самочувствие пациента. В случае злокачественных опухолей это включает, не ограничиваясь перечисленным, аномальный или неконтролируемый рост клеток, метастазы, помехи нормальному функционированию близлежащих клеток, аномальные уровни высвобождения цитокинов или других продуктов секреции, супрессию или обострение воспалительного или иммунологического ответа и т.д.
Введение "в сочетании с" одним или более дополнительными терапевтическими средствами включает одновременное (совместное) и последовательное введение в любом порядке.
Используемые в данном описании "носители" включают фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергающегося их действию в используемых дозах и концентрациях. Часто физиологически приемлемый носитель является забуференным водным раствором. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный и буферы других органических кислот; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (имеющие приблизительно менее чем 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатобразующие агенты, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные соединения, такие как TWEENTM, полиэтиленгликоль (ПЭГ) и PLURONICSTM.
В данном описании "низкомолекулярная молекула" определяется как молекула, имеющая молекулярную массу приблизительно менее чем в 500 Дальтон.
Способы реализации настоящего изобретения
EGFL8
Ген Egfl8 человека кодирует секретируемый белок ~32 кДа, который является эволюционно консервативным. Аминокислотная последовательность человека (Homo sapiens) (SEQ ID NO:1) имеет приблизительно 80% гомологию с последовательностью мыши (Mus musculus; SEQ ID NO:2). Номерами доступа для полипептидов EGFL8 являются следующие: NM_030652 (Homo sapiens), NM_152922 (Mus musculus).
Получение и идентификация антагонистов активности EGFL8
Были разработаны скрининг-анализы антагонистических средств-кандидатов для идентификации соединений, которые связываются с полипептидами EGFL8 или образуют с ними комплекс или иным способом мешают взаимодействию EGFL8 с другими клеточными белками.
Низкомолекулярные молекулы способны действовать в качестве антагонистов EGFL8 и, таким образом, быть терапевтически эффективными. Такие низкомолекулярные молекулы могут включать низкомолекулярные молекулы, образующиеся природным путем, искусственные органические или неорганические соединения и пептиды. Однако в настоящем изобретении низкомолекулярные молекулы не ограничены указанными формами. Обширные библиотеки низкомолекулярных молекул являются коммерчески доступными, и в данной области хорошо известно множество анализов, предназначенных для скрининга указанных молекул на предмет обнаружения требуемой активности.
В некоторых вариантах осуществления низкомолекулярные молекулы-антагонисты EGFL8 идентифицируют по их способности ингибировать одну или более биологических активностей EGFL8. Таким образом, соединение-кандидат приводят в контакт с EGFL8. Затем определяют биологическую активность EGFL8. В одном из вариантов осуществления определяют способность EGFL8 поддерживать адгезию и миграцию эндотелиальных клеток. Соединение идентифицируют в качестве антагониста, если происходит ингибирование биологической активности EGFL8.
Соединения, идентифицируемые в качестве антагонистов EGFL8, могут быть использованы в способах по изобретению. Например, антагонисты EGFL8 могут быть использованы для лечения злокачественных опухолей.
В случае злокачественных опухолей могут быть использованы различные хорошо известные животные модели для более полного понимания роли EGFL8 в развитии и патогенезе опухолей, а также для проверки эффективности терапевтических средств-кандидатов, включая антитела и другие антагонисты нативных полипептидов EGFL8, такие как низкомолекулярные молекулы-антагонисты. Природа in vivo таких моделей делает их особенно предсказательными в отношении ответов у пациента-человека. Животные модели опухолей и злокачественных опухолей (например, рака молочной железы, рака толстой кишки, рака предстательной железы, рака легкого и т.д.) включают как нерекомбинантных, так и рекомбинантных (трансгенных) животных. Нерекомбинантные животные модели включают, например, грызунов, например, модели мыши. Такие модели могут быть разработаны путем введения опухолевых клеток в организм сингенной мыши с использованием стандартных технологий, например, путем подкожной инъекции, инъекции в хвостовую вену, имплантации селезенки, внутрибрюшинной имплантации, имплантации под почечную капсулу или ортотопической имплантации, например, когда клетки злокачественной опухоли толстой кишки имплантируют в ткань толстого кишечника. См., например, публикацию PCT No. WO 97/33551, опубликованную 18 сентября 1997. Вероятно, наиболее часто используемым видом животных в онкологических исследованиях являются иммунодефицитные мыши и, в частности, “голые” мыши. То наблюдение, что “голые” мыши с гипо/аплазией тимуса могут успешно выступать в качестве хозяина для ксенотрансплантатов опухоли человека, привело к их широкомасштабному использованию для этих целей. Аутосомно-рецессивный ген nu вводили в очень большое количество различных конгенных штаммов “голых” мышей, включая, например, ASW, A/He, AKR, BALB/c, B10.LP, C17, C3H, C57BL, C57, CBA, DBA, DDD, I/st, NC, NFR, NFS, NFS/N, NZB, NZC, NZW, P, RIII и SJL. Кроме того, было разработано множество других разнообразных животных, отличных от “голых” мышей, с наследственными иммунологическими дефектами, и эти животные были использованы в качестве реципиентов опухолевых трансплантатов. Для ознакомления с дальнейшими подробностями см., например, The Nude Mouse in Oncology Research, E. Boven and B. Winograd, eds. (CRC Press, Inc., 1991).
Клетки, вводимые в организм таких животных, могут быть клеточными линиями, полученными из известных опухолей/злокачественных опухолей, таких как любая из перечисленных выше линий опухолевых клеток, и, например, клеточная линия B104-1-1 (стабильная линия клеток NIH-3T3, трансфицированных протоонкогеном neu); ras-трансфицированные клетки NIH-3T3; Caco-2 (ATCC® HTB-37); или умеренно дифференцированная линия клеток II аденокарциномы толстого кишечника человека, HT-29 (ATCC® HTB-38); или клеточные линии из опухолей и злокачественных опухолей. Образцы опухолей или злокачественных опухолей могут быть получены из организма пациентов, подвергаемых хирургическому вмешательству, с использованием стандартных условий, включая замораживание и хранение в жидком азоте. Karmali et al., Br. J. Cancer 48: 689-696 (1983).
Опухолевые клетки могут быть введены в организм животных, таких как “голые” мыши или EGFL8-нокаутные мыши, различными способами. Подкожное (п/к) пространство у мышей является весьма подходящим для опухолевой трансплантации. Опухоли могут быть трансплантированы п/к в виде солидных блоков, в виде пункционной биопсии с использованием троакара или в виде клеточных суспензий. В случае солидных блоков или имплантации троакара фрагменты опухолевой ткани подходящего размера вводят в подкожное пространство. Клеточные суспензии, являющиеся свежеприготовленными из первичных опухолей или являющиеся стабильными линиями опухолевых клеток, инъецируют подкожно. Опухолевые клетки могут быть также инъецированы в виде подкожных имплантатов. При такой локализации инокулят откладывается между нижней частью кожной соединительной ткани и подкожной тканью.
Животные модели рака молочной железы могут быть разработаны, например, путем имплантации клеток нейробластомы крысы (из которых первоначально был выделен онкоген neu) или neu-трансфицированных клеток NIH-3T3 в организм “голых” мышей, в основном так, как описано Drebin et al. Proc. Nat. Acad. Sci. USA 83: 9129-9133 (1986).
Аналогично, животные модели рака толстой кишки могут быть разработаны путем перепрививания клеток злокачественной опухоли толстой кишки животным, например, “голым” мышам, что приводит к возникновению опухолей у этих животных. Модель ортотопического трансплантата рака толстой кишки человека у “голых” мышей была описана, например, Wang et al., Cancer Research 54: 4726-4728 (1994) и Too et al., Cancer Research 55: 681-684 (1995). Указанная модель основана на так называемой "METAMOUSE®", продаваемой компанией Anticancer, Inc., (San Diego, California).
Опухоли, которые растут у животных, могут быть извлечены и культивированы in vitro. Затем клетки из указанных культур in vitro можно переносить животным. Такие опухоли могут служить в качестве мишеней для дальнейшего тестирования или скрининга лекарственных средств. Альтернативно, опухоли, образующиеся в результате пассажей (перепрививания), можно изолировать, и затем РНК, полученную из клеток, взятых до пассажей, и из клеток, выделенных после одного или более циклов пассирования, подвергнуть анализу на предмет определения уровней экспрессии представляющих интерес генов. Технологии такого пассирования (перепрививания) могут быть использованы в отношении любых известных опухолей или линий злокачественных клеток.
Например, Meth A, CMS4, CMS5, CMS21 и WEHI-164 представляют собой индуцированные саркомы самок мышей BALB/c (DeLeo et al., J. Exp. Med. 146:720 (1977)), обеспечивающие высококонтролируемую модельную систему для изучения противоопухолевой активности различных агентов. Palladino et al., J. Immunol. 138:4023-4032 (1987). Вкратце, опухолевые клетки размножали in vitro в клеточной культуре. Перед инъецированием в организм животных указанные линии клеток отмывали и суспендировали в буфере, при плотности клеток, приблизительно составляющей от 10×106 до 10×107 клеток/мл. Затем животных подкожно инфицировали 10-100 мкл указанной клеточной суспензии, и в течение одной-трех недель наблюдали за ними в ожидании появления опухоли.
Кроме того, карцинома легких Льюиса у мышей, которая является одной из наиболее полно изученных опухолей, может быть использована в качестве исследовательской опухолевой модели. Эффективность, достигаемая на указанной опухолевой модели, коррелировала с положительными эффектами при лечении пациентов-людей, у которых диагностирован мелкоклеточный рак легких (SCCL). Указанную опухоль можно ввести в организм нормальных мышей путем инъецирования фрагментов опухоли от пораженных мышей или клеток, стабилизированных в культуре. Zupi et al., Br. J. Cancer 41: suppl. 4, 30 (1980). Имеются указания на то, что опухоли могут развиться даже в результате инъецирования одной клетки и что очень большой процент инфицированных опухолевых клеток выживает. Для получения дополнительной информации в связи с указанной опухолевой моделью см. Zacharski, Haemostasis 16:300-320 (1986).
Одним из путей оценки эффективности тестируемого соединения на животной модели с имплантированной опухолью является измерение размера опухоли до и после лечения. Обычно размер имплантированных опухолей измеряют штангенциркулем в двух или трех измерениях (направлениях). Измерение, ограниченное измерениями в двух направлениях, недостаточно точно отражает размер опухоли; поэтому его обычно преобразуют в соответствующий объем, используя математическую формулу. Однако измерение объема опухоли является весьма приблизительным. Терапевтические эффекты лекарственного средства-кандидата могут быть лучше описаны в терминах задержки роста, вызванной лечением, и специфической задержки роста. Другим важным параметром при описании роста опухоли является время удвоения объема опухоли. Компьютерные программы для расчета и описания роста опухолей также доступны, например, программа, опубликованная Rygaard and Spang-Thomsen, Proc. 6th Int. Workshop on Immune-Deficient Animals, Wu and Sheng eds. (Basel, 1989), p. 301. Указано, однако, что реакции некроза и воспаления, сопровождающие лечение, могут на самом деле привести к увеличению размера опухоли, во всяком случае, на начальных этапах. Следовательно, необходимо производить тщательный мониторинг указанных изменений, используя сочетание морфометрического метода и метода анализа проточной цитометрии.
Эффективность идентифицированных в данном описании антител, связывающихся с EGFL8, и других лекарственных средств-кандидатов может быть тестирована также и при лечении спонтанных опухолей у животных. Подходящей мишенью для таких исследований является кошачья оральная плоскоклеточная карцинома (SCC). Кошачья оральная SCC является высокоинвазивной злокачественной опухолью, которая представляет собой наиболее частое оральное злокачественное поражение у кошек, насчитывающее, согласно публикациям, свыше 60% оральных опухолей у данного вида. Оно редко метастазирует в отдаленные области, хотя указанная низкая встречаемость может быть скорее результатом коротких сроков выживаемости кошек с такой опухолью. Такие опухоли обычно не поддаются хирургическому лечению, прежде всего в силу анатомических особенностей ротовой полости у кошек. В настоящее время для этих опухолей не существует эффективного лечения. Перед включением в программу исследования каждую кошку подвергают полному клиническому обследованию и биопсии, и сканированию с использованием метода компьютерной томографии (КТ). Кошек, у которых диагностировали сублингвальные оральные плоскоклеточные опухоли, исключали из программы исследований. В результ