Антитела к рецептору тимусного стромального лимфопоэтина
Иллюстрации
Показать всеПредложенное изобретение относится к области иммунологии. Предложены варианты антитела к рецептору тимусного стромального лимфопоэтина (hTSLP) человека, характеризующиеся наличием вариабельных областей легкой и тяжелой цепи или 3 CDR легкой цепи и 3 CDR тяжелой цепи соответственно. Описаны варианты выделенного или рекомбинантного кодирующего полинуклеотида, выделенная клетка-хозяина для получения антитела, содержащая кодирующие ДНК. Описан способ лечения воспалительного нарушения, опосредованного hTSLP, включающий введение фармацевтической композиции, включающей эффективное количество антитела. Использование изобретения обеспечивает новые антитела против hTSLP человека, что может найти применение в медицине для лечения воспалительных заболеваний, связанных с активностью hTSLP. 6 н. и 21 з.п. ф-лы, 8 ил., 2 табл., 3 пр.
Реферат
Цитокины и иммунные клетки опосредуют специфические физиологические механизмы или пути, например, пути, ведущие к различным воспалительным нарушениям. Человеческий тимусный стромальный лимфопоэтин (TSLP) представляет собой ИЛ-7-подобный цитокин, который образуется человеческими эпителиальными клетками. Он стимулирует дифференцировку В-клеток и, кроме того, может костимулировать как тимоциты, так и зрелые Т-клетки. TSLP связывается со специфическим гетеродимерным рецептором на человеческих дендритных клетках CD11c+(DC's). Рецепторный гетеродимер состоит из общей цепи γ-подобного рецептора (рецептор TSLP; TSLPR) и ИЛ-7R-α-цепи. См., например, статьи Tonozuka et al., Cytogenet. Cell Genet. 93:23-25, 2001; Pandey et al., Nat. Immunol. 1:59-64, 2000; L.S.Park et al., J. Exp. Med. 192:659-670, 2000 и Reche et al., J. Immunol. 167:336-343, 2001. Связывание лиганда с рецептором индуцирует секрецию DC's ТН2-привлекающих цитокинов, TARC (тимусного и регулируемого активацией хемокина) и MDC (хемокина, выделенного из макрофагов). Кроме того, TSLP также индуцирует сильную активацию DC, экспансию непримированных (наивных) Т-клеток CD4+ и последующую поляризацию в отношении фенотипа TH2, продуцирующего проаллергические цитокины интерлейкин 4 (ИЛ-4), ИЛ-5, ИЛ-13 и фактор некроза опухоли α.
Обнаружено, что передача сигнала TSLP приводит в результате к активации фактора транскрипции Stat5. Более того, показано, что пациенты, как с острым, так и с хроническим атопическим дерматитом характеризуются сверхэкспрессией TSLP в кожных поражениях, позволяя предположить, что экспрессия TSLP ассоциирована с аллергическим воспалением in vivo. Помимо кожных кератиноцитов высокий уровень экспрессии TSLP обнаружен в эпителиальных клетках бронхов, гладких мышцах и легочных фибробластов, также поддерживая возможную роль TSLP в респираторных аллергических симптомах. Более того, механизмом, который мог бы участвовать в поддержании фенотипа ТН2, является то, что IgE-активированные мастоциты экспрессируют очень высокий уровень TSLP.
Приблизительно 20% населения западных стран страдает от воспалительных нарушений, например, аллергических заболеваний, которые включают астму, ринит, атопический дерматит и лекарственную аллергию. У 50%-80% пациентов с атопическим дерматитом имеется или развивается астма или аллергический ринит. До настоящего времени отсутствует лечение аллергии, вызываемой астмой, атопическим дерматитом и аллергическим ринитом. Современные препараты, такие как антагонисты β-2 адреноцептора для лечения астмы, элидел для лечения атопического дерматита и H1-антигистамин для лечения аллергического ринита, используют для получения направленности на симптомы. Таким образом, в области техники существует повышенная потребность в усовершенствованных лекарственных препаратах для лечения данных воспалительных нарушений, в частности аллергического воспаления. Настоящее изобретения направлено на данную и другие проблемы.
Раскрытие изобретения
Вариант осуществления изобретения в данном контексте предусматривает выделенное человеческое или гуманизированное антитело или его функциональный фрагмент с антигенсвязывающим участком, который специфичен в отношении белка рецептора тимусного стромального лимфопоэтина человека (hTSLPR)-мишени, и антитело или его функциональный фрагмент связывается с hTSLPR. В близком варианте осуществления связывание с hTSLPR определяют по меньшей мере по связыванию рецептора hTSLP клеточной поверхности, препятствующему высвобождение воспалительного медиатора.
В еще одном варианте осуществления изобретение предусматривает выделенный антигенсвязывающий участок антитела или его функциональный фрагмент. В ряде вариантов осуществления выделенный антигенсвязывающий участок включает участок H-CDR1, имеющий последовательность аминокислот TYGMS (SEQ ID NO: 7), и его консервативные варианты. Как описано в данном контексте, консервативные варианты включают остатки аминокислот в любой из идентифицированных последовательностей аминокислот. В близком варианте осуществления выделенный антигенсвязывающий участок представляет собой участок H-CDR2, имеющий последовательность аминокислот WINTYSGVPRYADDFKG (SEQ ID NO: 8), и его консервативные варианты. В другом близком варианте осуществления выделенный антигенсвязывающий участок представляет собой участок H-CDR3, имеющий последовательность аминокислот EGFITTVVGAAGRFVY (SEQ ID NO: 9), и его консервативные варианты.
В другом варианте осуществления выделенный антигенсвязывающий участок представляет собой участок L-CDR1, имеющий последовательность аминокислот KASQDVGTAVA (SEQ ID NO: 10), и его консервативные варианты. В еще одном близком варианте осуществления выделенный антигенсвязывающий участок представляет собой участок L-CDR2, имеющий последовательность аминокислот WASTRHT (SEQ ID NO: 11), и его консервативные варианты. В еще одном близком варианте осуществления выделенный антигенсвязывающий участок представляет собой участок L-CDR3, имеющий последовательность аминокислот QQYSTYPT (SEQ ID NO: 12), и его консервативные варианты.
В другом варианте осуществления выделенный антигенсвязывающий участок представляет собой тяжелую цепь, имеющую последовательность аминокислот вариабельной области SEQ ID NO: 5, и последовательность, имеющую идентичность последовательности на участках CDR по меньшей мере 60, 70, 80, 90 или 95 процентов относительно участка CDR SEQ ID NO: 5. В близком варианте осуществления выделенный антигенсвязывающий участок представляет собой легкую цепь, имеющую последовательность аминокислот вариабельной области SEQ ID NO: 6 и последовательность, имеющую идентичность последовательности на участках CDR по меньшей мере 60, 70, 80, 90 или 95 процентов относительно участка CDR SEQ ID NO: 6.
В другом аспекте настоящее изобретение представляет моноклональные антагонистические антитела к hTSLPR. Некоторые из антител к TSLPR, представленных в изобретении, обладают такой же специфичностью связывания, как у эталонного антитела, которое включает последовательность вариабельной области тяжелой цепи SEQ ID NO: 5 и последовательность вариабельной области легкой цепи SEQ ID NO: 6. Некоторые из данных антител являются полностью человеческими антителами, которые проявляют такую же специфичность связывания, как у эталонного антитела. Некоторые из антител имеют последовательность участка, определяющего комплементарность, тяжелой цепи (CDR) TYGMS (SEQ ID NO: 7), WINTYSGVPRYADDFKG (SEQ ID NO: 8) или EGFITTVVGAAGRFVY (SEQ ID NO: 9); или последовательность CDR легкой цепи KASQDVGTAVA (SEQ ID NO: 10), WASTRHT (SEQ ID NO: 11) или QQYSTYPT (SEQ ID NO: 12).
Некоторые антитела к hTSLPR имеют последовательности CDR1, CDR2 и CDR3 тяжелой цепи TYGMS (SEQ ID NO: 7), WINTYSGVPRYADDFKG (SEQ ID NO: 8) и EGFITTVVGAAGRFVY (SEQ ID NO: 9), соответственно, и последовательности CDR1, CDR2 и CDR3 легкой цепи KASQDVGTAVA (SEQ ID NO: 10). WASTRHT (SEQ ID NO: 11) и QQYSTYPT (SEQ ID NO: 12), соответственно. Некоторые другие антитела, представленные в изобретении, включают последовательность вариабельной области тяжелой цепи аминокислот, которая по меньшей мере на 85% идентична SEQ ID NO: 5, и последовательность вариабельной области легкой цепи аминокислот, которая по меньшей мере на 85% идентична SEQ ID NO: 6. Некоторые другие антитела к hTSLPR, представленные в изобретении, имеют последовательность вариабельной области тяжелой цепи аминокислот, которая идентична SEQ ID NO: 5, и последовательность вариабельной области легкой цепи аминокислот, которая идентична SEQ ID NO: 6.
Некоторые антитела к hTSLPR, представленные в изобретении, представляют собой мышиные антитела. Ряд других представляют собой химерные антитела. Некоторые из химерных антител имеют константную область тяжелой цепи человека и константную область легкой цепи человека. Некоторые другие антитела к hTSLPR, представленные в изобретении, являются гуманизированными антителами. Некоторые другие антитела к hTSLPR, представленные в изобретении, являются полностью человеческими антителами, которые проявляют такую же специфичность связывания, как антитело, которое включает последовательность вариабельной области тяжелой цепи SEQ ID NO: 5 и последовательность вариабельной области легкой цепи SEQ ID NO: 6. В изобретении также представлены одноцепочечные антитела, например, фрагмент Fab. Некоторые из антител к hTSLPR относятся к изотипу IgG1. Некоторые другие антитела относятся к изотипу IgG4.
В другом аспекте изобретение представляет выделенные или рекомбинантные полинуклеотиды (например, ДНК), которые кодируют полипептид, включающий вариабельную область тяжелой цепи или вариабельную область легкой цепи антитела к hTSLPR, представленного в изобретении. Например, полинуклеотиды могут кодировать тяжелую цепь антитела, которая включает последовательности CDR1, CDR2 и CDR3 тяжелой цепи TYGMS (SEQ ID NO: 7), WINTYSGVPRYADDFKG (SEQ ID NO: 8) и EGFITTVVGAAGRFVY (SEQ ID NO: 9), соответственно. Полинуклеотиды могут также кодировать легкую цепь антитела, которая включает последовательности CDR1, CDR2 и CDR3, KASQDVGTAVA (SEQ ID NO: 10), WASTRHT (SEQ ID NO: 11) и QQYSTYPT (SEQ ID NO: 12), соответственно. Некоторые полинуклеотиды, представленные в изобретении, кодируют зрелую последовательность вариабельной области тяжелой цепи, которая по меньшей мере на 90% идентична зрелой области SEQ ID NO: 5. Некоторые другие полинуклеотиды кодируют зрелую последовательность вариабельной области легкой цепи, которая по меньшей мере на 90% идентична зрелой области SEQ ID NO: 6. Некоторые из данных полинуклеотидов кодируют зрелую последовательность вариабельной области тяжелой цепи, которая идентична зрелой области SEQ ID NO: 5 или зрелой последовательности вариабельной области легкой цепи, которая идентична зрелой области SEQ ID NO: 6.
В другом аспекте изобретение представляет выделенные клетки-хозяева, которые несут (1) сегмент рекомбинантной ДНК, кодирующий тяжелую цепь антитела к hTSLPR, соответствующего изобретению, и (2) второй сегмент рекомбинантной ДНК, кодирующий легкую цепь антитела. В некоторых клетках-хозяевах сегменты рекомбинантной ДНК соответственно функционально связаны с первым и вторым промотором и способны экспрессироваться в клетках-хозяевах. Некоторые из данных клеток-хозяев экспрессируют моноклональное антитело, которое имеет последовательности CDR1, CDR2 и CDR3 тяжелой цепи TYGMS (SEQ ID NO: 7), WINTYSGVPRYADDFKG (SEQ ID NO: 8) и EGFITTVVGAAGRFVY (SEQ ID NO: 9), соответственно, и последовательности CDR1, CDR2 и CDR3 легкой цепи KASQDVGTAVA (SEQ ID NO: 10), WASTRHT (SEQ ID NO: 11) и QQYSTYPT (SEQ ID NO: 12), соответственно. Некоторые другие клетки-хозяева экспрессируют антитело к hTSLPR, которое включает зрелую последовательность вариабельной области тяжелой цепи, которая по меньшей мере на 90% идентична зрелому участку SEQ ID NO: 5, и зрелую последовательность вариабельной области легкой цепи, которая по меньшей мере на 90% идентична зрелому участку SEQ ID NO: 6. Некоторые из данных клеток-хозяев экспрессируют антитело к hTSLPR, которое включает зрелую последовательность вариабельной области тяжелой цепи, которая идентична зрелому участку SEQ ID NO: 5, и зрелую последовательность вариабельной области легкой цепи, которая идентична зрелому участку SEQ ID NO: 6. Некоторые из клеток-хозяев представляют собой клетки млекопитающего, отличные от человеческих.
В другом аспекте изобретение представляет способы лечения воспалительного нарушения у субъекта, например, больного человека. Данные способы предусматривают введение пациенту фармацевтической композиции, которая включает эффективное количество антитела к hTSLPR. Как правило, антитело к hTSLPR имеет такую же специфичность связывания, как у антитела к hTSLPR, которое включает последовательность вариабельной области тяжелой цепи SEQ ID NO: 5 и последовательность вариабельной области легкой цепи SEQ ID NO: 6. В ряде способов лечения используют полностью человеческое антитело. В ряде способов, антитело к hTSLPR несет последовательности тяжелой цепи CDR1, CDR2 и CDR3 TYGMS (SEQ ID NO: 7), WINTYSGVPRYADDFKG (SEQ ID NO: 8) и EGFITTVVGAAGRFVY (SEQ ID NO: 9), соответственно, и последовательности легкой цепи CDR1, CDR2 и CDR3 KASQDVGTAVA (SEQ ID NO: 10), WASTRHT (SEQ ID NO: 11) и QQYSTYPT (SEQ ID NO: 12), соответственно. В ряде способов используемое антитело к hTSLPR включает зрелую последовательность вариабельной области тяжелой цепи, которая идентична зрелому участку SEQ ID NO: 5, и зрелую последовательность вариабельной области легкой цепи, которая идентична зрелому участку SEQ ID NO: 6. Некоторые способы направлены на лечение пациентов, которые страдают от аллергического воспалительного заболевания. Примеры аллергических воспалительных заболеваний, которые поддаются лечению, включают атопический дерматит, астму или аллергический ринит.
В еще одном варианте осуществления изобретение представляет иммуноконъюгат, состоящий из первого компонента, который представляет собой антитело или его фрагмент, и второй компонент, имеющий вторую последовательность аминокислот. Например, иммуноконъюгат представляет собой цитотоксин, или иммуноконъюгат представляет собой связывающий белок или антитело, имеющие специфичность связывания с мишенью, которая отлична от hTSLPR.
В другом варианте осуществления изобретение представляет набор, включающий антитело или фрагмент антитела. В некоторых вариантах осуществления набор далее включает фармацевтически приемлемый носитель или, соответственно, наполнитель. В других близких вариантах осуществления антитело в наборе находится в унифицированной дозе. В еще одном близком варианте осуществления набор включает инструкции по применению при введении пациенту.
Дальнейшее понимание природы и преимуществ настоящего изобретения можно получить посредством ссылки на остальные разделы описания и формулу изобретения.
Краткое описание чертежей
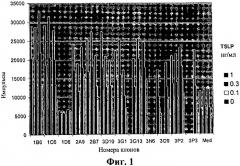
На фиг.1 представлен скрининг антагонистических антител к TSLPR с использованием анализа hTSLP-зависимой пролиферации клеток в клетках BaF3/hTSLPR/hIL7Rα.
На фиг.2А-2С представлена очистка мышиных и химерных моноклональных антител к hTSLPR. А: химерное антитело IgGI; В: химерное антитело IgG4 и С: мышиное антитело IgGI.
На фиг.3А-3С показана антагонистическая активность очищенного мышиного антитела к hTSLPR (клон 1D6.C9) с помощью анализа пролиферации клеток и анализа сигнала люциферазы. А: пролиферация клеток Ba/F3-hTSLPR-hIL7Rα; В: пролиферация клеток BaF3/hTSLPR/hIL7Rα/Stat5-Luc и С: активность люциферазы клеток BaF3/hTSLPR/hIL7Rα/Stat5-Luc.
На фиг.4 представлены нуклеотидные последовательности вариабельных областей клона мышиного моноклонального антитела к hTSLPR 1D6.C9.
На фиг.5 представлены последовательности аминокислот вариабельной области клона мышиного антитело к hTSLPR 1D6.C9. Участки, определяющие комплементарность (CDRs), и скелетные области (FRs) показаны подчеркнутыми остатками или остатками, выделенными курсивом.
На фиг.6 показаны результаты анализов сигнала люциферазы, сравнивающие антагонистическую активность очищенного мышиного и химерного антител к hTSLPR в клетках Ba/F3, проявляющих сверхэкспрессию hTSLPR, hIL7Rα и Stat5-Luc.
На фиг.7 показано ингибирование TSLP-опосредованной секреции TARC из человеческих моноцитов посредством мышиного и химерного антител к hTSLPR.
На фиг.8 показана идентификация антитело-связывающего домена - антитело TSLPR связывается с прерывистым эпитопом.
Детальное описание изобретение
Настоящее изобретение основано отчасти на разработке авторами антагонистических антител к человеческому TSLPR. Антитела к hTSLPR, генерированные в мыши, или химерные антитела к hTSLPR, созданные in vitro, как обнаружено, способны ингибировать активности, опосредованные передачей сигнала TSLP, например, TSLP-опосредованная пролиферация клеток. Таким образом данные антитела используют в качестве терапевтических или профилактических агентов против ряда заболеваний или нарушений, опосредованных или ассоциированных с активностями передачи сигнала TSLP, например, аллергических воспалительных заболеваний, таких атопический дерматит и астма. Следующие разделы представляют руководство по получению и использованию композиций, представленных в изобретении, и осуществлению способов, представленных в изобретении.
I. Определения
Пока не определено иначе, все технические и научные термины, используемые в данном контексте, имеют такое же значение, какое, как правило, имеет в виду обычный специалист в области техники, к которой относится данное изобретение. Следующие ссылки представляют специалисту общее определение многих терминов, используемых в данном изобретении: Oxford Dictionary of Biochemistry and Molecular Biology под ред. Smith et al., Oxford University Press (исправленное издание, 2000); Dictionary of Microbiology and Molecular Biology под ред. Singleton, John Wiley & Sons (3 испр. изд., 2002) и А Dictionary of Biology (Oxford Paperback Reference) под ред. Martin and Hine, Oxford University Press (4 испр. изд., 2000). Кроме того, следующие определения представлены, чтобы помочь читателю в практической реализации изобретения.
Для того чтобы настоящее изобретение было легче понять, для ряда терминов сначала даны определения. Дополнительные определения приводят на протяжении детального описания.
Термин "иммунный ответ" относится к действию, например, лимфоцитов, антигенпрезентирующих клеток, фагоцитарных клеток, гранулоцитов и растворимых макромолекул, продуцируемых вышеуказанными клетками или печенью (включая антитела, цитокины и комплемент), которое приводит в результате к избирательному повреждению, разрушению или удалению из организма человека поражающих патогенов, клеток или тканей, инфицированных патогенами, раковых клетки или, в случаях аутоиммунитета или патологического воспаления, нормальных человеческих клеток или тканей.
Термин "путь сигнальной трансдукции" относится к биохимическим взаимоотношениям между рядом молекул сигнальной трансдукции, которые играют роль в передаче сигнала от одной части клетки к другой части клетки.
Термин "антитело" относительно данного контекста включает целые антитела и любые его антигенсвязывающий фрагмент (т.е. "антигенсвязывающую часть") или одиночные цепи. Природное "антитело" представляет собой гликопротеин, включающий по меньшей мере две тяжелых (Н) цепи и две легких (L) цепи, связанные между собой дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (в данном контексте сокращенно VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (в данном контексте сокращенно VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL можно далее подразделить на гипервариабельные участки, называемые участками, определяющими комплементарность (CDR), расположенные между участками, которые являются более консервативными, называемыми скелетными участками (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей включают связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента.
Термин "антигенсвязывающая часть" антитела (или просто "антигенная часть"), как используют в данном контексте, относится к антителу полной длины или одному или более фрагментов антитела, которые сохраняют способность специфически связываться с антигеном (например, TSLPR). Показано, что антигенсвязывающая функция антитела может быть осуществлена фрагментами антитела полной длины. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающая часть" антитела, включают фрагмент Fab, одновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1; фрагмент F(ab)2, двухвалентный фрагмент, включающий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области; фрагмент, состоящий из доменов VH и СН1; фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела; фрагмент dAb (см. статью Ward et al., 1989 Nature 341:544-546), который состоит из домена VH, и выделенный участок, определяющий комплементарность (CDR).
Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются отдельными генами, они могут быть связаны при использовании рекомбинантных методов синтетическим линкером, который дает возможность получить их в виде одной белковой цепи, в которой участки VL и VH спарены с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, статьи Bird et al., 1988 Science 242:423-426 и Huston et al., 1988 Proc. Natl. Acad. Sci. 85:5879-5883). Предусматривают также, что данные одноцепочечные антитела охватываются термином "антигенсвязывающая часть" антитела. Данные фрагменты антитела получают, используя принятые методы, известные компетентным специалистам в области техники, и проводят скрининг фрагментов на применение таким же образом, как интактных антител.
Термин "выделенное антитело", как используют в данном контексте, относится к антителу, которое в существенной степени очищено от других антител, имеющих другие антигенные специфичности (например, выделенное антитело, которое специфически связывает TSLPR, в существенной степени очищено от антител, которые специфически связывают антигены, отличные от TSLPR). Однако выделенное антитело, которое специфически связывает TSLPR, может обладать перекрестной реактивностью с другими антигенами, такими как молекулы TSLPR других видов. Более того, выделенное антитело может быть в существенной степени очищено от другого клеточного материала и/или химических веществ.
Термины "моноклональное антитело" или "композиция моноклональных антител", как используют в данном контексте, относятся к препарату молекул антитела одной молекулярной композиции. Композиция моноклонального антитела проявляет одну специфичность связывания и аффинность в отношении определенного эпитопа.
Термин "человеческое антитело", как используют в данном контексте, предусматривает включение антител, имеющих вариабельные области, в которых как скелетные участки, так и участки CDR выделены из последовательностей человеческий природы. Более того, если антитело включает константную область, то константная область также выделена из данных человеческих последовательностей, например, последовательностей зародышевой линии человека. Человеческие антитело, представленные в изобретении, могут включать остатки аминокислот, не кодируемые человеческими последовательностями (например, мутации, введенные путем неспецифического или сайт-специфического мутагенеза in vitro или путем соматической мутации in vivo).
Термин "человеческое моноклональное антитело" относится к антителам, проявляющим одну специфичность связывания, которые имеют вариабельные области, в которых как скелетные участки, так и участки CDR выделены из человеческих последовательностей. В одном варианте осуществления человеческие моноклональные антитела получают с помощью гибридомы, которая включает В-клетку, полученную от трансгенного животного, отличного от человека, например, трансгенной мыши, имеющей геном, включающий трансген человеческой тяжелой цепи и трансген легкой цепи, слитый с иммортализованной клеткой.
Термин "рекомбинантное человеческое антитело", как используют в данном контексте, включает все человеческие антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными методами, такие как антитела, выделенные у животного (например, мыши), которое является трансгенным или трансхромосомным в отношении генов иммуноглобулина человека, или полученной из него гибридомы, антитела, выделенные из клетки-хозяина, трансформированной с целью получения экспрессии человеческого антитела, например, из трансфектомы, антитела, выделенные из библиотеки рекомбинантных комбинаторных человеческих антител, и антитела, полученные экспрессированные, созданные или выделенные любыми другими средствами, которые включают сплайсинг всей или части последовательностей гена иммуноглобулина человека с другими последовательностями ДНК. Данные рекомбинантные человеческие антитела имеют вариабельные области, в которых скелетные участки и участки CDR выделены из последовательностей иммуноглобулина зародышевой линии человека. Однако в ряде вариантов осуществления данные рекомбинантные человеческие антитела могут быть подвергнуты мутагенезу in vitro (или, когда используют животное, трансгенное по последовательностям Ig человека, соматическому мутагенезу in vivo) и, таким образом, последовательности аминокислот областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и выделены из и относятся к последовательностям VH и VL зародышевой линии человека, могут не существовать в естественных условиях в репертуаре зародышевой линии антител человека in vivo.
"Химерное антитело" представляет собой молекулу антитела, в которой (а) константная область или ее часть изменена, замещена или заменена так, что антигенсвязывающий центр (вариабельная область) связан с константной областью другого или измененного класса, эффекторной функции и/или вида, либо полностью другой молекулой, которая придает химерному антителу новые свойства, например, фермента, токсина, гормона, фактора роста, лекарства и т.п.; или (b) вариабельная область или ее часть изменена, замещена или заменена вариабельной областью, имеющей другую или измененную антигенную специфичность. Например, как показано в примерах ниже, мышиное антитело к hTSLPR можно модифицировать замещением его константной области константной областью из человеческого иммуноглобулина. Вследствие замещения человеческой константной областью химерное антитело может сохранять свою специфичность в плане распознавания человеческого TSLPR, имея при этом пониженную антигенность у человека по сравнению с исходным мышиным антителом.
"Гуманизированное" антитело представляет собой антитело, которое сохраняет реакционность нечеловеческого антитела, являясь при этом менее иммуногенным для человека. Это может достигаться, например, путем сохранения нечеловеческих участков CDR и замещения остальных частей антитела их человеческими аналогами (т.е. константной области, а также скелетных частей вариабельной области). См., например, статьи Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855, 1984; Morrison and Oi, Adv. ImmunoL, 44:65-92, 1988; Verhoeyen et al., Science, 239:1534-1536, 1988; Padlan, Molec. Immun., 28:489-498, 1991; и Padlan, Molec. Immun., 31:169-217, 1994. Другие примеры технологии человеческой инженерии включают, но без ограничения перечисленным, метод Хота, раскрытый в US 5766886.
Термин "гуманиринг", как используют в данном контексте, относится к способу превращения нечеловеческих антител в инженерные человеческие антитела (См., например, метод KaloBios' Humaneering™).
Как используют в данном контексте, термин "изотип" относится к классу антител (например, IgM, IgE, IgG, такому как IgGI или IgG4), который дают гены константной области тяжелой цепи.
Фразы "антитело, распознающее антиген", и "антитело, специфическое в отношении антигена", используют в данном контексте взаимозаменяемо с термином "антитело, которое связывается специфически с антигеном".
Как используют в данном контексте, антитело, которое "специфически связывается с человеческим TSLPR", относится к антителу, которое связывается с человеческим TSLPR с KD 200×10-12 М или меньше, 150×10-12 М или меньше либо 100×10-12 М или меньше.
Термин "специфичность связывания", как используют в данном контексте, относится к способности паратопа отдельного антитела реагировать только с одной антигенной детерминантой. Паратоп антитела находится в части Fab молекулы и сконструирован из гипервариабельных областей тяжелой и легкой цепей. Аффинность связывания антитела представляет собой силу реакции между одной антигенной детерминантой и одним паратопом на антителе. Она представляет собой сумму сил притяжения и отталкивания, действующих между антигенной детерминантной и паратопом антитела. Аффинность является константой равновесия, которая описывает реакцию антиген-антитело.
Специфическое связывание между двумя элементами означает связывание с константой равновесия (KA) по меньшей мере 1×107 М-1, 108 М-1, 109 М-1 или 1010 М-1. Выражение "специфически (или избирательно) связывается" с антителом (например, антителом к hTSLPR) относится к реакции связывания, которая является определяющей в отношении присутствия родственного антигена (например, человеческий полипептид TSLPR) в гетерогенной популяции белков и других биологических компонентов. В дополнение к вышеупомянутой константе равновесия (KA) антитело к hTSLPR, представленное в изобретении, как правило, имеет константу диссоциации (Kd) приблизительно 1×10-2 сек.-1, 1×10-3 сек.-1, 1×10-4 сек.-1 или ниже и связывается с человеческим TSLPR с аффинностью, которая по меньшей мере в два раза превышает его аффинность связывания с неспецифическим антигеном (например, BSA). Выражения "антитело, распознающее антиген", и "антитело, специфическое в отношении антигена", используют в данном контексте взаимозаменяемо с термином "антитело, которое специфически связывается с антигеном".
Термин "эпитоп" означает белковую детерминанту, способную к специфическому связыванию с антителом. Эпитопы обычно состоят из химически активных поверхностных групп молекул, таких как аминокислотные или сахарные боковые цепи, и, как правило, имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первыми, но не с последними утрачивается в присутствии денатурирующих растворителей.
Термин "нуклеиновая кислота" используют в данном контексте взаимозаменяемо с термином "полинуклеотид" и относится к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам либо в одно-, либо в двухцепочечной форме. Термин охватывает нуклеиновые кислоты, содержащие известные аналоги нуклеотидов или модифицированные скелетные остатки или связи, которые являются синтетическими, природными и неприродными, которые имеют свойства связывания, близкие свойствам эталонной нуклеиновой кислоты, и которые метаболизируются аналогично эталонным нуклеотидам. Примеры данных аналогов включают, но без ограничения перечисленным, фосфоротиоаты, фосфорамидаты, метилфосфонаты, хиральные метилфосфонаты, 2-O-метилрибонуклеотиды, пептид-нуклеиновые кислоты (ПНК).
Пока не указано иначе, термин определенная последовательность нуклеиновой кислоты также подразумеваемым образом охватывает ее консервативно модифицированные варианты (например, замещения вырожденных кодонов) и комплементарные последовательности, а также ясно указываемую последовательность. В частности, как детально описано ниже, замещения вырожденных кодонов могут достигаться посредством генерации последовательностей, в которых третье положение одного или более выбранных (или всех) кодонов замещают смешанным основанием и/или дезоксиинозиновыми остатками (см. статьи Batzer et al,. Nucleic Acid Res. 19:5081, 1991; Ohtsuka et al., J. Biol. Chem. 260:2605-2608, 1985 и Rossolini et al., Mol. Cell. Probes 8:91-98, 1994).
Термин "аминокислота" относится к природным и синтетическим аминокислотам, а также аналогам аминокислот и миметикам аминокислот, которые действуют подобно природным аминокислотам. Природными аминокислотами являются аминокислоты, кодируемые генетическим кодом, а также те аминокислоты, которые модифицируют позднее, например, гидроксипролин, γ-карбоксиглутамат и O-фосфосерин. Аналоги аминокислот относятся к соединениям, которые имеют такую основную химическую структуру, как природная аминокислота, т.е., α-атом углерода, который связан с водородом, карбоксильной группой, аминогруппой и R-группой, например, гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний. Данные аналоги имеют модифицированные R-группы (например, норлейцин) или модифицированные пептидные скелеты, но сохраняют такую же основную химическую структуру, как природная аминокислота. Миметики аминокислот относятся к химическим соединениям, которые имеют структуру, отличную от общей химической структуры аминокислоты, но действуют подобно природной аминокислоте.
Термины "полипептид" и "белок" используют в данном контексте взаимозаменяемо в отношении к полимеру из остатков аминокислот. Термины применяют для полимеров аминокислот, в которых один или более остатков аминокислот является искусственным химическим миметиком соответствующей природной аминокислоты, а также для полимеров природных аминокислот и полимера неприродных аминокислот. Пока не указано иначе, термин определенная полипептидная последовательность также подразумеваемым образом охватывает ее консервативно модифицированные варианты.
Термин "консервативно модифицированный вариант" относится к последовательностям, как аминокислот, так и нуклеиновых кислот. Касательно определенных последовательностей нуклеиновых кислот, консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или в основном идентичные последовательности аминокислот, или те, в которых нуклеиновая кислота не кодирует последовательность аминокислот в основном идентичных последовательностей. Вследствие вырожденности генетического кода большое число функционально идентичных нуклеиновых кислот кодирует любой заданный белок. Например, все кодоны GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом в каждом положении, где кодоном определен аланин, кодон может быть изменен на любой из описанных соответствующих кодонов без изменения кодируемого полипептида. Данные варианты нуклеиновой кислоты представляют собой "молчащие варианты", которые представляют собой один из видов консервативно модифицированных вариантов. В данном контексте каждая последовательность нуклеиновой кислоты, которая кодирует полипептид, описывает также каждый возможный вариант нуклеиновой кислоты. Компетентный специалист будет иметь в виду, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является единственным кодоном для метионина, и TGG, который обычно является единственным кодоном для триптофана), может быть модифицирован с получением функционально идентичной молекулы. Соответственно, каждый молчащий вариант нуклеиновой кислоты, который кодирует полипептид, подразумевается в каждой из описанных последовательностей.
Для полипептидных последовательностей "консервативно модифицированные варианты" включают индивидуальные замены, делеции или вставки в полипептидную последовательность, которые приводят к замене аминокислоты химически близкой аминокислотой. Таблицы консервативных замен, представляющие функционально близкие аминокислоты, хорошо известны в области техники. Данные консервативно модифицированные варианты дополняют и не исключают полиморфные варианты, межвидовые гомологи и аллели, представленные в изобретении. Следующие восемь групп включают аминокислоты, которые представляют собой консервативные замены друг для друга:
1) Аланин (А), Глицин (G);
2) Аспарагиновая кислота (D), Глутаминовая кислота (Е);
3) Аспарагин (N), Глутамин (Q);
4) Аргинин (R), Лизин (K);
5) Изолейцин (I), Лейцин (L), Метионин (М), Валин (V);
6) Фенилаланин (F), Тирозин (Y), Триптофан (W);
7) Серин (S), Треонин (Т) и
8) Цистеин (С), Метионин (М) (см., например, монографию Creighton, Proteins (1984)).
Термины "идентичный" или процент "идентичности" в контексте двух или более последовательностей нуклеиновых кислот или полипептидов относятся к двум или более последовательностей или субпоследовательностей, которые являются одинаковыми. Две последовательности являются "в существенной мере идентичными", если две последовательности имеют определенный процент остатков аминокислот или нуклеотидов, которые являются одинаковыми (т.е., идентичность 60%, необязательно идентичность 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% относительно заданного участка или, если не определено, относительно целой последовательности) при сравнении и выравнивании для максимального соответствия относительно окна сравнения либо сконструированного участка, как измеряют при использовании одного из следующих алгоритмов сравнения последовательностей или посредством выравнивания вручную и визуального изучения. Необязательно идентичность существует относительно участка, который составляет по меньшей мере приблизительно 50 нуклеотидов (или 10 аминокислот) в длину или, более предпочтительно, отн