Способ получения клетки, способной продуцировать гетеропротеины с высоким выходом
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к способу получения клетки СНО, способной продуцировать желаемый полипептид с высоким выходом, клетке, полученной данным способом, способу получения желаемого полипептида, способу количественного увеличения продукции полипептида клеткой СНО с сильной экспрессией переносчика таурина. Способ включает культивирование клетки СНО, в которую был искусственно перенесен ген переносчика таурина (TauT), была введена ДНК, кодирующая желаемый полипептид, и ДНК, кодирующая дигидрофолатредуктазу (DHFR), в присутствии концентрации метотрексата, при которой 90% или более клеток, в которые не был введен TauT, погибают в течение 3 недель после субкультивирования. Отбирают из числа выживших клеток СНО, клетку СНО, способную продуцировать желаемый полипептид с высоким выходом. Клетка, полученная данным способом, продуцирует желаемый полипептид с более высоким выходом, чем клетка СНО, трансфицированная ДНК, кодирующей желаемый полипептид, и ДНК, кодирующей DHFR, но не геном переносчика таурина. Способ получения желаемого полипептида включает культивирование вышеуказанной клетки и выделение желаемого пептида. Предложенное изобретение позволяет продуцировать желаемый полипептид с высоким выходом. 4 н. и 5 з.п. ф-лы, 10 ил., 6 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу получения клетки, способной продуцировать гетеропротеины с высоким выходом.
УРОВЕНЬ ТЕХНИКИ
Если белки, пригодные в качестве фармацевтических средств, получают с помощью технологии рекомбинантных ДНК, то применение клеток животных позволяет осуществить их сложную посттрансляционную модификацию и сворачивание, к чему прокариотические клетки не способны. Поэтому в качестве клеток-хозяев для продуцирования рекомбинантных белков часто используют клетки животных.
Недавно было разработано множество биопрепаратов, таких как антитела и физиологически активные белки. Методики, которые позволяют осуществить эффективную продукцию рекомбинантных белков клетками животных, способствуют снижению стоимости биопрепаратов и сулят их стабильную поставку пациентам.
В этих обстоятельствах желателен способ продуцирования белков, обладающий повышенной эффективностью продуцирования.
Было известно, что под воздействием метотрексата (MTX) в клетках амплифицируется (амплификация гена) некоторое число копий гена дигидрофолатредуктазы (DHFR), в результате чего клетки становятся устойчивыми к MTX. В промышленном производстве широко применяется способ количественного повышения продуцирования полезного белка, при котором плазмиды с геном белка, расположенным непосредственно ниже гена DHFR, вводят в клетки животных, а затем эти клетки культивируют в питательной среде с добавкой MTX для того, чтобы индуцировать амплификацию гена (патентный документ 1).
[Патентный документ 1]
Японская патентная публикация №6-30588
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ ИЗОБРЕТЕНИЕМ
Целью настоящего изобретения является создание клетки, способной продуцировать белки с высоким выходом, и обеспечение способа получения такой клетки.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ПРОБЛЕМЫ
Авторы настоящего изобретения направили все свои усилия на решение вышеуказанной проблемы. В результате они обнаружили, что клетки-хозяева приобретали устойчивость к MTX при сильной экспрессии в этих клетках переносчика таурина (TauT), а также что клетки, которые стали продуцировать антитело после введения в них гена антитела, приобретали устойчивость к MTX при сильной экспрессии в этих клетках TauT и, кроме того, что способность к продукции антитела клетками, продуцирующими антитело, в которых одновременно экспрессировались TauT и декарбоксилаза цистеинсульфиновой кислоты (CSAD), улучшалась при обработке клеток высокой концентрацией MTX. Эти открытия привели к завершению настоящего изобретения.
Настоящее изобретение в целом можно описать следующим образом.
(1) Способ получения клетки, способной продуцировать желаемый полипептид с высоким выходом, в котором клетку с сильной экспрессией переносчика таурина, куда была введена ДНК, кодирующая желаемый полипептид, культивируют в присутствии высокой концентрации метотрексата, а из числа выживших клеток отбирают клетку, способную продуцировать желаемый полипептид с высоким выходом.
(2) Способ согласно (1) выше, в котором в клетку с сильной экспрессией переносчика таурина, куда была введена ДНК, кодирующая желаемый полипептид, также вводят ДНК, кодирующую дигидрофолатредуктазу (DHFR).
(3) Способ согласно (2) выше, в котором клетка с сильной экспрессией переносчика таурина, куда была введена ДНК, кодирующая желаемый полипептид, представляет собой клетку, котрансформированную одной молекулой, содержащей ДНК, кодирующую желаемый полипептид, и ДНК, кодирующую дигидрофолатредуктазу (DHFR).
(4) Способ согласно (3) выше, в котором молекула, содержащая ДНК, кодирующую желаемый полипептид, и ДНК, кодирующую дигидрофолатредуктазу (DHFR), представляет собой вектор.
(5) Способ согласно любому (1)-(4) выше, в котором клетка с сильной экспрессией переносчика таурина также сильно экспрессирует декарбоксилазу цистеинсульфиновой кислоты.
(6) Клетка, полученная способом согласно любому из (1)-(5) выше.
(7) Способ получения желаемого полипептида, в котором культивируют клетку согласно (6) выше.
(8) Способ согласно (7) выше, в котором желаемый полипептид представляет собой антитело.
(9) Способ получения фармацевтического продукта, содержащего полипептид, полученный способом согласно (7) или (8).
(10) Способ количественного увеличения продукции полипептида клеткой с сильной экспрессией переносчика таурина, в которую была введена ДНК, кодирующая желаемый полипептид, причем указанный способ включает обработку клетки высокой концентрацией метотрексата.
(11) Способ согласно (10) выше, в котором в клетку с сильной экспрессией переносчика таурина, куда была введена ДНК, кодирующая желаемый полипептид, также вводят ДНК, кодирующую дигидрофолатредуктазу.
(12) Способ согласно (11) выше, в котором клетка с сильной экспрессией переносчика таурина, куда была введена ДНК, кодирующая желаемый полипептид, представляет собой клетку, котрансформированную одной молекулой, содержащей ДНК, кодирующую желаемый полипептид, и ДНК, кодирующую дигидрофолатредуктазу.
(13) Способ согласно любому из (10)-(12) выше, в котором клетка с сильной экспрессией переносчика таурина, также сильно экспрессирует декарбоксилазу цистеинсульфиновой кислоты.
(14) Способ получения клетки, способной продуцировать желаемый полипептид с высоким выходом, в котором клетку с сильной экспрессией переносчика таурина, куда была введена ДНК, кодирующая желаемый полипептид, культивируют в присутствии высокой концентрации метотрексата, а из числа выживших клеток отбирают клетку, способную продуцировать желаемый полипептид с высоким выходом.
(15) Способ количественного увеличения продукции полипептида клеткой с сильной экспрессией переносчика таурина, в которую была введена ДНК, кодирующая желаемый полипептид, причем указанный способ включает обработку клетки метотрексатом.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
Настоящее изобретение сделало возможной продукцию желаемого полипептида, включая антитело, с высоким выходом.
Настоящее описание изобретения охватывает содержание, раскрытое в описании изобретения и/или чертежах японской патентной заявки №2007-267384, приоритет которой испрашивается по настоящей патентной заявке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлены клетки-хозяева, в которых сильно экспрессируется TauT, что характеризует устойчивость к MTX.
На фиг.2 показано, что штамм TauT, относящийся к клеткам, продуцирующим антитело к глипикану-3, в которых сильно экспрессируется TauT, и штамм TauT/CSAD, относящийся к вышеуказанным клеткам, продуцирующим антитело, в которых также сильно экспрессируется CSAD, обладают большей устойчивостью к MTX по сравнению с родительским штаммом.
На фиг.3 представлено изменение количества клеток по времени при непрерывном субкультивировании клеток в присутствии высокой концентрации MTX. На 28-ые сутки после инициации культуры условия были восстановлены до начального состояния 20 нМ MTX с целью повторного начала пролиферации.
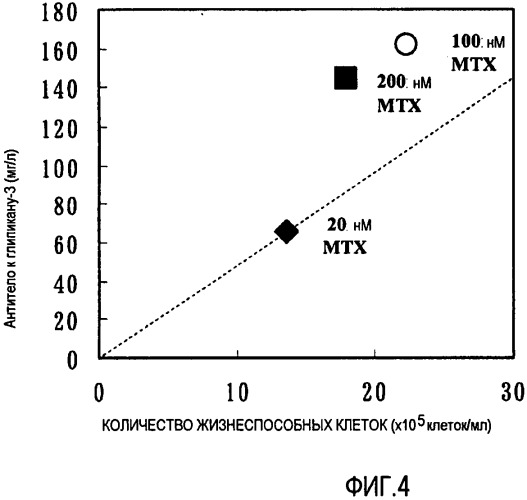
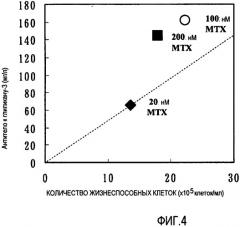
На фиг.4 представлена усиленная способность клеток к продукции антител после их обработки высокой концентрацией MTX. Наибольшую величину продукции в расчете на клетку демонстрировали клетки, обработанные 200 нМ MTX.
На фиг.5 представлена плазмида, в которой был экспрессирован TauT хомяка (622 аминокислоты), для селекции с гигромицином.
На фиг.6 представлена плазмида, в которой был экспрессирован CSAD хомяка (493 аминокислоты), для селекции с пуромицином.
На фиг.7 представлена нуклеотидная последовательность вновь клонированного происходящего из клеток CHO гена переносчика таурина хомяка, и установленная на ее основе аминокислотная последовательность.
На фиг.8 представлена топология на мембране переносчика таурина, которая была воссоздана на основе трансмембранных участков и ориентаций, предсказанных программой TMpred по аминокислотной последовательности вновь клонированного происходящего из клеток CHO TauT хомяка, со ссылкой на ФИГ. 5 из публикации Shinichi Uchida et al., Proc. Natl. Acad. Sci. USA Vol.89, pp.8230-8234, September 1992. Знак указывает на специфические аминокислотные остатки TauT хомяка. Большое число аминокислотных остатков, отличающихся от аминокислотных остатков в TauT человека, находится во 2-й петле (EX: внеклеточная область мембраны), 12-ом трансмембранном участке (TM) и на C-конце (IC: внутриклеточная область).
На фиг.9 представлена нуклеотидная последовательность вновь клонированного происходящего из клеток CHO гена CSAD хомяка и установленная на ее основе аминокислотная последовательность.
На фиг.10 представлена структура phGC33CAG1, которая представляет собой экспрессирующую плазмиду для гуманизированного антитела к глипикану-3 человека.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже в настоящем документе более подробно описаны различные варианты осуществления настоящего изобретения.
Настоящее изобретение относится к способу получения клетки, способной продуцировать желаемый полипептид с высоким выходом, в котором клетку с сильной экспрессией переносчика таурина, куда была введена ДНК, кодирующая желаемый полипептид, культивируют в присутствии высокой концентрации MTX, а из числа выживших клеток отбирают клетку, способную продуцировать желаемый полипептид с высоким выходом.
В соответствии со способом по настоящему изобретению клетку с сильной экспрессией TauT, в которую была введена ДНК, кодирующая желаемый полипептид, культивируют в присутствии высокой концентрации MTX.
ДНК, кодирующую желаемый полипептид, вводят в клетку, сильно экспрессирующую TauT.
В способе по настоящему изобретению желаемый полипептид конкретно не ограничен. Полипептид может представлять собой любой полипептид, такой как антитело (например, антитело к рецептору IL-6, антитело к IL-6, антитело к глипикану-3, антитело к CD3, антитело к CD20, антитело к GPIIb/IIIa, антитело к TNF, антитело к CD25, антитело к EGFR, антитело к Her2/neu, антитело к RSV, антитело к CD33, антитело к CD52, антитело к IgE, антитело к CD11a, антитело к VEGF, антитело к VLA4 и т.д.) или физиологически активный белок (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, интерферон, интерлейкины, такие как IL-1 или IL-6, t-PA, урокиназу, сывороточный альбумин, фактор свертывающей системы крови, парагормон [PTH] и т.д.). Особенно предпочтительным является антитело, и этим антителом может быть любое антитело, например природное антитело, антитело с низкой молекулярной массой (например, Fab, scFv, sc(Fv)2), химерное антитело, гуманизированное антитело и т.д.
Известно, что переносчик таурина представляет собой мембранный белок, обладающий функцией захвата аминокислот (таких как таурин и β-аланин) в клетки.
Клетка, которая сильно экспрессирует переносчик таурина, конкретно не ограничена, при условии, что эта клетка обладает повышенным уровнем экспрессии переносчика таурина по сравнению с соответствующей природной клеткой. Природная клетка также конкретно не ограничена. Можно использовать клетку, которую используют в качестве хозяина при продукции рекомбинантного белка (например, клетки CHO).
Наряду с тем, что клетка, сильно экспрессирующая TauT, может представлять собой любую клетку, которая может являться эукариотической клеткой, включая клетки животных, клетки растений и клетки дрожжей, или прокариотической клеткой, включая Escherichia coli и Bacillus subtilis, пригодной является культивируемая клетка, используемая в качестве хозяина при продукции рекомбинантного белка. Предпочтительными являются клетки животных, такие как клетка CHO и клетка COS, и среди них особенно предпочтительной является клетка CHO. Для продукции желаемого полипептида также особенно предпочтительной является клетка CHO с дефицитом dhfr (например, клеточная линия DXB11 из клеток CHO или клеточная линия DG44 из клеток CHO). Поскольку клетка CHO с дефицитом dhfr является ауксотрофной по гипоксантину и тимидину, такая клетка не может расти в среде, лишенной гипоксантина и тимидина (далее называемой в этом документе как "среда без HT"); однако клетка приобретает способность к росту в среде без HT после трансформации ее рекомбинантным вектором, содержащим ген DHFR. В соответствии с этим в качестве хозяина удобно использовать клетку CHO с дефицитом dhfr, поскольку селекцию трансформированной клетки можно проводить, основываясь на ауксотрофности клетки по гипоксантину и тимидину.
В качестве клетки, сильно экспрессирующей переносчик таурина, может быть приведена клетка, в которую искусственно перенесен ген переносчика таурина. Клетка, в которую был искусственно перенесен ген переносчика таурина, может быть получена способами, известными специалисту в данной области. Например, такую клетку можно получить встраиванием гена переносчика таурина в вектор и трансформацией этого вектора в клетку. Кроме того, понятие "клетки, в которые был искусственно перенесен ген TauT", охватывает в этом документе клетки, в которых был активирован эндогенный ген TauT с помощью технологии активации генов (см., например, международную публикацию WO 94/12650), так чтобы осуществлялась сильная экспрессия TauT.
В качестве TauT, подлежащего сильной экспрессии в клетке, можно использовать TauT, происходящий из любого организма. Более конкретно, можно использовать TauT, выделенный из организма человека или грызуна (такого как мышь, крыса или хомяк). Предпочтительно использовать TauT, выделенный из организма человека, грызуна или того же биологического вида, к которому принадлежит клетка-хозяин. Например, если клетка, которой позволяют сильно экспрессировать TauT, представляет собой клетку яичника китайского хомяка (клетку CHO), то предпочтительно использовать TauT, происходящий из человека или хомяка.
Кроме того, в качестве гена TauT, подлежащего сильной экспрессии в клетке, можно использовать любую из перечисленных ниже ДНК, от (a) до (e), кодирующих TauT.
(a) ДНК, кодирующая полипептид с аминокислотной последовательностью, которая представлена в SEQ ID NO: 2, или с аминокислотной последовательностью SC6A6_RAT (P31643), SC6A6_MOUSE (O35316), SC6A6_HUMAN (P31641), SC6A6_BOVIN (Q9MZ34) или SC6A6_CANFA (Q00589) в UniProt Knowledgebase;
(b) ДНК, кодирующая полипептид с аминокислотной последовательностью, происходящей из аминокислотной последовательности, представленной в SEQ ID NO: 2, или с аминокислотной последовательностью SC6A6_RAT (P31643), SC6A6_MOUSE (O35316), SC6A6_HUMAN (P31641), SC6A6_BOVIN (Q9MZ34) или SC6A6_CANFA (Q00589) в UniProt Knowledgebase, полученная путем замены, делеции, вставки и/или инсерции одного или более аминокислотных остатков, и, тем не менее, обладающая активностью TauT;
(с) ДНК, кодирующая полипептид, обладающий 70% или более гомологией аминокислотной последовательности с аминокислотной последовательностью, представленной в SEQ ID NO: 2, или с аминокислотной последовательностью SC6A6_RAT (P31643), SC6A6_MOUSE (O35316), SC6A6_HUMAN (P31641), SC6A6_BOVIN (Q9MZ34) или SC6A6_CANFA (Q00589) в UniProt Knowledgebase при сохранении активности TauT;
(d) ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ID NO: 1 или нуклеотидную последовательность M96601, L03292, Z18956, AF260239 или M95495 в банке данных GenBank;
(e) ДНК, которая гибридизируется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 1, или нуклеотидную последовательность M96601, L03292, Z18956, AF260239 или M95495 в банке данных GenBank при строгих условиях, и которая, тем не менее, кодирует полипептид, обладающий активностью TauT.
ДНК согласно (a) представляет собой ДНК, кодирующую TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки, иллюстрируемую ДНК согласно (d).
ДНК согласно (b) представляет собой ДНК, кодирующую полипептид, функционально эквивалентный TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки, иллюстрируемый полипептидом, имеющим аминокислотную последовательность, происходящую из аминокислотной последовательности TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки в результате делеции одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептидом, имеющим аминокислотную последовательность, происходящую из аминокислотной последовательности TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки в результате вставки одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; и полипептидом, имеющим аминокислотную последовательность, происходящую из аминокислотной последовательности TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки в результате замены одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот, другими аминокислотами.
Выражение "функционально эквивалентный TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки" означает наличие видов активности, сходных с видами активности TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки, например активности связывания таурина, активности транспортировки таурина в клетки и т.д. К таким полипептидам относятся, например, мутанты TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки. Этот термин охватывает TauT, происходящий из организмов других биологических видов.
Аминокислотные остатки, подлежащие мутации, конкретно не ограничены. Предпочтительно аминокислотные остатки подвергаются мутации в другие аминокислотные остатки, в которых сохраняются свойства исходной боковой цепи аминокислот. Конкретные примеры свойств боковой цепи аминокислот включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с боковой цепью, содержащей гидрофильную группу (S, T и Y), аминокислоты с боковой цепью, содержащей атом серы (C и M), аминокислоты с боковой цепью, содержащей карбоновую кислоту и амид (D, N, E и Q), аминокислоты с боковой цепью, содержащей основание (R, K и H) и аминокислоты с боковой цепью, содержащей ароматическую группу (H, F, Y и W) (В скобках приведены однобуквенные коды аминокислот).
Сообщалось о том, что полипептид, имеющий аминокислотную последовательность, происходящую из первоначальной аминокислотной последовательности в результате модификации (такой как делеция, вставка и/или замещение одной или нескольких аминокислот), сохраняет биологическую активность исходного полипептида (Mark, D. F. et al., Proc. Natl. Acad. Sci. USA (1984) 81, 5662-5666; Zoller, M. J. & Smith, M. Nucleic Acids Research (1982) 10, 6487-6500; Wang, A. et al., Science 224, 1431-1433; Dalbadie-McFarland, G. et al., Proc. Natl. Acad. Sci. USA (1982) 79, 6409-6413).
ДНК согласно (c) кодирует полипептид, функционально эквивалентный TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки, который представляет собой полипептид, обладающий по меньшей мере 70%, предпочтительно 97% или более, более предпочтительно 98% или более, более предпочтительно 99% или более гомологией с аминокислотной последовательностью TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки. Для определения гомологии полипептидов можно следовать алгоритму, описанному в Wilbur, W. J. and Lipman, D. J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
ДНК можно получить способами, известными специалисту в данной области. Например, ДНК можно получать получением библиотеки кДНК из клетки, экспрессирующей TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки, и проведением гибридизации с использованием части последовательности ДНК TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки (например, SEQ ID NO: 1) в качестве зонда. Библиотеку кДНК можно получать, например, способом, описанным в Sambrook, J. et al., Molecular Cloning, Cold Spring Harbor Laboratory Press (1989). Альтернативно можно использовать коммерческую библиотеку кДНК. Также ДНК TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки можно получать выделением РНК из клетки, экспрессирующей TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки, синтезом олигонуклеотидных молекул ДНК на основе последовательности ДНК, кодирующей TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки (например, SEQ ID NO: 1), и проведением ПЦР с использованием олигонуклеотидных молекул ДНК в качестве праймеров, тем самым амплифицируя кДНК, кодирующую TauT.
Кроме того, путем определения нуклеотидной последовательности полученной кДНК, можно определить участок трансляции, кодирующий полипептид, и получить аминокислотную последовательность TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки или полипептида, функционально эквивалентного ему. Более того, путем скрининга геномной библиотеки с применением полученной кДНК в качестве зонда можно выделить геномную ДНК.
Конкретно, можно использовать следующие способы. Во-первых, из клеток, тканей или сходных с ними, экспрессирующих TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки, выделяют мРНК. Для выделения мРНК получают тотальную РНК известными способами, например способом ультрацентрифугирования с гуанидином (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299), способом AGPC (Chomczynski, P. and Sacchi, N., Anal. Biochem. (1987) 162, 156-159) или сходными с ними, а затем мРНК очищают от тотальной РНК, применяя набор для очистки мРНК (Pharmacia) и т.д. Альтернативно, мРНК можно получить прямо, используя набор QuickPrep для очистки мРНК (Pharmacia).
Из полученной мРНК с использованием обратной транскриптазы синтезируют кДНК. Альтернативно кДНК можно синтезировать с использованием коммерческого набора, такого как AMV Reverse Transcriptase First-Strand cDNA Synthesis (SEIKAGAKU CORPORATION). Также можно синтезировать и амплифицировать кДНК способом 5'-RACE (Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932) с использованием набора 5'-Ampli FINDER RACE (Clontech) и полимеразной цепной реакции (ПЦР) с праймерами. Далее можно использовать точечный мутагенез для внесения мутаций в полученную таким образом ДНК. Затем мутированную таким способом ДНК можно амплифицировать с помощью ПЦР.
Из полученного в результате ПЦР продукта извлекают представляющий интерес фрагмент ДНК и лигируют его в векторную ДНК с получением тем самым рекомбинантного вектора. Вектор вводят в хозяина (например, E.coli), а затем проводят селекцию полученных колоний, с получением тем самым требуемого рекомбинантного вектора. Нуклеотидную последовательность представляющей интерес ДНК можно подтвердить известным способом, таким как дидезоксинуклеотидный способ обрыва цепи.
Кроме того, для ДНК можно сконструировать нуклеотидную последовательность с повышенной эффективностью экспрессии, принимая во внимание частоту применения кодонов в хозяине, подлежащем применению для экспрессии (Grantham, R. et al., Nucleic Acids Research (1981) 9, p.43-74). Кроме того, ДНК можно модифицировать с использованием коммерчески доступных наборов или известных способов. Примеры таких модификаций включают, но не ограничиваются ими, расщепление ферментами рестрикции, вставку синтетических олигонуклеотидов или соответствующих фрагментов ДНК, добавление линкеров и вставку кодона инициации (ATG) и/или стоп-кодона (TAA, TGA или TAG).
ДНК согласно (e) представляет собой ДНК, которая гибридизируется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 1, или нуклеотидную последовательность M96601, L03292, Z18956, AF260239 или M95495 в GenBank, в строгих условиях и кодирует полипептид, функционально эквивалентный TauT хомяка, крысы, мыши, человека, крупного рогатого скота или собаки. Строгие условия, включая, например, условия низкой строгости, может правильно выбрать специалист в данной области. К условиям низкой строгости относятся, например, 42°C, 2×SSC и 0,1% SDS, предпочтительно 50°C, 2×SSC и 0,1% SDS. Более предпочтительно выбирать условия высокой строгости. К условиям высокой строгости относятся, например, 65°C, 2×SSC и 0,1% SDS. В этих условиях по мере повышения температуры гибридизации можно получить ДНК с повышенной гомологией. Описанная выше ДНК, которая гибридизуется, предпочтительно представляет собой ДНК, полученную из природных источников, например кДНК или хромосомную ДНК. Эти ДНК, выделенные способами гибридизации, обычно обладают высокой идентичностью нуклеотидной последовательности с нуклеотидной последовательностью, представленной в SEQ ID NO: 1, или нуклеотидной последовательностью M96601, L03292, Z18956, AF260239 или M95495 в GenBank. Термин "высокая идентичность" обычно относится к гомологии 96% или более, предпочтительно к гомологии 98% или более, более предпочтительно к гомологии 99% или более. Идентичность нуклеотидных последовательностей можно определить при помощи алгоритма BLAST (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993). На основе этого алгоритма были разработаны такие компьютерные программы как BLASTN и BLASTX (Altschul et al. J. Mol. Biol. 215:403-410, 1990). Если нуклеотидные последовательности анализируют в программе BLASTN, основанной на алгоритме BLAST, можно установить, например, такие параметры как score = 100 и wordlength = 12. Известны конкретные процедуры для этих способов анализа (.).
Когда используется клетка, в которую искусственно перенесен ген TauT, порядок переноса гена TauT и переноса ДНК, кодирующей желаемый полипептид, конкретно не ограничен. ДНК, кодирующую желаемый полипептид, можно переносить после переноса гена TauT. Альтернативно ген TauT можно переносить после переноса ДНК, кодирующей желаемый полипептид. Также можно переносить ген TauT и ДНК, кодирующую желаемый полипептид, одновременно.
Клетка, сильно экспрессирующая TauT, может также сильно экспрессировать CSAD.
В качестве клетки, сильно экспрессирующей CSAD, может быть взята клетка, в которую был искусственно перенесен ген CSAD. Клетка, в которую был искусственно перенесен ген CSAD, может быть получена способами, известными специалисту в данной области. Например, такую клетку можно получить, встраивая ген CSAD в вектор и трансформируя этим вектором клетки. Кроме того, понятие "клетки, в которые был искусственно перенесен ген CSAD", охватывает в этом документе клетки, в которых был активирован эндогенный ген CSAD посредством технологии активации генов (см., например, международную публикацию WO 94/12650), так чтобы осуществлялась сильная экспрессия CSAD.
В качестве CSAD, подлежащего сильной экспрессии в клетке, можно использовать CSAD, происходящий из любого организма. Конкретно, можно использовать CSAD, выделенный из организма человека, грызуна (такого как мышь, крыса или хомяк), иглобрюха (такого как тигровая рыба фугу) или асцидии (такой как Ciona intestnalis). Предпочтительно можно использовать CSAD, выделенный из организма человека, грызуна или того же биологического вида, к которому принадлежит клетка-хозяин. Например, если клетка, которой дают возможность сильно экспрессировать CSAD, представляет собой клетку яичника китайского хомяка (клетку CHO), то предпочтительно использовать CSAD, происходящий из организма человека или хомяка.
Кроме того, в качестве гена CSAD, подлежащего сильной экспрессии в клетке, можно использовать любую из перечисленных ниже ДНК от (a1) до (e1).
(a1) ДНК, кодирующая полипептид с аминокислотной последовательностью, которая представлена в SEQ ID NO: 4, или с аминокислотной последовательностью CSAD_RAT (Q64611), CSAD_MOUSE (Q9DBE0) или CSAD_HUMAN (Q9Y600) в UniProt Knowledgebase;
(b1) ДНК, кодирующая полипептид с аминокислотной последовательностью, происходящей из аминокислотной последовательности, представленной в SEQ ID NO: 4, или с аминокислотной последовательностью CSAD_RAT (Q64611), CSAD_MOUSE (Q9DBE0) или CSAD_HUMAN (Q9Y600) в UniProt Knowledgebase путем замены, делеции, вставки и/или инсерции одного или более аминокислотных остатков, но с сохранением активности CSAD;
(c1) ДНК, кодирующая полипептид, обладающий гомологией аминокислотной последовательности 70% или более с аминокислотной последовательностью, представленной в SEQ ID NO: 4, или с аминокислотной последовательностью CSAD_RAT (Q64611), CSAD_MOUSE (Q9DBE0) или CSAD_HUMAN (Q9Y600) в UniProt Knowledgebase, и тем не менее сохраняющий активность CSAD.
(d1) ДНК, имеющая нуклеотидную последовательность, представленную в SEQ ID NO: 3, или нуклеотидную последовательность M64755, AK005015 или AF116546 (GenBank);
(e1) ДНК, которая гибридизируется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 3, или нуклеотидную последовательность M64755, AK005015 или AF116546 (GenBank) в строгих условиях, и тем не менее кодирует полипептид, обладающий активностью CSAD.
ДНК согласно (a1) представляет собой ДНК, кодирующую CSAD хомяка, крысы, мыши или человека. Например, она может представлять собой ДНК согласно (d1). Ферментативная активность CSAD крупного рогатого скота идентифицирована, однако информация о его последовательности недоступна.
ДНК согласно (b1) представляет собой ДНК, кодирующую полипептид, функционально эквивалентный CSAD хомяка, крысы, мыши или человека, иллюстрируемый полипептидом, имеющим аминокислотную последовательность, происходящую из аминокислотной последовательности CSAD хомяка, крысы, мыши или человека, путем делеции одной или более аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептидом, имеющим аминокислотную последовательность, происходящую из аминокислотной последовательности CSAD хомяка, крысы, мыши или человека, путем вставки одной или более аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; и полипептидом, имеющим аминокислотную последовательность, происходящую из аминокислотной последовательности CSAD хомяка, крысы, мыши или человека, путем замены одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот, другими аминокислотами.
Выражение "полипептид, который функционально эквивалентен CSAD хомяка, крысы, мыши или человека" используется для обозначения того, что полипептид обладает декарбоксилирующей активностью, которая эквивалентна активности, присущей CSAD хомяка, крысы, мыши или человека, такой как ферментативная активность в отношении синтеза гипотаурина из 3-сульфиновокислого аланина, ферментативная активность в отношении синтеза таурина из цистеиновой кислоты, и ферментативная активность по типу глутаматдекарбоксилазы в отношении синтеза β-аланина из аспарагиновой кислоты. Такой полипептид охватывает, например, мутанты CSAD хомяка, крысы, мыши или человека. Он также охватывает CSAD, выделенный из других биологических видов (например, CSAD крупного рогатого скота и т.п.).
Аминокислотные остатки, подлежащие мутации, конкретно не ограничены. Предпочтительно аминокислотные остатки подвергаются мутации в другие аминокислотные остатки, в которых сохраняются свойства исходной боковой цепи аминокислот. Конкретные примеры свойств боковой цепи аминокислот включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с боковой цепью, содержащей гидрофильную группу (S, T и Y), аминокислоты с боковой цепью, содержащей атом серы (C и M), аминокислоты с боковой цепью, содержащей карбоновую кислоту и амид (D, N, E и Q), аминокислоты с боковой цепью, содержащей основание (R, K и H) и аминокислоты с боковой цепью, содержащей ароматическую группу (H, F, Y и W) (В скобках приведены однобуквенные коды аминокислот).
ДНК согласно (c1) кодирует полипептид, функционально эквивалентный CSAD хомяка, крысы, мыши или человека, который представляет собой полипептид, обладающий, по меньшей мере, 70%, предпочтительно 97% или более, более предпочтительно 98% или более, еще предпочтительнее 99% или более гомологией с аминокислотной последовательностью CSAD хомяка, крысы, мыши или человека. Для определения гомологии полипептидов можно следовать алгоритму, описанному в Wilbur, W. J. and Lipman, D. J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
ДНК можно получить способами, известными специалисту в данной области. Например, ДНК можно получать получением библиотеки кДНК из клетки, экспрессирующей CSAD хомяка, крысы, мыши или человека, и проведением гибридизации с использованием части последовательности ДНК CSAD хомяка, крысы, мыши или человека (например, SEQ ID NO: 3) в качестве зонда. Библиотеку кДНК можно получать, например, способом, описанным в Sambrook, J. et al., Molecular Cloning, Cold Spring Harbor Laboratory Press (1989). Альтернативно можно использовать коммерческую библиотеку кДНК. Также ДНК CSAD хомяка, крысы, мыши или человека можно получать выделением РНК из клетки, экспрессирующей CSAD хомяка, крысы, мыши или человека, синтезом олигонуклеотидных молекул ДНК на основе последовательности ДНК, кодирующей CSAD хомяка, крысы, мыши или человека (например, SEQ ID NO: 3), и проведением ПЦР с использованием олигонуклеотидных молекул ДНК в качестве праймеров, тем самым амплифицируя кДНК, кодирующую CSAD.
Кроме того, путем определения нуклеотидной последовательности полученной кДНК, можно определить участок трансляции, кодирующий полипептид, и получить аминокислотную последовательность CSAD хомяка, крысы, мыши или человека или полипептида, функционально эквивалентного ему. Более того, путем скрининга геномной библиотеки с применением полученной кДНК в качестве зонда можно выделить геномную ДНК.
Конкретно, можно использовать следующие способы. Во-первых, из клеток, тканей или сходных с ними экспрессирующих CSAD хомяка, крысы, мыши или человека выделяют мРНК. Для выделения мРНК получают тотальную РНК известными способами, например способом ультрацентрифугирования с гуанидином (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299), способом AGPC (Chomczynski, P. and Sacchi, N., Anal. Biochem. (1987) 162, 156-159) или сходными с ними, а затем мРНК очищают от тотальной РНК, применяя набор для очистки мРНК (Pharmacia) и т.д. Альтернативно, мРНК можно получить прямо, используя набор QuickPrep для очистки мРНК (Pharmacia).
Из полученной мРНК с использованием обратной транскриптазы синтезируют кДНК. Альтернативно кДНК можно синтезировать с использованием коммерческого набора, такого как AMV Reverse Transcriptase First-Strand cDNA Synthesis (SEIKAGAKU CORPORATION). Также можно синтезировать и амплифицировать кДНК способом 5'-RACE (Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932) с использованием набора 5'-Ampli FINDER RACE (Clontech) и полимеразной цепной реакции (ПЦР) с праймерами. Далее можно использовать точечный мутагенез для внесения мутаций в полученную таким образом ДНК. Затем мутированную таким способом ДНК можно амплифицировать с помощью ПЦР.
Из полученного в результате ПЦР продукта извлекают представляющий интерес фрагмент ДНК и лигируют его в векторную ДНК с получением тем самым рекомбинантного вектора. Вектор вводят в хозяина (например, E.coli), а затем проводят селекцию полученных колоний, с получением тем самым требуемого рекомбинантного вектора. Нуклеотидную последовательность представляющей интерес ДНК можно подтвердить известным способом, таким как дидезоксинуклеотидный способ обрыва цепи.
Кроме того, для ДНК можно сконструировать нуклеотидную последовательность с повышенной эффективностью экспрессии, принимая во внимание частоту применения кодонов в хозяине, подлежащем применению для экспрессии (Grantham, R. et al., Nucleic Acids Research (1981) 9, p.43-74). Кроме того, ДНК можно модифицировать с использованием коммерчески доступных наборов или известных способов. Примеры таких модификаций включают, но не ограничиваются ими, расщепление ферментами рестрикции, вставку синтетических олигонуклеотидов или соответствующих фрагментов ДНК, добавление линкеров и вставку кодона инициации (ATG) и/или стоп-кодона (TAA, TGA или TAG).
ДНК согласно (e1) представляет собой ДНК, которая гибридизируется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 3, или нуклеотидную последовательность M64755, AK005015 или AF116546 в GenBank, в строгих условиях и кодирует полипептид, функционально эквивалентный CSAD хомяка, крысы, мыши или человека. Строгие условия, включая, например, условия низкой строгости, может правильно выбрать специалист в данной области. К условиям низкой строгости относятся, например, 42°C, 2×SSC и 0,1% SDS, предпочтительно 50°C, 2×SSC и 0,1% SDS. Более предпочтительно выбирать условия высокой строгости. К условиям высокой строгости относятся, например, 65°C, 2×SSC и 0,1% SDS. В этих условиях по мере повышения температуры гибридизации можно получить ДНК с повышенной гомологией. Описанная выше ДНК, которая гибридизуется, предпочтительно представляет собой ДНК, полученную из природных источников, например кДНК, или хромосомную ДНК. Эти ДНК, выделенные способами гибридизации, обычно обладают высокой идентичностью нуклеотидной последовательности с нуклеотидной последовательностью, представленной в SEQ ID NO: 3, или с